Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Test rapide de résistance du bois à la biodégradation par les crustacés marins xylophages
Dans cet article
Résumé
Ce protocole présente une méthode d’évaluation du taux d’alimentation du crustacé xylophage Limnoria en mesurant la production de granulés fécaux. Cette méthode est conçue pour être utilisée dans des laboratoires non spécialisés et peut être incorporée dans des protocoles d’essai standard afin d’évaluer la durabilité accrue du bois dans des conditions marines.
Résumé
Les invertébrés xylophages détruisent rapidement les bois marins et les infrastructures côtières en bois, causant des milliards de dollars de dommages dans le monde entier chaque année. Comme les traitements du bois avec des biocides à large spectre, tels que la créosote et l’arséniate de cuivre chromaté (CCA), sont maintenant limités dans l’utilisation marine par la législation, des essences de bois naturellement durables et de nouvelles méthodes de préservation du bois sont nécessaires. Ces méthodes sont soumises à des tests afin de répondre aux normes réglementaires, telles que la norme européenne pour tester les agents de préservation du bois contre les foreurs marins, EN 275. L’étude initiale des essences de bois durables ou des traitements de préservation du bois peut être réalisée rapidement et à peu de frais grâce à des tests en laboratoire, ce qui offre de nombreux avantages par rapport aux essais sur le terrain en mer qui sont généralement des efforts coûteux et à long terme. De nombreuses espèces de Limnoria (gribble) sont des crustacés marins xylophages. Les limnoria sont idéales pour les tests en laboratoire de la biodégradation du bois par les foreurs marins, en raison de la praticité de leur élevage dans des aquariums et de la facilité de mesurer leurs taux d’alimentation en bois. Nous décrivons ici un test de laboratoire normalisable pour évaluer la biodégradation du bois à l’aide de gribble.
Introduction
Les foreurs de bois peuvent causer des dommages importants aux structures marines en bois, telles que les défenses maritimes, les jetées et les structures aquacoles; dont le remplacement ou la restauration coûte des milliards de dollars par an dans le monde1,2,3. Afin de protéger ces structures, le bois est souvent traité pour réduire la biodégradation. Cependant, en raison de la restriction de l’utilisation des biocides à large spectre en Australie, dans l’UE, au Royaume-Uni et aux États-Unis, dans le milieu marin, de nouvelles techniques de modification et de nouvelles espèces de bois naturellement durables pour les foreurs sont recherchées4,5,6,7. Les nouvelles techniques de préservation du bois dans le milieu marin nécessitent des tests approfondis afin de respecter les normes réglementaires et de limiter les impacts environnementaux des dangers tels que la lixiviation de tout agent de conservation chimique. Par exemple, la norme européenne EN 275, qui est la norme européenne actuelle de 1992, est utilisée pour évaluer les traitements de préservation du bois contre les dommages causés par le foreur du bois marin8,9. Cette norme, ainsi que d’autres législations contre l’utilisation de composés biocides, tels que CCA4,5,6,7 et la créosote10, nécessite des méthodes durables et non toxiques de protection du bois et l’utilisation d’essences de bois naturellement durables pour remplacer les traitements biocides11,12 . Les essais en mer, tels que ceux spécifiés dans la norme EN 275, nécessitent de longues périodes d’exposition et sont donc coûteux et lents à produire des résultats significatifs. Les tests en laboratoire, cependant, offrent une alternative beaucoup plus rapide aux méthodes d’essai de préservation des produits du bois contre l’attaque de l’agrile du bois marin, permettant une évaluation rapide des ajustements aux calendriers de traitement13. Les résultats de cette expérience de laboratoire rapide sont conçus pour éclairer les nouveaux processus de modification du bois et pour identifier les essences de bois ayant une durabilité naturelle aux dommages causés par les foreurs. Un faible taux d’alimentation et une faible vitalité peuvent indiquer une résistance accrue dans les produits potentiels et cette information peut ensuite être transmise aux partenaires de l’industrie pour leur permettre d’améliorer les conceptions. Notre méthode permet une réponse agile et rapide, ce qui est souhaitable dans l’industrie, et une fois que les produits prometteurs ont été identifiés, les résultats peuvent être complétés par ceux des essais en mer.
Limnoria est un genre de crustacés isopodes de la famille des Limnoriidae. Il existe plus de 60 espèces de Limnoria dans le monde13,14,15, avec trois espèces communes trouvées au Royaume-Uni, Limnoria lignorum, Limnoria tripunctata et Limnoria quadripunctata16. Ils creusent des tunnels à la surface du bois qui est immergé dans l’eau de mer, causant souvent des dommages économiquement importants. Les gribbles sont très abondants dans les eaux côtières du Royaume-Uni et sont faciles à entretenir dans des conditions de laboratoire, ce qui en fait des organismes idéaux pour l’étude de la biodégradation du bois par les invertébrés marins foreurs de bois. L’évaluation des taux d’alimentation et de la vitalité des gribbles sur différentes espèces de bois et les méthodes de préservation du bois peuvent déterminer l’efficacité de leur résistance à la biodégradation. Le protocole suivant établit une méthode standard pour mesurer les taux d’alimentation des gribbles, développée à partir de celle décrite par Borges et ses collègues12,17, en plus de rationaliser l’introduction de l’analyse d’images pour rendre le processus utilisable dans des laboratoires non spécialisés. L’analyse d’images est également utilisée pour réduire les limites pratiques du comptage manuel d’un grand nombre d’échantillons. La durabilité dans les essais marins à long terme, selon la norme britannique EN350-1:1994, est classée en référence à l’aubier Pinus sylvestris18. Dans les tests de laboratoire à court terme présentés ici, nous utilisons l’aubier de pin sylvestre (Pinus sylvestris L) comme témoin pour tester le bois de cœur des espèces ekki (Lophira alata Banks ex C.F Gaertn), hêtre (Fagus sylvatica L), châtaignier doux (Castanea sativa Mill) et térébenthine (Syncarpia glomulifera (Sm.) Nied). La production moyenne de granulés fécaux et la vitalité parmi huit répétitions par espèce de bois ont été utilisées comme indicateur de durabilité. Nous fournissons des données illustratives recueillies à partir d’une évaluation typique, en utilisant l’espèce gribble Limnoria quadripunctata et une gamme d’espèces de bois naturellement durables. Limnoria quadripunctata, identifiée par les clés fournies par Menzies (1951), a été sélectionnée comme l’espèce optimale pour les essais de biodégradation en raison du fait qu’elle est le membre le plus étudié de la famille et qu’elle est bien établie comme espèce modèle à utiliser dans les essais de biodégradation. Ce protocole s’applique également à l’essai de bois de différents traitements, bien que le témoin utilisé devrait être des réplications non traitées de la même espèce.
Protocole
1. Préparation des bâtonnets d’essai
- Une fois les processus de traitement terminés, coupez le bois sec en bâtonnets d’essai d’une taille de 2 mm x 4 mm x 20 mm (Figure 1). Le séchage à l’air colle à un poids constant, dans des conditions de laboratoire. Utilisez au moins 5 répliques de chaque bois testé.

Figure 1 : Bâtonnets d’essai utilisés dans les essais de laboratoire à court terme pour évaluer les taux d’alimentation des gribbles. Bâtonnets de bois d’essai de 2 mm x 4 mm x 20 mm. De gauche à droite : ekki, térébenthine, châtaignier doux et bois de hêtre et aubier de pin sylvestre. Barre d’échelle 4 mm. Veuillez cliquer ici pour agrandir cette figure.
- Imprégnation sous vide
- Après la préparation du bois (c.-à-d. la coupe et le traitement, s’il y a lieu), placez les bâtonnets sous une maille dans un contenant en plastique saluant les aliments, à l’intérieur du dessiccateur sous vide et remplacez le couvercle en veillant à ce qu’il y ait un joint étanche, facilité par un revêtement de graisse sous vide (figure 2).
- Fixez une vanne à trois voies entre le tuyau reliant le dessiccateur et la pompe, avec un troisième tube menant à l’air libre (Figure 2). Assurez-vous que la vanne à trois voies est fermée à l’air et faites fonctionner la pompe pour obtenir un vide compris entre -0,75 et -1,0 bar dans le dessiccateur à vide et maintenez ce vide pendant 45 minutes - 1 heure.
- Immergez l’extrémité ouverte du troisième tube dans un récipient d’eau de mer. Éteignez la pompe et fermez la vanne menant à la pompe, puis ouvrez lentement la vanne jusqu’à ce que l’eau de mer soit aspirée par le vide dans le dessiccateur. Laissez l’eau s’écouler jusqu’à ce qu’elle remplisse le récipient en plastique, au-dessus du niveau de la maille.
- Retirez ensuite le tube de l’eau de mer dans le récipient, en laissant entrer l’air, jusqu’à ce que le dessiccateur revienne à la pression atmosphérique. Gardez les bâtons immergés sous le maillage jusqu’à ce qu’ils coulent au fond du récipient en plastique.

Figure 2 : Équipement utilisé pour imprégner sous vide les bâtonnets de bois avec de l’eau de mer, en préparation de l’alimentation des gribbles lors d’un essai d’alimentation en laboratoire. A) Dessiccateur sous vide; B) Pompe; C) Manomètre pour le dessiccateur à vide; D) La vanne à trois voies menant au dessiccateur à vide, à la pompe et à l’air libre ou à l’eau de mer (tube orange). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Bois de lixiviation
- Immerger des bâtonnets d’essai saturés d’eau de mer dans de l’eau de mer contenue dans des tubes de 50 mL (figure 3). Remplacez l’eau régulièrement pendant une période de 20 jours.
REMARQUE : Le processus de lixiviation s’applique à tout bois expérimental à l’essai, y compris les bois traités ou naturels.
- Immerger des bâtonnets d’essai saturés d’eau de mer dans de l’eau de mer contenue dans des tubes de 50 mL (figure 3). Remplacez l’eau régulièrement pendant une période de 20 jours.

Figure 3 : Lixiviat des bâtonnets de bois pour la préparation à l’alimentation des gribbles lors d’un essai d’alimentation en laboratoire. Le bois qui a été complètement immergé dans l’eau de mer contenue dans un tube Falcon de 50 ml, avec un changement d’eau régulier (1-3 jours), a produit un lixiviat de couleur distincte. De gauche à droite lixiviat du bois de cœur de; châtaignier doux, térébenthine, ekki, hêtre et aubier de pin sylvestre. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Extraction de Gribble
- Extraire des spécimens individuels de gribble d’un bloc de bois infesté. Utilisez une paire de pinces fines et un pinceau fin (taille 000/0,4 mm ou moins). Pelez soigneusement tout bois qui recouvre le terrier de gribble avec les pinces
REMARQUE : Les terriers se trouvent à la surface du bois et peuvent être identifiés par de petits trous (figure 4). - Une fois que les gribbles ont été exposés, utilisez un pinceau pour ramasser doucement les individus par en dessous et déposez-les dans une boîte de Pétri remplie d’eau de mer. Vérifiez le gribble au microscope pour identifier les espèces et vous assurer qu’aucun dommage n’a été causé lors de l’extraction.
NOTE: Battre les pléopodes est un signe de vitalité.- Jetez toutes les femelles qui couvent des œufs car les femelles gravides ont une capacité d’alimentation réduite.

Figure 4 : Image d’un terrier de gribble avec deux trous de ventilation typiques. L. terrier quadripunctata sur un bâton de pin Radiata, dimensionné 2 mm x 4 mm x 20 mm. Deux trous de ventilation plus petits peuvent être vus à côté de l’entrée du terrier. Barre d’échelle 2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Identification de Limnoria quadripunctata
- Identifier Limnoria quadripunctata sous un stéréomicroscope par les quatre tubercules distincts, disposés en motif carré, sur les pléotelson de l’animal en plus d’une carène en forme de X sur la cinquième pléonite19 (Figure 5).

Figure 5 : Caractéristiques d’identification de Limnoria quadripunctata. Image de la surface dorsale Limnoria quadripunctata, prise sur un stéréomicroscope à grossissement x20. Les caractéristiques d’identification indiquées par la flèche rouge - indique la carène en forme de X et la flèche bleue - indiquent quatre tubercules sur pléotelson. Barre d’échelle 1 mm. Veuillez cliquer ici pour agrandir cette figure.
3. Préparer les plaques de puits
- Dans les plaques multipuits avec des puits de diamètre 20 mm, placer un bâton d’essai et 5 mL d’eau de mer non filtrée, entre 32 et 35 PSU, par puits (figure 6).
- Placez systématiquement les traitements/essences de bois dans toute la plaque du puits afin que chaque type de bois soit représenté au moins une fois par plaque. Ajouter un gribble par puits.
REMARQUE: La température doit être maintenue stable dans un incubateur à 20 °C ± 2 °C pour l’espèce L. quadripunctata, d’autres espèces de Limnoria peuvent être utilisées avec des ajustements de la température en fonction de l’espèce spécifique. - Gardez les plaques dans des conditions d’obscurité constante car la photopériode n’a pas d’effet sur le taux d’alimentation des gribble15.

Figure 6 : Installation expérimentale pour le test d’alimentation des gribbles. Un exemple d’une plaque multi-puits de 12 utilisée dans les tests en laboratoire de la vitesse d’alimentation des gribbles. Chaque puits contient 5 ml d’eau de mer et un bâtonnet d’essai (20 mm x 4 mm x 2 mm) de différentes essences de bois; Aubier et ekki du pin sylvestre, hêtre, châtaignier doux et bois de cœur de térébenthine. Barre d’échelle 20 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Collecte et comptage des granulés fécaux et évaluation de la vitalité.
- Deux fois par semaine, retirer le bâtonnet d’essai et chaque gribble (un par puits) de la plaque de puits et placer dans une plaque de puits fraîchement préparée (contenant 5 mL d’eau de mer par puits [32-35 PSU, 18-22 °C]).
- Utilisez un pinceau pour brosser doucement les granulés fécaux du bâton avant de transférer et conservez les granulés fécaux dans le puits d’origine.
REMARQUE: Avant de transférer le gribble dans une assiette de puits frais, la vitalité peut être évaluée sur une échelle de 1 à 5; 1 = mort, 2 = passif, pas sur le bois, 3 = nageant activement ou battant des pléopodes, pas sur le bois, 4 = rampant à la surface du bois, 5 = enfoui dans le bois. - Traitement d'images
- Utilisez un pinceau fin pour séparer les touffes afin que les granulés individuels soient visibles et brossez les granulés loin des bords mêmes du puits. Prenez une photo détaillée au stéréomicroscope, à l’agrandissement x4 et téléchargez-la sur un ordinateur (Figure 7).
REMARQUE: Assurez-vous que les granulés sont au point et que l’arrière-plan est uniforme, sans ombres ni reflets de lumière à la surface de l’eau.
- Utilisez un pinceau fin pour séparer les touffes afin que les granulés individuels soient visibles et brossez les granulés loin des bords mêmes du puits. Prenez une photo détaillée au stéréomicroscope, à l’agrandissement x4 et téléchargez-la sur un ordinateur (Figure 7).
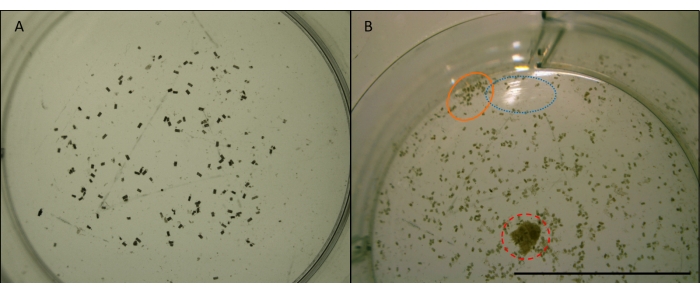
Figure 7 : Image de granulés fécaux gribble. L. granulés fécaux quadripunctata (petits granulés cylindriques bruns) provenant de l’alimentation en bois de pin Radiata dans un puits d’une plaque multipuit. Pris à un grossissement x4. Images avant manipulation pour l’analyse d’images (voir Figure 7). A) Exemple d’une image appropriée à utiliser pour le comptage automatisé dans ImageJ. Les granulés sont suffisamment étalés et éloignés des bords du puits. Le puits est centré et il n’y a pas d’obstructions ou de reflets. B) Un exemple d’image qui ne convient pas à l’analyse d’images. Le puits est excentré, coupant la moitié inférieure. Le cercle bleu (pointillé) montre la réflexion de la lumière sur la surface de l’eau. Le cercle orange (solide) montre les granulés qui sont agglutinés trop près les uns des autres et trop près du bord du puits. Le cercle rouge (en pointillés) montre une copeau de bois qui n’a pas été enlevée. Barre d’échelle 10 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Processus de génération du nombre de granulés fécaux à l’aide d’ImageJ.
- Téléchargez ImageJ (dernière version du 21/03/08, 1.8.0_172) à partir de https://imagej.nih.gov/ij/download.html ou exécutez-le à partir du navigateur de l’ordinateur.
- Téléchargez une pile d’images par glisser-déposer ou en sélectionnant Fichier | Importer | Séquence d’images | Parcourir. Ne modifiez aucun paramètre, puis sélectionnez OK.
- Ensuite, utilisez l’outil cercle pour sélectionner la section inférieure du puits contenant les granulés fécaux. Supprimez les bords du puits, sélectionnez Modifier | Clair à l’extérieur. Rendez l’image binaire, sélectionnez Traiter | Rendre binaire.
- Calibrer en sélectionnant Analyser | Définissez l’échelle et choisissez le nombre de pixels par millimètre pour l’image (par exemple 10 pixels = 1 mm). Comptez les granulés, sélectionnez Analyser | Analyser les particules.
- Dans la zone en regard de Taille (unité2), sélectionnez un seuil inférieur identique à celui de la pastille de plus petite taille, en utilisant l’échelle de l’unité définie précédemment (par exemple, si 10 pixels = 1 mm et que la plus petite pastille est de 0,5 mm, choisissez 5-infini).
- Dans la zone de liste déroulante Afficher , sélectionnez Contours , puis cochez Résumer et appuyez sur OK (Figure 8).
NOTE: De plus amples informations peuvent être trouvées sur https://imagej.nih.gov/ij/docs/guide/index.html

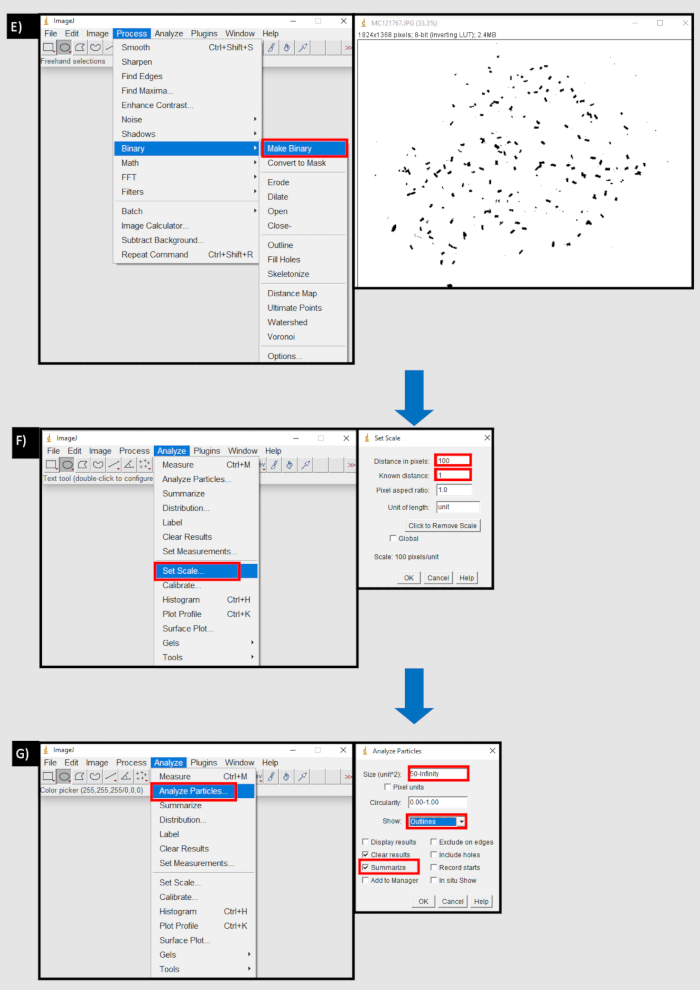
Figure 8 : Organigramme du procédé utilisé dans ImageJ pour compter les granulés fécaux. A) Importation d’une séquence d’images dans l’onglet Fichier d’ImageJ. B) Le bouton parcourir dans la boîte de dialogue 'Importer la séquence d’images' pour importer une séquence d’images à partir d’un périphérique local. C) Utilisation de l’outil cercle pour sélectionner une zone contenant des pastilles fécales D) Bouton Effacer à l’extérieur dans la zone de l’onglet d’édition pour supprimer en dehors de la zone sélectionnée. E) Créer un bouton binaire dans l’onglet Processus. F) Définir le bouton d’échelle dans l’onglet Analyser. La distance en pixels est équivalente au nombre de pixels pour une unité de mesure (mm). G) Bouton Analyser les particules dans l’onglet Analyser. Taille (unité^2) réglée sur le seuil inférieur de la taille des granulés fécaux, en pixels, à l’infini. Afficher les 'contours' et 'résumer' sont sélectionnés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
-
Analyse des données
- Convertissez le nombre de granulés en granulés par jour, ce qui donne une mesure indirecte du taux d’alimentation. Jetez les données de tout individu en mue les jours où la mue s’est produite (figure 9).
REMARQUE: La mue se produit sur 1-3 jours et peut être identifiée lorsqu’une mue complète de l’exosquelette peut être vue.
- Convertissez le nombre de granulés en granulés par jour, ce qui donne une mesure indirecte du taux d’alimentation. Jetez les données de tout individu en mue les jours où la mue s’est produite (figure 9).

Figure 9 : Exemple de mue gribble. Gribble (L. quadripunctata) muant, sur un bâton d’essai en bois de pin Radiata de 20 mm x 4 mm x 2 mm. Les mues sont indiquées par des cercles rouges. Barre d’échelle 2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Une expérience d’alimentation de L. quadripunctata a été réalisée sur une période de 20 jours, en utilisant cinq types de bois différents (aubier de pin sylvestre (Pinus sylvestris L) et bois de cœur de hêtre (Fagus sylvatica L), d’ekki (Lophira alata Banks ex C. F Gaertn), de châtaignier doux (Castanea sativa Mil) et de térébenthine (Syncarpia glomulifera (Sm.) Neid)) (voir table des matières), en novembre 2020. Huit bâton...
Discussion
Avant de sélectionner des spécimens de gribble à utiliser dans l’expérience d’alimentation, les individus doivent être examinés pour évaluer leur pertinence. Il peut y avoir une certaine variation dans le taux d’alimentation entre les individus en raison des différences de taille, de sorte que seuls les spécimens adultes adultes doivent être sélectionnés. Aucune différence significative entre le taux d’alimentation des individus entre 1,5 mm et 3 mm de longueur n’a été détectée par Borges et a...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts lié à cette étude.
Remerciements
Merci au Conseil norvégien de la recherche (Oslo Regional Fund, Alcofur rffofjor 269707) et à l’Université de Portsmouth (bourse de recherche doctorale de la Faculté des sciences) d’avoir financé les études de Lucy Martin. Aussi, à Gervais S. Sawyer qui a fourni le bois utilisé pour générer les résultats représentatifs. La térébenthine a été fournie par le professeur Philip Evans de l’Université de la Colombie-Britannique.
matériels
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
Références
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon