É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Testes rápidos de resistência da madeira à biodegradação por crustáceos chatos da madeira marinha
Neste Artigo
Resumo
Este protocolo apresenta um método para avaliar a taxa de alimentação do crustáceo chato de madeira, Limnoria, medindo a produção de pelotas fecais. Este método foi projetado para uso em laboratórios não especializados e tem potencial para incorporação em protocolos de teste padrão, para avaliar a maior durabilidade da madeira em condições marinhas.
Resumo
Invertebrados chatos de madeira destroem rapidamente madeiras marinhas e infraestrutura costeira de madeira, causando bilhões de dólares de danos em todo o mundo todos os anos. Como os tratamentos de madeira com biocidas de amplo espectro, como creosote e arsênio de cobre cromado (CCA), são agora restritos no uso marinho pela legislação, espécies de madeira naturalmente duráveis e novos métodos de preservação da madeira são necessários. Esses métodos passam por testes para atender às normas regulamentares, como o padrão europeu para testar conservantes de madeira contra borers marinhos, EN 275. A investigação inicial de espécies de madeira duráveis ou tratamentos de conservantes de madeira pode ser realizada de forma rápida e barata através de testes laboratoriais, o que oferece muitas vantagens sobre ensaios de campo marinho que são tipicamente caros, esforços de longo prazo. Muitas espécies de Limnoria (gribble) são crustáceos chatos de madeira marinha. A limnoria é ideal para uso em testes laboratoriais de biodegradação de madeira por borers de madeira marinha, devido à praticidade de criá-los em aquário e à facilidade de medir suas taxas de alimentação em madeira. Aqui, descrevemos um teste laboratorial padronizado para avaliar a biodegradação de madeira usando gribble.
Introdução
Os borers de madeira podem causar danos extensivos às estruturas de madeira marinha, como defesas marítimas, píeres e estruturas de aquicultura; a substituição ou restauração da qual custa bilhões de dólares por ano em todo o mundo1,2,3. Para proteger essas estruturas, a madeira é frequentemente tratada para reduzir a biodegradação. No entanto, devido à restrição do uso de biocidas de amplo espectro na Austrália, UE, Reino Unido e EUA, no ambiente marinho, novas técnicas de modificação e espécies de madeira que são naturalmente duráveis aos borers são procuradas 4,5,6,7. Novas técnicas para a preservação da madeira no ambiente marinho exigem testes minuciosos para atender às normas regulamentares e limitar os impactos ambientais de riscos como o lixiviação de qualquer conservante químico. Por exemplo, o padrão europeu, EN 275, que é o padrão europeu atual a partir de 1992, é usado para avaliar tratamentos de preservação da madeira contra danos de madeira marinha 8,9. Essa norma, juntamente com outras legislações contra o uso de compostos biocidas, como CCA4,5,6,7 e creosote10, necessita de métodos sustentáveis e não tóxicos de proteção da madeira e uso de espécies de madeira naturalmente duráveis para substituir tratamentos biocidas11,12 . Ensaios marinhos, como os especificados na EN 275, exigem longos períodos de exposição e, portanto, são caros e lentos para produzir resultados significativos. Os testes laboratoriais, no entanto, fornecem uma alternativa muito mais rápida para testar métodos de preservação de produtos madeireiros contra ataque de madeira marinha, permitindo uma avaliação rápida dos ajustes nos horários de tratamento13. Os resultados deste rápido experimento laboratorial são projetados para informar novos processos de modificação da madeira e identificar espécies de madeira com durabilidade natural para danos de borer. Uma baixa taxa de alimentação e vitalidade podem indicar maior resistência em produtos potenciais e essas informações podem então ser devolvidas aos parceiros do setor para permitir que eles melhorem os projetos. Nosso método permite uma resposta ágil e rápida, que é desejável na indústria, e uma vez que produtos promissores foram identificados, os resultados podem ser complementados com os de ensaios marinhos.
Gribbles (Limnoria) é um gênero de crustáceo isópode na família Limnoriidae. Existem mais de 60 espécies de Limnoria em todo o mundo13,14,15, com três espécies comuns encontradas no Reino Unido, Limnoria lignorum, Limnoria tripunctata e Limnoria quadripunctata16. Eles carregavam túneis na superfície da madeira que está submersa na água do mar, muitas vezes causando danos economicamente significativos. Os gribbles são altamente abundantes em águas costeiras do Reino Unido e são fáceis de manter em condições laboratoriais, tornando-os organismos ideais para o estudo da biodegradação de madeira por invertebrados chatos à madeira marinha. Avaliar as taxas de alimentação e vitalidade dos gribbles em diferentes espécies de madeira e métodos de preservação da madeira pode determinar a eficácia de sua resistência à biodegradação. O protocolo a seguir estabelece um método padrão para medir as taxas de alimentação de gribble, desenvolvido a partir do descrito por Borges e seus colegas12,17, além de agilizar a introdução da análise de imagem para tornar o processo operável em laboratórios não especializados. A análise de imagem também é usada para reduzir as limitações práticas de contagem manual de grandes amostras. A durabilidade nos testes marítimos de longo prazo, de acordo com o Padrão Britânico EN350-1:1994, são classificados em referência a Pinus sylvestris sapwood18. Nos testes laboratoriais de curto prazo apresentados aqui, usamos o pinheiro escocês (Pinus sylvestris L) como controle para testar a madeira da espécie ekki (Lophira alata Banks ex C.F Gaertn), faia (Fagus sylvatica L), castanha doce (Castanea sativa Mill) e terpentina (Syncarpia glomulifera (Sm.) Nied). A produção média de pelotas fecais e a vitalidade entre oito réplicas por espécie de madeira foram utilizadas como indicador de durabilidade. Fornecemos dados ilustrativos coletados de uma avaliação típica, usando as espécies de gribble Limnoria quadripunctata e uma gama de espécies de madeira naturalmente duráveis. Limnoria quadripunctata, identificada pelas chaves fornecidas por Menzies (1951), foi selecionada como a espécie ideal para ensaios de biodegradação devido ao fato de ser o membro mais bem estudado da família e é bem estabelecida como uma espécie modelo para uso em ensaios de biodegradação. Este protocolo também é aplicável para testar madeiras de diferentes tratamentos, embora o controle utilizado deva ser replicações não tratadas da mesma espécie.
Protocolo
1. Preparando varas de teste
- Depois que todos os processos de tratamento estiverem concluídos, corte a madeira seca em varas de teste para tamanho 2 mm x 4 mm x 20 mm (Figura 1). O ar seco gruda em um peso constante, em condições laboratoriais. Use pelo menos 5 réplicas de cada madeira que está sendo testada.

Figura 1: Varas de teste usadas em testes laboratoriais de curto prazo para avaliar as taxas de alimentação de gribble. Teste varas de madeira tamanho 2 mm x 4 mm x 20 mm. Da esquerda para a direita: ekki, terebintina, castanha doce e madeira de faia e madeira de pinheiro escocês. Barra de escala 4 mm. Clique aqui para ver uma versão maior desta figura.
- Impregnação de vácuo
- Pós-preparação da madeira (ou seja, corte e tratamento, se aplicável), coloque as varas sob uma malha em um recipiente plástico seguro para alimentos, dentro do dessecador de vácuo e substitua a tampa garantindo que haja uma vedação apertada, facilitada por um revestimento de graxa de vácuo (Figura 2).
- Conecte uma válvula de três vias entre a tubulação que liga o dessecador e a bomba, com um terceiro tubo que leva ao ar livre (Figura 2). Certifique-se de que a válvula de três vias esteja fechada ao ar e execute a bomba para obter um vácuo entre -0,75 a -1,0 barra dentro do desiccador de vácuo e segure este vácuo por 45 minutos - 1 hora.
- Submergir a extremidade aberta do terceiro tubo em um recipiente de água do mar. Desligue a bomba e feche a válvula que leva à bomba e abra lentamente a válvula até que a água do mar seja puxada pelo vácuo para dentro do desiccador. Deixe a água fluir até encher o recipiente plástico, acima do nível da malha.
- Em seguida, retire o tubo da água do mar no recipiente, permitindo a entrada de ar, até que o desiccador retorne à pressão atmosférica. Mantenha as varas submersas sob a malha até afundarem no fundo do recipiente de plástico.

Figura 2: Equipamento usado para aspirar varas de madeira impregnadas com água do mar, em preparação para alimentação para gribbles durante um ensaio de alimentação laboratorial. A) Desiccator a vácuo; B) Bomba; C) Medidor de pressão para o desiccador de vácuo; D) A válvula de três vias que leva ao desiccador de vácuo, bomba e a ar livre ou água do mar (tubo laranja). Clique aqui para ver uma versão maior desta figura.
- Leaching Wood
- Submerse as varas de teste saturadas da água do mar na água do mar contidas em tubos de 50 mL (Figura 3). Substitua a água regularmente por um período de 20 dias.
NOTA: O processo de lixiviação se aplica a qualquer madeira experimental em teste, incluindo madeiras tratadas ou naturais.
- Submerse as varas de teste saturadas da água do mar na água do mar contidas em tubos de 50 mL (Figura 3). Substitua a água regularmente por um período de 20 dias.

Figura 3: Leachate de varas de madeira para preparação para alimentação a gribbles durante um ensaio de alimentação laboratorial. Madeira totalmente submersa na água do mar contida em um tubo Falcon de 50 ml, com mudança de água regular (1-3 dias), produziu lixachate claramente colorido. Da esquerda para a direita leachate de heartwood de; castanha doce, terebintina, ekki, e faia e pinheiro escocês sapwood. Clique aqui para ver uma versão maior desta figura.
2. Extraindo gribble
- Extrair espécimes individuais de gribble de um bloco de madeira infestado. Use um par de fórceps finos e um pincel fino (tamanho 000/0,4 mm ou menor). Retire cuidadosamente qualquer madeira que está cobrindo a toca de gribble com as fórceps
NOTA: As tocas são encontradas na superfície da madeira e podem ser identificadas por pequenos orifícios (Figura 4). - Uma vez que gribble tenha sido exposto, use um pincel para pegar gentilmente indivíduos de baixo e depositar em uma placa de petri cheia de água do mar. Verifique o gribble sob um microscópio para identificar espécies e para garantir que nenhum dano tenha sido causado durante a extração.
NOTA: Vencer pleópodes é sinal de vitalidade.- Descarte qualquer fêmea que pense em ovos, pois as fêmeas gravid têm uma capacidade de alimentação reduzida.

Figura 4: Imagem de uma toca de gribble com dois orifícios típicos de ventilação. L. quadripunctata burrow em uma vara de madeira de pinheiro Radiata, tamanho 2 mm x 4 mm x 20 mm. Dois orifícios de ventilação menores podem ser vistos ao lado da entrada da toca. Barra de escala 2 mm. Clique aqui para ver uma versão maior desta figura.
- Identificação de Limnoria quadripunctata
- Identifique limnoria quadripunctata sob um estereomicroscópio pelos quatro tubérculos distintos, dispostos em um padrão quadrado, no pleotelson do animal, além de uma carina em forma de X no quinto pleonite19 (Figura 5).

Figura 5: Limnoria quadripunctata identificando características. Imagem da superfície dorsal Limnoria quadripunctata, tirada em um estereómico na ampliação x20. A identificação de características mostradas por seta vermelha - indica a carina em forma de X e seta azul - indica quatro tubercles em pleotelson. Barra de escala 1 mm. Clique aqui para ver uma versão maior desta figura.
3. Preparando placas de poço
- Em placas multi-poços com poços de diâmetro de 20 mm, coloque uma vara de teste e 5 mL de água do mar não filtrada, entre 32-35 PSU, por poço (Figura 6).
- Coloque tratamentos/espécies de madeira sistematicamente em toda a placa do poço para que cada tipo de madeira seja representada pelo menos uma vez por placa. Adicione um gribble por bem.
NOTA: A temperatura deve ser mantida estável em uma incubadora a 20 °C ± 2 °C para a espécie L. quadripunctata, outras espécies de Limnoria podem ser usadas com ajustes na temperatura feita para se adequar às espécies específicas. - Mantenha as placas em condições escuras constantes, pois o fotoperóudo não tem efeito na taxa de alimentação de gribble15.

Figura 6: Configuração experimental para ensaio de alimentação de gribble. Um exemplo de uma placa de 12 multi-poços usada nos testes laboratoriais da taxa de alimentação de gribble. Cada poço contém 5 ml de água do mar e um bastão de teste (20 mm x 4 mm x 2 mm) de diferentes espécies de madeira; Scots Pine sapwood e ekki, faia, castanha doce, e madeira de coração de terpentina. Barra de escala 20 mm. Clique aqui para ver uma versão maior desta figura.
4. Coleta e Contagem de Pelotas Fecais e Avaliação da Vitalidade.
- Duas vezes por semana, remova o bastão de ensaio e cada gribble (um por poço) da placa do poço e coloque em uma placa de poço recém-preparada (contendo 5 mL de água do mar por poço [32-35 PSU, 18-22 °C]).
- Use um pincel para escovar suavemente as pelotas fecais da vara antes de transferir e reter as pelotas fecais dentro do poço original.
NOTA: Antes de transferir o gribble para uma placa de poço fresco, a vitalidade pode ser avaliada em uma escala de 1-5; 1= morto, 2 = passivo, não na madeira, 3 = ativamente nadando ou batendo pleópodes, não na madeira, 4 = rastejando na superfície da madeira, 5 = escavado na madeira. - Processamento de imagens
- Use um pincel fino para separar qualquer aglomerado para que as pelotas individuais sejam visíveis e escove as pelotas longe das bordas do poço. Tire uma fotografia detalhada sob um microscópio estéreo, na ampliação x4 e faça upload para um computador (Figura 7).
NOTA: Certifique-se de que as pelotas estão em foco e o fundo é uniforme, sem sombras ou reflexos de luz na superfície da água.
- Use um pincel fino para separar qualquer aglomerado para que as pelotas individuais sejam visíveis e escove as pelotas longe das bordas do poço. Tire uma fotografia detalhada sob um microscópio estéreo, na ampliação x4 e faça upload para um computador (Figura 7).
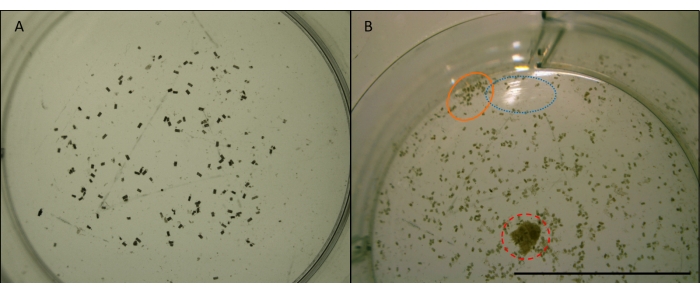
Figura 7: Imagem de balas fecais gribble. L. pelotas fecais quadripunctata (pequenas, cilíndricas, pelotas marrons) de se alimentar em madeira de pinheiro Radiata em um poço de uma placa multi-bem. Tomada na ampliação x4. Imagens anteriores à manipulação para análise de imagem (ver Figura 7). A) Exemplo de uma imagem adequada a ser usada para contagem automatizada no ImageJ. As pelotas estão suficientemente espalhadas para fora e longe das bordas do poço. O poço está centrado e não há obstruções ou reflexos. B) Um exemplo de uma imagem inadequada para análise de imagem. O poço está fora do centro, cortando a metade inferior. O círculo azul (pontilhado) mostra reflexo de luz fora da superfície da água. O círculo laranja (sólido) mostra pelotas que são agrupadas muito de perto e muito perto da borda do poço. O círculo vermelho (tracejado) mostra um chip de madeira que não foi removido. Barra de escala 10 mm. Clique aqui para ver uma versão maior desta figura.
- Processo para gerar contagem de pelotas fecais usando imageJ.
- Baixe ImageJ (versão mais recente em 21/03/08, 1.8.0_172) de https://imagej.nih.gov/ij/download.html ou executado a partir do navegador do computador.
- Carregue uma pilha de imagens arrastando e soltando ou selecionando arquivo | | de importação sequência de imagens | Navegue. Não altere nenhum parâmetro e selecione Ok.
- Em seguida, use a ferramenta de círculo para selecionar a seção inferior do poço que contém as pelotas fecais. Remova as bordas do poço, selecione Editar | Claro lá fora. Torne a imagem binária, selecione Processe | Faça binário.
- Calibrar selecionando análise | Defina escala e escolha o número de pixels por milímetro para a imagem (por exemplo 10 pixels = 1 mm). Conte as pelotas, selecione Analisar | Analise partículas.
- Na caixa ao lado do Tamanho (unidade2), selecione um limiar inferior que seja o mesmo que a menor pelota de tamanho, usando a escala da unidade definida anteriormente (por exemplo, se 10 pixels = 1 mm e a menor pelota for de 0,5 mm, escolha 5-infinito).
- Na caixa de soltar show, selecione Contornos e, em seguida, marque Resumo e pressione Okay (Figura 8).
NOTA: Mais informações podem ser encontradas em https://imagej.nih.gov/ij/docs/guide/index.html

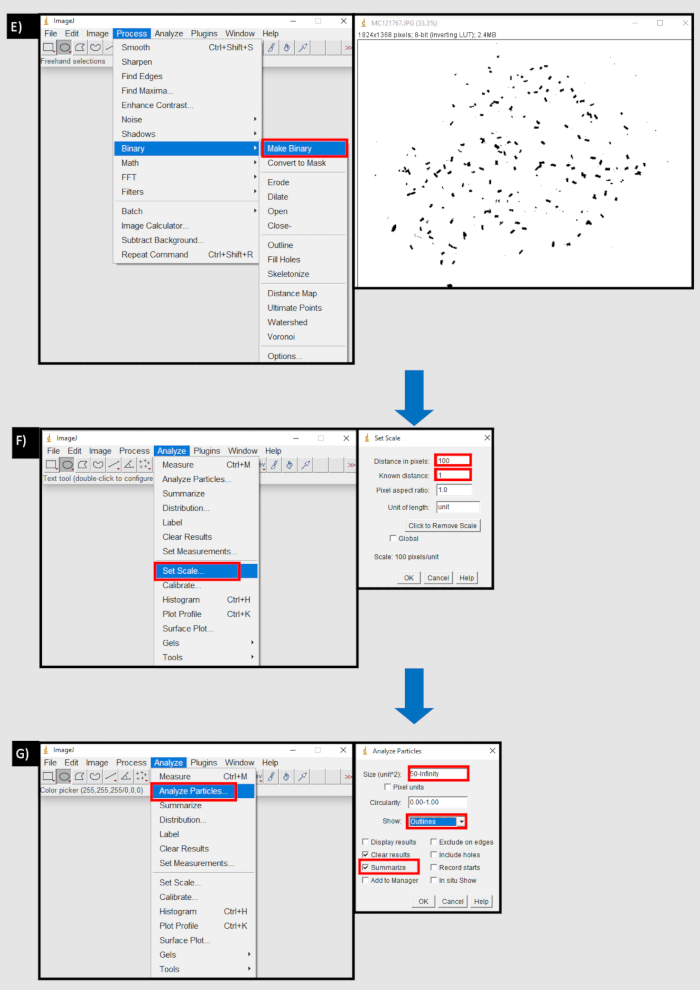
Figura 8: Um diagrama de fluxo do processo utilizado no ImageJ para contar pelotas fecais. A) Importar uma sequência de imagem na guia Arquivo da ImageJ. B) O botão de navegação na caixa de diálogo 'Import Image Sequence' para importar uma sequência de imagens de um dispositivo local. C) Utilização da ferramenta de círculo para selecionar área que contenha pelotas fecais D) Limpe o botão externo na área da guia de edição para remover fora da área selecionada. E) Faça o botão binário na guia do processo. F) Defina o botão de escala na guia Analisar. A distância em pixels equivale ao número de pixels a uma unidade de medição (mm). G) Analisar o botão de partículas na guia Analisar. Tamanho (unidade^2) definido para o limiar inferior do tamanho da pelota fecal, em pixels, para o infinito. Mostrar 'contornos' e 'resumir' são selecionados. Clique aqui para ver uma versão maior desta figura.
-
Análise de dados
- Converter pelotas conta em pelotas por dia, o que dá e medida indireta da taxa de alimentação. Descartar dados de qualquer indivíduo moulting nos dias em que ocorreu a moldagem (Figura 9).
NOTA: A moldagem ocorre ao longo de 1-3 dias e pode ser identificada quando um molde completo do exoesqueleto pode ser visto.
- Converter pelotas conta em pelotas por dia, o que dá e medida indireta da taxa de alimentação. Descartar dados de qualquer indivíduo moulting nos dias em que ocorreu a moldagem (Figura 9).

Figura 9: Exemplo de um molde de gribble. Gribble (L. quadripunctata) moldagem, em um bastão de teste de madeira de pinheiro Radiata tamanho 20 mm x 4 mm x 2 mm. Os moldes são indicados por círculos vermelhos. Barra de escala 2 mm. Clique aqui para ver uma versão maior desta figura.
Resultados
Um experimento de alimentação de L. quadripunctata foi realizado ao longo de 20 dias, usando cinco tipos diferentes de madeira (pinheiro escocês (Pinus sylvestris L) madeira de safira, e madeira de bepênula (Fagus sylvatica L), ekki (Lophira alata Banks ex C. F Gaertn), castanha doce (Castanea sativa Mil) e terebintina (Syncarpia glomulifera (Sm.) Neid)) (Ver Tabela de Materiais), em novembro de 2020. Oito bastões de réplica foram usad...
Discussão
Antes de selecionar espécimes de gribble para serem usados no experimento de alimentação, os indivíduos devem ser examinados para avaliar sua adequação. Pode haver alguma variação na taxa de alimentação entre os indivíduos devido a diferenças de tamanho, por isso apenas espécimes adultos adultos totalmente crescidos devem ser selecionados. Não foi detectada diferença significativa entre a taxa de alimentação dos indivíduos entre 1,5 mm e 3 mm de comprimento por Borges et al., 200917
Divulgações
Os autores não têm conflitos de interesse relacionados ao presente estudo.
Agradecimentos
Obrigado ao Conselho de Pesquisa da Noruega (Fundo Regional de Oslo, Alcofur rffofjor 269707) e à Universidade de Portsmouth (Faculdade de Ciências de Pesquisa em Pesquisa) por fornecer financiamento para os estudos de Lucy Martin. Além disso, para Gervais S. Sawyer que forneceu a madeira usada para gerar os resultados representativos. A terpentina foi fornecida pelo Prof. Philip Evans da Universidade da Colúmbia Britânica.
Materiais
| Name | Company | Catalog Number | Comments |
| 12-well cell culture plates | ThermoFisher Scientific | 150200 | |
| 50ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Adjustable volume pipette | Fisher Scientific | FBE10000 | 1-10 ml |
| Beech | G. Sawyer (consultant in timber technology) | Fagus sylvatica | Taxonomic authority: L |
| Ekki | G. Sawyer (consultant in timber technology) | Lophira alata | Taxonomic authority: Banks ex C. F. Gaertn. |
| Forceps | Fisher Scientific | 10098140 | |
| Incubator | LMS LTD | INC5009 | |
| Microporous specimen capsules | Electron Microscopy Sciences | 70187-20 | |
| Petri dish | Fisher Scientific | FB0875713 | |
| Scots Pine | G. Sawyer (consultant in timber technology) | Pinus sylvestris | Taxonomic authority: L. |
| Size 00000 paintbrush | Hobby Craft | 5674331001 | Size 000 or 0000 also acceptable |
| Sweet Chestnut | G. Sawyer (consultant in timber technology) | Castanea sativa | Taxonomic authority: Mill |
| Turpentine | P. Evans (Professor, Dept. Wood Science, University of British Columbia) | Syncarpia glomulifera | Taxonomic authority: (Sm.) Nied. |
| Vacuum desiccator | Fisher Scientific | 15544635 |
Referências
- Morrell, J. J., Kutz, M. Protection of wood-based materials. Handbook of environmental degradation of materials, 3rd ed. , 343-368 (2018).
- Distel, D. L., Goodell, B., Nicholas, D., Schultz, T. The biology of marine wood boring bivalves and their bacterial endosymbionts. Wood deterioration and preservation. , 253-271 (2003).
- Buslov, V., Scola, P. Inspection and structural evaluation of timber pier: case study. Journal of Structural Engineering. 117 (9), 2725-2741 (1991).
- Registration Eligibility Decision for Chromated Arsenicals. List A, Case No. 0132. US EPA - Office of prevention, pesticides and toxic substances Available from: https://swap.stanford.edu/20110202084/http://www.epa.gov/oppsrrd1/reregistration/REDs/cca_red.pdf (2008)
- Arsenic timber treatments (CCA and arsenic trioxide) review scope document, Review series 03.1. ISSN number 1443. Australian pesticides and veterinary medicines authority Available from: https://apvma.gov.au/sites/default/files/publication/14296-arsenic-timber-review-scope.pdf (2003)
- Commission directive 2003/2/EC of 6 January 2003 relating to restrictions on the marketing and use of arsenic (tenth adaptation to technical progress to Council Deretive 76/769/EEC). Official Journal of the European Communities Available from: https://www.legislation.gov.uk/eudr/2003/2/adopted (2003)
- The Hazardous Waste (England and Wales) Regulations 2005 No.894. Environmental Protection England and Wales Available from: https://www.legislation.gov.uk/uksi/2005/894/contents/made (2005)
- Palanti, S., Cragg, S. M., Plarre, R. Resistance against marine borers: About the revision of EN 275 and the attempt for a new laboratory standard for Limnoria. International Research Group on Wood Preservation, Document No. IRG/WP 20-20669. , (2020).
- The European Commission for Standardization. EN 275:1992. Wood preservatives- Determination of the protective effectiveness against marine wood borers. The European Commission for Standardization (CEN). , (1992).
- European Commission. Directive 98/8/EC concerning the placing of biocidal products on the market. Communication and Information Resource Centre for Administrations, Businesses and Citizens. , (2010).
- Mantanis, G. I. Chemical modification of wood by acetylation or furfurylation: A review of the present scaled-up technologies. BioResources. 12 (2), 4478-4489 (2017).
- Borges, L. M. S., Cragg, S. M., Bergot, J., Williams, J. R., Shayler, B., Sawyer, G. S. Laboratory screening of tropical hardwoods for natural resistance to the marine borer Limnoria quadripunctata: The role of leachable and non-leachable factors. Holzforschung. 62 (1), 99-111 (2008).
- Cragg, S. M., Pitman, A., Henderson, S. Developments in the understanding of the biology of marine wood boring crustaceans and in methods of controlling them. International Biodeterioration & Biodegradation. 43 (4), 197-205 (1999).
- Cookson, L. J., Vic, M. D. C. Additions to the taxonomy of the Limnoriidae. Memoirs of the Museum of Victoria. 56 (1), 129-143 (1997).
- Cookson, L. Australasian species of Limnoriidae (Crustacea: Isopoda). Memoirs of the Museum of Victoria. 52 (2), 137 (1991).
- Jones, L. T. The geographical and vertical distribution of British Limnoria [Crustacea: Isopoda]. Journal of the Marine Biological Association of the United Kingdom. 43 (3), 589-603 (1963).
- Borges, L. M. S., Cragg, S. M., Busch, S. A laboratory assay for measuring feeding and mortality of the marine wood borer Limnoria under forced feeding conditions: A basis for a standard test method. International Biodeterioration & Biodegradation. 63 (3), 289-296 (2009).
- BSI Standards Publication. BS EN 350:2016. Durability of wood and wood-based products - Testing and classification of the durability to biological agents of wood and wood-based materials. BSI Standards Publication. , (2016).
- Menzies, R. . The phylogeny, systematics, distribution, and natural history of limnoria. , 196-208 (1951).
- Palanti, S., Feci, E., Anichini, M. Comparison between four tropical wood species for their resistance to marine borers (Teredo spp and Limnoria spp) in the Strait of Messina. International Biodeterioration & Biodegradation. 104, 472-476 (2015).
- Delgery, C. C., Cragg, S. M., Busch, S., Morgan, E. Effects of the epibiotic heterotrich ciliate Mirofolliculina limnoriae and moulting on the faecal pellet production by the wood-boring isopods Limnoria tripunctata and Limnoria quadripunctata. Journal of Experimental Marine Biology and Ecology. 334 (2), 165-173 (2006).
- Morrell, J. J., Helsing, G. G., Graham, R. D. Marine wood maintenance manual: a guide for proper use of Douglas-fir in marine exposures. Forest Research Laboratory. , (1984).
- Slevin, C. R., Westin, M., Lande, S., Cragg, S. Laboratory and marine trials of resistance of furfurylated wood to marine borers. Eighth European Conference on Wood Modification. , 464-471 (2015).
- Westin, M., et al. Marine borer resistance of acetylated and furfurylated wood - results from up to 16 years of field exposure. International Research Group on Wood Preservation. , (2016).
- Westin, M., Rapp, A., Field Nilsson, T. Field test of resistance of modified wood to marine borers. Wood Material Science and Engineering. 1 (1), 34-38 (2006).
- Borges, L. M. S. Biodegradation of wood exposed in the marine environment: Evaluation of the hazard posed by marine wood-borers in fifteen European sites. International Biodeterioration & Biodegradation. 96 (1), 97-104 (2014).
- Treu, A., et al. Durability and protection of timber structures in marine environments in Europe: An overview. BioResources. 14 (4), 10161-10184 (2019).
- Williams, J. R., Sawyer, G. S., Cragg, S. M., Simm, J. A questionnaire survey to establish the perceptions of UK specifiers concerning the key material attributes of timber for use in marine and freshwater engineering. Journal of the Institute of Wood Science. 17 (1), 41-50 (2005).
- Purnell, P. The carbon footprint of reinforced concrete. Advances in Cement Research. 25 (6), 362-368 (2013).
- Hill, C. A. S. The environmental consequences concerning the use of timber in the built environment. Frontiers in Built Environment. 5, 129 (2019).
- Mercer, T. G., Frostick, L. E. Leaching characteristics of CCA-treated wood waste: a UK study. Science of the Total Environment. 427, 165-174 (2012).
- Brown, C. J., Eaton, R. A., Thorp, C. H. Effects of chromated copper arsenate (CCA) wood preservative on early fouling community formation. Marine Pollution Bulletin. 42 (11), 1103-1113 (2001).
- Brown, C. J., Eaton, R. A. Toxicity of chromated copper arsenate (CCA)-treated wood to non-target marine fouling communities in Langstone Harbour, Portsmouth, UK. Marine Pollution Bulletin. 42 (4), 310-318 (2001).
- Brown, C. J., Albuquerque, R. M., Cragg, S. M., Eaton, R. A. Effects of CCA (copper-chrome-arsenic) preservative treatment of wood on the settlement and recruitment of wood of barnacles and tube building polychaete worms. Biofouling. 15 (1-3), 151-164 (2000).
- Lebow, S. T., Foster, D. O., Lebow, P. K. Release of copper, chromium and arsenic from treated southern pine exposed in seawater and freshwater. Forest Products Journal. 49 (7), 80-89 (1999).
- Smith, P. T. Risk to human health and estuarine posed by pulling out creosote-treated timber on oyster farms. Aquatic Toxicology. 86 (2), 287-298 (2008).
- Brown, C. J., et al. Assessment of Effects of Chromated Copper Arsenate (CCA)-Treated Timber on Nontarget Epibiota by Investigation of Fouling Community Development at Seven European Sites. Archives of Environmental Contamination and Toxicology. 45 (1), 0037-0047 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados