A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد التنفس الميتوكوندريا وتحلل الجليكوليسيس في عينات الأنسجة الشبكية Ex Vivo
In This Article
Summary
وصف هنا هو بروتوكول مفصل لإجراء اختبار الإجهاد الميتوكوندريا ونسبة الجليكوليك المقايسة في عينات الأنسجة الشبكية في الجسم الحي السابق باستخدام تحليل حيوي التجارية.
Abstract
التنفس الميتوكوندريا هو مسار توليد الطاقة الحرجة في جميع الخلايا، وخاصة المستقبلات الضوئية الشبكية التي تمتلك عملية التمثيل الغذائي نشطة للغاية. بالإضافة إلى ذلك ، تظهر المستقبلات الضوئية أيضا انحلال غليكوليسيس هوائي عالي مثل الخلايا السرطانية. يمكن أن توفر القياسات الدقيقة لهذه الأنشطة الأيضية رؤى قيمة في التوازن الخلوي في ظل الظروف الفسيولوجية وفي حالات المرض. وقد وضعت عالية الإنتاجية المقايسات المستندة إلى لوحة صغيرة لقياس التنفس الميتوكوندريا ومختلف الأنشطة الأيضية في الخلايا الحية. ومع ذلك، يتم تطوير الغالبية العظمى من هذه للخلايا المستزرعة ولم يتم تحسين لعينات الأنسجة سليمة والتطبيق السابق فيفو. وصف هنا هو مفصل خطوة بخطوة بروتوكول، وذلك باستخدام تكنولوجيا الفلورية القائمة على لوحة صغيرة، لقياس مباشرة معدل استهلاك الأكسجين (OCR) كمؤشر على التنفس الميتوكوندريا، فضلا عن معدل الحموضة خارج الخلية (ECAR) كمؤشر على انحلال الجليكوليسيس، في الأنسجة الشبكية السابقة سليمة . وقد استخدمت هذه الطريقة لتقييم بنجاح الأنشطة الأيضية في شبكية العين الماوس الكبار وإظهار تطبيقه في التحقيق في الآليات الخلوية للشيخوخة والمرض.
Introduction
الميتوكوندريا هي العضية الأساسية التي تنظم التمثيل الغذائي الخلوي، والإشارات، وداء التوازن، وموت الخلايا المبرمج من خلال تنسيق العمليات الفسيولوجية الحاسمة المتعددة1. الميتوكوندريا بمثابة قوة في الخلية لتوليد أدينوسين ثلاثي الفوسفات (ATP) من خلال الفوسفور التأكسدي (OXPHOS) وتوفير الطاقة التي تدعم تقريبا جميع الأحداث الخلوية. يتم استقلاب غالبية الأكسجين الخلوي في الميتوكوندريا ، حيث يعمل كمقبول الإلكترون النهائي في سلسلة نقل الإلكترون (ETC) أثناء التنفس الهوائي. يمكن أيضا إنتاج كميات منخفضة من ATP من انحلال الجليكوليس في السيتوسول ، حيث يتم تحويل الجلوكوز إلى بيروفاتي ، والتي يمكن تحويلها إلى لاكتات أو نقلها إلى الميتوكوندريا وتأكسدها إلى أسيتيل -CoA ، وهي ركيزة في دورة حمض الثلاثي (دورة TCA).
شبكية العين هي واحدة من الأنسجة الأكثر نشاطا الأيضية في الثدييات2، وعرض مستويات عالية من التنفس الميتوكوندريا واستهلاك الأكسجين عالية للغاية3. قضيب ومخروط مستقبلات ضوئية تحتوي على كثافة عالية من Mitochondria4، وOXPHOS يولد معظم ATP في شبكية العين5. بالإضافة إلى ذلك، تعتمد شبكية العين أيضا بشكل كبير على انحلال الجليكوليسيس الهوائي6,7 عن طريق تحويل الجلوكوز إلى لاكتات5. وترتبط عيوب الميتوكوندريا مع مختلف الأمراض العصبية8,9; ومع متطلباتها الفريدة من الطاقة العالية ، فإن شبكية العين معرضة بشكل خاص للعيوب الأيضية ، بما في ذلك تلك التي تؤثر على OXPHOS4 الميتوكوندريا وتحلل الجليكوليسيس10. الخلل الوظيفي الميتوكوندريا والعيوب في انحلال الجليكوليسيس متورطة في الشبكية111,12 والأمراض التنكسية البقعي13, الضمور البقعي المرتبط بالعمر10,14,15,16, واعتلال الشبكية السكري17,18. لذلك، يمكن أن توفر القياسات الدقيقة لتنفس الميتوكوندريا وتحلل الجليكوليسيس معايير مهمة لتقييم سلامة وصحة شبكية العين.
يمكن قياس تنفس الميتوكوندريا من خلال تحديد معدل استهلاك الأكسجين (OCR). وبالنظر إلى أن تحويل الجلوكوز إلى بيروفاتي وبالتالي إلى اللاكتات يؤدي إلى قذف البروتونات إلى البيئة خارج الخلية وتحمضها ، فإن قياسات معدل الحموضة خارج الخلية (ECAR) توفر مؤشرا على تدفق انحلال الجليكوليزي. كما تتكون شبكية العين من أنواع الخلايا المتعددة مع العلاقات الحميمة والتآزر النشط، بما في ذلك تبادل الركائز6، فمن الضروري لتحليل وظيفة الميتوكوندريا والتمثيل الغذائي في سياق أنسجة الشبكية بأكملها مع صفح سليمة والدوائر. على مدى العقود القليلة الماضية، تم استخدام أقطاب كلارك O2 وغيرها من الأقطاب الكهربائية الدقيقة الأكسجين لقياس استهلاك الأكسجين في شبكية العين19،20،21. هذه الأقطاب الأكسجين لديها قيود كبيرة في الحساسية، ومتطلبات حجم عينة كبيرة، والحاجة إلى التحريك المستمر للعينة تعليق، الأمر الذي يؤدي عادة إلى تعطيل السياق الخلوي والأنسجة. تم تطوير البروتوكول الموصوف هنا باستخدام تقنية مضان تعتمد على الألواح الدقيقة لقياس استقلاب الطاقة الميتوكوندريا في أنسجة شبكية العين السابقة للفأر السابق تشريحها حديثا. يسمح بقياسات متوسطة الإنتاجية في الوقت الحقيقي لكل من OCR و ECAR في وقت واحد باستخدام عينة صغيرة (لكمة 1 مم) من أنسجة الشبكية في الجسم الحي مع تجنب الحاجة إلى التعليق والتحريك المستمر.
أظهرت هنا هو الإجراء التجريبي لالقساء الإجهاد الميتوكوندريا ونسبة الجليكوليك المقايسة على أقراص لكمة الشبكية تشريح حديثا. يسمح هذا البروتوكول بقياس الأنشطة الأيضية المتعلقة بالميتوكوندريا في سياق الأنسجة الحية السابقة. تختلف عن المقايسات التي أجريت باستخدام الخلايا المستزرعة، والقراءات التي تم الحصول عليها هنا تعكس التمثيل الغذائي للطاقة مجتمعة على مستوى الأنسجة وتتأثر بالتفاعلات بين أنواع الخلايا المختلفة داخل الأنسجة. تم تعديل البروتوكول من الإصدار 22,23 المنشور سابقا للتكيف مع الجيل الجديد من محلل التدفق خارج الخلية Agilent Seahorse 24-wells (XFe24) مع لوحة التقاط الجزيرة. كما تم تحسين متوسط المقايسة وتركيزات مركب الحقن وعدد / مدة دورات الفحص لأنسجة الشبكية. يتم إعطاء بروتوكول مفصل خطوة بخطوة لإعداد أقراص لكمة الشبكية. يمكن الحصول على مزيد من المعلومات حول إعداد البرنامج وتحليل البيانات من دليل المستخدم الخاص بالشركة المصنعة24,25,26.
Protocol
تمت الموافقة على جميع بروتوكولات الماوس من قبل لجنة العناية بالحيوان واستخدامه التابعة للمعهد الوطني للعيون (NEI ASP# 650). تم إيواء الفئران في ظروف مظلمة خفيفة 12 ساعة ورعايتها باتباع توصيات دليل رعاية واستخدام المختبر ، ومعهد الموارد الحيوانية المختبرية ، وسياسة خدمة الصحة العامة بشأن الرعاية الإنسانية واستخدام المختبر.
1. ترطيب خرطوشة الاستشعار وإعداد المتوسطة المقايسة
- في اليوم السابق للتجربة، أضف 1 مل من وسيط المعايرة إلى كل بئر من لوحة المرافق. ضع غطاء Hydro-Booster في الأعلى وقم بخفض خرطوشة المستشعر من خلال الفتحة على الغطاء. تحقق للتأكد من أن المستشعر مغمور في وسيط المعايرة. احتضان خرطوشة الاستشعار بين عشية وضحاها في حاضنة خالية من ثاني أكسيد الكربون في 37 درجة مئوية لتنشيط الفلوروفوريس.
ملاحظة: لمنع التبخر، يتم ترطيب الحاضنة عن طريق حفظ صينية من الماء في الداخل، ويتم لف كاسيت خرطوشة الاستشعار بغلاف بلاستيكي واضح. - إعداد المتوسطة المقايسة عن طريق إعادة تشكيل المتوسطة DMEM Seahorse مع إضافة الجلوكوز، بيروفاتي، والغلوتامين إلى التركيزات المطلوبة. في المقايسات التي ذكرت في هذه المقالة، والتركيز النهائي للركائز في المتوسط المقايسة هي: 6 مليون متر من الجلوكوز، 0.12 mM من بيروفاتي، و 0.5 mM من الجلوتامين. لكل لوحة المقايسة، يتم إعداد 40 مل من المتوسط المقايسة الطازجة في يوم التجربة.
- إعداد برنامج الفحص في محلل باتباع إرشادات الشركة المصنعة26. في المقايسة المبينة هنا، يتم تعيين البروتوكول على النحو التالي: 5 دورات من القياسات لخط الأساس، ثم حقن المنفذ A، تليها 4 دورات من القياسات، ثم حقن المنفذ B تليها 4 دورات من القياسات. وتتكون كل دورة من مزيج (3 دقائق)، والانتظار (2 دقيقة) وقياس (3 دقائق).
2. طلاء إدراج شبكة من جزيرة التقاط microplate
- إعداد مزيج الطلاء عن طريق الجمع بين 20 ميكرولتر من متوسط مرفق الخلية (على سبيل المثال، الخلية تاك) مع 171 ميكرولتر من بيكربونات الصوديوم 0.1 M و 9 ميكرولتر من 1 M NaOH.
- افتح غطاء الكاسيت الذي يحتوي على إدراجات شبكية. ماصة 8 ميكرولتر من مزيج الطلاء إلى كل إدراج شبكة. استخدام طرف ماصة لتشويه بلطف / نشر قطرة حول لتوزيع مزيج الطلاء على قدم المساواة في جميع أنحاء إدراج شبكة.
- أغلق الكاسيت واترك إدراج الشبكة لاحتضانها في درجة حرارة الغرفة لمدة 25 دقيقة على الأقل ل الامتزاز.
- غسل إدراج شبكة عن طريق pipetting 4 مل من المتوسط المقايسة مباشرة على إدراج شبكة. هز بلطف كاسيت لضمان غسل جميع إدراج شبكة مع وسيطة المقايسة.
- إبقاء إدراج شبكة جانبا. وهي جاهزة للاستخدام.
3. إعداد مركبات الحقن
- إخراج الأسهم aliquots من Bam15 (10 mM)، Rotenone (10 mM)، أنتيميسين A (10 mM) و 2-DG (500 mM) من -80 درجة مئوية الفريزر وذوبان الجليد في درجة حرارة الغرفة.
ملاحظة: المخزون 2-DG جاهز للاستخدام. الأدوية الأخرى تحتاج إلى تخفيفها إلى المخزون العامل. - الاحماء 10 مل من المتوسطة المقايسة في حمام مائي 37 درجة مئوية.
- تمييع 10 MM Bam15 الأسهم إلى 50 ميكرومتر الأسهم العاملة باستخدام إجراء تخفيف خطوتين: مزيج 20 ميكرولتر من 10 MM الأسهم مع 20 ميكرولتر من DMSO للحصول على 5 MM الأسهم المتوسطة. ثم مزيج 10 ميكرولتر من المخزون المتوسط أعلاه 5 MM مع 990 ميكرولتر من المتوسطة المقايسة قبل الحارة للحصول على المخزون النهائي 50 ميكرومتر العمل.
- تمييع والجمع بين 10 MM Rotenone و 10 M Antimycin A الأسهم إلى 10 ميكرومتر Rotenone / Antimycin A (تعفن / AA) مخزون العمل من خطوتين من التخفيف: مزيج 10 ميكرولتر كل من 10 MM Rotenone و 10 M Antimycin A الأسهم مع 80 ميكروغرام من DMSO للحصول على 1 متر روت / AA المخزون المتوسط. ثم مزيج 10 ميكرولتر من الأسهم المتوسطة أعلاه 1 mM مع 990 ميكرولتر من المتوسطة المقايسة قبل الحارة للحصول على النهائي 10 ميكرومتر تعفن / AA المخزون العامل.
- إعداد طازجة مخزونات العمل المذكورة أعلاه من مركبات الحقن في يوم التجربة ووضعها جانبا في درجة حرارة الغرفة حتى تحميلها في منافذ الحقن من خرطوشة الاستشعار.
4. تشريح الشبكية وإعداد لكمة الشبكية
- قتل الفأر عن طريق اختناق ثاني أكسيد الكربون باتباع إرشادات AVMA حول القتل الرحيم27.
ملاحظة: لا تترك الحيوان في غرفة ثاني أكسيد الكربون لفترة أطول من الوقت اللازم للقتل الرحيم. - عيون الاختزال ومكان في الجليد القديم 1x برنامج تلفزيوني العازلة في طبق بيتري ومن ثم وضعه تحت المجهر تشريح.
- إزالة بعناية، عن طريق قطع مع microscissors، عضلات المستقيم اضافية تعلق خارج مقلة العين وقطع العصب البصري.
- استخدام إبرة 30 G لكمة ثقب على حافة القرنية (طي النسيان); هذا بمثابة موقع الإدراج للميكروسيسورس. ثم استخدمي ميكروسيسورس تشريح دقيق لإجراء قطع دائري على طول حافة القرنية، وفصله عن كوب العين الخلفي.
- استخدام ملقط تشريح حاد لإزالة القرنية والعدسة ، والفكاهة الزجاجية بعيدا عن كأس العين.
- استخدام microscissors تشريح غرامة لجعل عدة تخفيضات صغيرة على طبقة تصلب في حافة كأس العين. تجنب قطع طبقة الشبكية. استخدام اثنين من ملقط تشريح حاد للتمسك الأنسجة الصلبة في كل جانب من قطع وسحب بعناية فائقة على طبقة مشقوقة لإزالته من شبكية العين العصبية. كرر هذا حول كوب العين حتى تتم إزالة جميع تصلب ويتم الحصول على كوب الشبكية سليمة.
- استخدام microscissors تشريح وجعل تخفيضات شعاعي على كأس الشبكية لتسطيح وتوليد عدة أقسام متميزة.
ملاحظة: اعتمادا على مهارات الشخص في تشريح وخبرته في التعامل مع أنسجة الشبكية الطازجة، يمكن قطع كوب الشبكية لتوليد 3 إلى 5 أقسام متميزة. - استخدمي وخزة قطرها 1 مم لقطع قرص شبكية واحد من كل قسم من كوب الشبكية المسطح.
ملاحظة: يجب توخي الحذر للحصول على أقراص الشبكية لكمة على مسافة متساوية من رأس العصب البصري. - استخدام ملقط لنقل إدراج شبكة المغلفة مسبقا في تشريح بتري الطبق. مع مساعدة من اثنين من فرش رمش فائقة الدقة، ضع قرص لكمة الشبكية على إدراج شبكة. يتم وضع القرص لكمة الشبكية في وسط إدراج شبكة مع الجانب طبقة الخلية العقدة أسفل لمس شبكة وطبقة مستقبلات ضوئية التي تواجه ما يصل.
ملاحظة: في كثير من الأحيان، تبقى بعض خلايا RPE متصلة بالمصوابات الضوئية، ويمكن استخدام تصبغ هذه الخلايا كمؤشر على اتجاه قرص لكمة الشبكية.
5. تحميل منافذ حقن خرطوشة الاستشعار والمعايرة
- أخرج كاسيت لوحة خرطوشة الاستشعار المرطب من حاضنة 37 درجة مئوية. قم بإزالة غطاء Hydro-Booster وضع خرطوشة المستشعر مرة أخرى على لوحة المرافق.
- تحميل الحجم المطلوب من حقن مركب حلول المخزون العمل في المنافذ المناسبة. عقد تلميح ماصة في زاوية 45 درجة. أدخل طرف ماصة في منتصف الطريق إلى منفذ الحقن مع شطبة من طرف ضد الجدار المقابل من منفذ الحقن وتحميل بلطف المجمع في كل منفذ. تجنب إدخال فقاعات الهواء.
- راجع دليل مستخدم الأداة لحجم المركب المحمل في كل منفذ حقن لإجراء فحص محدد. في التجارب المقدمة في هذه الورقة، يتم تحميل 68 ميكرولتر من 50 ميكرومتر Bam15 مخزون العمل (لتقييم الإجهاد الميتوكوندريا) أو 68 ميكرولتر من 10 ميكرومتر تعفن / AA المخزون العامل (لتقييم معدل الجليكوليك) في المنفذ A؛ يتم تحميل 75 ميكرولتر من 10 ميكرومتر تعفن / AA مخزون العمل (لالقساء الإجهاد الميتوكوندريا) أو 75 ميكرولتر من 500 mM 2-DG مخزون العمل (لتقييم معدل الجليكوليك) في الميناء B.
- تحميل منافذ الحقن لجميع الآبار من لوحة بما في ذلك الآبار تصحيح الخلفية والآبار الفارغة لضمان الحقن السليم. تحميل الحل المركب المعني في كل منفذ الآبار تصحيح الخلفية. يمكن استبدال وسيطة المقايسة ، بدلا من الحل المركب ، في كل من موانئ آبار البنك.
- ضع لوحة خرطوشة الاستشعار المحملة، مع غطاء إيقاف، في آلة المحلل لبدء المعايرة قبل تشغيل المقايسة. بعد انتهاء المعايرة، سيقوم البرنامج بإيقاف التشغيل تلقائيا، في انتظار استبدال لوحة المرافق بلوحة التقاط الجزر التي تحتوي على لكمات شبكية العين.
6. تحميل لوحة التقاط الجزيرة وبدء تشغيل المقايسة
- إضافة 607 ميكرولتر من وسيط المقايسة إلى كل بئر من لوحة التقاط الجزر
- استخدام ملقط للاستيلاء على حافة إدراج شبكة تحتوي على أقراص لكمة الشبكية على رأس وأخذها من طبق بيتري. اضغط بخفة على الجزء السفلي من إدراج شبكة على النسيج مسح امتصاص لإزالة السائل الإضافي ووضعها في بئر لوحة التقاط الجزيرة. كرر هذه الخطوة حتى يتم وضع جميع إدراج شبكة مع اللكمات الشبكية في لوحة التقاط الجزيرة. املأ آبار تصحيح الخلفية والآبار الفارغة بإدراج شبكة فارغة.
- استخدام ملقطين Graefe اثنين للضغط بعناية وبلطف على حافة كل إدراج شبكة وتأكد من أن يتم إدراجها بشكل آمن في الجزء السفلي من لوحة التقاط الجزيرة.
- ضع لوحة التقاط الجزر المحملة في حاضنة 37 درجة مئوية لمدة 5 دقائق للإحماء.
- إخراج لوحة المرافق بعد اكتمال المعايرة واستبدالها مع واستبدالها لوحة التقاط الجزيرة، مع غطاء قبالة، تحتوي على اللكمات الشبكية.
- استئناف تشغيل المقايسة.
7. تشغيل إنهاء وتخزين البيانات
- بعد اكتمال التشغيل، أخرج خرطوشة الاستشعار ولوحة التقاط الجزر التي تحتوي على لكمات شبكية العين. يتم حفظ البيانات تلقائيا كملف .asyr.
- استخدم برنامج تحليل البيانات المقترن لعرض البيانات وتحليلها بعد دليل المستخدم الخاص بالشركة المصنعة26.
- استخدم الدالة تصدير لتصدير ملف .xslx للبيانات، والتي يمكن عرضها وتحليلها باستخدام برنامج جدول البيانات.
8. إنقاذ العينة لكمة الشبكية
- بعد الفحص، أخرج اللوحة من الجهاز، وأزل خرطوشة الاستشعار وأزل وسيط المقايسة برفق من كل بئر باستخدام ماصة.
- تطبيق الغطاء مرة أخرى على وختم الجانبين من لوحة مع شريط البارافيلم.
- يخزن عند -80 درجة مئوية.
- للتطبيع، تحديد إجمالي الحمض النووي أو محتوى البروتين من لكمة في كل بئر.
9. تحليل البيانات
- اختبار الإجهاد الميتوكوندريا
ملاحظة: تمثل قيمة OCR المقاسة (totalOCR) إجمالي استهلاك الأكسجين من الأنسجة. بعد حقن Bam15 (uncoupler) ، يزيد OCR من المستوى القاعدي (totalOCRbasal) إلى الحد الأقصى (totalOCRmax) وينزل بعد حقن Rot / AA. تمثل قيمة OCR المتبقية بعد حقن ROT/AA (totalOCRRot/AA) استهلاك الأكسجين غير الميتوكوندريا.- حساب استهلاك الأكسجين المرتبطة الميتوكوندريا على النحو:
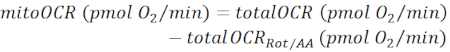 (Eq. 1) 28
(Eq. 1) 28
- حساب قدرة الاحتياطي الميتوكوندريا (MRC) على النحو التالي:
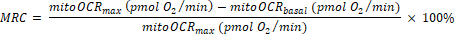 (Eq. 2) 29
(Eq. 2) 29
ملاحظة: القراءة الأخيرة بين القياسات 5 قبل حقن Bam15 يؤخذ كقيمة "القاعدية" (ل totalOCRbasal و mitoOCRbasal). أعلى قراءة بين القياسات 4 بعد حقن Bam15 يستخدم كقيمة "ماكس" (ل totalOCRmax و mitoOCRmax). يتم استخدام أدنى قراءة بين القياسات 4 بعد حقن تعفن / AA كما totalOCRRot / AA.
- حساب استهلاك الأكسجين المرتبطة الميتوكوندريا على النحو:
- فحص معدل الجليكوليك
ملاحظة: تمثل قيمة ECAR المقاسة (totalECAR) التحمض الكلي للوسط من خلال النشاط الأيضي للأنسجة. بشكل عام ، يؤدي تحمض البيئة الدقيقة خارج الخلية بشكل رئيسي عن طريق قذف المنتج الجليكوليكي ، اللاكتات. نواتج استقلاب الركائز في دورة TCA الميتوكوندريا في إنتاج ثاني أكسيد الكربون، الذي يحمض أيضا المتوسط خارج الخلية من خلال الترطيب إلى بيكربونات.- ساهم الميتوكوندريا الفرعية التحمض المتوسط (mitoECAR) من totalECAR للحصول على جليكوكار.
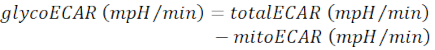 (Eq. 3) 28
(Eq. 3) 28
ملاحظة: التنفس الميتوكوندريا ودورة TCA هي عمليات مقرونة بقوة. إنتاج ثاني أكسيد الكربون من الميتوكوندريا هو وظيفة من معدل OXPHOS، الذي يمكن قياسه عن طريق ميتوكر. - حساب mitoECAR على النحو التالي:
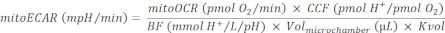 (Eq. 4) 28
(Eq. 4) 28
حيث يكون CCF (عامل مساهمة CO2 ) قيمة نسبة محسوبة تجريبيا، تمثل مقدار مساهمة H+ من التحمض بوساطة ثاني أكسيد الكربون مقابل كل استهلاك O2 من OXPHOS. تم تحديد إطار التعاون القطري لهذا النظام مسبقا ليكون 0.6028. يتم تحديد القياس الدقيق للتحمض المتوسط من خلال القدرة العازلة للوسط ، وحساسية مستشعر درجة الحموضة للأداة ، وقدرة غرفة القياس الفعالة. هنا، BF (عامل المخزن المؤقت) هو معلمة من قدرة العازلة التجريبية في الموقع ، تمثل كمية H + أو OH- المضافة إلى غرفة القياس الفعالة لتغيير مستوى درجة الحموضة من قبل وحدة واحدة. عند استخدام وسيطة المقايسة المخصصة، يمكن تحديد BF عن طريق إعادة تحديد الكميات المعروفة من الحمض في وسيطة المقايسة بعد بروتوكول عامل المخزن المؤقت30. يحتوي S seahorse DMEM متوسط درجة الحموضة 7.4 المستخدمة في هذا البروتوكول على BF محدد مسبقا من 2.60 ملليمول H +/L/pH. تحتوي لوحة التقاط الجزر المستخدمة في هذا البروتوكول على فولميكروميبر = 16.6 ميكرولتر31. عامل قياس حجم، Kvol، هو ثابت يحدد تجريبيا. لا تتوفر قيمة Kvol للوحة التقاط الجزر ولكن يمكن حسابها من قيمة اللوح الصغير28 ، مما يفسر فرق الحجم في الغرف الدقيقة ، ليكون 0.41.
ملاحظة: حقن العفن / AA يغلق التنفس الميتوكوندريا ويجبر الأنسجة على التحول إلى انحلال الجليكوليسيس لإنتاج ATP، مما يؤدي إلى ارتفاع قذف اللاكتات وزيادة في قياس ECAR. توقف تحلل الجليكوليسيس عن طريق حقن 2-DG، ويكشف قياس ECAR المتبقي عن تحمض متوسط غير جليكوليتيك وغير الميتوكوندريا. - حساب سعة الاحتياطي الجليكوليكي (GRC) على النحو التالي:
 (Eq. 5) 32
(Eq. 5) 32
حيث، القراءة الأخيرة بين القياسات 5 قبل حقن تعفن / AA تؤخذ على أنها قيمة "القاعدية" (جليكوكارباسال). أعلى قراءة بين 4 القياسات بعد حقن تعفن / AA يستخدم كقيمة "ماكس" (جليكوكارماكس). وتستخدم أدنى قراءة بين القياسات 4 بعد حقن 2-DG كما glycoECAR2-DG.
- ساهم الميتوكوندريا الفرعية التحمض المتوسط (mitoECAR) من totalECAR للحصول على جليكوكار.
- التطبيع
ملاحظة: التطبيع ضروري عند مقارنة القراءات من أنسجة الشبكية من مختلف الفئات العمرية أو بين عينات من النوع البري والباثولوجية / التنكسية، والتي قد تختلف في أعداد الخلايا.- استخدام مجموعات متاحة commerically لتقييم محتوى الحمض النووي في كل قرص لكمة الشبكية33,34.
- بدلا من ذلك، استخدم عازلة الفحص الإشعاعي (RIPA buffer) لاستخراج البروتين الكلي من لكمة الشبكية واستخدام محتوى البروتين للتطبيع.
ملاحظة: تم تحديد مساحة سطح شبكية العين الماوس الكبار سابقا أن يكون حوالي 20 مم2، ويحتوي كل شبكية العين ~ 6.5 مليون cells35. وبالتالي، كل لكمة شبكية قطرها 1 ملم هو ~ 1/25 من شبكية العين واحدة ويحتوي على خلايا ~ 260K. يمكن للمرء أن يشير إلى هذه الأرقام عند مقارنة البيانات من لكمة شبكية العين لتلك الموجودة من عينات الأنسجة الأخرى أو الخلايا المستزرعة،
النتائج
البيانات المبلغ عنها هنا هي تمثيلية الميتوكوندريا الإجهاد المقايسة تظهر تتبع OCR (الشكل 1) ونسبة السكر في تحليل يظهر تتبع OCR وتتبع ECAR (الشكل 2)، والتي أجريت باستخدام تشريح حديثا 1 مم أقراص لكمة الشبكية من 4 أشهر من العمر المعدلة وراثيا NRL-L-EGFP mice36
Discussion
وترد هنا تعليمات مفصلة لأداء المقايسات القائمة على الألواح الدقيقة من التنفس الميتوكوندريا ونشاط انحلال الجليكوليسيس باستخدام الجسم الحي السابق، وأقراص لكمة الشبكية تشريح حديثا. وقد تم تحسين البروتوكول إلى: 1) ضمان استخدام وسيطة المقايسة مناسبة للأنسجة الشبكية في الجسم الحي السا...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ويدعم هذا العمل برنامج البحوث داخل العين التابع للمعهد الوطني للعيون (ZIAEY000450 وZIAEY000546).
Materials
| Name | Company | Catalog Number | Comments |
| 1X PBS | Thermo Fisher | 14190-144 | |
| 2-Deoxy glucose (2-DG), 500 mM stock solution | Sigma | D6134 | Dissolve in Seahorse XF DMEM medium, prepare ahead of time |
| 30-gauge needle | BD Precision Glide | 305106 | |
| Antimycin A, 10 mM stock solution | Sigma | A8674 | Dissolve in DMSO, prepare ahead of time |
| Bam15, 10 mM stock solution | TimTec | ST056388 | Dissolve in DMSO, prepare ahead of time |
| Biopsy puncher, 1 mm | Integra Miltex | 33-31AA | |
| Cell-Tak | Corning Life Sciences | CB40240 | |
| CO2 asphyxiation chamber | |||
| Dissection forceps-Dumont #5 | Fine Science Tools | 11251-10 | Stright tip |
| Dissection forceps-Dumont #7 | Fine Science Tools | 11274-20 | Curved tip |
| Dissection microscope | |||
| DMSO | Sigma | D2438 | |
| Graefe forceps | Fine Science Tools | 11051-10 | Curved, Serrated tip |
| Microscissors | Fine Science Tools | 15004-08 | Curved tip |
| NaOH solution, 1 M | Sigma-Aldrich | S8263 | Aqueous solution, prepare ahead of time |
| Rotenone, 10 mM stock solution | Sigma | R8875 | Dissolve in DMSO, prepare ahead of time |
| Seahorse calibration medium | Agilent | 100840-000 | |
| Seahorse XF 1.0 M glucose | Agilent | 103577-100 | |
| Seahorse XF 100 mM pyruvate | Agilent | 103578-100 | |
| Seahorse XF 200 mM glutamine | Agilent | 103579-100 | |
| Seahorse XF DMEM medium | Agilent | 103575-100 | pH 7.4, with 5 mM HEPES |
| Seahorse XFe24 Islet Capture FluxPak | Agilent | 103518-100 | Containing Sensor Cartridge and Islet Capture microplate |
| Seahorse XFe24, Extra Cellular Flux Analyzer | Agilent | ||
| Sodium bicarbonate solution, 0.1 M | Sigma-Aldrich | S5761 | Aqueous solution, prepare ahead of time |
| Superfine eyelash brush | Ted Pella | 113 |
References
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wong-Riley, M. T. Energy metabolism of the visual system. Eye Brain. 2, 99-116 (2010).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retina and Eye Research. 20, 175-208 (2001).
- Barot, M., Gokulgandhi, M. R., Mitra, A. K. Mitochondrial dysfunction in retinal diseases. Current Eye Research. 36 (12), 1069-1077 (2011).
- Joyal, J. S., Gantner, M. L., Smith, L. E. H. Retinal energy demands control vascular supply of the retina in development and disease: The role of neuronal lipid and glucose metabolism. Progress in Retina and Eye Research. 64, 131-156 (2018).
- Hurley, J. B., Lindsay, K. J., Du, J. Glucose, lactate, and shuttling of metabolites in vertebrate retinas. Journal of Neuroscience Research. 93 (7), 1079-1092 (2015).
- Haydinger, C. D., Kittipassorn, T., Peet, D. J. Power to see-Drivers of aerobic glycolysis in the mammalian retina: A review. Clinical and Experimental Ophthalmology. 48 (8), 1057-1071 (2020).
- Wright, A. F., et al. Lifespan and mitochondrial control of neurodegeneration. Nature Genetics. 36, 1153-1158 (2004).
- Bossy-Wetzel, E., Schwarzenbacher, R., Lipton, S. A. Molecular pathways to neurodegeneration. Nature Medicine. 10, 2-9 (2004).
- Leveillard, T., Philp, N. J., Sennlaub, F. Is retinal metabolic dysfunction at the center of the pathogenesis of age-related macular degeneration. International Journal of Molecular Sciences. 20 (3), (2019).
- Vlachantoni, D., et al. Evidence of severe mitochondrial oxidative stress and a protective effect of low oxygen in mouse models of inherited photoreceptor degeneration. Human Molecular Genetics. 20 (2), 322-335 (2011).
- Grenell, A., et al. Loss of MPC1 reprograms retinal metabolism to impair visual function. Proceedings of the National Academy of Science U. S. A. 116 (9), 3530-3535 (2019).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews in Genetics. 11 (4), 273-284 (2010).
- Jarrett, S. G., Boulton, M. E. Consequences of oxidative stress in age-related macular degeneration. Molecular Aspects of Medicine. 33 (4), 399-417 (2012).
- Rozing, M., et al. Age-related macular degeneration: A two-level model hypothesis. Progress in Retina Eye Research. 76, 100825 (2020).
- Yokosako, K., et al. Glycolysis in patients with age-related macular degeneration. Open Ophthalmology Journal. 8, 39-47 (2014).
- Bek, T. Mitochondrial dysfunction and diabetic retinopathy. Mitochondrion. 36, 4-6 (2017).
- Yumnamcha, T., Guerra, M., Singh, L. P., Ibrahim, A. S. Metabolic dysregulation and neurovascular dysfunction in diabetic retinopathy. Antioxidants. 9 (12), (2020).
- Futterman, S., Kinoshita, J. H. Metabolism of the retina. I. Respiration of cattle retina. Journal of Biological Chemistry. 234 (4), 723-726 (1959).
- Linsenmeier, R. A. Effects of light and darkness on oxygen distribution and consumption in the cat retina. Journal of General Physiology. 88 (4), 521-542 (1986).
- Medrano, C. J., Fox, D. A. Oxygen consumption in the rat outer and inner retina: light- and pharmacologically-induced inhibition. Experiments in Eye Research. 61 (3), 273-284 (1995).
- Kooragayala, K. Quantification of oxygen consumption in retina ex vivo demonstrates limited reserve capacity of photoreceptor mitochondria. Investigative Ophthalmology and Visual Science. 56 (13), 8428-8436 (2015).
- Adlakha, Y. K., Swaroop, A. Determination of mitochondrial oxygen consumption in the retina ex vivo: applications for retinal disease. Methods in Molecular Biology. 1753, 167-177 (2018).
- . Agilent Mitocondrial stress test user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Cell_Mito_Stress_Test_Kit_User_Guide.pdf (2021)
- . Agilent Glycolytic rate assay user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . Agilent wave 2.6 user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . AVMA Guidelines for the Euthanasia of Animals Available from: https://www.avma.org/sites/default/files/2020-01/2020-Euthanasia-Final-1-17-20.pdf (2021)
- . Improving Quantification of Cellular Glycolytic Rate Using Agilent Seahorse XF Technology Available from: https://www.agilent.com/cs/library/whitepaper/public/whitepaper-improve-quantification-of-cellular-glycolytic-rate-cell-analysis-5991-7894en-agilent.pdf (2021)
- . Report Generator User Guide Agilent Seahorse XF Cell Mito Stress Test Available from: https://www.agilent.com/cs/library/usermanuals/public/Report_Generator_User_Guide_Seahorse_XF_Cell_Mito_Stress_Test_Single_File.pdf (2021)
- . Agilent Seahorse XF Buffer Factor Protocol Available from: https://www.agilent.com/cs/library/usermanuals/public/usermanual-xf-buffer-factor-protocol-cell-analysis-S7888-10010en-agilent.pdf (2021)
- . Agilent sensor cartridges and cell culture microplates Available from: https://www.agilent.com/cs/library/brochures/5991-8657EN_seahorse_plastics_brochure.pdf (2021)
- . Agilent Seahorse XF Glycolysis Stress Test Kit User Guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Glycolysis_Stress_Test_Kit_User_Guide.pdf (2021)
- Fan, Y. Y. A bioassay to measure energy metabolism in mouse colonic crypts, organoids, and sorted stem cells. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309, 1-9 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. Journal of Neuroscience. 18 (21), 8936-8946 (1998).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proceedings of the National Academy of Science U. S. A. 103 (10), 3890-3895 (2006).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Corso-Diaz, X., et al. Genome-wide profiling identifies DNA methylation signatures of aging in rod photoreceptors associated with alterations in energy metabolism. Cell Reports. 31 (3), 107525 (2020).
- Berkowitz, B. A., et al. Mitochondrial respiration in outer retina contributes to light-evoked increase in hydration in vivo. Investigative Ophthalmology and Visual Science. 59 (15), 5957-5964 (2018).
- Joyal, J. S., et al. Retinal lipid and glucose metabolism dictates angiogenesis through the lipid sensor Ffar1. Nature Medicine. 22 (4), 439-445 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved