A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קביעת נשימה מיטוכונדריאלית וגליקוליזיס בדגימות רקמת רשתית Ex Vivo
In This Article
Summary
מתואר כאן פרוטוקול מפורט לביצוע בדיקת מתח מיטוכונדריאלית ובוחן קצב גליקוליטי בדגימות רקמת רשתית ex vivo באמצעות ביואנלייזר מסחרי.
Abstract
נשימה מיטוכונדריאלית היא מסלול קריטי לייצור אנרגיה בכל התאים, במיוחד קולטני אור ברשתית בעלי חילוף חומרים פעיל מאוד. בנוסף, קולטני אור מציגים גם גליקוליזה אירובית גבוהה כמו תאים סרטניים. מדידות מדויקות של פעילויות מטבוליות אלה יכולות לספק תובנות חשובות על הומאוסטזיס תאי בתנאים פיזיולוגיים ובמדינות מחלה. בדיקות מבוססות מיקרו-לוחית בעלות תפוקה גבוהה פותחו כדי למדוד נשימה מיטוכונדריאלית ופעילויות מטבוליות שונות בתאים חיים. עם זאת, רובם המכריע של אלה מפותחים עבור תאים מתורבתים ולא עברו אופטימיזציה עבור דגימות רקמה שלמה עבור יישום ex vivo. מתואר כאן פרוטוקול מפורט שלב אחר שלב, באמצעות טכנולוגיית פלואורסצנטיות מבוססת מיקרופלסטיט, כדי למדוד ישירות את קצב צריכת החמצן (OCR) כאינדיקטור לנשימה מיטוכונדריאלית, כמו גם שיעור החמצה חוץ תאית (ECAR) כאינדיקטור לגליקוליזיס, ברקמת רשתית ex vivo שלמה. שיטה זו שימשה כדי להעריך בהצלחה פעילויות מטבוליות רשתית עכבר למבוגרים ולהדגים את היישום שלה בחקירת מנגנונים תאיים של הזדקנות ומחלות.
Introduction
המיטוכונדריה הם אברונים חיוניים המווסתים את חילוף החומרים התאי, איתות, הומאוסטזיס, אפופטוזיס על ידי תיאום תהליכים פיזיולוגיים חיוניים מרובים1. המיטוכונדריה משמשת תחנת הכוח בתא ליצירת אדנוסין טריפוספט (ATP) באמצעות זרחן חמצוני (OXPHOS) ולספק אנרגיה התומכת כמעט בכל האירועים התאיים. רוב החמצן התאי מטבוליזם במיטוכונדריה, שם הוא משמש כקבל האלקטרונים הסופי בשרשרת הובלת האלקטרונים (ETC) במהלך נשימה אירובית. כמויות נמוכות של ATP ניתן גם לייצר גליקוליזה בציטוסול, שבו גלוקוז מומר pyruvate, אשר ניתן להמיר עוד יותר לקטט או להיות מועבר לתוך מיטוכונדריה מחומצן אצטיל-CoA, מצע במחזור חומצה tricarboxylic (מחזור TCA).
הרשתית היא אחת הרקמות הפעילות ביותר מבחינה מטבולית ביונקים2, המציגה רמות גבוהות של נשימה מיטוכונדריאלית וצריכת חמצן גבוהה מאוד3. מוט ו photoreceptors חרוט מכילים צפיפות גבוהה של מיטוכונדריה4, ו OXPHOS מייצר את רוב ATP ברשית5. בנוסף, הרשתית מסתמכת גם בכבדות על גליקוליזה אירובית6,7 על ידי המרת גלוקוז לקטט5. פגמים מיטוכונדריאליים קשורים למחלות ניווניות שונות8,9; ועם דרישות האנרגיה הגבוהה הייחודיות שלה, הרשתית פגיעה במיוחד לפגמים מטבוליים, כולל אלה המשפיעים על OXPHOS4 מיטוכונדריאלי וגליקוליזיס10. תפקוד לקוי מיטוכונדריאלי ופגמים בגליקוליזיס מעורבים במחלות ניווניות ברשתית11,12 ו- macular13, ניוון מקולרי הקשור לגיל10,14,15,16, ורטינופתיה סוכרתית17,18. לכן, מדידות מדויקות של נשימה מיטוכונדריאלית וטליקוליזה יכולות לספק פרמטרים חשובים להערכת שלמות ובריאות הרשתית.
ניתן למדוד נשימה מיטוכונדריאלית באמצעות קביעת שיעור צריכת החמצן (OCR). בהתחשב בכך ההמרה של גלוקוז pyruvate ולאחר מכן לקטט תוצאות שחול של פרוטונים לתוך חמצה של הסביבה החוץ תאית, מדידות של שיעור החמצה חוץ תאית (ECAR) לספק אינדיקציה של שטף גליקוליזה. כמו הרשתית מורכבת מסוגי תאים מרובים עם יחסים אינטימיים וסינרגיה פעילה, כולל חילופי מצעים6, זה הכרחי לנתח את התפקוד המיטוכונדריאלי ואת חילוף החומרים בהקשר של רקמת הרשתית כולה עם למינציה ומעגלים שלמים. במשך העשורים האחרונים, אלקטרודות O2 מסוג קלארק ומיקרו-ectectrodes חמצן אחרים שימשו למדידת צריכת חמצן ברשתית19,20,21. אלקטרודות חמצן אלה יש מגבלות עיקריות ברגישות, דרישה של נפח מדגם גדול, ואת הצורך ערבוב מתמשך של דגימת השעיה, אשר בדרך כלל מוביל להפרעה של הקשר הסלולר והרקמות. הפרוטוקול המתואר כאן פותח באמצעות טכניקה מבוססת מיקרו-פלאט, פלואורסצנטיות למדידת חילוף החומרים של אנרגיה מיטוכונדריאלית ברקמת רשתית עכבר ex vivo ניתחה זה עתה. זה מאפשר מדידות בזמן אמת באמצע תפוקה של OCR ו- ECAR בו זמנית באמצעות מדגם קטן (פונץ '1 מ"מ) של רקמת רשתית ex vivo תוך הימנעות הצורך השעיה ערבוב מתמשך.
הוכח כאן הוא ההליך הניסיוני לבדיקת מתח מיטוכונדריאלי ובוחן קצב גליקוליטי על דיסקי ניקוב רשתית שזה עתה נותחו. פרוטוקול זה מאפשר מדידה של פעילויות מטבוליות הקשורות במיטוכונדריה בהקשר של רקמת ex vivo. בשונה מבוחות שבוצעו באמצעות תאים מתורבתים, הקריאות המתקבלות כאן משקפות את חילוף החומרים של האנרגיה המשולבת ברמת הרקמה ומושפעות מאינטראקציות בין סוגי התאים השונים בתוך הרקמה. הפרוטוקול משתנה מגרסה שפורסמה בעבר22,23 כדי להסתגל לדור החדש של מנתח השטף החוץ-תאי Agilent Seahorse 24-בארות (XFe24) עם צלחת לכידת אי. בינוני אסאי, ריכוזי תרכובת הזרקה, ומספר/משך של מחזורי בדיקת אופטימיזציה גם עבור רקמת הרשתית. פרוטוקול מפורט שלב אחר שלב ניתן להכנת דיסקים ניקוב רשתית. מידע נוסף על הגדרת התוכנית וניתוח נתונים ניתן לקבל ממדריך המשתמש של היצרן24,25,26.
Protocol
כל פרוטוקולי העכבר אושרו על ידי הוועדה לטיפול בבעלי חיים ושימוש במכון העיניים הלאומי (NEI ASP# 650). עכברים שוכנו בתנאים כהים של 12 שעות ויטופלו על ידי ביצוע המלצות המדריך לטיפול ושימוש בחיות מעבדה, המכון למשאבי בעלי חיים במעבדה ומדיניות שירות הבריאות הציבורי לטיפול אנושי ושימוש בחיות מעבדה.
1. מחסנית חיישן לחות והכנת מדיום ה- Assay
- יום לפני הניסוי, להוסיף 1 מ"ל של מדיום הכיול לכל באר של צלחת השירות. הנח את כיסוי ההידרו-בוסטר בחלק העליון והנמיך את מחסנית החיישן דרך הפתח על הכיסוי. ודא כי החיישן שקוע במדיום הכיול. לדגור את מחסנית החיישן לילה בחממה CO2 חינם ב 37 °C (37 °F) כדי להפעיל את fluorophores.
הערה: כדי למנוע אידוי, החממה לחה על ידי שמירת מגש מים בפנים, ואת קלטת מחסנית החיישן עטוף בניילון נצמד. - הכן את מדיום הבדיקה על ידי שחזור מדיום DMEM סוסון הים עם תוספת של גלוקוז, פירובט וגלוטמין לריכוזים הרצויים. בבחינות שדווחו במאמר זה, הריכוז הסופי של מצעים במדיום ההסתה הם: 6 mM של גלוקוז, 0.12 מ"מ של פירובט, ו 0.5 mM של גלוטמין. עבור כל צלחת מ"ל, 40 מ"ל של מדיום אסאי מוכן טרי ביום הניסוי.
- הגדר את תוכנית ה- assay במנתח בהתאם להוראת היצרן26. ב- assay המודגם כאן, הפרוטוקול מוגדר כדלקמן: 5 מחזורים של מדידות עבור בסיסי, ולאחר מכן להזריק יציאה A, ואחריו 4 מחזורים של מדידות, ולאחר מכן להזריק יציאה B ואחריו 4 מחזורים של מדידות. כל מחזור מורכב מתערובת (3 דקות), לחכות (2 דקות) ולמדוד (3 דקות).
2. ציפוי תוספות רשת של מיקרו-לוח לכידת איים
- הכן את תערובת הציפוי על ידי שילוב של 20 μL של מדיום מצורף התא (למשל, Cell-Tak) עם 171 μL של 0.1 M נתרן ביקרבונט ו 9 μL של 1 M NaOH.
- פתח את המכסה של הקלטת המכילה תוספות רשת. Pipette 8 μL של תערובת הציפוי לכל מוסיף רשת. השתמשו בקצה פיפטה כדי למרוח/לפזר בעדינות את הטיפה כדי לפזר את תערובת הציפוי באופן שווה לאורך כל התוספת של הרשת.
- סגור את הקלטת ואפשר לתוספות הרשת לדגור בטמפרטורת החדר למשך 25 דקות לפחות לספיגה.
- לשטוף את רשת להוסיף על ידי pipetting 4 מ"ל של בינוני assay ישירות על תוספות רשת. יש לנער בעדינות את הקלטת כדי להבטיח שכל התוספות של הרשת נשטפות עם מדיום ה-assay.
- שמור את רשת ההוספה בצד. הוא מוכן לשימוש.
3. הכנת תרכובות הזרקה
- הוציאו עליונים של Bam15 (10 מ"מ), רוטנון (10 מ"מ), אנטימצין A (10 מ"מ) ו-2-DG (500 מ"ר) ממקפיא של -80 מעלות צלזיוס והפשיר בטמפרטורת החדר.
הערה: מלאי 2-DG מוכן לשימוש. התרופות האחרות צריכות להיות מדוללות למלאי עובד. - לחמם 10 מ"ל של בינוני אסאי באמבט מים 37 °C(37 °F).
- לדלל 10 mM Bam15 מניות כדי 50 μM עובד מניות באמצעות הליך דילול דו שלבי: לערבב 20 μL של 10 mM מניות עם 20 μL של DMSO כדי לקבל 5 mM מניות ביניים. לאחר מכן לערבב 10 μL של מלאי ביניים מעל 5 mM עם 990 μL של בינוני אשוח התחמם מראש כדי לקבל את המלאי האחרון 50 μM עובד.
- לדלל ולשלב 10 mM רוטנון ו 10 mM אנטימיצין מניה ל 10 μM רוטנון / אנטימצין A (רוט/AA) עובד מניות על ידי שני שלבים של דילול: לערבב 10 μL כל אחד של 10 mM רוטנון ו 10 mM אנטימיצין A מניות עם 80 μL של DMSO כדי לקבל 1 mM Rot / AA מניות ביניים. לאחר מכן לערבב 10 μL של מלאי ביניים מעל 1 mM עם 990 μL של בינוני אסאי מחמם מראש כדי לקבל את 10 μM רוט האחרון / AA עובד מניות.
- הכן טרי את מלאי העבודה הנ"ל של תרכובות הזרקה ביום הניסוי והניח אותם בצד בטמפרטורת החדר עד לטעינה ליציאות הזרקה של מחסנית החיישן.
4. ניתוח רשתית והכנת אגרוף רשתית
- המתת חסד עכבר על ידי חנק CO2 בעקבות הנחיות AVMA על המתת חסד27.
הערה: אין להשאיר את החיה בתא CO2 זמן רב יותר מהזמן הדרוש להמתת חסד. - יש להקפיץ עיניים ולהניח לתוך חיץ PBS 1x ישן בקרח בצלחת פטרי ולאחר מכן למקם אותו תחת מיקרוסקופ ביתוח.
- הסר בזהירות, על ידי חיתוך עם microscissors, שרירי רקטוס נוסף מחובר מחוץ גלגל העין לחתוך את עצב הראייה.
- השתמש מחט 30 G כדי ניקוב חור בקצה הקרנית (לימבוס); זה משמש כאתר ההכנסה עבור microscissors. לאחר מכן, השתמש microscissors ביתור עדין כדי להפוך חתך מעגלי לאורך קצה הקרנית, הפרדתו מכוס העין האחורית.
- השתמש במלקחיים חדים כדי להסיר את הקרנית, העדשה ואת ההומור הזגג הרחק מכוס העין.
- השתמש microscissors ניתוח עדין כדי להפוך כמה חתכים קטנים על השכבה scleral בקצה של העין. הימנע חיתוך שכבת הרשתית. השתמש בשני מלקחיים חדים כדי להחזיק ברקמת הסקלרלי בכל צד של החתך ולמשוך בזהירות רבה את השכבה הסקלרלית כדי להסיר אותה מהרשתית העצבית. חזור על זה סביב העין עד שכל sclera מוסר רשתית שלמה מתקבלת.
- השתמש microscissors ביתור ולעשות חתכים רדיאליים על הרשתית כדי לשטח אותו וליצור כמה חלקים נפרדים.
הערה: בהתאם לכישורי הניתוח והניסיון של האדם בטיפול ברקמת רשתית טרייה, ניתן לחתוך את הרשתית כדי ליצור 3 עד 5 חלקים נפרדים. - השתמש במחבט ביופסיה בקוטר 1 ממ כדי לחתוך דיסק רשתית אחד מכל חלק של הרשתית השטוחה.
הערה: יש להקפיד על כך שדיסק הרשתית יכה במרחק שווה מראש עצב הראייה. - השתמש במלקחיים כדי להעביר את תוספות רשת מצופה מראש לתוך צלחת פטרי לנתח. בעזרת שתי מברשות ריסים superfine, מניחים את דיסק ניקוב הרשתית על הכנס רשת. דיסק ניקוב הרשתית ממוקם במרכז הכנס הרשת עם צד שכבת תא גנגליון כלפי מטה נוגעים ברשת ושכבת קולטן הפוטו-קולטור הפונה כלפי מעלה.
הערה: לעתים קרובות, כמה תאי RPE נשארים מחוברים קולטני אור, ואת הפיגמנטציה של תאים אלה יכול לשמש אינדיקטור של כיוון דיסק ניקוב הרשתית.
5. טעינת יציאות הזרקת מחסנית החיישנים וכיול
- הוציא את קלטת צלחת מחסנית החיישן הלחות מתוך החממה של 37 מעלות צלזיוס. הסר את כיסוי Hydro-Booster והחזר את מחסנית החיישן ללוח השירות.
- טען את הנפח הרצוי של פתרונות מלאי עבודה מורכב הזרקה לתוך יציאות מתאימות. החזק את קצה הפיפטה בזווית של 45 מעלות. הכנס את קצה הפיפטה באמצע הדרך ליציאת הזרקה עם שיפוע הקצה כנגד הקיר הנגדי של יציאת ההזרקה וטען בעדינות את המתחם לכל יציאה. הימנעו מהכנסת בועות אוויר.
- עיין במדריך למשתמש במכשיר עבור עוצמת הקול של המתחם שנטען בכל יציאת הזרקה לבדיקה ספציפית. בניסויים שהוצגו במאמר זה, 68 μL של 50 μM Bam15 ממלאי עבודה (לבדיקת מתח מיטוכונדריאלי) או 68 μL של 10 μM Rot / AA עובד מניות (עבור שיעור גליקוליטי assay) נטען לתוך נמל A; 75 μL של 10 μM רוט / AA עובד מניות (עבור הלחץ המיטוכונדריאלי assay) או 75 μL של 500 mM 2-DG עבודה מניות (עבור שיעור גליקוליטי assay) נטען לתוך יציאה B.
- יציאות הזרקת עומס של כל בארות הצלחת כולל בארות תיקון רקע ובארות ריקות כדי להבטיח הזרקה נכונה. טען את הפתרון המורכב המתאים בכל יציאה עבור בארות תיקון הרקע. ניתן להחליף מדיום אשי, במקום הפתרון המורכב, בכל אחת מנמלי בארות הבנק.
- הנח את צלחת מחסנית החיישן הטעון, עם מכסה כבוי, לתוך מכונת המנתח כדי להתחיל כיול לפני הריצה. לאחר שהכיול נגמר, התוכנית תושהה באופן אוטומטי, מחכה להחלפת צלחת השירות עם צלחת לכידת האי המכיל אגרופים רשתית.
6. טעינת צלחת לכידת האי ולהתחיל לרוץ
- הוסף 607 μL של בינוני אסאי לכל באר של צלחת לכידת האי
- השתמש במלקחיים כדי לתפוס את שפת הכניסה רשת המכיל דיסקים ניקוב רשתית על גבי ולהוציא אותו מן צלחת פטרי. הקש קלות על החלק התחתון של רשת להוסיף על רקמת לנגב סופג כדי להסיר נוזל נוסף ולשים אותו לתוך הבאר של צלחת לכידת האי. חזור על שלב זה עד שכל התוספות רשת עם אגרופים רשתית ממוקמים לתוך צלחת לכידת האי. מלא בארות תיקון רקע ובארות ריקות עם תוספות רשת ריקות.
- השתמש בשני מלקחיים של גראף כדי ללחוץ בזהירות ובעדינות על שפת כל הוספת רשת ולוודא שהם מוכנסים בבטחה בתחתית צלחת לכידת האי.
- מניחים את צלחת לכידת האי הטעון לתוך אינקובטור 37 °C במשך 5 דקות כדי להתחמם.
- הופלט את צלחת השירות לאחר השלמת הכיול והחלף אותה בצלחת לכידת האי, עם מכסה כבוי, המכיל אגרופים ברשתית.
- תחדש את ריצת ההסתה.
7. הפעלת סיום ואחסון נתונים
- לאחר השלמת הריצה, להוציא את מחסנית החיישן ואת צלחת לכידת האי המכיל אגרופים רשתית. הנתונים נשמרים באופן אוטומטי כקובץ .asyr
- השתמש בתוכנת ניתוח הנתונים המשויכת כדי להציג ולנתח את הנתונים בהתאם למדריך למשתמש של היצרן26.
- השתמש בפונקציה Export כדי לייצא קובץ .xslx של הנתונים, שניתן להציג ולנתח באמצעות תוכנת גיליון אלקטרוני.
8. שמירת דגימת אגרוף הרשתית
- לאחר ההסרה, הוציאו את הצלחת מהמכונה, הסירו את מחסנית החיישן והוציאו בעדינות את מדיום ההסתה מכל באר באמצעות פיפטה.
- החל את הכיסוי בחזרה על ולאטום את הצדדים של הצלחת עם רצועת parafilm.
- יש לאחסן ב-80 °C (70 °F).
- לנורמליזציה, לכמת את תכולת ה- DNA או החלבון הכוללת של האגרוף בכל באר.
9. ניתוח נתונים
- מבחן מתח מיטוכונדריאלי
הערה: ערך זיהוי האו-און האום האום האון אוקטו (totalOCR) הנמדד מייצג את צריכת החמצן הכוללת על ידי הרקמה. לאחר הזרקת Bam15 (uncoupler), זיהוי OCR עולה מרמת הבזל (totalOCRbasal) לרמה המרבית (totalOCRmax) ויורד בעקבות הזרקת Rot/AA. ערך זיהוי האום אוטורי (OCR) השיורי לאחר הזרקת Rot/AA (totalOCRRot/AA) מייצג צריכת חמצן שאינה מיטוכונדריאלית.- חשב צריכת חמצן הקשורה במיטוכונדריה כ:
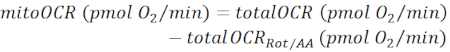 (א"ק 1) 28
(א"ק 1) 28
- חשב את קיבולת העתודה המיטוכונדריאלית (MRC) כ:
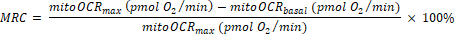 (א"ק 2) 29
(א"ק 2) 29
הערה: הקריאה האחרונה בין 5 המדידות לפני הזרקת Bam15 נלקחת כערך "בזאלי" (עבור totalOCRbasal ו mitoOCRbasal). הקריאה הגבוהה ביותר מבין 4 המדידות לאחר הזרקת Bam15 משמשת כערך "מקסימום" (עבור totalOCRmax ו- mitoOCRmax). הקריאה הנמוכה ביותר מבין 4 המדידות לאחר הזרקת הרוטציה/AA משמשת כ- totalOCRRot/AA.
- חשב צריכת חמצן הקשורה במיטוכונדריה כ:
- שיעור גליקוליטי
הערה: ערך ECAR הנמדד (totalECAR) מייצג את החמצת המדיום הכוללת על ידי הפעילות המטבולית של הרקמה. באופן כללי, החמצה של מיקרו-סביבה חוץ תאית תוצאות בעיקר על ידי שחול של המוצר הגליקוליטי, לקטט. קטבוליזם של מצעים במחזור TCA מיטוכונדריאלי תוצאות בייצור של CO2, אשר גם חומצי את המדיום החוץ תאי באמצעות הידרציה כדי ביקרבונט.- מיטוכונדריאלי תת-מערכת תרם החמצה בינונית (mitoECAR) מ- totalECAR כדי להשיג את הגליקו-קאר.
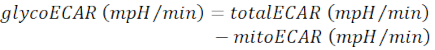 (א"ק 3) 28
(א"ק 3) 28
הערה: נשימה מיטוכונדריאלית ומחזור TCA הם תהליכים מצמידים מאוד. ייצור CO2 מהמיטוכונדריה הוא פונקציה של קצב OXPHOS, אשר ניתן למדידה על ידי mitoOCR. - חשב את המיטו-קאר כ:
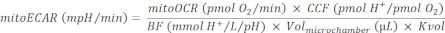 (א"ק 4) 28
(א"ק 4) 28
כאשר, CCF (גורם תרומת CO2) הוא ערך יחס מחושב אמפירית, המייצג את כמות תרומת H + מהחמצה מתווכת CO2 לעומת כל צריכת O2 מ- OXPHOS. CCF עבור מערכת זו נקבע מראש להיות 0.6028. מדידה מדויקת של החמצה בינונית נקבעת על ידי קיבולת החיץ של המדיום, הרגישות של חיישן ה- pH של המכשיר וקיבולת תא המדידה היעילה. כאן, BF (גורם חוצץ) הוא פרמטר של קיבולת חיץ ניסיוני in situ, המייצג את כמות H + או OH - הוסיף לתא המדידה היעיל כדי לשנות את רמת ה- pH על ידי יחידה אחת. כאשר נעשה שימוש במדיום בדיקת assay מותאם אישית, ניתן לקבוע את ה- BF על ידי טיטרציה כמויות ידועות של חומצה למדיום בדיקת בעקבות פרוטוקול גורם המאגר30. ל- PH בינוני מסוג סוסון ים 7.4 המשמש בפרוטוקול זה יש BF שנקבע מראש של 2.60 mmol H+/L/pH. לוח לכידת האי המשמש בפרוטוקול זה כולל Volmicrochamber = 16.6 μL31. גורם שינוי קנה המידה של הנפח, Kvol, הוא קבוע שנקבע אמפירית. ערך Kvol אינו זמין עבור צלחת לכידת האי, אך ניתן לחשב אותו מהערך של המיקרו-לוח28, המסביר שהפרש הנפח במיקרו-צ'אמברים שלהם הוא 0.41.
הערה: הזרקת הרוט/AA משביתה את הנשימה המיטוכונדריאלית ומאלצת את הרקמה לעבור לגליקוליזיס לייצור ATP, מה שמוביל לשחול לקטט גבוה יותר ולעלייה במדידת ECAR. גליקוליזה נפסקת עם הזרקת 2-DG, ומדידת ECAR שיורית מגלה החמצה לא גליקולית ולא מיטוכונדריאלית של בינוני. - חשב את קיבולת העתודה הגליקוליטית (GRC) כ:
 (א"ק 5) 32
(א"ק 5) 32
כאשר, הקריאה האחרונה בין 5 המדידות לפני הזרקת Rot /AA נלקחת כערך "בזאלי" (glycoECARbasal). הקריאה הגבוהה ביותר מבין 4 המדידות לאחר הזרקת Rot/AA משמשת כערך "מקסימום" (glycoECARmax). הקריאה הנמוכה ביותר מבין 4 המדידות לאחר הזרקת 2-DG משמשת כ- glycoECAR2-DG.
- מיטוכונדריאלי תת-מערכת תרם החמצה בינונית (mitoECAR) מ- totalECAR כדי להשיג את הגליקו-קאר.
- נרמול
הערה: נורמליזציה חיונית בעת השוואת הקריאות מרקמות רשתית של קבוצות גיל שונות או בין סוג פראי ודגימות פתולוגיות /ניווניות, אשר עשוי להיות שונה במספרי התאים.- השתמש בערכות זמינות באופן קומי כדי להעריך את תוכן ה- DNA בכל דיסק ניקוב רשתית33,34.
- לחלופין, השתמש במאגר לבדיקת אסאי radioimmunoprecipitation (חיץ RIPA) כדי לחלץ חלבון כולל מחבט הרשתית ולהשתמש בתוכן החלבון לנורמליזציה.
הערה: שטח הפנים של רשתית עכבר בוגרת נקבע בעבר להיות סביב 20 מ"מ2, וכל רשתית מכילה ~ 6.5 מיליון תאים35. לפיכך, כל פונץ' רשתית בקוטר 1 מ"מ הוא ~ 1/25 של רשתית אחת ומכיל ~ 260K תאים. אפשר להתייחס למספרים האלה כאשר משווים את הנתונים מחבט רשתית לאלה מדגימות רקמות אחרות או תאים מתורבתים,
תוצאות
הנתונים המדווחים כאן הם בדיקת לחץ מיטוכונדריאלית מייצגת המציגה עקבות זיהוי התווים האופטי (איור 1) ובוחן קצב גליקוליטי המציג עקבות זיהוי OCR ועקבות ECAR (איור 2), שבוצעו באמצעות דיסקים של ניקוב רשתית 1 מ"מ טריים מעכברי Nrl-L-EGFP מהונדסים בני 4 חודשים (רק...
Discussion
כאן מפורטות הוראות לביצוע בדיקות מבוססות מיקרו-פלט של נשימה מיטוכונדריאלית ופעילות גליקוליזה באמצעות דיסקים של ניקוב רשתית ex vivo, שניתחו זה עתה. הפרוטוקול עבר אופטימיזציה ל: 1) להבטיח שימוש במדיום בדיקת אסאי מתאים לרקמת רשתית ex vivo ; 2) להעסיק בגודל הנכון של דיסקים ניקוב רשתית כדי לק...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכת על ידי תוכנית המחקר התוך-ארצית של מכון העיניים הלאומי (ZIAEY000450 ו- ZIAEY000546).
Materials
| Name | Company | Catalog Number | Comments |
| 1X PBS | Thermo Fisher | 14190-144 | |
| 2-Deoxy glucose (2-DG), 500 mM stock solution | Sigma | D6134 | Dissolve in Seahorse XF DMEM medium, prepare ahead of time |
| 30-gauge needle | BD Precision Glide | 305106 | |
| Antimycin A, 10 mM stock solution | Sigma | A8674 | Dissolve in DMSO, prepare ahead of time |
| Bam15, 10 mM stock solution | TimTec | ST056388 | Dissolve in DMSO, prepare ahead of time |
| Biopsy puncher, 1 mm | Integra Miltex | 33-31AA | |
| Cell-Tak | Corning Life Sciences | CB40240 | |
| CO2 asphyxiation chamber | |||
| Dissection forceps-Dumont #5 | Fine Science Tools | 11251-10 | Stright tip |
| Dissection forceps-Dumont #7 | Fine Science Tools | 11274-20 | Curved tip |
| Dissection microscope | |||
| DMSO | Sigma | D2438 | |
| Graefe forceps | Fine Science Tools | 11051-10 | Curved, Serrated tip |
| Microscissors | Fine Science Tools | 15004-08 | Curved tip |
| NaOH solution, 1 M | Sigma-Aldrich | S8263 | Aqueous solution, prepare ahead of time |
| Rotenone, 10 mM stock solution | Sigma | R8875 | Dissolve in DMSO, prepare ahead of time |
| Seahorse calibration medium | Agilent | 100840-000 | |
| Seahorse XF 1.0 M glucose | Agilent | 103577-100 | |
| Seahorse XF 100 mM pyruvate | Agilent | 103578-100 | |
| Seahorse XF 200 mM glutamine | Agilent | 103579-100 | |
| Seahorse XF DMEM medium | Agilent | 103575-100 | pH 7.4, with 5 mM HEPES |
| Seahorse XFe24 Islet Capture FluxPak | Agilent | 103518-100 | Containing Sensor Cartridge and Islet Capture microplate |
| Seahorse XFe24, Extra Cellular Flux Analyzer | Agilent | ||
| Sodium bicarbonate solution, 0.1 M | Sigma-Aldrich | S5761 | Aqueous solution, prepare ahead of time |
| Superfine eyelash brush | Ted Pella | 113 |
References
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wong-Riley, M. T. Energy metabolism of the visual system. Eye Brain. 2, 99-116 (2010).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retina and Eye Research. 20, 175-208 (2001).
- Barot, M., Gokulgandhi, M. R., Mitra, A. K. Mitochondrial dysfunction in retinal diseases. Current Eye Research. 36 (12), 1069-1077 (2011).
- Joyal, J. S., Gantner, M. L., Smith, L. E. H. Retinal energy demands control vascular supply of the retina in development and disease: The role of neuronal lipid and glucose metabolism. Progress in Retina and Eye Research. 64, 131-156 (2018).
- Hurley, J. B., Lindsay, K. J., Du, J. Glucose, lactate, and shuttling of metabolites in vertebrate retinas. Journal of Neuroscience Research. 93 (7), 1079-1092 (2015).
- Haydinger, C. D., Kittipassorn, T., Peet, D. J. Power to see-Drivers of aerobic glycolysis in the mammalian retina: A review. Clinical and Experimental Ophthalmology. 48 (8), 1057-1071 (2020).
- Wright, A. F., et al. Lifespan and mitochondrial control of neurodegeneration. Nature Genetics. 36, 1153-1158 (2004).
- Bossy-Wetzel, E., Schwarzenbacher, R., Lipton, S. A. Molecular pathways to neurodegeneration. Nature Medicine. 10, 2-9 (2004).
- Leveillard, T., Philp, N. J., Sennlaub, F. Is retinal metabolic dysfunction at the center of the pathogenesis of age-related macular degeneration. International Journal of Molecular Sciences. 20 (3), (2019).
- Vlachantoni, D., et al. Evidence of severe mitochondrial oxidative stress and a protective effect of low oxygen in mouse models of inherited photoreceptor degeneration. Human Molecular Genetics. 20 (2), 322-335 (2011).
- Grenell, A., et al. Loss of MPC1 reprograms retinal metabolism to impair visual function. Proceedings of the National Academy of Science U. S. A. 116 (9), 3530-3535 (2019).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews in Genetics. 11 (4), 273-284 (2010).
- Jarrett, S. G., Boulton, M. E. Consequences of oxidative stress in age-related macular degeneration. Molecular Aspects of Medicine. 33 (4), 399-417 (2012).
- Rozing, M., et al. Age-related macular degeneration: A two-level model hypothesis. Progress in Retina Eye Research. 76, 100825 (2020).
- Yokosako, K., et al. Glycolysis in patients with age-related macular degeneration. Open Ophthalmology Journal. 8, 39-47 (2014).
- Bek, T. Mitochondrial dysfunction and diabetic retinopathy. Mitochondrion. 36, 4-6 (2017).
- Yumnamcha, T., Guerra, M., Singh, L. P., Ibrahim, A. S. Metabolic dysregulation and neurovascular dysfunction in diabetic retinopathy. Antioxidants. 9 (12), (2020).
- Futterman, S., Kinoshita, J. H. Metabolism of the retina. I. Respiration of cattle retina. Journal of Biological Chemistry. 234 (4), 723-726 (1959).
- Linsenmeier, R. A. Effects of light and darkness on oxygen distribution and consumption in the cat retina. Journal of General Physiology. 88 (4), 521-542 (1986).
- Medrano, C. J., Fox, D. A. Oxygen consumption in the rat outer and inner retina: light- and pharmacologically-induced inhibition. Experiments in Eye Research. 61 (3), 273-284 (1995).
- Kooragayala, K. Quantification of oxygen consumption in retina ex vivo demonstrates limited reserve capacity of photoreceptor mitochondria. Investigative Ophthalmology and Visual Science. 56 (13), 8428-8436 (2015).
- Adlakha, Y. K., Swaroop, A. Determination of mitochondrial oxygen consumption in the retina ex vivo: applications for retinal disease. Methods in Molecular Biology. 1753, 167-177 (2018).
- . Agilent Mitocondrial stress test user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Cell_Mito_Stress_Test_Kit_User_Guide.pdf (2021)
- . Agilent Glycolytic rate assay user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . Agilent wave 2.6 user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . AVMA Guidelines for the Euthanasia of Animals Available from: https://www.avma.org/sites/default/files/2020-01/2020-Euthanasia-Final-1-17-20.pdf (2021)
- . Improving Quantification of Cellular Glycolytic Rate Using Agilent Seahorse XF Technology Available from: https://www.agilent.com/cs/library/whitepaper/public/whitepaper-improve-quantification-of-cellular-glycolytic-rate-cell-analysis-5991-7894en-agilent.pdf (2021)
- . Report Generator User Guide Agilent Seahorse XF Cell Mito Stress Test Available from: https://www.agilent.com/cs/library/usermanuals/public/Report_Generator_User_Guide_Seahorse_XF_Cell_Mito_Stress_Test_Single_File.pdf (2021)
- . Agilent Seahorse XF Buffer Factor Protocol Available from: https://www.agilent.com/cs/library/usermanuals/public/usermanual-xf-buffer-factor-protocol-cell-analysis-S7888-10010en-agilent.pdf (2021)
- . Agilent sensor cartridges and cell culture microplates Available from: https://www.agilent.com/cs/library/brochures/5991-8657EN_seahorse_plastics_brochure.pdf (2021)
- . Agilent Seahorse XF Glycolysis Stress Test Kit User Guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Glycolysis_Stress_Test_Kit_User_Guide.pdf (2021)
- Fan, Y. Y. A bioassay to measure energy metabolism in mouse colonic crypts, organoids, and sorted stem cells. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309, 1-9 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. Journal of Neuroscience. 18 (21), 8936-8946 (1998).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proceedings of the National Academy of Science U. S. A. 103 (10), 3890-3895 (2006).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Corso-Diaz, X., et al. Genome-wide profiling identifies DNA methylation signatures of aging in rod photoreceptors associated with alterations in energy metabolism. Cell Reports. 31 (3), 107525 (2020).
- Berkowitz, B. A., et al. Mitochondrial respiration in outer retina contributes to light-evoked increase in hydration in vivo. Investigative Ophthalmology and Visual Science. 59 (15), 5957-5964 (2018).
- Joyal, J. S., et al. Retinal lipid and glucose metabolism dictates angiogenesis through the lipid sensor Ffar1. Nature Medicine. 22 (4), 439-445 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved