JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
전 비보 망막 조직 샘플에서 미토콘드리아 호흡 및 글리코리시스의 결정
요약
여기에 기재된 미토콘드리아 응력 분석기 및 글리코리질 속도 분석기의 상세한 프로토콜은 상용 생체 분석기를 이용한 전 생체 망 막 조직 샘플에서 이다.
초록
미토콘드리아 호흡은 모든 세포, 특히 고활성 신진 대사를 가진 망막 광수용체에서 중요한 에너지 생성 경로입니다. 또한, 광수용체는 또한 암세포와 같은 높은 유산소 글리코리시스를 나타낸다. 이러한 신진 대사 활동의 정확한 측정생리 조건 및 질병 상태에서 세포 항상성에 귀중 한 통찰력을 제공할 수 있습니다. 높은 처리량 마이크로 플레이트 기반 의 소사는 살아있는 세포에서 미토콘드리아 호흡 및 다양한 대사 활동을 측정하기 위해 개발되었습니다. 그러나, 이들 중 대부분은 배양 된 세포를 위해 개발 되고 그대로 조직 샘플 및 응용 프로그램 ex vivo에 대 한 최적화 되지 않았습니다. 여기에 설명된 상세한 단계별 프로토콜은 마이크로플레이트 기반 형광 기술을 사용하여 미토콘드리아 호흡의 지표로서 산소 소비율(OCR)을 직접 측정하고, 전 생체 망막 조직에서, 글리코리시스의 지표로서 세포외산성화율(ECAR)을 직접 측정한다. 이 방법은 성공적으로 성인 마우스 망막에서 신진 대사 활동을 평가하고 노화와 질병의 세포 메커니즘을 조사에 그것의 응용 프로그램을 입증하는 데 사용되었습니다.
서문
미토콘드리아는 여러 가지 중요한 생리적 과정을 조정하여 세포 대사, 신호, 항상성 및 세포 사멸을 조절하는 필수 세포기관입니다1. 미토콘드리아는 산화 인산화(OXPHOS)를 통해 아데노신 삼위산염(ATP)을 생성하고 거의 모든 세포 이벤트를 지원하는 에너지를 제공하는 세포의 강국역할을 합니다. 세포 산소의 대다수는 유산소 호흡 도중 전자 수송 사슬 (ETC)에 있는 최종 전자 수용자로 작용하는 미토콘드리아에서 대사됩니다. 낮은 양의 ATP는 또한 포도당이 피루바테로 변환되는 시토솔의 글리코리시스로부터 생산될 수 있으며, 이는 젖산으로 더 변환되거나 미토콘드리아로 이송되고 삼환산성 사이클(TCA 사이클)의 기판인 아세틸-코아로 산화될 수 있다.
망막은 포유류에서 가장 신진 대사 활성 조직 중 하나입니다2, 미토콘드리아 호흡의 높은 수준을 표시하 고 매우 높은 산소 소비3. 막대와 콘 광수용체는 미토콘드리아4의 고밀도를 함유하고 있으며, OXPHOS는 망막5에서 대부분의 ATP를 생성한다. 또한, 망막은 또한 유산소 글리코리시스6,7에 크게 의존하여 포도당을 락테이트5로 변환합니다. 미토콘드리아 결함은 다양한 신경 퇴행성 질환과 연관되어 있습니다8,9; 그리고 그것의 독특한 높은 에너지 요구와 함께, 망막은 미토콘드리아 OXPHOS4 및 glycolysis10에 영향을 미치는 사람들을 포함하여 신진 대사 결함에 특히 취약합니다. 글리코리시스의 미토콘드리아 기능 장애 및 결함은 망막11,12 및 황반13 퇴행성 질환, 연령 관련 황반 변성10,14,15,16 및 당뇨병 성 망막증17,18에 연루되어 있습니다. 따라서 미토콘드리아 호흡 및 글리코리시스의 정확한 측정은 망막의 무결성과 건강을 평가하기 위한 중요한 매개 변수를 제공할 수 있습니다.
미토콘드리아 호흡은 산소 소비율(OCR)의 측정을 통해 측정될 수 있다. 포도당이 피루바테로 전환되고 젖산으로 전환하여 세포 외 환경의 배설 및 세포 외 환경의 산성화를 초래한다는 점을 감안할 때, 세포외 산성화율(ECAR)의 측정은 글리코리시스 플럭스의 표시를 제공한다. 망막은 기판6의 교환을 포함하여 친밀한 관계 및 적극적인 시너지를 가진 다중 세포 모형으로 구성되기 때문에, 온전한 적층 및 회로를 가진 전체 망막 조직의 맥락에서 미토콘드리아 기능 및 물질 대사를 분석하는 것이 필수적이다. 지난 수십 년 동안, 클라크 타입 O2 전극 및 그밖 산소 미세 전극은 망막19,20,21에 있는 산소 소비를 측정하기 위하여 이용되었습니다. 이러한 산소 전극은 감도에 있는 중요한 한계, 큰 견본 부피의 요구 사항 및 일반적으로 세포 및 조직 문맥의 중단으로 이끌어 내는 일시 중단 견본의 연속적인 교반을 위한 필요를 가지고 있습니다. 여기서 설명된 프로토콜은 마이크로플레이트 계의 형광 기술을 사용하여 새로 해부된 전 생체 내 마우스 망막 조직에서 미토콘드리아 에너지 대사를 측정하여 개발되었다. 그것은 서스펜션 및 연속 교반의 필요성을 피하면서 전 생체 망막 조직의 작은 샘플 (1mm 펀치)를 사용하여 동시에 OCR과 ECAR모두의 중간 처리량 실시간 측정을 허용합니다.
여기에 입증된 미토콘드리아 스트레스 분석 및 글리코리질 속도 분석시 에 대한 실험 절차로, 갓 해부된 망막 펀치 디스크에 대한 분석. 이 프로토콜은 전 생체 조직 맥락에서 미토콘드리아 관련 대사 활동의 측정을 허용한다. 배양된 세포를 사용하여 수행된 애서와는 달리, 여기서 얻은 수치는 조직 수준에서 결합된 에너지 대사를 반영하고 조직 내의 상이한 세포 유형 간의 상호 작용에 의해 좌우된다. 이 프로토콜은 이전에 게시된 버전22,23에서 수정되어 Islet Capture 플레이트를 사용하여 애질런트 해마 세포 외 플럭스 24-wells(XFe24) 분석기의 새로운 세대에 적응합니다. 분석 매체, 주사 화합물 농도, 및 분석 주기의 수/기간 또한 망막 조직에 대 한 최적화 되었습니다. 망막 펀치 디스크의 준비를 위해 자세한 단계별 프로토콜이 제공됩니다. 프로그램 설정 및 데이터 분석에 대한 자세한 내용은 제조업체의 사용자 가이드24,25,26에서 얻을 수 있습니다.
프로토콜
모든 마우스 프로토콜은 국립 안과 연구소의 동물 관리 및 사용 위원회에 의해 승인되었다 (NEI ASP # 650). 마우스는 12h 어두운 조건에 보관하고 실험실 동물의 배려 그리고 사용을 위한 가이드의 권고, 실험실 동물 자원 연구소 및 실험실 동물의 인도적인 배려 그리고 사용에 대한 공중 위생 서비스 정책의 권고에 따라 배려되었습니다.
1. 센서 카트리지를 수분화하고 분석 매체의 준비
- 실험 전날, 교정 매체의 1mL을 유틸리티 플레이트의 각 웰에 추가합니다. 하이드로 부스터 커버를 상단에 놓고 커버의 개구부를 통해 센서 카트리지를 낮춥니다. 센서가 교정 매체에 침수되었는지 확인합니다. 37°C의 CO2 가없는 인큐베이터에서 센서 카트리지를 하룻밤 동안 배양하여 형광을 활성화합니다.
참고: 증발을 방지하기 위해 인큐베이터는 물 트레이를 내부에 보관하여 가습되고 센서 카트리지 카세트는 투명한 플라스틱 랩으로 감쌉니다. - 원하는 농도로 포도당, 피루바테 및 글루타민을 첨가하여 해마 DMEM 배지를 재구성하여 분석 매체를 준비한다. 이 문서에서 보고된 분석서에서, 분석 매체에 있는 기판의 최종 농도는: 포도당의 6mM, pyruvate의 0.12 mM, 및 글루타민의 0.5 mMMM입니다. 각 분석판에 대해, 분석 매체의 40mL는 실험 당일 신선하게 제조된다.
- 제조업체의 지침에 따라 분석기에서 분석 프로그램을 설정합니다26. 여기서 입증된 분석에서 프로토콜은 다음과 같이 설정됩니다: 기준선에 대한 측정 5주기, 포트 A를 주입한 다음 4주기의 측정을 한 다음 포트 B를 주입한 다음 포트 B를 주입한 다음 4주기의 측정이 수행됩니다. 각 사이클은 혼합 (3 분), 대기 (2 분) 및 측정 (3 분)으로 구성됩니다.
2. 아슬렛 의 코팅 메쉬 인서트가 마이크로 플레이트를 캡처
- 세포 부착 매체(예를 들어, 셀탁)의 20 μL과 중탄산나트륨 171μL, 1M NaOH의 9μL을 결합하여 코팅 믹스를 준비한다.
- 메쉬 인서트가 포함된 카세트의 뚜껑을 엽니다. 각 메쉬 인서트에 코팅 믹스의 파이펫 8 μL. 파이펫 팁을 사용하여 물방울을 부드럽게 얼룩/ 분산하여 메쉬 삽입 전체에 코팅 믹스를 균등하게 분배합니다.
- 카세트를 닫고 메쉬 인서트가 흡착을 위해 실온에서 최소 25분 동안 배양할 수 있도록 합니다.
- 분석 매체의 4mL를 메쉬 인서트에 직접 피펫팅하여 메쉬 인서트를 세척합니다. 카세트를 부드럽게 흔들어 모든 메쉬 인서트가 분석 매체로 세척되도록 합니다.
- 메쉬 인서트를 따로 둡니다. 사용할 준비가 되어 있습니다.
3. 사출 화합물 준비
- -80°C 냉동고에서 Bam15(10mM), 로테네네(10mMM), 안티마이신 A(10mMM), 2-DG(500mMMMMMM)의 재고 알리쿼트를 꺼내실 온도에서 해동하십시오.
참고 : 2-DG 재고는 사용할 준비가되어 있습니다. 다른 약물은 작업 주식에 희석 될 필요가있다. - 37°C 수조에서 분석 매체의 10mL를 데우습니다.
- 10mM Bam15 스톡을 2단계 희석 절차를 사용하여 50 μM 작업 재고로 희석하십시오: 10m m 의 20 μL을 DMSO 20 μL과 혼합하여 5mM 중간 재고를 얻습니다. 그런 다음 위의 5m 중간 재고의 10 μL을 990 μL의 사전 온온 분석 매체와 혼합하여 최종 50 μM 작업 재고를 얻습니다.
- 희석 및 10 mM 안티 마이신 A 재고10 μM 로테네네 / 안티 마이신 A (로트 / AA) 희석의 두 단계로 작업 재고 : 혼합 10 μL 각각 10 mM 로테네네와 10 mM 안티 마이신 주식 DMSO의 80 μL 을 얻을 수 있습니다. 그런 다음 위의 1m 중간 재고의 10 μL을 사전 데운 분석 매체의 990 μL과 혼합하여 최종 10 μM Rot/AA 작업 재고를 얻습니다.
- 실험 당일 에 언급된 사출 화합물의 작업 재고를 신선하게 준비하고 센서 카트리지의 사출 포트에 적재될 때까지 실온에서 따로 둡니다.
4. 망막 해부 및 망막 펀치 준비
- 안락사27에 AVMA 지침에 따라 CO2 질식에 의해 마우스를 안락사.
참고: 안락사에 필요한 시간보다 더 오래 CO2 챔버에 동물을 두지 마십시오. - 눈을 이결시키고 페트리 접시에 얼음 오래된 1x PBS 버퍼에 넣은 다음 해부 현미경 아래에 놓습니다.
- 조심스럽게 제거, 미세 사이주로 절단하여, 안구 외부에 부착 된 여분의 정류 근육과 시신경을 잘라.
- 30 G 바늘을 사용하여 각막 가장자리에 구멍을 뚫습니다 (림푸스); 이것은 미세 시저에 대한 삽입 부위역할을합니다. 그런 다음 미세 해부 미세 시저를 사용하여 각막 가장자리를 따라 원형 절단을 하여 후방 눈컵과 분리합니다.
- 날카로운 해부 집게를 사용하여 각막, 렌즈 및 유리체 유머를 아이 컵에서 제거하십시오.
- 미세 해부 미세 시저를 사용하여 아이 컵의 가장자리에서 경마 층에 몇 가지 작은 상처를 만듭니다. 망막 층을 자르지 마십시오. 두 개의 날카로운 해부 집게를 사용하여 절단의 각 면에 있는 경추 조직을 붙잡고 매우 신중하게 경마층을 당겨 신경 망막에서 제거하십시오. 모든 clera가 제거되고 그대로 망막 컵이 얻어질 때까지 아이 컵 주위에 이것을 반복하십시오.
- 해부 미세 시저를 사용하고 망막 컵에 방사형 컷을 만들어 평평하게 만들고 몇 가지 뚜렷한 섹션을 생성합니다.
참고: 사람의 해부 기술과 신선한 망막 조직을 다루는 경험에 따라 망막 컵을 잘라 3 ~ 5 개의 뚜렷한 섹션을 생성 할 수 있습니다. - 1mm 직경생검 펀처를 사용하여 평평한 망막 컵의 각 섹션에서 망막 디스크 하나를 자른다.
참고: 시신경 헤드와 동일한 거리에서 망막 디스크를 펀치하기 위해 주의를 기울여야 합니다. - 집게를 사용하여 미리 코팅된 메쉬 인서트를 해부 페트리 접시에 전달합니다. 두 개의 초미세 속눈썹 브러쉬의 도움으로 망막 펀치 디스크를 메쉬 인서트에 놓습니다. 망막 펀치 디스크는 메시와 광수용체 층을 위로 향하여 아래로 신경절 세포 층측면으로 메쉬 인서트의 중앙에 배치됩니다.
참고: 자주, 일부 RPE 세포는 광수용체에 부착된 채로 남아 있으며, 이들 세포의 색소 침착은 망막 펀치 디스크 방향의 지표로 사용될 수 있다.
5. 센서 카트리지 사출 포트 및 교정
- 37°C 인큐베이터에서 수화 센서 카트리지 플레이트 카세트를 꺼내십시오. 하이드로 부스터 커버를 제거하고 센서 카트리지를 유틸리티 플레이트에 다시 배치합니다.
- 원하는 양의 사출 화합물 작업 재고 솔루션을 적절한 포트에 로드합니다. 파이펫 팁을 45° 각도로 유지합니다. 파이펫 팁을 사출 포트의 반대 벽에 대한 팁의 경사와 함께 사출 포트에 중간 삽입하고 부드럽게 각 포트에 화합물을로드합니다. 기포를 도입하지 마십시오.
- 특정 분석에 대한 각 사출 포트에 로드된 화합물의 부피에 대한 계측기 사용자 가이드를 참조하십시오. 본 논문에 제시된 실험에서, 50 μM Bam15 작업 재고의 68 μL (미토콘드리아 응력 분석용) 또는 10 μM Rot/AA 작업 재고의 68 μL (글리코리틱 속도 분석용)가 포트 A에 적재된다; 75 μM Rot/AA 작업 재고 (미토콘드리아 응력 분석용) 또는 500 mM 2-DG 작업 재고의 75 μL (글리코리틱 속도 분석용)가 포트 B에 로드됩니다.
- 적절한 주입을 보장하기 위해 배경 보정 우물과 빈 우물을 포함하여 플레이트의 모든 우물의 부하 주입 포트. 배경 보정 웰에 대해 각 포트에 각 복합 솔루션을 로드합니다. 분석 매체는 복합 용액 대신 은행 우물의 각 포트에서 대체 될 수 있습니다.
- 로드된 센서 카트리지 플레이트를 뚜껑을 닫은 상태로 분석기 기계에 배치하여 분석 실행 전에 교정을 시작합니다. 교정이 끝나면 프로그램이 자동으로 일시 중지되어 망막 펀치가 들어있는 islet 캡처 플레이트로 유틸리티 플레이트의 교체를 기다리고 있습니다.
6. 아일렛 캡처 플레이트를 로드하고 분석 실행 시작
- 아슬릿 캡처 플레이트의 각 웰에 분석 매체의 607 μL 추가
- 집게를 사용하여 망막 펀치 디스크가 들어 있는 메쉬 인서트의 테두리를 잡고 페트리 접시에서 꺼낸다. 흡수닦기 티슈에 메쉬 인서트 의 바닥을 가볍게 두드려 여분의 액체를 제거하고 아슬레 캡처 플레이트의 우물에 넣습니다. 망막 펀치가 있는 모든 메쉬 인서트가 이 슬레표 캡처 플레이트에 배치될 때까지 이 단계를 반복합니다. 빈 메쉬 인서트와 배경 보정 우물과 빈 우물을 채웁니다.
- 두 개의 Graefe 집게를 사용하여 각 메쉬 인서트의 테두리를 신중하고 부드럽게 누르고 이 것들이 아일렛 캡처 플레이트의 바닥에 단단히 삽입되었는지 확인합니다.
- 로드된 아일렛 캡처 플레이트를 37°C 인큐베이터에 넣고 5분 동안 데워지도록 합니다.
- 교정이 완료된 후 유틸리티 플레이트를 꺼내서 이를 분리하여 슬개미 펀치를 포함한 뚜껑을 닫은 이슬 캡처 플레이트로 교체합니다.
- 분석 실행을 다시 시작합니다.
7. 종료 및 데이터 저장소 실행
- 실행이 완료되면 센서 카트리지와 망막 펀치가 들어있는 islet 캡처 플레이트를 배출합니다. 데이터는 자동으로 .asyr 파일로 저장됩니다.
- 관련 데이터 분석 소프트웨어를 사용하여 제조업체의 사용자 guide26에 따른 데이터를 보고 분석합니다.
- 내보내기 함수를 사용하여 스프레드시트 소프트웨어를 사용하여 보고 분석할 수 있는 데이터의 .xslx 파일을 내보냅니다.
8. 망막 펀치 샘플 저장
- 분석 후, 기계에서 플레이트를 꺼내 센서 카트리지를 제거하고 파이펫을 사용하여 각 우물에서 분석 매체를 부드럽게 제거합니다.
- 덮개를 다시 바르고 판의 측면을 파라필름 스트립으로 밀봉합니다.
- -80 °C에 보관하십시오.
- 정상화를 위해, 각 웰에 펀치의 총 DNA 또는 단백질 함량을 정량화한다.
9. 데이터 분석
- 미토콘드리아 스트레스 분석
참고: 측정된 OCR 값(totalOCR)은 조직에 의한 총 산소 소비를 나타냅니다. Bam15 (un커플러) 주입 후, OCR은 기저 수준(totalOCRbasal)에서 최대 레벨(totalOCRmax)으로 증가하고 Rot/AA 주입 후 내려갑니다. Rot/AA 주입 후 잔류 OCR 값(totalOCRRot/AA)은 비미토콘드리아 산소 소비를 나타냅니다.- 미토콘드리아 관련 산소 소비를 다음과 같이 계산합니다.
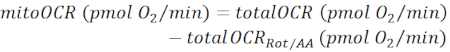 (Eq. 1) 28
(Eq. 1) 28
- 미토콘드리아 예비 용량(MRC)을 다음과 같이 계산합니다.
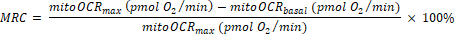 (Eq. 2) 29
(Eq. 2) 29
참고: Bam15 주입 전에 5측정 중 마지막 판독은 "기초" 값(totalOCRbasal 및 미토오크바살)으로 측정됩니다. Bam15 주입 에 따른 4가지 측정 중 가장 높은 판독값은 "최대" 값(totalOCRmax 및 mitoOCRmax)으로 사용됩니다. Rot/AA 주입 후 4가지 측정 중 가장 낮은 판독값은 totalOCRRot/AA로 사용됩니다.
- 미토콘드리아 관련 산소 소비를 다음과 같이 계산합니다.
- 글리코리틱 속도 분석
참고: 측정된 ECAR 값(totalECAR)은 조직의 대사 활성에 의한 매체의 총 산성화를 나타낸다. 일반적으로, 세포외 미세 환경의 산성화는 주로 글리코리스틱 생성물의 압출에 의해, 젖산염에 의해 생성된다. 미토콘드리아 TCA 주기에서 기판의 이화작용은 CO2의 생산에 기인하며, 이는 또한 중탄산염에 수분을 공급하여 세포외 배지를 산성화합니다.- 미토콘드리아를 빼는 미토콘드리아기여 중산성화(mitoECAR)를 totalECAR로부터 글리코에카를 획득한다.
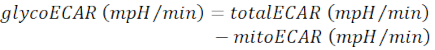 (Eq. 3) 28
(Eq. 3) 28
참고: 미토콘드리아 호흡 및 TCA 주기는 강하게 결합된 프로세스입니다. 미토콘드리아로부터 CO2 의 생산은 미토OCR에 의해 측정 가능한 OXPHOS의 속도의 기능입니다. - 미토에카를 다음과 같이 계산합니다.
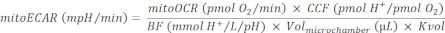 (Eq. 4) 28
(Eq. 4) 28
여기서, CCF(CO2 기여도계)는 경험적으로 계산된 비율 값으로, OXPHOS의 각 O2 소비대 CO2 매개 산성화에서 H+ 기여의 양을 나타냅니다. 이 시스템의 CCF는 0.6028로 미리 결정됩니다. 중간 산성화의 정확한 측정은 매체의 완충 용량, 계측기 pH 센서의 감도 및 효과적인 측정 챔버 용량에 의해 결정됩니다. 여기서, BF(Buffer Factor)는 시투 실험 완충 용량의 파라미터로, 효과적인 측정 챔버에 첨가된 H+또는 OH-의 양을 나타내며 pH 레벨을 1단위로 변화시다. 맞춤형 분석 매체가 사용될 때, BF는 버퍼 팩터 프로토콜30에 따라 분석 매체에 알려진 양의 산을 적시하여 결정될 수 있다. 이 프로토콜에 사용되는 해마 DMEM 배지 pH 7.4는 2.60 mmol H +/L/pH의 미리 결정된 BF를 가지고 있습니다. 이 프로토콜에 사용되는 이 슬레클 캡처 플레이트에는 Volmicrochamber = 16.6 μL31이 있습니다. 볼륨 배율 조정 계수인 Kvol은 경험적으로 결정된 상수입니다. Kvol 값은 islet 캡처 플레이트에 사용할 수 없지만 마이크로 플레이트28의 값에서 계산할 수 있으며, 마이크로 챔버의 부피 차이를 0.41로 계산할 수 있다.
참고: Rot/AA의 주사는 미토콘드리아 호흡을 차단하고 조직이 ATP 생산을 위한 글리코리시스로 전환하도록 강요하여 젖산 염출이 증가하고 ECAR 측정이 증가합니다. 글리코리시스는 2-DG 주입으로 중단되고 잔류 ECAR 측정은 배지의 비혈당 및 비 미토콘드리아 산성화를 나타낸다. - 다음으로 글리코리스틱 예비 용량(GRC)을 계산합니다.
 (Eq. 5) 32
(Eq. 5) 32
여기서, Rot/AA 주입 전에 5측정 중 마지막 판독은 "기저" 값(글리코에카르바살)으로 채취된다. Rot/AA 주입 후 4가지 측정 중 가장 높은 판독값은 "최대" 값(글리코에카맥스)으로 사용됩니다. 2-DG 주입 다음 4 측정 중 가장 낮은 판독값은 글리코에카2-DG로 사용된다.
- 미토콘드리아를 빼는 미토콘드리아기여 중산성화(mitoECAR)를 totalECAR로부터 글리코에카를 획득한다.
- 표준화
참고: 정규화는 다른 연령 집단의 망막 조직에서 또는 세포 수에 다를 수 있는 야생 형 및 병리학/퇴행성 견본 사이에서 측정을 비교할 때 필수적입니다.- 각 망막 펀치 디스크33,34의 DNA 함량을 평가하기 위해 commerically 사용 가능한 키트를 사용합니다.
- 대안적으로, 방사성 면역 침전 분석 버퍼(RIPA 버퍼)를 사용하여 망막 펀치로부터 총 단백질을 추출하고 정상화를 위해 단백질 함량을 사용한다.
참고: 성인 마우스 망막의 표면적은 이전에 약 20mm2로 결정되었으며 각 망막에는 ~650만 개의 세포가 포함되어 있습니다35. 따라서, 각 1mm 직경 망막 펀치는 단일 망막의 ~1/25이며 ~ 260K 세포를 함유하고 있습니다. 망막 펀치의 데이터를 다른 조직 샘플 이나 배양 세포에서 데이터와 비교할 때 이러한 숫자를 참조할 수 있습니다.
결과
여기에 보고된 데이터는 OCR 추적(도 1) 및 OCR 추적 및 ECAR 추적(그림 2)을 보여주는 대표적인 미토콘드리아 응력 분석서이며, 이는 4개월 된 트랜스제닉 Nrl-L-EGFP mice36 (C57B/L6 배경)에서 갓 해부된 1mm 망막 펀치 디스크를 사용하여 수행되었다. 이 마우스는 일반적인 망막 발달, 조직학 및 생리학을 변경하지 않고 막대 광수용체에서 ...
토론
여기에 제공된 미토콘드리아 호흡 및 글리코리시스 활성의 마이크로플레이트 기반 의 작용을 전 생체, 갓 해부한 망막 펀치 디스크를 사용하여 수행하기 위한 자세한 지침이 있습니다. 프로토콜은 최적화되었습니다 : 1) 전 생체 망막 조직에 적합한 분석 매체의 사용을 보장; 2) 장비의 최적의 검출 범위에 속하는 OCR 및 ECAR 판독값을 얻기 위해 망막 펀치 디스크의 적절한 크기를 고용;...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 국립 안과 연구소 (ZIAEY000450 및 ZIAEY000546)의 교내 연구 프로그램에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 1X PBS | Thermo Fisher | 14190-144 | |
| 2-Deoxy glucose (2-DG), 500 mM stock solution | Sigma | D6134 | Dissolve in Seahorse XF DMEM medium, prepare ahead of time |
| 30-gauge needle | BD Precision Glide | 305106 | |
| Antimycin A, 10 mM stock solution | Sigma | A8674 | Dissolve in DMSO, prepare ahead of time |
| Bam15, 10 mM stock solution | TimTec | ST056388 | Dissolve in DMSO, prepare ahead of time |
| Biopsy puncher, 1 mm | Integra Miltex | 33-31AA | |
| Cell-Tak | Corning Life Sciences | CB40240 | |
| CO2 asphyxiation chamber | |||
| Dissection forceps-Dumont #5 | Fine Science Tools | 11251-10 | Stright tip |
| Dissection forceps-Dumont #7 | Fine Science Tools | 11274-20 | Curved tip |
| Dissection microscope | |||
| DMSO | Sigma | D2438 | |
| Graefe forceps | Fine Science Tools | 11051-10 | Curved, Serrated tip |
| Microscissors | Fine Science Tools | 15004-08 | Curved tip |
| NaOH solution, 1 M | Sigma-Aldrich | S8263 | Aqueous solution, prepare ahead of time |
| Rotenone, 10 mM stock solution | Sigma | R8875 | Dissolve in DMSO, prepare ahead of time |
| Seahorse calibration medium | Agilent | 100840-000 | |
| Seahorse XF 1.0 M glucose | Agilent | 103577-100 | |
| Seahorse XF 100 mM pyruvate | Agilent | 103578-100 | |
| Seahorse XF 200 mM glutamine | Agilent | 103579-100 | |
| Seahorse XF DMEM medium | Agilent | 103575-100 | pH 7.4, with 5 mM HEPES |
| Seahorse XFe24 Islet Capture FluxPak | Agilent | 103518-100 | Containing Sensor Cartridge and Islet Capture microplate |
| Seahorse XFe24, Extra Cellular Flux Analyzer | Agilent | ||
| Sodium bicarbonate solution, 0.1 M | Sigma-Aldrich | S5761 | Aqueous solution, prepare ahead of time |
| Superfine eyelash brush | Ted Pella | 113 |
참고문헌
- Nunnari, J., Suomalainen, A. Mitochondria: In sickness and in health. Cell. 148 (6), 1145-1159 (2012).
- Wong-Riley, M. T. Energy metabolism of the visual system. Eye Brain. 2, 99-116 (2010).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retina and Eye Research. 20, 175-208 (2001).
- Barot, M., Gokulgandhi, M. R., Mitra, A. K. Mitochondrial dysfunction in retinal diseases. Current Eye Research. 36 (12), 1069-1077 (2011).
- Joyal, J. S., Gantner, M. L., Smith, L. E. H. Retinal energy demands control vascular supply of the retina in development and disease: The role of neuronal lipid and glucose metabolism. Progress in Retina and Eye Research. 64, 131-156 (2018).
- Hurley, J. B., Lindsay, K. J., Du, J. Glucose, lactate, and shuttling of metabolites in vertebrate retinas. Journal of Neuroscience Research. 93 (7), 1079-1092 (2015).
- Haydinger, C. D., Kittipassorn, T., Peet, D. J. Power to see-Drivers of aerobic glycolysis in the mammalian retina: A review. Clinical and Experimental Ophthalmology. 48 (8), 1057-1071 (2020).
- Wright, A. F., et al. Lifespan and mitochondrial control of neurodegeneration. Nature Genetics. 36, 1153-1158 (2004).
- Bossy-Wetzel, E., Schwarzenbacher, R., Lipton, S. A. Molecular pathways to neurodegeneration. Nature Medicine. 10, 2-9 (2004).
- Leveillard, T., Philp, N. J., Sennlaub, F. Is retinal metabolic dysfunction at the center of the pathogenesis of age-related macular degeneration. International Journal of Molecular Sciences. 20 (3), (2019).
- Vlachantoni, D., et al. Evidence of severe mitochondrial oxidative stress and a protective effect of low oxygen in mouse models of inherited photoreceptor degeneration. Human Molecular Genetics. 20 (2), 322-335 (2011).
- Grenell, A., et al. Loss of MPC1 reprograms retinal metabolism to impair visual function. Proceedings of the National Academy of Science U. S. A. 116 (9), 3530-3535 (2019).
- Wright, A. F., Chakarova, C. F., Abd El-Aziz, M. M., Bhattacharya, S. S. Photoreceptor degeneration: genetic and mechanistic dissection of a complex trait. Nature Reviews in Genetics. 11 (4), 273-284 (2010).
- Jarrett, S. G., Boulton, M. E. Consequences of oxidative stress in age-related macular degeneration. Molecular Aspects of Medicine. 33 (4), 399-417 (2012).
- Rozing, M., et al. Age-related macular degeneration: A two-level model hypothesis. Progress in Retina Eye Research. 76, 100825 (2020).
- Yokosako, K., et al. Glycolysis in patients with age-related macular degeneration. Open Ophthalmology Journal. 8, 39-47 (2014).
- Bek, T. Mitochondrial dysfunction and diabetic retinopathy. Mitochondrion. 36, 4-6 (2017).
- Yumnamcha, T., Guerra, M., Singh, L. P., Ibrahim, A. S. Metabolic dysregulation and neurovascular dysfunction in diabetic retinopathy. Antioxidants. 9 (12), (2020).
- Futterman, S., Kinoshita, J. H. Metabolism of the retina. I. Respiration of cattle retina. Journal of Biological Chemistry. 234 (4), 723-726 (1959).
- Linsenmeier, R. A. Effects of light and darkness on oxygen distribution and consumption in the cat retina. Journal of General Physiology. 88 (4), 521-542 (1986).
- Medrano, C. J., Fox, D. A. Oxygen consumption in the rat outer and inner retina: light- and pharmacologically-induced inhibition. Experiments in Eye Research. 61 (3), 273-284 (1995).
- Kooragayala, K. Quantification of oxygen consumption in retina ex vivo demonstrates limited reserve capacity of photoreceptor mitochondria. Investigative Ophthalmology and Visual Science. 56 (13), 8428-8436 (2015).
- Adlakha, Y. K., Swaroop, A. Determination of mitochondrial oxygen consumption in the retina ex vivo: applications for retinal disease. Methods in Molecular Biology. 1753, 167-177 (2018).
- . Agilent Mitocondrial stress test user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Cell_Mito_Stress_Test_Kit_User_Guide.pdf (2021)
- . Agilent Glycolytic rate assay user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . Agilent wave 2.6 user guide Available from: https://www.agilent.com/cs/library/usermanuals/public/103344-400.pdf (2021)
- . AVMA Guidelines for the Euthanasia of Animals Available from: https://www.avma.org/sites/default/files/2020-01/2020-Euthanasia-Final-1-17-20.pdf (2021)
- . Improving Quantification of Cellular Glycolytic Rate Using Agilent Seahorse XF Technology Available from: https://www.agilent.com/cs/library/whitepaper/public/whitepaper-improve-quantification-of-cellular-glycolytic-rate-cell-analysis-5991-7894en-agilent.pdf (2021)
- . Report Generator User Guide Agilent Seahorse XF Cell Mito Stress Test Available from: https://www.agilent.com/cs/library/usermanuals/public/Report_Generator_User_Guide_Seahorse_XF_Cell_Mito_Stress_Test_Single_File.pdf (2021)
- . Agilent Seahorse XF Buffer Factor Protocol Available from: https://www.agilent.com/cs/library/usermanuals/public/usermanual-xf-buffer-factor-protocol-cell-analysis-S7888-10010en-agilent.pdf (2021)
- . Agilent sensor cartridges and cell culture microplates Available from: https://www.agilent.com/cs/library/brochures/5991-8657EN_seahorse_plastics_brochure.pdf (2021)
- . Agilent Seahorse XF Glycolysis Stress Test Kit User Guide Available from: https://www.agilent.com/cs/library/usermanuals/public/XF_Glycolysis_Stress_Test_Kit_User_Guide.pdf (2021)
- Fan, Y. Y. A bioassay to measure energy metabolism in mouse colonic crypts, organoids, and sorted stem cells. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309, 1-9 (2015).
- Huang, L., et al. Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids. Nature Medicine. 21 (11), 1364-1371 (2015).
- Jeon, C. J., Strettoi, E., Masland, R. H. The major cell populations of the mouse retina. Journal of Neuroscience. 18 (21), 8936-8946 (1998).
- Akimoto, M., et al. Targeting of GFP to newborn rods by Nrl promoter and temporal expression profiling of flow-sorted photoreceptors. Proceedings of the National Academy of Science U. S. A. 103 (10), 3890-3895 (2006).
- Kenwood, B. M., et al. Identification of a novel mitochondrial uncoupler that does not depolarize the plasma membrane. Molecular Metabolism. 3 (2), 114-123 (2014).
- Corso-Diaz, X., et al. Genome-wide profiling identifies DNA methylation signatures of aging in rod photoreceptors associated with alterations in energy metabolism. Cell Reports. 31 (3), 107525 (2020).
- Berkowitz, B. A., et al. Mitochondrial respiration in outer retina contributes to light-evoked increase in hydration in vivo. Investigative Ophthalmology and Visual Science. 59 (15), 5957-5964 (2018).
- Joyal, J. S., et al. Retinal lipid and glucose metabolism dictates angiogenesis through the lipid sensor Ffar1. Nature Medicine. 22 (4), 439-445 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유