A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصوير الأوعية الدموية العميقة في العين باستخدام الموجات فوق الصوتية المحسنة للتدفق
In This Article
Summary
نحن نقدم تقنية الموجات فوق الصوتية غير الغازية لتوليد تصوير الأوعية ثلاثية الأبعاد في العين دون استخدام عوامل التباين.
Abstract
الشبكية داخل العين هي واحدة من أكثر الأنسجة التي تتطلب الطاقة في الجسم ، وبالتالي تتطلب معدلات عالية من توصيل الأكسجين من إمدادات الدم الغنية. الصفيحة الشعرية للمشيمية تبطن السطح الخارجي للشبكية وهي المصدر المهيمن للأكسجين في معظم شبكية العين الفقارية. ومع ذلك ، فإن هذا السرير الوعائي يمثل تحديا للتصوير باستخدام التقنيات البصرية التقليدية بسبب موقعه خلف شبكية العين عالية امتصاص الضوء. هنا نصف تقنية الموجات فوق الصوتية عالية التردد مع تعزيز التدفق اللاحق لتصوير أسرة الأوعية الدموية العميقة (0.5-3 سم) للعين بدقة مكانية وزمانية عالية. تعمل هذه الطريقة غير الغازية بشكل جيد في الأنواع التي تحتوي على خلايا دم حمراء نواة (نماذج حيوانية غير ثديية وجنينية). يسمح بتوليد صور الأوعية ثلاثية الأبعاد غير الغازية دون استخدام عوامل التباين ، وهو مستقل عن زوايا تدفق الدم مع حساسية أعلى من تقنيات التصوير بالموجات فوق الصوتية القائمة على دوبلر.
Introduction
يفرض التمثيل الغذائي العالي على شبكية العين الفقارية مقايضة جوهرية بين حاجتين متناقضتين. ارتفاع معدلات تدفق الدم ومسار خفيف خال من الأوعية الدموية. لتجنب الاضطراب البصري لخلايا الدم الحمراء المتغلغلة ، تتلقى شبكية العين لجميع الفقاريات الأكسجين والمواد المغذية عبر ورقة من الشعيرات الدموية خلف المستقبلات الضوئية ، المشيمية الشعرية1،2،3. ومع ذلك ، فإن هذا المصدر الوحيد للمغذيات والأكسجين يفرض قيودا على الانتشار على سمك شبكية العين4,5 ، لذلك تمتلك العديد من الأنواع النشطة بصريا مجموعة متنوعة من شبكات الأوعية الدموية المعقدة لتوفير إمدادات دم إضافية لهذا العضو النشط استقلابيا 6. وتشمل هذه الأسرة الوعائية الأوعية الدموية التي تغلغل في طبقات الشبكية الداخلية في الثدييات وبعض الأسماك4،7،8،9،10 ، والأوعية الدموية على الجانب الداخلي (المواجه للضوء) من شبكية العين الموجودة في العديد من الأسماك والزواحف والطيور4،11،12،13 ، والترتيبات الوعائية المعاكسة للأسماك المشيمية ، و rete choroid mirabile ، الذي يسمح بتوليد ضغوط جزئية من الأكسجين في الغلاف الجوي الفائق14،15،16،17،18،19،20. على الرغم من أن هذه المسارات الإضافية غير المشيمية لإمدادات المغذيات الشبكية تلعب دورا أساسيا في تغذية المتطلبات الأيضية للرؤية الفائقة4، فإن التشريح ثلاثي الأبعاد لهذه الهياكل الوعائية غير مفهوم بشكل جيد، مما يحد من فهمنا للتطور المورفولوجي للعين الفقارية.
تقليديا ، تمت دراسة إمدادات الدم في شبكية العين باستخدام التقنيات البصرية ، مثل تنظير قاع العين. توفر هذه الفئة من التقنيات معلومات غير مدمرة عالية الإنتاجية عن تشريح الأوعية الدموية غير المشيمية بدقة عالية21 وبالتالي فهي تستخدم بسهولة في التشخيص السريري للتشوهات في بنية الأوعية الدموية الشبكية22. ومع ذلك، تمتص ظهارة صبغة الشبكية الضوء المنقول وتحد من عمق الرؤية في هذه التقنيات البصرية، مما يوفر معلومات مخفضة عن البنية المشيمية ووظيفتها دون استخدام عامل التباين21. هناك قيود مماثلة على العمق في التصوير المقطعي بالتماسك البصري (OCT). يمكن لهذه التقنية توليد صور وعائية قاع العين عالية الدقة باستخدام موجات الضوء على الحساب التقني لاختراق العمق23، في حين يمكن للتصوير العميق المحسن OCT تصور المشيمية على حساب جودة تصوير الشبكية24. يتغلب التصوير بالرنين المغناطيسي على القيود البصرية لتنظير العين و OCT ويمكنه رسم خريطة لطبقات الأوعية الدموية في شبكية العين، وإن كان ذلك بدقة منخفضة25. يحافظ علم الأنسجة والتصوير المقطعي المحوسب الدقيق (μCT) على الدقة العالية للتقنيات البصرية ويوفران معلومات عن مورفولوجيا الأوعية الدموية للعين بأكملها4، ولكن كلتا التقنيتين تتطلبان أخذ عينات من العين، وبالتالي لا يمكن استخدامهما في العيادة أو الأنواع النادرة أو المهددة بالانقراض. للتغلب على بعض القيود المفروضة على تقنيات تصوير الشبكية المعمول بها ، تقدم الدراسة هنا بروتوكول الموجات فوق الصوتية على الحيوانات المخدرة ، حيث يتم رسم خريطة لحركة الدم في سيليكو على سلسلة من عمليات المسح بالموجات فوق الصوتية ثنائية الأبعاد متساوية التباعد التي تغطي العين بأكملها من خلال تطبيق تقنية مماثلة كما هو موضح سابقا للتصوير الجنيني والقلب والأوعية الدموية26،27 ، 28 وفي تصوير الأوعية OCT29. يسمح هذا النهج بتوليد صور الأوعية الدموية العميقة ثلاثية الأبعاد ثلاثية الأبعاد غير الغازية دون استخدام عامل تباين ويفتح آفاقا جديدة لرسم خرائط توزيع تدفق الدم داخل العين عبر الأنواع.
Protocol
تم تنفيذ البروتوكول أدناه بإذن من هيئة التفتيش الدنماركية للتجارب على الحيوانات داخل وزارة الأغذية والزراعة ومصايد الأسماك الدنماركية ، الإدارة البيطرية والغذائية الدنماركية (رقم التصريح 2016-15-0201-00835).
1. التخدير والموجات فوق الصوتية المتوسطة
- تخدير البحث.
ملاحظة: يعتمد نوع وجرعة التخدير المناسب بشكل كبير على الأنواع. بشكل عام ، التخدير القائم على الغمر مثل MS-222 (حمض ميثان سلفونيك الإيثيل 3-أمينوبنزوات) ، والبنزوكاين (إيثيل 4-أمينوبنزوات) ، والبروبوفول (2,6-ثنائي إيزوبروبيل فينول) مفيد في الأسماك والبرمائيات التي تمتص بسهولة المخدر فوق الخياشيم أو الجلد (على سبيل المثال ، 0.05 ملغ · L-1 البنزوكاين في سمك السلمون المرقط قوس قزح). تتوفر مجموعة من المركبات الذائبة التي يمكن إعطاؤها عن طريق الوريد والعضل وداخل الصفاق للسالم ، وكذلك التخدير القائم على الغاز. الفاكسالون الذي يتم إعطاؤه عن طريق العضل مفيد في الزواحف (على سبيل المثال ، 30 ملغم · كغ-1 في السحالي) ، والإيسوفلوران الذي يدار كغاز مفيد في الطيور (على سبيل المثال ، 2 ٪ في الهواء للحمام). ارجع إلى الأدبيات المنشورة30،31،32 للحصول على نظرة عامة كاملة على التخدير المتاح عبر الأنواع. - اختبار ردود الفعل في الحيوان لتأكيد المستوى الأمثل من التخدير. تأكد من أن الحيوان بلا حراك تماما أثناء الإجراء لأن إجراء الموجات فوق الصوتية المعزز بالتدفق حساس لضوضاء الحركة.
- يمكن للتخدير العميق جدا أن يغير أنماط تدفق الدم، لذا قم بإجراء معايرة الجرعة في مرحلة بدء التجربة.
- زيادة جرعة التخدير في خطوات ومراقبة تدفق الدم في العين بمساعدة الموجات فوق الصوتية البسيطة وضع السطوع (B-mode).
ملاحظة: يتم الحصول على المستوى الأمثل من التخدير عندما يكون الحيوان بلا حراك (باستثناء التنفس) مع تدفق الدم المرئي في العين.
- إذا كان نوع / جرعة المخدر غير مسموح به لحركات الجهاز التنفسي ، فتأكد من التهوية الكافية للحيوان ، على سبيل المثال ، باستخدام مضخة هواء لأكسجة الماء للأنواع المائية أو جهاز تنفس صناعي للأنواع التي تتنفس الهواء.
- ضع الحيوان في وضع يسمح بالوصول المباشر من الأعلى إلى العين.
ملاحظة: اعتمادا على الأنواع ، يمكن أن يكون هذا إما في وضع ضعيف أو جانبي. قد يكون من المفيد بناء جهاز حمل بسيط باستخدام قطعة صغيرة من المعدن غير التفاعلي (مثل الفولاذ المقاوم للصدأ) وأربطة مطاطية فضفاضة (انظر الشكل 1). - ضع وسط الموجات فوق الصوتية المناسب على عين الحيوان. إذا كانت الجفون المتدرجة (الموجات فوق الصوتية غير منفذة) تغطي العين ، فقم بإزاحتها بلطف باستخدام قطعة قطن.
ملاحظة: بالنسبة للأنواع المائية ، فإن أفضل وسط للموجات فوق الصوتية هو مياه الخزان النظيفة التي يعيش فيها الحيوان عادة. بالنسبة للأنواع الأرضية ، تضمن كمية سخية من هلام الموجات فوق الصوتية حركات وتصويرا حرا لمحول الموجات فوق الصوتية (أي مسبار الصفيف الخطي) عبر سطح العين بأكمله. مطلوب مرهم بيطري على العين المقابلة للأنواع الأرضية.
2. 2D و 3D العين الموجات فوق الصوتية الحصول على صورة
- ضع محول الموجات فوق الصوتية الإنسي للعين إما في اتجاه ظهري / بطني أو روسترال / ذيلي اعتمادا على اتجاه الصورة المطلوب.
- في الوضع B ، مع أقصى عمق للمجال ، قم بتصوير الجزء الإنسي والأعمق من العين وتأكد من أن جميع الهياكل ذات الأهمية مرئية في مجال الصورة.
ملاحظة: في بعض الأنواع ، تشغل العدسة البلورية نسبة كبيرة نسبيا من الفكاهة الزجاجية ، والتي قد تمتص الموجات فوق الصوتية ، خاصة عند الترددات الأعلى. - ترجم محول الطاقة ببطء إلى كل جانب أثناء فحص الصور في الوقت الفعلي. تأكد من أن جميع الهياكل ذات الأهمية مرئية في حقل الصورة ؛ إذا لم يكن الأمر كذلك ، فقم بالتبديل إلى محول طاقة بتردد أقل وعمق أكبر للمجال.
ملاحظة: تسمح الترددات المركزية التالية بأقصى عمق مجال على النحو التالي: 21 ميجاهرتز: 3 سم، 40 ميجاهرتز: 1.5 سم، 50 ميجاهرتز: 1 سم (انظر الجدول 1). ومع ذلك ، يمكن أن يكون عمق قيم المجال الأقصى هذه أقل بشكل ملحوظ إذا كانت العين تحتوي على هياكل متكلسة أو غيرها من الهياكل غير المنفذة بالموجات فوق الصوتية. - اضبط عمق الصورة، وإزاحة العمق (المسافة من أعلى الصورة إلى بنية الاهتمام)، وعرض الصورة، بالإضافة إلى عدد المناطق البؤرية وموقعها لتغطية المنطقة المطلوبة ذات الأهمية في جميع الأبعاد المكانية الثلاثة (على سبيل المثال، عمق 1 سم، إزاحة عمق 2 مم، عرض صورة 1 سم، منطقة بؤرية واحدة).
ملاحظة: على الرغم من أن التسمية المحددة للأزرار التي تضبط هذه المعلمات قد تختلف بين أنظمة الموجات فوق الصوتية، إلا أن معظم الأنظمة سيكون لها أزرار بأسماء منطقية لهذه التعديلات. عادة ما تؤثر إعدادات معلمات الصورة هذه على نطاق الدقة الزمنية المحتملة لاكتساب الموجات فوق الصوتية. - اضبط معدل الإطارات في حدود 50-120 إطارا·s-1.
ملاحظة: يجب أن تكون الدقة الزمنية (أي الفاصل الزمني بين عمليات المسح B-scans المتتالية) كافية لعرض تباين كثافة البكسل الكبير في الأوعية الدموية المصورة، أي يجب ألا تكون الدقة الزمنية عالية جدا. من ناحية أخرى ، لإكمال تسجيل 3D كامل للعين في وقت معقول ، لا يمكن أن تكون الدقة الزمنية منخفضة للغاية. عادة ما تكون الدقة الزمنية التي تتراوح بين 50-120 إطارا·s-1 كافية لإجراء تعزيز التدفق في معظم الأنواع. في بعض أنظمة الموجات فوق الصوتية ، يمكن الحصول على هذه الدقة الزمنية المطلوبة عن طريق التبديل بين أوضاع "التصوير العام" (الدقة المكانية العالية / الزمنية المنخفضة) و "أمراض القلب" (الدقة المكانية المنخفضة / الزمنية العالية). - اضبط كسب 2D إلى مستوى (~ 5 ديسيبل) ، بحيث تكون الهياكل التشريحية مرئية فقط في اكتساب الوضع B لزيادة نسبة الإشارة إلى الضوضاء في إعادة الإعمار اللاحقة المحسنة للتدفق.
- للحصول على صورة ثنائية الأبعاد محسنة بالتدفق في موضع شريحة واحدة، قم بترجمة الترجام إلى هذا الموضع وتابع في الخطوة 3.1.
- للحصول على تسجيل 3D لمنطقة بأكملها من الاهتمام ، على سبيل المثال ، شبكية العين ، ترجمة محول الطاقة إلى طرف واحد من المنطقة محل الاهتمام.
- لتحديد الموقع الدقيق للنهاية القصوى للمنطقة ذات الاهتمام ، قم بزيادة مكاسب 2D لفترة وجيزة.
- بعد اكتمال وضع محول الطاقة الصحيح ، قم بخفض كسب 2D قبل التسجيل لضمان أقصى نسبة إشارة إلى ضوضاء في إعادة البناء اللاحقة المعززة بالتدفق.
- لكل خطوة (شريحة) في التسجيل ثلاثي الأبعاد ، احصل على ≥100 إطار (على النحو الأمثل ≥1000 إطار).
- باستخدام مناور دقيق أو محرك محول طاقة مدمج ، قم بترجمة المحول عبر المنطقة بأكملها ذات الأهمية في خطوات ، على سبيل المثال ، 25 ميكرومتر أو 50 ميكرومتر (تذكر ملاحظة حجم الخطوة) وكرر اقتناء ≥100 إطار لكل خطوة.
- القتل الرحيم لحيوان البحث وفقا لإرشادات رعاية الحيوان الخاصة بالمؤسسة.
3. إعادة بناء الصورة المحسنة للتدفق
- تصدير التسجيلات إلى التصوير الرقمي والاتصالات في شكل ملف الطب (DICOM) (القليل من النهاية).
- لإنتاج صورة واحدة محسنة التدفق استنادا إلى تسجيل سينمائي ≥100 إطار (T)، احسب الانحراف المعياري على مستوى البكسل (STD(x,y)) باستخدام الصيغة:
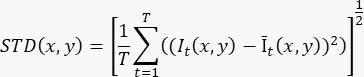
حيث It(x,y) هي شدة البكسل عند إحداثيات البكسل (x,y) في الوقت t، و Īt(x,y) هي القيمة الحسابية المتوسطة ل I بمرور الوقت. - كرر الخطوة 3.2 لكل شريحة في التسجيل ثلاثي الأبعاد.
- لأتمتة عملية حساب STD وإعادة بناء الصورة لشرائح متعددة في تسجيل ثلاثي الأبعاد ، قم بإجراء هذه العملية في وضع الدفعات باستخدام ، على سبيل المثال ، ImageJ والبرنامج النصي الماكرو التكميلي (الملف التكميلي 1).
- دمج جميع الشرائح المعاد إنشاؤها في مكدس صورة واحد (الأمر تحويل الصور إلى مكدس في ImageJ).
- حدد سمك الشريحة من حجم الخطوة المستخدم أثناء الاكتساب (الأمر خصائص في ImageJ).
- احفظ مكدس الصور كملف TIF 3D.
ملاحظة: يمكن لاحقا استخدام التسجيلات ثلاثية الأبعاد المرجحة بالتدفق للأوعية الدموية العينية لإنشاء تجسيدات حجمية وبناء نماذج تشريحية رقمية وفيزيائية للهياكل الوعائية للعين. خيارات معالجة الصور هذه خارج نطاق هذا البروتوكول. راجع المقالات المنشورة سابقا لمزيد من التفاصيل33,34,35.
النتائج
يمكن تطبيق تقنية الموجات فوق الصوتية المعززة بالتدفق لتصوير الأسرة الوعائية للعين في مجموعة من الأنواع وقد استخدمت حاليا في 46 نوعا مختلفا من الفقاريات (الشكل 1 ، الجدول 1). يوفر وجود خلايا الدم الحمراء النواة في الفقاريات الثدييات غير البالغة تباينا إيجابيا للدم ا...
Discussion
يوفر تصوير الأوعية الدموية باستخدام الموجات فوق الصوتية المعززة بالتدفق طريقة جديدة للتصوير غير الغازي للأوعية الدموية للعين التي توفر العديد من المزايا مقارنة بالتقنيات الحالية ولكن لها حدودها الجوهرية. الميزة الأساسية للموجات فوق الصوتية المعززة بالتدفق هي القدرة على توليد تصوير ال?...
Disclosures
ويعلن صاحبا البلاغ أنه لا توجد مصالح كاملة.
Acknowledgements
وقد تلقى هذا العمل تمويلا من مؤسسة كارلسبرغ (CF17-0778; CF18-0658)، ومؤسسة لوندبيك (R324-2019-1470; R346-2020-1210) ، ومؤسسات Velux (00022458) ، ومؤسسة A.P. Møller لتقدم العلوم الطبية ، وبرنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي بموجب اتفاقية منحة Marie Skłodowska-Curie (رقم 754513) ، ومؤسسة أبحاث جامعة آرهوس.
Materials
| Name | Company | Catalog Number | Comments |
| MS-222 | Sigma | E10521-50G | |
| Benzocaine | Sigma | E-1501 | |
| Propofol | B Braun | 12260470_0320 | |
| Alfaxalon | Jurox | NA | |
| Isoflurane | Zoetis | 50019100 | |
| Ultrasound scanner | VisualSonics | Vevo 2100 |
References
- Yu, C. Q., Schwab, I. R., Dubielzig, R. R. Feeding the vertebrate retina from the Cambrian to the Tertiary. Journal of Zoology. 278 (4), 259-269 (2009).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retinal and Eye Research. 20 (2), 175-208 (2001).
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Damsgaard, C., et al. Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife. , 8 (2019).
- Buttery, R. G., Hinrichsen, C. F. L., Weller, W. L., Haight, J. R. How thick should a retina be? A comparative study of mammalian species with and without intraretinal vasculature. Vision Research. 31 (2), 169-187 (1991).
- Ames, A., Li, Y., Heher, E., Kimble, C. Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. The Journal of Neuroscience. 12 (3), 840-853 (1992).
- Chase, J. The Evolution of retinal vascularization in mammals: A comparison of vascular and avascular retinae. Ophthalmology. 89 (12), 1518-1525 (1982).
- Johnson, G. L. Ophthalmoscopic studies on the eyes of mammals. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 254 (794), 207-220 (1968).
- Johnson, G. L. I. Contributions to the comparative anatomy of the mammalian eye, chiefly based on ophthalmoscopic examination. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 194 (194-206), 1-82 (1901).
- Rodriguez-Ramos Fernandez, J., Dubielzig, R. R. Ocular comparative anatomy of the family Rodentia. Veterinary Ophthalmology. 16, 94-99 (2013).
- Copeland, D. E. Functional vascularization of the teleost eye. Current Topics in Eye Research. 3, 219-280 (1980).
- Meyer, D. B., Crescitelli, F. . The Visual System in Vertebrates. Handbook of Sensory Physiology. 7, (1977).
- Potier, S., Mitkus, M., Kelber, A. Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126 (2020).
- Wittenberg, J. B., Wittenberg, B. A. Active secretion of oxygen into the eye of fish. Nature. 194, 106-107 (1962).
- Damsgaard, C. Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology. 252, 110840 (2021).
- Damsgaard, C., et al. A novel acidification mechanism for greatly enhanced oxygen supply to the fish retina. Elife. 9, (2020).
- Wittenberg, J. B., Haedrich, R. L. The choroid rete mirabile of the fish eye. II. Distribution and relation to the pseudobranch and to the swimbladder rete mirabile. Biological Bulletin. 146 (1), 137-156 (1974).
- Wittenberg, J. B., Wittenberg, B. A. The choroid rete mirabile of the fish eye. I. Oxygen secretion and structure: comparison with the swimbladder rete mirabile. Biological Bulletin. 146 (1), 116-136 (1974).
- Berenbrink, M. Historical reconstructions of evolving physiological complexity: O2 secretion in the eye and swimbladder of fishes. Journal of Experimental Biology. 210, 1641-1652 (2007).
- Berenbrink, M., Koldkjaer, P., Kepp, O., Cossins, A. R. Evolution of oxygen secretion in fishes and the emergence of a complex physiological system. Science. 307 (5716), 1752-1757 (2005).
- Keane, P. A., Sadda, S. R. Retinal imaging in the twenty-first century: State of the art and future directions. Ophthalmology. 121 (12), 2489-2500 (2014).
- Yung, M., Klufas, M. A., Sarraf, D. Clinical applications of fundus autofluorescence in retinal disease. International Journal of Retina and Vitreous. 2 (1), 12 (2016).
- Ang, M., et al. Optical coherence tomography angiography: a review of current and future clinical applications. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (2), 237-245 (2018).
- Spaide, R. F., Koizumi, H., Pozonni, M. C. Enhanced depth imaging spectral-domain optical coherence tomography. American Journal of Ophthalmology. 146 (4), 496-500 (2008).
- Shen, Q., et al. Magnetic resonance imaging of tissue and vascular layers in the cat retina. Journal of Magnetic Resonance Imaging. 23 (4), 465-472 (2006).
- Tan, G. X., Jamil, M., Tee, N. G., Zhong, L., Yap, C. H. 3D reconstruction of chick embryo vascular geometries using non-invasive high-frequency ultrasound for computational fluid dynamics studies. Annals of Biomedical Engineering. 43 (11), 2780-2793 (2015).
- Ho, S., Tan, G. X. Y., Foo, T. J., Phan-Thien, N., Yap, C. H. Organ dynamics and fluid dynamics of the HH25 chick embryonic cardiac ventricle as revealed by a novel 4D high-frequency ultrasound imaging technique and computational flow simulations. Annals of Biomedical Engineering. 45 (10), 2309-2323 (2017).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments: JoVE. (141), e57089 (2018).
- Jia, Y., et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Optics Express. 20 (4), 4710-4725 (2012).
- Clarke, K. W., Trim, C. M., Trim, C. M. . Veterinary Anaesthesia E-Book. , (2013).
- Flecknell, P. . Laboratory Animal Anaesthesia. , (2015).
- West, G., Heard, D., Caulkett, N. . Zoo Animal and Wildlife Immobilization and Anesthesia. , (2014).
- Lauridsen, H., Hansen, K., Nørgård, M. &. #. 2. 1. 6. ;., Wang, T., Pedersen, M. From tissue to silicon to plastic: three-dimensional printing in comparative anatomy and physiology. Royal Society Open Science. 3 (3), 150643 (2016).
- Lauridsen, H., et al. Inside out: Modern imaging techniques to reveal animal anatomy. PLoS One. 6 (3), 17879 (2011).
- Ruthensteiner, B., Heß, M. Embedding 3D models of biological specimens in PDF publications. Microscopy Research and Technique. 71 (11), 778-786 (2008).
- Damsgaard, C., Lauridsen, H. Deep vascular imaging in the eye with flow-enhanced ultrasound. bioRxiv. , 447055 (2021).
- Mueller, R. L., Ryan Gregory, T., Gregory, S. M., Hsieh, A., Boore, J. L. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders. Zoology. 111 (3), 218-230 (2008).
- Greis, C. Quantitative evaluation of microvascular blood flow by contrast-enhanced ultrasound (CEUS). Clinical Hemorheology and Microcirculation. 49, 137-149 (2011).
- Urs, R., Ketterling, J. A., Tezel, G., Silverman, R. H. Contrast-enhanced plane-wave ultrasound imaging of the rat eye. Experimental Eye Research. 193, 107986 (2020).
- Walls, G. L. . The vertebrate eye and its adaptive radiation. , (1942).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved