É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem vascular profunda no olho com ultrassom aumentado de fluxo
Neste Artigo
Resumo
Apresentamos uma técnica de ultrassom não invasiva para geração de angiografias tridimensionais no olho sem o uso de agentes de contraste.
Resumo
A retina dentro do olho é um dos tecidos mais exigentes de energia do corpo e, portanto, requer altas taxas de entrega de oxigênio de um rico suprimento de sangue. A lâmina capilar das linhas coroides da superfície externa da retina e é a fonte dominante de oxigênio na maioria das retinas vertebradas. No entanto, este leito vascular é desafiador para a imagem com técnicas ópticas tradicionais devido à sua posição atrás da retina altamente absorvente de luz. Aqui descrevemos uma técnica de ultrassom de alta frequência com posterior aumento de fluxo para leitos vasculares profundos de imagem (0,5-3 cm) do olho com alta resolução espacial. Este método não invasivo funciona bem em espécies com glóbulos vermelhos nucleados (modelos animais não mamíferos e fetais). Permite a geração de angiografias tridimensionais não invasivas sem o uso de agentes de contraste, e é independente dos ângulos de fluxo sanguíneo com uma sensibilidade maior do que as técnicas de ultrassom baseadas em Doppler.
Introdução
O alto metabolismo da retina vertebrado impõe um tradeoff intrínseco entre duas necessidades contrastantes; altas taxas de fluxo sanguíneo e um caminho leve desprovido de vasos sanguíneos. Para evitar perturbação visual de glóbulos vermelhos perfumados, a retina de todos os vertebrados recebe oxigênio e nutrientes através de uma folha de capilares atrás dos fotorreceptores, o choriocapillaris1,2,3. No entanto, esta única fonte de nutrientes e oxigênio impõe uma limitação de difusão à espessura da retina4,5, de modo que muitas espécies visualmente ativas possuem uma variedade de redes vasculares elaboradas para fornecer suprimento sanguíneo adicional a este órgão metabolicamente ativo6. Esses leitos vasculares incluem vasos sanguíneos que perfumam as camadas internas da retina em mamíferos e alguns peixes4,7,8,9,10, vasos sanguíneos no lado interno (voltado para a luz) da retina encontrados em muitos peixes, répteis e aves4,11,12,13, e arranjos vasculares contracorrentes do choroide do peixe, o rete choroide mirabile, que permite a geração de pressões parciais de oxigênio super-atmosférica14,15,16,17,18,19,20. Apesar de esses caminhos adicionais não choroidais para o fornecimento de nutrientes da retina desempenharem um papel essencial no abastecimento dos requisitos metabólicos da visão superior4, a anatomia tridimensional dessas estruturas vasculares é mal compreendida, limitando nossa compreensão da evolução morfológica do olho vertebrado.
Tradicionalmente, o suprimento de sangue da retina tem sido estudado utilizando técnicas ópticas, como a oftalmoscopia fundus. Esta categoria de técnicas fornece informações não destrutivas de alto rendimento sobre anatomia não choroidal dos vasos sanguíneos em alta resolução21 e, portanto, é prontamente utilizada no diagnóstico clínico de anormalidades na estrutura do vaso da retina22. No entanto, o pigmento da retina absorve a luz transmitida e limita a profundidade de visão nessas técnicas ópticas, fornecendo informações reduzidas sobre estrutura e função coroidal sem o uso de agente de contraste21. Limitações de profundidade semelhantes são experimentadas na tomografia de coerência óptica (OUT). Esta técnica pode gerar angiografias fundus de alta resolução usando ondas de luz à custa técnica de penetração de profundidade23, enquanto a imagem de profundidade aprimorada OCT pode visualizar o coroide em detrimento da qualidade da imagem da retina24. A ressonância magnética supera as limitações ópticas da oftalmoscopia e do OCT e pode mapear camadas vasculares na retina, embora em baixa resolução25. A histologia e a tomografia microcomputada (μCT) mantêm a alta resolução das técnicas ópticas e fornecem informações sobre morfologia vascular de olhos inteiros4, mas ambas as técnicas requerem amostragem ocular e, portanto, não são possíveis na clínica ou espécies raras ou ameaçadas. Para superar algumas das limitações dessas técnicas de imagem da retina estabelecidas, o estudo aqui apresenta um protocolo de ultrassom em animais anestesiados, onde o movimento sanguíneo é mapeado em silico em uma série de ultrassonografias bidimensionais igualmente espaçadas que abrangem um olho inteiro, aplicando uma técnica comparável como descrito anteriormente para imagens embrionárias e cardiovasculares26,27, 28 e em ANgiografia OCT29. Esta abordagem permite a geração de angiografias oculares profundas tridimensionais não invasivas sem o uso de um agente de contraste e abre novas vias para mapear a distribuição do fluxo sanguíneo dentro do olho entre as espécies.
Protocolo
O protocolo abaixo foi realizado com permissão da Inspetoria Dinamarquesa de Experimentação animal dentro do Ministério dinamarquês de Alimentos, Agricultura e Pesca, Veterinária Dinamarquesa e Administração de Alimentos (Licença número 2016-15-0201-00835).
1. Anestesia e ultrassom médio
- Anestesiar o animal de pesquisa.
NOTA: Tipo e dose de anestesia apropriada são altamente dependentes de espécies. Em geral, anestésicos à base de imersão como MS-222 (ácido metanosulfônico etílico etílico, benzocaína (etílico 4-aminobenzoato) e propofol (2,6-diisopropil phenol) são úteis em peixes e anfíbios que absorvem prontamente o anestésico sobre brânquias ou pele (por exemplo, 0,05 mg· L-1 benzocaína em truta arco-íris). Uma gama de compostos dissolvidos que podem ser administrados por via intravenosa, intramuscularmente, intraperitoneally está disponível para amniotos, assim como anestésicos à base de gás. Alfaxalon administrado intramuscularmente é útil em répteis (por exemplo, 30 mg·kg-1 em lagartos), e o isoflurane administrado como gás é útil em aves (por exemplo, 2% no ar para pombos). Consulte a literatura publicada30,31,32 para uma visão geral completa dos anestésicos disponíveis entre as espécies. - Teste reflexos no animal para confirmar um nível ideal de anestesia. Certifique-se de que o animal está completamente imóvel durante o procedimento, pois o procedimento de ultrassom aumentado pelo fluxo é sensível ao ruído de movimento.
- Anestesia muito profunda pode alterar os padrões de fluxo sanguíneo, então realize uma titulação de dose na fase inicial de um experimento.
- Aumente a dosagem da anestesia em etapas e observe o fluxo sanguíneo no olho auxiliado pelo simples modo de brilho (modo B) ultrassom.
NOTA: Um nível ideal de anestesia é obtido quando o animal está imóvel (exceto respiração) com fluxo sanguíneo ocular visível.
- Se o tipo/dose de anestésico não for permissivo para movimentos respiratórios, então garanta ventilação adequada do animal, por exemplo, usando uma bomba de ar para oxigenar a água para espécies aquáticas ou um ventilador para espécies respiratórias.
- Posicione o animal em uma postura que permita acesso direto de cima ao olho.
NOTA: Dependendo das espécies, isso pode estar em uma posição supina ou lateral. Pode ser útil para construir um dispositivo de retenção simples usando um pequeno pedaço de metal não reativo (por exemplo, aço inoxidável) e elásticos soltos (ver Figura 1). - Coloque o meio de ultrassom adequado no olho do animal. Se as pálpebras dimensionadas (ultrassom impermeável) cobrirem o olho, então desloque-as suavemente com um cotonete.
NOTA: Para espécies aquáticas, o melhor meio de ultrassom é a água limpa do tanque em que o animal geralmente vive. Para espécies terrestres, uma generosa quantidade de gel de ultrassom garante movimentos livres e imagens do transdutor de ultrassom (ou seja, sonda de matriz linear) em toda a superfície do olho. A pomada veterinária no olho contralateral é necessária para espécies terrestres.
2. Aquisição de imagem de ultrassom ocular 2D e 3D
- Posicione o transdutor de ultrassom medial ao olho em uma orientação dorsal/ventral ou rostral/caudal, dependendo da orientação de imagem desejada.
- No modo B, com uma profundidade máxima de campo, imagem a parte medial e mais profunda do olho e certifique-se de que todas as estruturas de interesse são visíveis no campo da imagem.
NOTA: Em algumas espécies, a lente cristalina ocupa uma proporção relativamente grande do humor vítreo, que pode absorver o ultrassom, especialmente em frequências mais altas. - Traduza lentamente o transdutor para cada lado enquanto inspeciona as imagens em tempo real. Certifique-se de que todas as estruturas de interesse estejam visíveis no campo da imagem; se não, mude para um transdutor com menor frequência e maior profundidade de campo.
NOTA: As seguintes frequências centrais permitem a seguinte profundidade máxima de campo: 21 MHz: 3 cm, 40 MHz: 1,5 cm, 50 MHz: 1 cm (ver Tabela 1). No entanto, esses valores máximos de profundidade de campo podem ser marcadamente menores se o olho contiver estruturas calcificadas ou outras estruturas impermeáveis de ultrassom. - Ajuste a profundidade da imagem, deslocamento de profundidade (distância da parte superior da imagem até a estrutura de interesse), largura da imagem, bem como número e posição das zonas focais para cobrir a região desejada de interesse em todas as três dimensões espaciais (por exemplo, profundidade de imagem de 1 cm, deslocamento de profundidade de 2 mm, largura de imagem de 1 cm, uma zona focal).
NOTA: Embora a nomeação específica de botões que ajustam esses parâmetros possa variar entre sistemas de ultrassom, a maioria dos sistemas terá botões com nomes lógicos para esses ajustes. Essas configurações de parâmetros de imagem geralmente afetam o intervalo de possíveis resoluções temporais da aquisição do ultrassom. - Definir a taxa de quadros na faixa de 50-120 quadros·s-1.
NOTA: A resolução temporal (ou seja, o intervalo de tempo entre os sucessivos B-scans) deve ser adequada para exibir grande variabilidade de intensidade de pixel nos vasos sanguíneos imaged, ou seja, a resolução temporal não deve ser muito alta. Por outro lado, para completar uma gravação 3D completa do olho em um tempo razoável, a resolução temporal não pode ser muito baixa. Uma resolução temporal que varia de 50-120 quadros·s-1 é geralmente adequada para o procedimento aprimorado de fluxo na maioria das espécies. Em alguns sistemas de ultrassom, essa resolução temporal desejada pode ser obtida alternando entre os modos "imagem geral" (alta resolução espacial/baixa temporal) e "cardiologia" (baixa resolução espacial/alta temporal). - Ajuste o ganho 2D para um nível (~5 dB), de modo que as estruturas anatômicas são apenas visíveis na aquisição do modo B para aumentar a relação sinal-ruído na reconstrução subsequente aprimorada de fluxo.
- Para adquirir uma imagem aprimorada de fluxo 2D em uma única posição de fatia, traduza o transdutor para esta posição e continue na etapa 3.1.
- Para adquirir uma gravação 3D de toda uma região de interesse, por exemplo, a retina, traduza o transdutor a um extremo da região de interesse.
- Para determinar a posição exata do extremo final da região de interesse, aumente o ganho 2D brevemente.
- Após a colocação correta do transdutor ser concluída, diminua o ganho 2D antes de gravar para garantir a relação sinal-ruído máxima na reconstrução subsequente aprimorada de fluxo.
- Para cada etapa (fatia) na gravação 3D, adquira ≥100 quadros (ótimo ≥1000 quadros).
- Usando um micromanipulador ou motor transdutor de construção, traduza o transdutor em toda a região de interesse em etapas de, por exemplo, 25 μm ou 50 μm (lembre-se de notar o tamanho da etapa) e repita a aquisição de quadros ≥100 para cada etapa.
- Eutanize o animal de pesquisa de acordo com as diretrizes de cuidados com animais da instituição.
3. Reconstrução de imagem aprimorada pelo fluxo
- Exporte as gravações para o formato de arquivo de imagem digital e comunicações em medicina (DICOM) (pouco endian).
- Para produzir uma única imagem aprimorada de fluxo com base em uma gravação cine de ≥100 quadros (T), calcule o desvio padrão no nível do pixel (STD(x,y)) usando a fórmula:
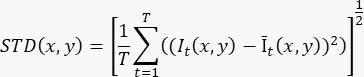
Onde It(x,y) é a intensidade do pixel na coordenada (x,y) pixel no tempo t, e Īt(x,y) é o valor médio aritmético de I ao longo do tempo. - Repita o passo 3.2 para cada fatia na gravação 3D.
- Para automatizar o processo de cálculo de DST e reconstrução de imagem para várias fatias em uma gravação 3D, realize esta operação no modo de lote usando, por exemplo, ImageJ e o script de macro suplementar (Arquivo Suplementar 1).
- Combine todas as fatias reconstruídas em uma pilha de imagens (Imagens para Stack comando no ImageJ).
- Especifique a espessura da fatia do tamanho da etapa usada durante a aquisição (comando Propriedades no ImageJ).
- Salve a pilha de imagens como um arquivo TIF 3D.
NOTA: Gravações tridimensionais ponderadas por fluxo de vasos sanguíneos oculares podem ser posteriormente usadas para criar renderizações de volume e construir modelos anatômicos digitais e físicos de estruturas vasculares do olho. Essas opções de processamento de imagens estão fora do escopo deste protocolo; consulte os artigos publicados anteriormente para mais detalhes33,34,35.
Resultados
A técnica de ultrassom aprimorada de fluxo para a imagem de leitos vasculares do olho pode ser aplicada em uma variedade de espécies e tem sido usada atualmente em 46 espécies diferentes de vertebrados (Figura 1, Tabela 1). A presença de glóbulos vermelhos nucleados em vertebrados não adulto-mamíferos fornece contraste positivo do sangue fluindo em comparação com tecido estático em gravações de cine (Arquivo Suplementar 2). No entanto, quando ana...
Discussão
A imagem vascular usando ultrassom aprimorado pelo fluxo fornece um novo método para imagens não invasivas da vasculatura do olho que oferece várias vantagens sobre as técnicas atuais, mas tem suas limitações intrínsecas. A principal vantagem do ultrassom aumentado pelo fluxo é a capacidade de gerar angiografias oculares com uma profundidade de campo que excede o epitélio pigmento da retina, que limita a profundidade de campo em técnicas ópticas. Na imagem de ultrassom, a resolução espacial e a profundidade ...
Divulgações
Os autores declaram que não existem interesses completos.
Agradecimentos
Este trabalho recebeu financiamento da Fundação Carlsberg (CF17-0778; CF18-0658), a Fundação Lundbeck (R324-2019-1470; R346-2020-1210), as Fundações Velux (00022458), a Fundação A.P. Møller para o Avanço da Ciência Médica, o programa de pesquisa e inovação Horizon 2020 da União Europeia sob o acordo de subvenção Marie Skłodowska-Curie (No. 754513) e a Fundação de Pesquisa da Universidade de Aarhus.
Materiais
| Name | Company | Catalog Number | Comments |
| MS-222 | Sigma | E10521-50G | |
| Benzocaine | Sigma | E-1501 | |
| Propofol | B Braun | 12260470_0320 | |
| Alfaxalon | Jurox | NA | |
| Isoflurane | Zoetis | 50019100 | |
| Ultrasound scanner | VisualSonics | Vevo 2100 |
Referências
- Yu, C. Q., Schwab, I. R., Dubielzig, R. R. Feeding the vertebrate retina from the Cambrian to the Tertiary. Journal of Zoology. 278 (4), 259-269 (2009).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retinal and Eye Research. 20 (2), 175-208 (2001).
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Damsgaard, C., et al. Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife. , 8 (2019).
- Buttery, R. G., Hinrichsen, C. F. L., Weller, W. L., Haight, J. R. How thick should a retina be? A comparative study of mammalian species with and without intraretinal vasculature. Vision Research. 31 (2), 169-187 (1991).
- Ames, A., Li, Y., Heher, E., Kimble, C. Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. The Journal of Neuroscience. 12 (3), 840-853 (1992).
- Chase, J. The Evolution of retinal vascularization in mammals: A comparison of vascular and avascular retinae. Ophthalmology. 89 (12), 1518-1525 (1982).
- Johnson, G. L. Ophthalmoscopic studies on the eyes of mammals. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 254 (794), 207-220 (1968).
- Johnson, G. L. I. Contributions to the comparative anatomy of the mammalian eye, chiefly based on ophthalmoscopic examination. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 194 (194-206), 1-82 (1901).
- Rodriguez-Ramos Fernandez, J., Dubielzig, R. R. Ocular comparative anatomy of the family Rodentia. Veterinary Ophthalmology. 16, 94-99 (2013).
- Copeland, D. E. Functional vascularization of the teleost eye. Current Topics in Eye Research. 3, 219-280 (1980).
- Meyer, D. B., Crescitelli, F. . The Visual System in Vertebrates. Handbook of Sensory Physiology. 7, (1977).
- Potier, S., Mitkus, M., Kelber, A. Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126 (2020).
- Wittenberg, J. B., Wittenberg, B. A. Active secretion of oxygen into the eye of fish. Nature. 194, 106-107 (1962).
- Damsgaard, C. Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology. 252, 110840 (2021).
- Damsgaard, C., et al. A novel acidification mechanism for greatly enhanced oxygen supply to the fish retina. Elife. 9, (2020).
- Wittenberg, J. B., Haedrich, R. L. The choroid rete mirabile of the fish eye. II. Distribution and relation to the pseudobranch and to the swimbladder rete mirabile. Biological Bulletin. 146 (1), 137-156 (1974).
- Wittenberg, J. B., Wittenberg, B. A. The choroid rete mirabile of the fish eye. I. Oxygen secretion and structure: comparison with the swimbladder rete mirabile. Biological Bulletin. 146 (1), 116-136 (1974).
- Berenbrink, M. Historical reconstructions of evolving physiological complexity: O2 secretion in the eye and swimbladder of fishes. Journal of Experimental Biology. 210, 1641-1652 (2007).
- Berenbrink, M., Koldkjaer, P., Kepp, O., Cossins, A. R. Evolution of oxygen secretion in fishes and the emergence of a complex physiological system. Science. 307 (5716), 1752-1757 (2005).
- Keane, P. A., Sadda, S. R. Retinal imaging in the twenty-first century: State of the art and future directions. Ophthalmology. 121 (12), 2489-2500 (2014).
- Yung, M., Klufas, M. A., Sarraf, D. Clinical applications of fundus autofluorescence in retinal disease. International Journal of Retina and Vitreous. 2 (1), 12 (2016).
- Ang, M., et al. Optical coherence tomography angiography: a review of current and future clinical applications. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (2), 237-245 (2018).
- Spaide, R. F., Koizumi, H., Pozonni, M. C. Enhanced depth imaging spectral-domain optical coherence tomography. American Journal of Ophthalmology. 146 (4), 496-500 (2008).
- Shen, Q., et al. Magnetic resonance imaging of tissue and vascular layers in the cat retina. Journal of Magnetic Resonance Imaging. 23 (4), 465-472 (2006).
- Tan, G. X., Jamil, M., Tee, N. G., Zhong, L., Yap, C. H. 3D reconstruction of chick embryo vascular geometries using non-invasive high-frequency ultrasound for computational fluid dynamics studies. Annals of Biomedical Engineering. 43 (11), 2780-2793 (2015).
- Ho, S., Tan, G. X. Y., Foo, T. J., Phan-Thien, N., Yap, C. H. Organ dynamics and fluid dynamics of the HH25 chick embryonic cardiac ventricle as revealed by a novel 4D high-frequency ultrasound imaging technique and computational flow simulations. Annals of Biomedical Engineering. 45 (10), 2309-2323 (2017).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments: JoVE. (141), e57089 (2018).
- Jia, Y., et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Optics Express. 20 (4), 4710-4725 (2012).
- Clarke, K. W., Trim, C. M., Trim, C. M. . Veterinary Anaesthesia E-Book. , (2013).
- Flecknell, P. . Laboratory Animal Anaesthesia. , (2015).
- West, G., Heard, D., Caulkett, N. . Zoo Animal and Wildlife Immobilization and Anesthesia. , (2014).
- Lauridsen, H., Hansen, K., Nørgård, M. &. #. 2. 1. 6. ;., Wang, T., Pedersen, M. From tissue to silicon to plastic: three-dimensional printing in comparative anatomy and physiology. Royal Society Open Science. 3 (3), 150643 (2016).
- Lauridsen, H., et al. Inside out: Modern imaging techniques to reveal animal anatomy. PLoS One. 6 (3), 17879 (2011).
- Ruthensteiner, B., Heß, M. Embedding 3D models of biological specimens in PDF publications. Microscopy Research and Technique. 71 (11), 778-786 (2008).
- Damsgaard, C., Lauridsen, H. Deep vascular imaging in the eye with flow-enhanced ultrasound. bioRxiv. , 447055 (2021).
- Mueller, R. L., Ryan Gregory, T., Gregory, S. M., Hsieh, A., Boore, J. L. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders. Zoology. 111 (3), 218-230 (2008).
- Greis, C. Quantitative evaluation of microvascular blood flow by contrast-enhanced ultrasound (CEUS). Clinical Hemorheology and Microcirculation. 49, 137-149 (2011).
- Urs, R., Ketterling, J. A., Tezel, G., Silverman, R. H. Contrast-enhanced plane-wave ultrasound imaging of the rat eye. Experimental Eye Research. 193, 107986 (2020).
- Walls, G. L. . The vertebrate eye and its adaptive radiation. , (1942).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados