Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Flow-Enhanced Ultrason ile Gözde Derin Vasküler Görüntüleme
Bu Makalede
Özet
Kontrast madde kullanılmadan gözde üç boyutlu anjiyografiler oluşturmak için non-invaziv bir ultrason tekniği sunuyoruz.
Özet
Göz içindeki retina, vücuttaki en enerji gerektiren dokulardan biridir ve bu nedenle zengin bir kan kaynağından yüksek oranda oksijen iletimi gerektirir. Koroidin kılcal laminası retinanın dış yüzeyini kaplar ve çoğu omurgalı retinasında baskın oksijen kaynağıdır. Bununla birlikte, bu vasküler yatağın, yüksek ışık emici retinanın arkasındaki konumu nedeniyle geleneksel optik tekniklerle görüntülenmesi zordur. Burada, gözün derin vasküler yataklarını (0.5-3 cm) yüksek spatiotemporal çözünürlükte görüntülemek için daha sonra akış iyileştirme ile yüksek frekanslı bir ultrason tekniğini tanımladık. Bu invaziv olmayan yöntem, çekirdekli kırmızı kan hücrelerine sahip türlerde (memeli olmayan ve fetal hayvan modelleri) iyi çalışır. Kontrast madde kullanılmadan non-invaziv üç boyutlu anjiyografilerin üretilmesine olanak sağlar ve Doppler bazlı ultrason görüntüleme tekniklerinden daha yüksek hassasiyete sahip kan akış açılarından bağımsızdır.
Giriş
Omurgalı retinasındaki yüksek metabolizma, iki zıt ihtiyaç arasında içsel bir denge oluşturur; yüksek kan akış hızları ve kan damarlarından yoksun hafif bir yol. Kırmızı kan hücrelerinin perfüze edilmesinin görsel rahatsızlığını önlemek için, tüm omurgalıların retinası, fotoreseptörlerin arkasındaki bir kılcal damar tabakası olan koryokapillaris1,2,3 aracılığıyla oksijen ve besin alır. Bununla birlikte, bu tek besin ve oksijen kaynağı, retinanın kalınlığına bir difüzyon sınırlaması getirir4,5, bu nedenle görsel olarak aktif birçok tür, metabolik olarak aktif olan bu organa ek kan kaynağı sağlamak için çeşitli ayrıntılı vasküler ağlara sahiptir6. Bu vasküler yataklar, memelilerde ve bazı balıklarda iç retinal tabakaları perfüze eden kan damarlarını4,7,8,9,10, birçok balıkta, sürüngende ve kuşta bulunan retinanın iç (ışığa bakan) tarafındaki kan damarlarını4,11,12,13 ve balık koroidinin, koroid rete'nin ters akımlı vasküler düzenlemelerini içerir. mirabile, süper atmosferik oksijen kısmi basınçlarının üretilmesine izin verir14,15,16,17,18,19,20. Retinal besin kaynağı için bu ek koroidal olmayan yolların, üstün görmenin metabolik gereksinimlerini karşılamada önemli bir rol oynamasına rağmen4, bu vasküler yapıların üç boyutlu anatomisi tam olarak anlaşılamamıştır ve omurgalı gözünün morfolojik evrimi hakkındaki anlayışımızı sınırlamaktadır.
Geleneksel olarak, retinal kan akımı, fundus oftalmoskopisi gibi optik teknikler kullanılarak incelenmiştir. Bu teknik kategorisi, yüksek çözünürlükte21 koroidal olmayan kan damarı anatomisi hakkında yüksek verimli tahribatsız bilgiler sağlar ve bu nedenle retinal damar yapısındaki anormalliklerin klinik tanısında kolayca kullanılır22. Bununla birlikte, retinal pigment epiteli iletilen ışığı emer ve bu optik tekniklerde görüş derinliğini sınırlar, kontrast madde kullanılmadan koroidal yapı ve fonksiyon hakkında daha az bilgi sağlar21. Benzer derinlik sınırlamaları optik koherens tomografide (OKT) de yaşanmaktadır. Bu teknik, derinlik penetrasyonunun teknik pahasına ışık dalgaları kullanarak yüksek çözünürlüklü fundus anjiyografileri üretebilir23, gelişmiş derinlik görüntüleme OCT'si ise retinal görüntüleme kalitesi pahasına koroidi görselleştirebilir24. Manyetik rezonans görüntüleme, oftalmoskopi ve OCT'nin optik sınırlamalarının üstesinden gelir ve düşük çözünürlükte de olsa retinadaki vasküler tabakaları haritalayabilir25. Histoloji ve mikrobilgisayarlı tomografi (μBT), optik tekniklerin yüksek çözünürlüğünü korur ve tüm göz vasküler morfolojisi hakkında bilgi sağlar4, ancak her iki teknik de oküler örnekleme gerektirir ve bu nedenle klinikte veya nadir veya nesli tükenmekte olan türlerde mümkün değildir. Bu yerleşik retinal görüntüleme tekniklerinin bazı sınırlamalarının üstesinden gelmek için, buradaki çalışma, embriyonik ve kardiyovasküler görüntüleme için daha önce tarif edildiği gibi karşılaştırılabilir bir teknik uygulanarak, tüm gözü kapsayan bir dizi eşit aralıklı iki boyutlu ultrason taraması üzerinde kan hareketinin siliko olarak haritalandırıldığı anestezi altındaki hayvanlar üzerinde bir ultrason protokolü sunmaktadır26,27, 28 ve OCT anjiyografide29. Bu yaklaşım, kontrast madde kullanmadan non-invaziv üç boyutlu derin oküler anjiyografilerin üretilmesine izin verir ve türler arasında göz içindeki kan akışı dağılımını haritalamak için yeni yollar açar.
Protokol
Aşağıdaki protokol, Danimarka Gıda, Tarım ve Balıkçılık Bakanlığı, Danimarka Veterinerlik ve Gıda İdaresi bünyesindeki Danimarka Hayvan Deneyleri Müfettişliği'nin izniyle gerçekleştirilmiştir (İzin numarası 2016-15-0201-00835).
1. Anestezi ve ultrason ortamı
- Araştırma hayvanını anestezi altına alın.
NOT: Uygun anestezinin tipi ve dozu yüksek oranda türe bağımlıdır. Genel olarak, MS-222 (etil 3-aminobenzoat metansülfonik asit), benzokain (etil 4-aminobenzoat) ve propofol (2,6-diizopropil fenol) gibi daldırma bazlı anestezikler, anesteziyi solungaçlar veya cilt üzerinde kolayca emen balık ve amfibilerde faydalıdır (örneğin, 0.05 mg · Gökkuşağı alabalığında L-1 benzokain). Amniyotlar için intravenöz, intramüsküler, intraperitoneal olarak uygulanabilen bir dizi çözünmüş bileşik, gaz bazlı anestezikler gibi mevcuttur. Kas içinden uygulanan alfaxalon sürüngenlerde faydalıdır (örneğin, kertenkelelerde 30 mg · kg-1) ve gaz olarak uygulanan izofluran kuşlarda faydalıdır (örneğin, güvercinler için havada% 2). Türler arasında mevcut anesteziklere tam bir genel bakış için yayınlanmış literatüre30,31,32 bakın. - Optimal anestezi seviyesini doğrulamak için hayvandaki refleksleri test edin. Akış artırılmış ultrason prosedürü hareket gürültüsüne duyarlı olduğundan, işlem sırasında hayvanın tamamen hareketsiz olduğundan emin olun.
- Çok derin anestezi kan akış düzenini değiştirebilir, bu nedenle bir deneyin başlangıç aşamasında bir doz titrasyonu yapın.
- Anestezi dozajını adım adım artırın ve basit parlaklık modu (B-modu) ultrasonu yardımıyla gözdeki kan akışını gözlemleyin.
NOT: Hayvan görünür oküler kan akışı ile hareketsiz olduğunda (solunum hariç) optimal bir anestezi seviyesi elde edilir.
- Anestezik türü / dozu solunum hareketleri için izin verilmiyorsa, hayvanın yeterli şekilde havalandırılmasını sağlayın, örneğin, su türleri için suyu oksijenlendirmek için bir hava pompası veya hava soluyan türler için bir vantilatör kullanarak.
- Hayvanı, yukarıdan göze doğrudan erişime izin veren bir duruşta konumlandırın.
NOT: Türlere bağlı olarak, bu sırtüstü veya yanal konumda olabilir. Küçük bir reaktif olmayan metal parçası (örneğin, paslanmaz çelik) ve gevşek lastik bantlar (bkz. Şekil 1) kullanarak basit bir tutma cihazı oluşturmak yararlı olabilir. - Hayvanın gözüne uygun ultrason ortamı yerleştirin. Ölçeklendirilmiş göz kapakları (ultrason geçirimsiz) gözü kaplarsa, bunları pamuklu çubukla yavaşça değiştirin.
NOT: Sucul türler için en iyi ultrason ortamı, hayvanın genellikle yaşadığı temiz tank suyudur. Karasal türler için, cömert miktarda ultrason jeli, ultrason dönüştürücüsünün (yani, doğrusal dizi probu) gözün tüm yüzeyi boyunca serbest hareketlerini ve görüntülenmesini sağlar. Karasal türler için kontralateral gözdeki veteriner merhemi gereklidir.
2. 2D ve 3D oküler ultrason görüntü alımı
- Ultrason transdüseri medial olarak göze istenen görüntü oryantasyonuna bağlı olarak dorsal / ventral veya rostral / kaudal oryantasyonda konumlandırın.
- B modunda, maksimum alan derinliği ile, gözün medial ve en derin kısmını görüntüleyin ve ilgilenilen tüm yapıların görüntü alanında görünür olduğundan emin olun.
NOT: Bazı türlerde, kristalin lens, özellikle daha yüksek frekanslarda ultrasonu emebilen vitreus mizahının nispeten büyük bir bölümünü kaplar. - Gerçek zamanlı görüntüleri incelerken dönüştürücüyü yavaşça her iki tarafa çevirin. İlgilenilen tüm yapıların görüntü alanında görünür olduğundan emin olun; değilse, daha düşük frekanslı ve daha büyük alan derinliğine sahip bir dönüştürücüye geçin.
NOT: Aşağıdaki merkez frekansları aşağıdaki maksimum alan derinliğine izin verir: 21 MHz: 3 cm, 40 MHz: 1,5 cm, 50 MHz: 1 cm (bkz. Tablo 1). Bununla birlikte, bu maksimum alan derinliği değerleri, göz kalsifiye veya diğer ultrason geçirimsiz yapılar içeriyorsa, belirgin şekilde daha düşük olabilir. - Görüntü derinliğini, derinlik ofsetini (görüntünün üst kısmından ilgilenilen yapıya olan mesafe), görüntü genişliğini ve ayrıca üç uzamsal boyutun hepsinde (ör. 1 cm görüntü derinliği, 2 mm derinlik ofseti, 1 cm görüntü genişliği, bir odak bölgesi) istenen ilgi alanını kapsayacak şekilde odak bölgelerinin sayısını ve konumunu ayarlayın.
NOT: Bu parametreleri ayarlayan düğmelerin belirli adlandırmaları ultrason sistemleri arasında farklılık gösterebilse de, çoğu sistemde bu ayarlamalar için mantıksal adlara sahip düğmeler olacaktır. Bu görüntü parametresi ayarları genellikle ultrason ediniminin olası zamansal çözünürlük aralığını etkiler. - Kare hızını 50-120 kare·s-1 aralığında ayarlayın.
NOT: Zamansal çözünürlük (yani, ardışık B-taramaları arasındaki zaman aralığı), görüntülenen kan damarlarında büyük piksel yoğunluğu değişkenliğini görüntülemek için yeterli olmalıdır, yani zamansal çözünürlük çok yüksek olmamalıdır. Öte yandan, gözün tam bir 3D kaydını makul bir sürede tamamlamak için zamansal çözünürlük çok düşük olamaz. 50-120 kare · s-1 arasında değişen bir zamansal çözünürlük, çoğu türde akışla güçlendirilmiş prosedür için genellikle yeterlidir. Bazı ultrason sistemlerinde istenen bu zamansal çözünürlük, "genel görüntüleme" (yüksek mekansal/düşük zamansal çözünürlük) ve "kardiyoloji" (düşük mekansal/yüksek zamansal çözünürlük) modları arasında geçiş yapılarak elde edilebilir. - 2D kazancı bir seviyeye (~ 5 dB) ayarlayın, böylece anatomik yapılar yalnızca B modu alımında görülebilir ve sonraki akışla geliştirilmiş rekonstrüksiyonda sinyal-gürültü oranını arttırır.
- Tek bir dilim konumunda 2B akışla geliştirilmiş bir görüntü elde etmek için, dönüştürücüyü bu konuma çevirin ve adım 3.1'de devam edin.
- İlgilenilen bir bölgenin tamamının, örneğin retinanın 3B kaydını elde etmek için, dönüştürücüyü ilgilenilen bölgenin bir uç noktasına çevirin.
- İlgilenilen bölgenin aşırı ucunun tam konumunu belirlemek için, 2B kazancı kısaca artırın.
- Doğru transdüser yerleşimi tamamlandıktan sonra, sonraki akışla geliştirilmiş yeniden yapılandırmada maksimum sinyal-gürültü oranı sağlamak için kayıttan önce 2D kazancı düşürün.
- 3B kayıttaki her adım (dilim) için ≥100 kare (en uygun şekilde ≥1000 kare) elde edin.
- Bir mikromanipülatör veya dahili transdüser motoru kullanarak, dönüştürücüyü ilgilenilen tüm bölge boyunca, örneğin 25 μm veya 50 μm (adım boyutunu not etmeyi unutmayın) adımlarıyla çevirin ve her adım için ≥100 kare alımını tekrarlayın.
- Araştırma hayvanını kurumun hayvan bakım kurallarına göre ötenazileştirin.
3. Akış ile geliştirilmiş görüntü yeniden yapılandırma
- Kayıtları dijital görüntüleme ve tıpta iletişim (DICOM) dosya formatına (little-endian) aktarın.
- ≥100 kare (T) cine kaydını temel alan tek bir akışla geliştirilmiş görüntü oluşturmak için aşağıdaki formülü kullanarak piksel düzeyindeki standart sapmayı (STD(x,y)) hesaplayın:
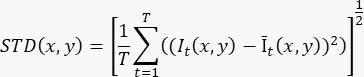
Burada It(x,y), t zamanındaki (x,y) piksel koordinatındaki pikselin yoğunluğudur ve Īt(x,y), I'nin zaman içindeki aritmetik ortalama değeridir. - 3B kayıttaki her dilim için adım 3.2'yi yineleyin.
- Bir 3B kayıtta birden fazla dilim için STD hesaplama ve görüntü yeniden yapılandırma işlemini otomatikleştirmek için, bu işlemi örneğin ImageJ ve ek makro komut dosyasını (Ek Dosya 1) kullanarak toplu iş modunda gerçekleştirin.
- Yeniden oluşturulan tüm dilimleri tek bir görüntü yığınında birleştirin (ImageJ'de Images to Stack komutu).
- Kesme kalınlığını edinme sırasında kullanılan adım boyutundan belirtin (ImageJ'de Özellikler komutu).
- Görüntü yığınını 3B TIF dosyası olarak kaydedin.
NOT: Oküler kan damarlarının akış ağırlıklı üç boyutlu kayıtları daha sonra hacim oluşturmaları oluşturmak ve gözün vasküler yapılarının dijital ve fiziksel anatomik modellerini oluşturmak için kullanılabilir. Bu görüntü işleme seçenekleri bu protokolün kapsamı dışındadır; Daha fazla ayrıntı için daha önce yayınlanmış makalelere bakın33,34,35.
Sonuçlar
Gözün vasküler yataklarını görüntülemek için akışla güçlendirilmiş ultrason tekniği bir dizi türde uygulanabilir ve şu anda 46 farklı omurgalı türünde kullanılmaktadır (Şekil 1, Tablo 1). Yetişkin olmayan memeli omurgalılarda çekirdekli kırmızı kan hücrelerinin varlığı, sinüs kayıtlarındaki statik dokuya kıyasla akan kanın pozitif kontrastını sağlar (Ek Dosya 2). Bununla birlikte, kare bazında analiz edildiğinde, k...
Tartışmalar
Akımla güçlendirilmiş ultrason kullanılarak yapılan vasküler görüntüleme, göz vaskülatürünün non-invaziv görüntülenmesi için mevcut tekniklere göre çeşitli avantajlar sunan, ancak içsel sınırlamaları olan yeni bir yöntem sağlar. Akışla güçlendirilmiş ultrasonun birincil avantajı, optik tekniklerde alan derinliğini sınırlayan retinal pigment epitelini aşan bir alan derinliğine sahip oküler anjiyografiler üretme yeteneğidir. Ultrason görüntülemede, uzamsal çözünürlük ve ala...
Açıklamalar
Yazarlar, tamamlanmış bir çıkar bulunmadığını beyan ederler.
Teşekkürler
Bu çalışma Carlsberg Vakfı'ndan (CF17-0778; CF18-0658), Lundbeck Vakfı (R324-2019-1470; R346-2020-1210), Velux Vakıfları (00022458), A.P. Møller Tıp Biliminin İlerlemesi Vakfı, Marie Skłodowska-Curie hibe anlaşması kapsamında Avrupa Birliği'nin Horizon 2020 araştırma ve inovasyon programı (No. 754513) ve Aarhus Üniversitesi Araştırma Vakfı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| MS-222 | Sigma | E10521-50G | |
| Benzocaine | Sigma | E-1501 | |
| Propofol | B Braun | 12260470_0320 | |
| Alfaxalon | Jurox | NA | |
| Isoflurane | Zoetis | 50019100 | |
| Ultrasound scanner | VisualSonics | Vevo 2100 |
Referanslar
- Yu, C. Q., Schwab, I. R., Dubielzig, R. R. Feeding the vertebrate retina from the Cambrian to the Tertiary. Journal of Zoology. 278 (4), 259-269 (2009).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retinal and Eye Research. 20 (2), 175-208 (2001).
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Damsgaard, C., et al. Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife. , 8 (2019).
- Buttery, R. G., Hinrichsen, C. F. L., Weller, W. L., Haight, J. R. How thick should a retina be? A comparative study of mammalian species with and without intraretinal vasculature. Vision Research. 31 (2), 169-187 (1991).
- Ames, A., Li, Y., Heher, E., Kimble, C. Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. The Journal of Neuroscience. 12 (3), 840-853 (1992).
- Chase, J. The Evolution of retinal vascularization in mammals: A comparison of vascular and avascular retinae. Ophthalmology. 89 (12), 1518-1525 (1982).
- Johnson, G. L. Ophthalmoscopic studies on the eyes of mammals. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 254 (794), 207-220 (1968).
- Johnson, G. L. I. Contributions to the comparative anatomy of the mammalian eye, chiefly based on ophthalmoscopic examination. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 194 (194-206), 1-82 (1901).
- Rodriguez-Ramos Fernandez, J., Dubielzig, R. R. Ocular comparative anatomy of the family Rodentia. Veterinary Ophthalmology. 16, 94-99 (2013).
- Copeland, D. E. Functional vascularization of the teleost eye. Current Topics in Eye Research. 3, 219-280 (1980).
- Meyer, D. B., Crescitelli, F. . The Visual System in Vertebrates. Handbook of Sensory Physiology. 7, (1977).
- Potier, S., Mitkus, M., Kelber, A. Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126 (2020).
- Wittenberg, J. B., Wittenberg, B. A. Active secretion of oxygen into the eye of fish. Nature. 194, 106-107 (1962).
- Damsgaard, C. Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology. 252, 110840 (2021).
- Damsgaard, C., et al. A novel acidification mechanism for greatly enhanced oxygen supply to the fish retina. Elife. 9, (2020).
- Wittenberg, J. B., Haedrich, R. L. The choroid rete mirabile of the fish eye. II. Distribution and relation to the pseudobranch and to the swimbladder rete mirabile. Biological Bulletin. 146 (1), 137-156 (1974).
- Wittenberg, J. B., Wittenberg, B. A. The choroid rete mirabile of the fish eye. I. Oxygen secretion and structure: comparison with the swimbladder rete mirabile. Biological Bulletin. 146 (1), 116-136 (1974).
- Berenbrink, M. Historical reconstructions of evolving physiological complexity: O2 secretion in the eye and swimbladder of fishes. Journal of Experimental Biology. 210, 1641-1652 (2007).
- Berenbrink, M., Koldkjaer, P., Kepp, O., Cossins, A. R. Evolution of oxygen secretion in fishes and the emergence of a complex physiological system. Science. 307 (5716), 1752-1757 (2005).
- Keane, P. A., Sadda, S. R. Retinal imaging in the twenty-first century: State of the art and future directions. Ophthalmology. 121 (12), 2489-2500 (2014).
- Yung, M., Klufas, M. A., Sarraf, D. Clinical applications of fundus autofluorescence in retinal disease. International Journal of Retina and Vitreous. 2 (1), 12 (2016).
- Ang, M., et al. Optical coherence tomography angiography: a review of current and future clinical applications. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (2), 237-245 (2018).
- Spaide, R. F., Koizumi, H., Pozonni, M. C. Enhanced depth imaging spectral-domain optical coherence tomography. American Journal of Ophthalmology. 146 (4), 496-500 (2008).
- Shen, Q., et al. Magnetic resonance imaging of tissue and vascular layers in the cat retina. Journal of Magnetic Resonance Imaging. 23 (4), 465-472 (2006).
- Tan, G. X., Jamil, M., Tee, N. G., Zhong, L., Yap, C. H. 3D reconstruction of chick embryo vascular geometries using non-invasive high-frequency ultrasound for computational fluid dynamics studies. Annals of Biomedical Engineering. 43 (11), 2780-2793 (2015).
- Ho, S., Tan, G. X. Y., Foo, T. J., Phan-Thien, N., Yap, C. H. Organ dynamics and fluid dynamics of the HH25 chick embryonic cardiac ventricle as revealed by a novel 4D high-frequency ultrasound imaging technique and computational flow simulations. Annals of Biomedical Engineering. 45 (10), 2309-2323 (2017).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments: JoVE. (141), e57089 (2018).
- Jia, Y., et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Optics Express. 20 (4), 4710-4725 (2012).
- Clarke, K. W., Trim, C. M., Trim, C. M. . Veterinary Anaesthesia E-Book. , (2013).
- Flecknell, P. . Laboratory Animal Anaesthesia. , (2015).
- West, G., Heard, D., Caulkett, N. . Zoo Animal and Wildlife Immobilization and Anesthesia. , (2014).
- Lauridsen, H., Hansen, K., Nørgård, M. &. #. 2. 1. 6. ;., Wang, T., Pedersen, M. From tissue to silicon to plastic: three-dimensional printing in comparative anatomy and physiology. Royal Society Open Science. 3 (3), 150643 (2016).
- Lauridsen, H., et al. Inside out: Modern imaging techniques to reveal animal anatomy. PLoS One. 6 (3), 17879 (2011).
- Ruthensteiner, B., Heß, M. Embedding 3D models of biological specimens in PDF publications. Microscopy Research and Technique. 71 (11), 778-786 (2008).
- Damsgaard, C., Lauridsen, H. Deep vascular imaging in the eye with flow-enhanced ultrasound. bioRxiv. , 447055 (2021).
- Mueller, R. L., Ryan Gregory, T., Gregory, S. M., Hsieh, A., Boore, J. L. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders. Zoology. 111 (3), 218-230 (2008).
- Greis, C. Quantitative evaluation of microvascular blood flow by contrast-enhanced ultrasound (CEUS). Clinical Hemorheology and Microcirculation. 49, 137-149 (2011).
- Urs, R., Ketterling, J. A., Tezel, G., Silverman, R. H. Contrast-enhanced plane-wave ultrasound imaging of the rat eye. Experimental Eye Research. 193, 107986 (2020).
- Walls, G. L. . The vertebrate eye and its adaptive radiation. , (1942).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır