需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用流量增强超声进行眼部深层血管成像
摘要
我们提出了一种非侵入性超声技术,用于在不使用造影剂的情况下在眼睛中生成三维血管造影。
摘要
眼睛内的视网膜是体内对能量要求最高的组织之一,因此需要从丰富的血液供应中输送高速率的氧气。脉络膜的毛细血管层排列在视网膜的外表面,是大多数脊椎动物视网膜中氧气的主要来源。然而,这种血管床由于其位于高度吸光的视网膜后面,因此使用传统光学技术进行成像具有挑战性。在这里,我们描述了一种高频超声技术,随后的流动增强,以高时空分辨率对眼睛的深血管床(0.5-3厘米)进行成像。这种非侵入性方法在有核红细胞的物种(非哺乳动物和胎儿动物模型)中效果很好。它允许在不使用造影剂的情况下生成非侵入性三维血管造影,并且它独立于血流角,具有比基于多普勒的超声成像技术更高的灵敏度。
引言
脊椎动物视网膜上的高新陈代谢在两种截然不同的需求之间进行了内在的权衡;高血流速和没有血管的光路。为了避免注注红细胞的视觉障碍,所有脊椎动物的视网膜通过光感受器后面的一片毛细血管(脉络膜毛细血管)接收氧气和营养物质1,2,3。然而,这种营养和氧气的单一来源对视网膜的厚度施加了扩散限制4,5,因此许多视觉活性物种拥有各种精心设计的血管网络,为这种代谢活跃的器官提供额外的血液供应6。这些血管床包括哺乳动物和一些鱼类视网膜内部层的血管4,7,8,9,10,许多鱼类,爬行动物和鸟类中发现的视网膜内侧(面向光线)的血管4,11,12,13,以及鱼类脉络膜,脉络膜爬行动物的反流血管排列奇迹,允许产生超大气氧分压14,15,16,17,18,19,20。尽管这些额外的非脉络膜视网膜营养供应途径在促进优越视力4的代谢需求方面起着至关重要的作用,但这些血管结构的三维解剖结构知之甚少,限制了我们对脊椎动物眼睛形态进化的理解。
传统上,视网膜血液供应是使用光学技术(例如眼底镜检查)进行研究的。这类技术以高分辨率21 提供有关非脉络膜血管解剖学的高通量非破坏性信息,因此很容易用于视网膜血管结构异常的临床诊断22。然而,在这些光学技术中,视网膜色素上皮吸收透射光并限制视深,从而在不使用造影剂的情况下减少有关脉络膜结构和功能的信息21。在光学相干断层扫描(OCT)中也遇到了类似的深度限制。该技术可以使用光波生成高分辨率的眼底血管造影,但以深度穿透为代价23,而增强的深度成像OCT可以以视网膜成像质量为代价可视化脉络膜24。磁共振成像克服了眼底镜检查和OCT的光学局限性,可以绘制视网膜中的血管层,尽管分辨率较低25。组织学和微量计算断层扫描(μCT)保持了光学技术的高分辨率,并提供了有关全眼血管形态的信息4,但这两种技术都需要眼部采样,因此在临床或稀有或濒危物种中是不可能的。为了克服这些已建立的视网膜成像技术的一些局限性,这里的研究提出了一种关于麻醉动物的超声方案,其中通过应用一种可比较的技术,在一系列间隔相等的二维超声扫描 上以计算机 形式绘制血液运动,这些扫描跨越整个眼睛,如前所述用于胚胎和心血管成像26,27,28 和OCT血管造影29。这种方法允许在不使用造影剂的情况下生成非侵入性的三维深眼血管造影,并为绘制不同物种的眼睛内血流分布开辟了新的途径。
研究方案
以下协议是在丹麦食品,农业和渔业部,丹麦兽医和食品管理局的丹麦动物实验检查局的许可下执行的(许可证号为2016-15-0201-00835)。
1. 麻醉和超声介质
- 麻醉研究动物。
注意:适当麻醉的类型和剂量高度依赖于物种。一般来说,浸渍式麻醉剂,如MS-222(3-氨基苯甲酸乙酯甲磺酸)、苯佐卡因(4-氨基苯甲酸乙酯)和丙泊酚(2,6-二异丙基苯酚)在鱼类和两栖动物中是有用的,它们很容易在鳃或皮肤上吸收麻醉剂(例如,0.05mg·虹鳟鱼中的L-1 苯佐卡因)。一系列可静脉内、肌内、腹腔给药的溶解化合物可用于羊膜,气体麻醉剂也是如此。肌内注射阿法沙龙对爬行动物有用(例如,在蜥蜴中为30 mg·kg-1 ),而作为气体施用的异氟醚对鸟类有用(例如,2%在空气中用于鸽子)。请参阅已发表的文献30,31,32 ,以全面概述跨物种可用的麻醉剂。 - 测试动物的反应,以确认最佳的麻醉水平。确保动物在手术过程中完全静止不动,因为流量增强的超声手术对运动噪音敏感。
- 太深的麻醉会改变血流模式,因此在实验的启动阶段进行剂量滴定。
- 分步增加麻醉剂量,并在简单亮度模式(B模式)超声的帮助下观察眼睛的血流量。
注意:当动物一动不动(呼吸除外)且可见眼血流时,可获得最佳麻醉水平。
- 如果麻醉剂的类型/剂量不允许呼吸运动,则确保动物充分通风,例如,使用空气泵为水生物种的水充氧,或为呼吸空气的物种使用呼吸呼吸的呼吸机。
- 将动物摆成允许从上方直接进入眼睛的姿势。
注意:根据物种的不同,这可以处于仰卧位或侧位。使用一小块非反应性金属(例如,不锈钢)和松散的橡皮筋来构建一个简单的保持装置是有用的(见 图1)。 - 将适当的超声培养基放在动物的眼睛上。如果鳞片眼睑(超声波不透水)覆盖眼睛,然后用棉签轻轻移开。
注意:对于水生物种,最好的超声介质是动物通常生活的清洁水箱水。对于陆地物种,大量的超声凝胶可确保超声换能器(即线性阵列探头)在整个眼睛表面的自由移动和成像。陆地物种需要对侧眼睛上的兽医软膏。
2. 2D和3D眼部超声图像采集
- 根据所需的图像方向,将超声换能器内侧定位为背侧/腹侧或喙/尾方向。
- 在B模式下,以最大景深对眼睛的内侧和最深处进行成像,并确保所有感兴趣的结构在图像场中都可见。
注意:在某些物种中,晶状体占玻璃体房的相对较大比例,其可能吸收超声波,特别是在较高频率下。 - 在检查实时图像时,将换能器缓慢地平移到每一侧。确保所有感兴趣的结构在图像场中都是可见的;如果没有,请切换到频率较低、景深较大的传感器。
注:以下中心频率允许以下最大景深:21 MHz:3厘米,40 MHz:1.5厘米,50 MHz:1厘米(见 表1)。然而,如果眼睛含有钙化或其他超声不透水结构,这些最大景深值可能会明显降低。 - 调整图像深度、深度偏移(从图像顶部到感兴趣结构的距离)、图像宽度以及焦点区域的数量和位置,以覆盖所有三个空间维度(例如,1 cm 图像深度、 2 mm 深度偏移、1 cm 图像宽度、一个焦点区域)中的所需感兴趣区域。
注意:尽管调整这些参数的按钮的特定命名可能因超声系统而异,但大多数系统都具有用于这些调整的逻辑名称的按钮。这些图像参数设置通常会影响超声采集的可能时间分辨率范围。 - 设置帧速率在50-120帧·s-1的范围内。
注意:时间分辨率(即连续B扫描之间的时间间隔)必须足以显示成像血管中的大像素强度变异性,即时间分辨率不得太高。另一方面,为了在合理的时间内完成眼睛的完整3D记录,时间分辨率不能太低。50-120帧·s-1 的时间分辨率通常足以满足大多数物种的流动增强程序。在某些超声系统上,可以通过在"一般成像"(高空间/低时间分辨率)和"心脏病学"(低空间/高时间分辨率)模式之间切换来获得所需的时间分辨率。 - 将2D增益调整到一个水平(~5 dB),因此解剖结构仅在B模式采集中可见,以增加随后的流量增强重建中的信噪比。
- 要在单个切片位置获取2D流动增强图像,请将探头平移到该位置并继续执行步骤3.1。
- 要获得整个感兴趣区域(例如视网膜)的3D记录,请将换能器转换为感兴趣区域的一个极端。
- 要确定感兴趣区域极端的确切位置,请短暂增加 2D 增益。
- 在正确的探头放置完成后,在录制前降低2D增益,以确保在随后的流量增强重建中具有最大的信噪比。
- 对于 3D 录制中的每个步骤(切片),获取≥100 帧(最佳≥ 1000 帧)。
- 使用显微操作器或内置传感器电机,以25 μm或50 μm的步长在整个感兴趣区域平移传感器,并为每个步骤重复≥100帧采集。
- 根据该机构的动物护理指南对研究动物实施安乐死。
3. 流量增强图像重建
- 将记录导出为医学数字成像和通信 (DICOM) 文件格式(小端)。
- 要根据≥100帧(T)电影记录生成单个流量增强图像,请使用以下公式计算像素水平(STD(x,y))的标准偏差:
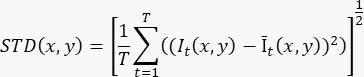
其中 It(x,y) 是像素在时间 t 时 (x,y) 像素坐标处的强度,Īt(x,y) 是 I 随时间变化的算术平均值。 - 对 3D 录制中的每个切片重复步骤 3.2。
- 要自动执行 3D 记录中多个切片的 STD 计算和图像重建过程,请使用 ImageJ 和补充宏脚本(补充文件 1)以批处理模式执行此操作。
- 将所有重建的切片合并到一个图像堆栈中(ImageJ 中的"图像到堆栈 "命令)。
- 根据采集期间使用的步长指定切片厚度(ImageJ 中的"属性" 命令)。
- 将图像堆栈另存为 3D TIF 文件。
注意:眼部血管的流动加权三维记录随后可用于创建体积渲染并构建眼睛血管结构的数字和物理解剖模型。这些图像处理选项超出了本协议的范围。有关更多详细信息,请参阅以前发表的文章33,34,35。
结果
用于成像眼睛血管床的流量增强超声技术可以应用于一系列物种,目前已用于46种不同的脊椎动物物种(图1, 表1)。非成体哺乳动物脊椎动物中有核红细胞的存在与电影记录中的静态组织相比,流动血液提供了积极的对比(补充文件2)。然而,当逐帧分析时,血液和周围组织之间的明显区别不太明显(图2A)。该协议中描述?...
讨论
使用流量增强超声的血管成像为眼睛脉管系统的非侵入性成像提供了一种新方法,与现有技术相比具有多项优势,但具有其内在局限性。流量增强超声的主要优点是能够生成景深超过视网膜色素上皮的眼部血管造影,这限制了光学技术的景深。在超声成像中,空间分辨率和景深最终由超声换能器频率决定,其中较高的频率会增加空间分辨率,但代价是景深较浅,因此换能器频率的选择引入了图像?...
披露声明
作者声明不存在完整的利益。
致谢
这项工作已获得嘉士伯基金会(CF17-0778;CF18-0658),伦德贝克基金会(R324-2019-1470;R346-2020-1210),Velux基金会(00022458),A.P. Møller医学科学促进基金会,Marie Skłodowska-Curie资助协议(第754513号)下的欧盟地平线2020研究和创新计划以及奥胡斯大学研究基金会。
材料
| Name | Company | Catalog Number | Comments |
| MS-222 | Sigma | E10521-50G | |
| Benzocaine | Sigma | E-1501 | |
| Propofol | B Braun | 12260470_0320 | |
| Alfaxalon | Jurox | NA | |
| Isoflurane | Zoetis | 50019100 | |
| Ultrasound scanner | VisualSonics | Vevo 2100 |
参考文献
- Yu, C. Q., Schwab, I. R., Dubielzig, R. R. Feeding the vertebrate retina from the Cambrian to the Tertiary. Journal of Zoology. 278 (4), 259-269 (2009).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retinal and Eye Research. 20 (2), 175-208 (2001).
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Damsgaard, C., et al. Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife. , 8 (2019).
- Buttery, R. G., Hinrichsen, C. F. L., Weller, W. L., Haight, J. R. How thick should a retina be? A comparative study of mammalian species with and without intraretinal vasculature. Vision Research. 31 (2), 169-187 (1991).
- Ames, A., Li, Y., Heher, E., Kimble, C. Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. The Journal of Neuroscience. 12 (3), 840-853 (1992).
- Chase, J. The Evolution of retinal vascularization in mammals: A comparison of vascular and avascular retinae. Ophthalmology. 89 (12), 1518-1525 (1982).
- Johnson, G. L. Ophthalmoscopic studies on the eyes of mammals. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 254 (794), 207-220 (1968).
- Johnson, G. L. I. Contributions to the comparative anatomy of the mammalian eye, chiefly based on ophthalmoscopic examination. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 194 (194-206), 1-82 (1901).
- Rodriguez-Ramos Fernandez, J., Dubielzig, R. R. Ocular comparative anatomy of the family Rodentia. Veterinary Ophthalmology. 16, 94-99 (2013).
- Copeland, D. E. Functional vascularization of the teleost eye. Current Topics in Eye Research. 3, 219-280 (1980).
- Meyer, D. B., Crescitelli, F. . The Visual System in Vertebrates. Handbook of Sensory Physiology. 7, (1977).
- Potier, S., Mitkus, M., Kelber, A. Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126 (2020).
- Wittenberg, J. B., Wittenberg, B. A. Active secretion of oxygen into the eye of fish. Nature. 194, 106-107 (1962).
- Damsgaard, C. Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology. 252, 110840 (2021).
- Damsgaard, C., et al. A novel acidification mechanism for greatly enhanced oxygen supply to the fish retina. Elife. 9, (2020).
- Wittenberg, J. B., Haedrich, R. L. The choroid rete mirabile of the fish eye. II. Distribution and relation to the pseudobranch and to the swimbladder rete mirabile. Biological Bulletin. 146 (1), 137-156 (1974).
- Wittenberg, J. B., Wittenberg, B. A. The choroid rete mirabile of the fish eye. I. Oxygen secretion and structure: comparison with the swimbladder rete mirabile. Biological Bulletin. 146 (1), 116-136 (1974).
- Berenbrink, M. Historical reconstructions of evolving physiological complexity: O2 secretion in the eye and swimbladder of fishes. Journal of Experimental Biology. 210, 1641-1652 (2007).
- Berenbrink, M., Koldkjaer, P., Kepp, O., Cossins, A. R. Evolution of oxygen secretion in fishes and the emergence of a complex physiological system. Science. 307 (5716), 1752-1757 (2005).
- Keane, P. A., Sadda, S. R. Retinal imaging in the twenty-first century: State of the art and future directions. Ophthalmology. 121 (12), 2489-2500 (2014).
- Yung, M., Klufas, M. A., Sarraf, D. Clinical applications of fundus autofluorescence in retinal disease. International Journal of Retina and Vitreous. 2 (1), 12 (2016).
- Ang, M., et al. Optical coherence tomography angiography: a review of current and future clinical applications. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (2), 237-245 (2018).
- Spaide, R. F., Koizumi, H., Pozonni, M. C. Enhanced depth imaging spectral-domain optical coherence tomography. American Journal of Ophthalmology. 146 (4), 496-500 (2008).
- Shen, Q., et al. Magnetic resonance imaging of tissue and vascular layers in the cat retina. Journal of Magnetic Resonance Imaging. 23 (4), 465-472 (2006).
- Tan, G. X., Jamil, M., Tee, N. G., Zhong, L., Yap, C. H. 3D reconstruction of chick embryo vascular geometries using non-invasive high-frequency ultrasound for computational fluid dynamics studies. Annals of Biomedical Engineering. 43 (11), 2780-2793 (2015).
- Ho, S., Tan, G. X. Y., Foo, T. J., Phan-Thien, N., Yap, C. H. Organ dynamics and fluid dynamics of the HH25 chick embryonic cardiac ventricle as revealed by a novel 4D high-frequency ultrasound imaging technique and computational flow simulations. Annals of Biomedical Engineering. 45 (10), 2309-2323 (2017).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments: JoVE. (141), e57089 (2018).
- Jia, Y., et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Optics Express. 20 (4), 4710-4725 (2012).
- Clarke, K. W., Trim, C. M., Trim, C. M. . Veterinary Anaesthesia E-Book. , (2013).
- Flecknell, P. . Laboratory Animal Anaesthesia. , (2015).
- West, G., Heard, D., Caulkett, N. . Zoo Animal and Wildlife Immobilization and Anesthesia. , (2014).
- Lauridsen, H., Hansen, K., Nørgård, M. &. #. 2. 1. 6. ;., Wang, T., Pedersen, M. From tissue to silicon to plastic: three-dimensional printing in comparative anatomy and physiology. Royal Society Open Science. 3 (3), 150643 (2016).
- Lauridsen, H., et al. Inside out: Modern imaging techniques to reveal animal anatomy. PLoS One. 6 (3), 17879 (2011).
- Ruthensteiner, B., Heß, M. Embedding 3D models of biological specimens in PDF publications. Microscopy Research and Technique. 71 (11), 778-786 (2008).
- Damsgaard, C., Lauridsen, H. Deep vascular imaging in the eye with flow-enhanced ultrasound. bioRxiv. , 447055 (2021).
- Mueller, R. L., Ryan Gregory, T., Gregory, S. M., Hsieh, A., Boore, J. L. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders. Zoology. 111 (3), 218-230 (2008).
- Greis, C. Quantitative evaluation of microvascular blood flow by contrast-enhanced ultrasound (CEUS). Clinical Hemorheology and Microcirculation. 49, 137-149 (2011).
- Urs, R., Ketterling, J. A., Tezel, G., Silverman, R. H. Contrast-enhanced plane-wave ultrasound imaging of the rat eye. Experimental Eye Research. 193, 107986 (2020).
- Walls, G. L. . The vertebrate eye and its adaptive radiation. , (1942).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。