Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes vasculares profundas en el ojo con ultrasonido con flujo mejorado
En este artículo
Resumen
Presentamos una técnica ecográfica no invasiva para generar angiografías tridimensionales en el ojo sin el uso de agentes de contraste.
Resumen
La retina dentro del ojo es uno de los tejidos más exigentes de energía en el cuerpo y, por lo tanto, requiere altas tasas de suministro de oxígeno de un rico suministro de sangre. La lámina capilar de la coroides recubre la superficie externa de la retina y es la fuente dominante de oxígeno en la mayoría de las retinas de los vertebrados. Sin embargo, este lecho vascular es difícil de visualizar con técnicas ópticas tradicionales debido a su posición detrás de la retina altamente absorbente de luz. Aquí describimos una técnica de ultrasonido de alta frecuencia con posterior mejora del flujo para obtener imágenes de lechos vasculares profundos (0,5-3 cm) del ojo con una alta resolución espaciotemporal. Este método no invasivo funciona bien en especies con glóbulos rojos nucleados (modelos animales no mamíferos y fetales). Permite la generación de angiografías tridimensionales no invasivas sin el uso de agentes de contraste, y es independiente de los ángulos de flujo sanguíneo con una sensibilidad más alta que las técnicas de imágenes de ultrasonido basadas en Doppler.
Introducción
El alto metabolismo en la retina de los vertebrados impone una compensación intrínseca entre dos necesidades contrastantes; altas tasas de flujo sanguíneo y un camino ligero desprovisto de vasos sanguíneos. Para evitar la alteración visual de la perfusión de los glóbulos rojos, la retina de todos los vertebrados recibe oxígeno y nutrientes a través de una lámina de capilares detrás de los fotorreceptores, los coriocapilaris1,2,3. Sin embargo, esta única fuente de nutrientes y oxígeno impone una limitación de difusión al grosor de la retina4,5, por lo que muchas especies visualmente activas poseen una variedad de elaboradas redes vasculares para proporcionar un suministro de sangre adicional a este órgano metabólicamente activo6. Estos lechos vasculares incluyen vasos sanguíneos que perfunden las capas internas de la retina en mamíferos y algunos peces4,7,8,9,10, vasos sanguíneos en el lado interno (orientado a la luz) de la retina que se encuentran en muchos peces, reptiles y aves4,11,12,13, y arreglos vasculares contracorrientes de la coroides de pescado, la coroides. mirabile, que permite la generación de presiones parciales de oxígeno sobrefosférico14,15,16,17,18,19,20. A pesar de que estas vías no coroideas adicionales para el suministro de nutrientes de la retina juegan un papel esencial en el fomento de los requisitos metabólicos de la visión superior4, la anatomía tridimensional de estas estructuras vasculares es poco conocida, lo que limita nuestra comprensión de la evolución morfológica del ojo vertebrado.
Tradicionalmente, el suministro de sangre retiniana se ha estudiado utilizando técnicas ópticas, como la oftalmoscopia del fondo de ojo. Esta categoría de técnicas proporciona información no destructiva de alto rendimiento sobre la anatomía no coroidea de los vasos sanguíneos en alta resolución21 y, por lo tanto, se utiliza fácilmente en el diagnóstico clínico de anomalías en la estructura de los vasos retinianos22. Sin embargo, el epitelio pigmentario de la retina absorbe la luz transmitida y limita la profundidad de visión en estas técnicas ópticas, proporcionando información reducida sobre la estructura y función coroidea sin el uso de agente de contraste21. Se experimentan limitaciones de profundidad similares en la tomografía de coherencia óptica (OCT). Esta técnica puede generar angiografías de fondo de ojo de alta resolución utilizando ondas de luz a expensas técnicas de la penetración de profundidad23, mientras que la OCT de imagen de profundidad mejorada puede visualizar la coroides a expensas de la calidad de la imagen de la retina24. La resonancia magnética supera las limitaciones ópticas de la oftalmoscopia y la OCT y puede mapear las capas vasculares de la retina, aunque a baja resolución25. La histología y la tomografía microinformática (μCT) mantienen la alta resolución de las técnicas ópticas y proporcionan información sobre la morfología vascular de todo el ojo4, pero ambas técnicas requieren muestreo ocular y, por lo tanto, no son posibles en la clínica o en especies raras o en peligro de extinción. Para superar algunas de las limitaciones de estas técnicas de imagen retiniana establecidas, el estudio presenta aquí un protocolo de ultrasonido en animales anestesiados, donde el movimiento de la sangre se mapea in silico en una serie de ecografías bidimensionales igualmente espaciadas que abarcan todo un ojo mediante la aplicación de una técnica comparable a la descrita anteriormente para la imagen embrionaria y cardiovascular26,27, 28 y en angiografía OCT29. Este enfoque permite la generación de angiografías oculares profundas tridimensionales no invasivas sin usar un agente de contraste y abre nuevas vías para mapear la distribución del flujo sanguíneo dentro del ojo a través de las especies.
Protocolo
El siguiente protocolo se realizó con el permiso de la Inspección Danesa de Experimentación Animal dentro del Ministerio Danés de Alimentación, Agricultura y Pesca, Administración Danesa de Veterinaria y Alimentos (número de permiso 2016-15-0201-00835).
1. Anestesia y medio de ultrasonido
- Anestesiar al animal de investigación.
NOTA: El tipo y la dosis de anestesia apropiada son altamente dependientes de la especie. En general, los anestésicos a base de inmersión como MS-222 (ácido metanosulfónico de etilo 3-aminobenzoato), benzocaína (4-aminobenzoato de etilo) y propofol (2,6-diisopropil fenol) son útiles en peces y anfibios que absorben fácilmente el anestésico sobre las branquias o la piel (por ejemplo, 0,05 mg · Benzocaína L-1 en trucha arco iris). Una gama de compuestos disueltos que se pueden administrar por vía intravenosa, intramuscular, intraperitoneal está disponible para los amniotas, al igual que los anestésicos a base de gas. Alfaxalon administrado por vía intramuscular es útil en reptiles (por ejemplo, 30 mg·kg-1 en lagartos), e isoflurano administrado como gas es útil en aves (por ejemplo, 2% en aire para palomas). Consulte la literatura publicada30,31,32 para obtener una visión general completa de los anestésicos disponibles en todas las especies. - Pruebe los reflejos en el animal para confirmar un nivel óptimo de anestesia. Asegúrese de que el animal esté completamente inmóvil durante el procedimiento, ya que el procedimiento de ultrasonido con flujo mejorado es sensible al ruido de movimiento.
- La anestesia demasiado profunda puede alterar los patrones de flujo sanguíneo, así que realice una titulación de la dosis en la fase inicial de un experimento.
- Aumente la dosis de anestesia en pasos y observe el flujo sanguíneo en el ojo con la ayuda de ultrasonido en modo de brillo simple (modo B).
NOTA: Se obtiene un nivel óptimo de anestesia cuando el animal está inmóvil (excepto la respiración) con flujo sanguíneo ocular visible.
- Si el tipo/dosis de anestésico no es permisivo para los movimientos respiratorios, asegúrese de una ventilación adecuada del animal, por ejemplo, utilizando una bomba de aire para oxigenar el agua para las especies acuáticas o un ventilador para las especies que respiran aire.
- Coloque al animal en una postura que permita el acceso directo desde arriba al ojo.
NOTA: Dependiendo de la especie, esto puede ser en posición supina o lateral. Puede ser útil construir un dispositivo de sujeción simple utilizando una pequeña pieza de metal no reactivo (por ejemplo, acero inoxidable) y bandas elásticas sueltas (ver Figura 1). - Coloque el medio de ultrasonido apropiado en el ojo del animal. Si los párpados escamosos (impermeables al ultrasonido) cubren el ojo, desplace estos suavemente con un hisopo de algodón.
NOTA: Para las especies acuáticas, el mejor medio de ultrasonido es el agua limpia del tanque en el que generalmente vive el animal. Para las especies terrestres, una cantidad generosa de gel de ultrasonido garantiza movimientos libres e imágenes del transductor de ultrasonido (es decir, sonda de matriz lineal) en toda la superficie del ojo. Se requiere ungüento veterinario en el ojo contralateral para las especies terrestres.
2. Adquisición de imágenes de ultrasonido ocular 2D y 3D
- Coloque el transductor de ultrasonido medial al ojo en una orientación dorsal / ventral o rostral / caudal dependiendo de la orientación de la imagen deseada.
- En el modo B, con una profundidad de campo máxima, tome una imagen de la parte medial y más profunda del ojo y asegúrese de que todas las estructuras de interés sean visibles en el campo de la imagen.
NOTA: En algunas especies, el cristalino ocupa una proporción comparativamente grande del humor vítreo, que puede absorber el ultrasonido, especialmente a frecuencias más altas. - Traduzca lentamente el transductor a cada lado mientras inspecciona las imágenes en tiempo real. Asegúrese de que todas las estructuras de interés sean visibles en el campo de la imagen; de lo contrario, cambie a un transductor con una frecuencia más baja y una mayor profundidad de campo.
NOTA: Las siguientes frecuencias centrales permiten la siguiente profundidad máxima de campo: 21 MHz: 3 cm, 40 MHz: 1,5 cm, 50 MHz: 1 cm (véase la Tabla 1). Sin embargo, estos valores máximos de profundidad de campo pueden ser marcadamente más bajos si el ojo contiene estructuras calcificadas u otras estructuras impermeables al ultrasonido. - Ajuste la profundidad de la imagen, el desplazamiento de profundidad (distancia desde la parte superior de la imagen hasta la estructura de interés), el ancho de la imagen, así como el número y la posición de las zonas focales para cubrir la región de interés deseada en las tres dimensiones espaciales (por ejemplo, profundidad de imagen de 1 cm, desplazamiento de profundidad de 2 mm, ancho de imagen de 1 cm, una zona focal).
NOTA: Aunque la nomenclatura específica de los botones que ajustan estos parámetros puede variar entre los sistemas de ultrasonido, la mayoría de los sistemas tendrán botones con nombres lógicos para estos ajustes. Estos ajustes de parámetros de imagen generalmente afectan el rango de posibles resoluciones temporales de la adquisición de ultrasonido. - Establezca la velocidad de fotogramas en el rango de 50-120 fotogramas·s-1.
NOTA: La resolución temporal (es decir, el intervalo de tiempo entre las sucesivas exploraciones B) debe ser adecuada para mostrar una gran variabilidad de la intensidad de píxeles en los vasos sanguíneos fotografiados, es decir, la resolución temporal no debe ser demasiado alta. Por otro lado, para completar una grabación 3D completa del ojo en un tiempo razonable, la resolución temporal no puede ser demasiado baja. Una resolución temporal que oscila entre 50-120 fotogramas·s-1 suele ser adecuada para el procedimiento de flujo mejorado en la mayoría de las especies. En algunos sistemas de ultrasonido, esta resolución temporal deseada se puede obtener cambiando entre los modos de "imagen general" (alta resolución espacial / baja resolución temporal) y "cardiología" (baja resolución espacial / alta resolución temporal). - Ajuste la ganancia 2D a un nivel (~ 5 dB), de modo que las estructuras anatómicas solo sean visibles en la adquisición del modo B para aumentar la relación señal-ruido en la posterior reconstrucción mejorada del flujo.
- Para adquirir una imagen mejorada con flujo 2D en una sola posición de corte, traduzca el transductor a esta posición y continúe en el paso 3.1.
- Para adquirir una grabación 3D de toda una región de interés, por ejemplo, la retina, traduzca el transductor a un extremo de la región de interés.
- Para determinar la posición exacta del extremo de la región de interés, aumente brevemente la ganancia 2D.
- Una vez completada la colocación correcta del transductor, reduzca la ganancia 2D antes de grabar para garantizar la máxima relación señal-ruido en la posterior reconstrucción mejorada del flujo.
- Para cada paso (slice) en la grabación 3D, adquiera ≥100 fotogramas (óptimamente ≥1000 fotogramas).
- Usando un micromanipulador o un motor de transductor incorporado, traduzca el transductor a través de toda la región de interés en pasos de, por ejemplo, 25 μm o 50 μm (recuerde anotar el tamaño del paso) y repita la adquisición de ≥100 cuadros para cada paso.
- Sacrificar al animal de investigación de acuerdo con las pautas de cuidado animal de la institución.
3. Reconstrucción de imagen mejorada por flujo
- Exporte las grabaciones al formato de archivo de imágenes digitales y comunicaciones en medicina (DICOM) (little-endian).
- Para producir una sola imagen mejorada de flujo basada en una grabación de cine de ≥100 fotogramas (T), calcule la desviación estándar en el nivel de píxeles (STD(x,y)) utilizando la fórmula:
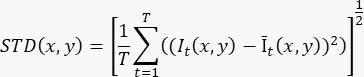
Donde It(x,y) es la intensidad del píxel en la coordenada del píxel (x,y) en el tiempo t, e Īt(x,y) es el valor medio aritmético de I a lo largo del tiempo. - Repita el paso 3.2 para cada segmento de la grabación 3D.
- Para automatizar el proceso de cálculo de ETS y reconstrucción de imágenes para múltiples segmentos en una grabación 3D, realice esta operación en modo por lotes utilizando, por ejemplo, ImageJ y el script de macro suplementario (Archivo suplementario 1).
- Combine todos los sectores reconstruidos en una pila de imágenes (comando Images to Stack en ImageJ).
- Especifique el grosor del segmento a partir del tamaño de paso utilizado durante la adquisición (comando Properties en ImageJ).
- Guarde la pila de imágenes como un archivo TIF 3D.
NOTA: Los registros tridimensionales ponderados por flujo de los vasos sanguíneos oculares se pueden utilizar posteriormente para crear representaciones de volumen y construir modelos anatómicos digitales y físicos de las estructuras vasculares del ojo. Estas opciones de procesamiento de imágenes están fuera del alcance de este protocolo; consulte los artículos publicados anteriormente para obtener más detalles33,34,35.
Resultados
La técnica de ultrasonido de flujo mejorado para obtener imágenes de los lechos vasculares del ojo se puede aplicar en una variedad de especies y actualmente se ha utilizado en 46 especies diferentes de vertebrados (Figura 1, Tabla 1). La presencia de glóbulos rojos nucleados en vertebrados de mamíferos no adultos proporciona un contraste positivo de la sangre que fluye en comparación con el tejido estático en las grabaciones de cine (Archivo complementario 2
Discusión
Las imágenes vasculares que utilizan ultrasonido de flujo mejorado proporcionan un nuevo método para la obtención de imágenes no invasivas de la vasculatura del ojo que ofrece varias ventajas sobre las técnicas actuales, pero tiene sus limitaciones intrínsecas. La principal ventaja del ultrasonido con flujo mejorado es la capacidad de generar angiografías oculares con una profundidad de campo que excede el epitelio pigmentario de la retina, lo que limita la profundidad de campo en las técnicas ópticas. En las im...
Divulgaciones
Los autores declaran que no existen intereses completos.
Agradecimientos
Este trabajo ha recibido financiación de la Fundación Carlsberg (CF17-0778; CF18-0658), la Fundación Lundbeck (R324-2019-1470; R346-2020-1210), las Fundaciones Velux (00022458), la Fundación A.P. Møller para el Avance de la Ciencia Médica, el programa de investigación e innovación Horizonte 2020 de la Unión Europea bajo el acuerdo de subvención Marie Skłodowska-Curie (No. 754513) y la Fundación de Investigación de la Universidad de Aarhus.
Materiales
| Name | Company | Catalog Number | Comments |
| MS-222 | Sigma | E10521-50G | |
| Benzocaine | Sigma | E-1501 | |
| Propofol | B Braun | 12260470_0320 | |
| Alfaxalon | Jurox | NA | |
| Isoflurane | Zoetis | 50019100 | |
| Ultrasound scanner | VisualSonics | Vevo 2100 |
Referencias
- Yu, C. Q., Schwab, I. R., Dubielzig, R. R. Feeding the vertebrate retina from the Cambrian to the Tertiary. Journal of Zoology. 278 (4), 259-269 (2009).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retinal and Eye Research. 20 (2), 175-208 (2001).
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Damsgaard, C., et al. Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife. , 8 (2019).
- Buttery, R. G., Hinrichsen, C. F. L., Weller, W. L., Haight, J. R. How thick should a retina be? A comparative study of mammalian species with and without intraretinal vasculature. Vision Research. 31 (2), 169-187 (1991).
- Ames, A., Li, Y., Heher, E., Kimble, C. Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. The Journal of Neuroscience. 12 (3), 840-853 (1992).
- Chase, J. The Evolution of retinal vascularization in mammals: A comparison of vascular and avascular retinae. Ophthalmology. 89 (12), 1518-1525 (1982).
- Johnson, G. L. Ophthalmoscopic studies on the eyes of mammals. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 254 (794), 207-220 (1968).
- Johnson, G. L. I. Contributions to the comparative anatomy of the mammalian eye, chiefly based on ophthalmoscopic examination. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 194 (194-206), 1-82 (1901).
- Rodriguez-Ramos Fernandez, J., Dubielzig, R. R. Ocular comparative anatomy of the family Rodentia. Veterinary Ophthalmology. 16, 94-99 (2013).
- Copeland, D. E. Functional vascularization of the teleost eye. Current Topics in Eye Research. 3, 219-280 (1980).
- Meyer, D. B., Crescitelli, F. . The Visual System in Vertebrates. Handbook of Sensory Physiology. 7, (1977).
- Potier, S., Mitkus, M., Kelber, A. Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126 (2020).
- Wittenberg, J. B., Wittenberg, B. A. Active secretion of oxygen into the eye of fish. Nature. 194, 106-107 (1962).
- Damsgaard, C. Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology. 252, 110840 (2021).
- Damsgaard, C., et al. A novel acidification mechanism for greatly enhanced oxygen supply to the fish retina. Elife. 9, (2020).
- Wittenberg, J. B., Haedrich, R. L. The choroid rete mirabile of the fish eye. II. Distribution and relation to the pseudobranch and to the swimbladder rete mirabile. Biological Bulletin. 146 (1), 137-156 (1974).
- Wittenberg, J. B., Wittenberg, B. A. The choroid rete mirabile of the fish eye. I. Oxygen secretion and structure: comparison with the swimbladder rete mirabile. Biological Bulletin. 146 (1), 116-136 (1974).
- Berenbrink, M. Historical reconstructions of evolving physiological complexity: O2 secretion in the eye and swimbladder of fishes. Journal of Experimental Biology. 210, 1641-1652 (2007).
- Berenbrink, M., Koldkjaer, P., Kepp, O., Cossins, A. R. Evolution of oxygen secretion in fishes and the emergence of a complex physiological system. Science. 307 (5716), 1752-1757 (2005).
- Keane, P. A., Sadda, S. R. Retinal imaging in the twenty-first century: State of the art and future directions. Ophthalmology. 121 (12), 2489-2500 (2014).
- Yung, M., Klufas, M. A., Sarraf, D. Clinical applications of fundus autofluorescence in retinal disease. International Journal of Retina and Vitreous. 2 (1), 12 (2016).
- Ang, M., et al. Optical coherence tomography angiography: a review of current and future clinical applications. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (2), 237-245 (2018).
- Spaide, R. F., Koizumi, H., Pozonni, M. C. Enhanced depth imaging spectral-domain optical coherence tomography. American Journal of Ophthalmology. 146 (4), 496-500 (2008).
- Shen, Q., et al. Magnetic resonance imaging of tissue and vascular layers in the cat retina. Journal of Magnetic Resonance Imaging. 23 (4), 465-472 (2006).
- Tan, G. X., Jamil, M., Tee, N. G., Zhong, L., Yap, C. H. 3D reconstruction of chick embryo vascular geometries using non-invasive high-frequency ultrasound for computational fluid dynamics studies. Annals of Biomedical Engineering. 43 (11), 2780-2793 (2015).
- Ho, S., Tan, G. X. Y., Foo, T. J., Phan-Thien, N., Yap, C. H. Organ dynamics and fluid dynamics of the HH25 chick embryonic cardiac ventricle as revealed by a novel 4D high-frequency ultrasound imaging technique and computational flow simulations. Annals of Biomedical Engineering. 45 (10), 2309-2323 (2017).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments: JoVE. (141), e57089 (2018).
- Jia, Y., et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Optics Express. 20 (4), 4710-4725 (2012).
- Clarke, K. W., Trim, C. M., Trim, C. M. . Veterinary Anaesthesia E-Book. , (2013).
- Flecknell, P. . Laboratory Animal Anaesthesia. , (2015).
- West, G., Heard, D., Caulkett, N. . Zoo Animal and Wildlife Immobilization and Anesthesia. , (2014).
- Lauridsen, H., Hansen, K., Nørgård, M. &. #. 2. 1. 6. ;., Wang, T., Pedersen, M. From tissue to silicon to plastic: three-dimensional printing in comparative anatomy and physiology. Royal Society Open Science. 3 (3), 150643 (2016).
- Lauridsen, H., et al. Inside out: Modern imaging techniques to reveal animal anatomy. PLoS One. 6 (3), 17879 (2011).
- Ruthensteiner, B., Heß, M. Embedding 3D models of biological specimens in PDF publications. Microscopy Research and Technique. 71 (11), 778-786 (2008).
- Damsgaard, C., Lauridsen, H. Deep vascular imaging in the eye with flow-enhanced ultrasound. bioRxiv. , 447055 (2021).
- Mueller, R. L., Ryan Gregory, T., Gregory, S. M., Hsieh, A., Boore, J. L. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders. Zoology. 111 (3), 218-230 (2008).
- Greis, C. Quantitative evaluation of microvascular blood flow by contrast-enhanced ultrasound (CEUS). Clinical Hemorheology and Microcirculation. 49, 137-149 (2011).
- Urs, R., Ketterling, J. A., Tezel, G., Silverman, R. H. Contrast-enhanced plane-wave ultrasound imaging of the rat eye. Experimental Eye Research. 193, 107986 (2020).
- Walls, G. L. . The vertebrate eye and its adaptive radiation. , (1942).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados