Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Tiefe vaskuläre Bildgebung im Auge mit flussverstärktem Ultraschall
In diesem Artikel
Zusammenfassung
Wir stellen eine nicht-invasive Ultraschalltechnik vor, um dreidimensionale Angiographien im Auge ohne den Einsatz von Kontrastmitteln zu erzeugen.
Zusammenfassung
Die Netzhaut im Auge ist eines der energieintensivsten Gewebe im Körper und benötigt daher eine hohe Sauerstoffzufuhr aus einer reichhaltigen Blutversorgung. Die Kapillarlamina der Aderhaut kleidet die äußere Oberfläche der Netzhaut aus und ist die dominierende Sauerstoffquelle in den meisten Netzhaut von Wirbeltieren. Dieses Gefäßbett ist jedoch aufgrund seiner Position hinter der stark lichtabsorbierenden Netzhaut mit traditionellen optischen Techniken schwierig abzubilden. Hier beschreiben wir eine Hochfrequenz-Ultraschalltechnik mit anschließender Strömungsverstärkung, um tiefe Gefäßbetten (0,5-3 cm) des Auges mit einer hohen raumzeitlichen Auflösung abzubilden. Diese nicht-invasive Methode funktioniert gut bei Arten mit kernhaltigen roten Blutkörperchen (nicht-säugetierische und fötale Tiermodelle). Es ermöglicht die Erstellung nicht-invasiver dreidimensionaler Angiographien ohne den Einsatz von Kontrastmitteln und ist unabhängig von Blutflusswinkeln mit einer höheren Empfindlichkeit als Doppler-basierte Ultraschall-Bildgebungsverfahren.
Einleitung
Der hohe Stoffwechsel auf der Netzhaut von Wirbeltieren erlegt einen intrinsischen Kompromiss zwischen zwei gegensätzlichen Bedürfnissen dar; hohe Blutflussraten und ein Lichtweg ohne Blutgefäße. Um Sehstörungen bei der Durchblutung roter Blutkörperchen zu vermeiden, erhält die Netzhaut aller Wirbeltiere Sauerstoff und Nährstoffe über eine Kapillarschicht hinter den Photorezeptoren, die Choriocapillaris1,2,3. Diese einzige Quelle von Nährstoffen und Sauerstoff erlegt jedoch eine Diffusionsbegrenzung der Dicke der Netzhaut vor4,5, so dass viele visuell aktive Spezies eine Vielzahl von ausgeklügelten Gefäßnetzwerken besitzen, um dieses metabolisch aktive Organ zusätzlich mit Blut zu versorgen6. Zu diesen Gefäßbetten gehören Blutgefäße, die die inneren Netzhautschichten bei Säugetieren und einigen Fischen durchbluten4,7,8,9,10, Blutgefäße auf der inneren (lichtzugewandten) Seite der Netzhaut, die bei vielen Fischen, Reptilien und Vögeln zu finden sind4,11,12,13 und gegenstromförmige Gefäßanordnungen der Fischaderhaut, der Aderhautrete Mirable, das die Erzeugung von Super-Luftsauerstoff-Partialdrücken ermöglicht14,15,16,17,18,19,20. Obwohl diese zusätzlichen nicht-choroidalen Pfade für die retinale Nährstoffversorgung eine wesentliche Rolle bei der Deckung der metabolischen Anforderungen des überlegenen Sehens spielen4, ist die dreidimensionale Anatomie dieser Gefäßstrukturen kaum verstanden, was unser Verständnis der morphologischen Entwicklung des Wirbeltierauges einschränkt.
Traditionell wurde die retinale Blutversorgung mit optischen Techniken wie der Fundus-Ophthalmoskopie untersucht. Diese Kategorie von Techniken liefert zerstörungsfreie Hochdurchsatzinformationen über die nicht-choroidale Blutgefäßanatomie in hoher Auflösung21 und wird daher leicht in der klinischen Diagnose von Anomalien in der Netzhautgefäßstruktur verwendet22. Das retinale Pigmentepithel absorbiert jedoch das durchgelassene Licht und begrenzt die Sichttiefe bei diesen optischen Techniken, wodurch die Informationen über die Struktur und Funktion der Aderhaut ohne den Einsatz von Kontrastmitteln reduziert werden21. Ähnliche Tiefenbeschränkungen treten bei der optischen Kohärenztomographie (OCT) auf. Diese Technik kann hochauflösende Fundusangiographien unter Verwendung von Lichtwellen auf Kosten der Tiefenpenetration erzeugen23, während die erweiterte Tiefenbildgebung OCT die Aderhaut auf Kosten der retinalen Bildgebungsqualität visualisieren kann24. Die Magnetresonanztomographie überwindet die optischen Einschränkungen von Ophthalmoskopie und OCT und kann Gefäßschichten in der Netzhaut abbilden, wenn auch mit niedriger Auflösung25. Histologie und Mikrocomputertomographie (μCT) halten die hohe Auflösung der optischen Techniken aufrecht und liefern Informationen über die Ganzaugen-Gefäßmorphologie4, aber beide Techniken erfordern eine Augenprobenahme und sind daher in der Klinik oder bei seltenen oder gefährdeten Arten nicht möglich. Um einige der Einschränkungen dieser etablierten retinalen Bildgebungsverfahren zu überwinden, präsentiert die Studie hier ein Ultraschallprotokoll an anästhesierten Tieren, bei dem die Blutbewegung in silico auf einer Reihe von zweidimensionalen Ultraschalluntersuchungen mit gleichem Abstand abgebildet wird, die ein ganzes Auge überspannen, indem eine vergleichbare Technik angewendet wird, wie zuvor für embryonale und kardiovaskuläre Bildgebung beschrieben26,27, 28 und in der Angiographie des OKT29. Dieser Ansatz ermöglicht die Generierung nicht-invasiver dreidimensionaler Tiefen-Augenangiographien ohne Verwendung eines Kontrastmittels und eröffnet neue Wege zur Kartierung der Blutflussverteilung innerhalb des Auges über Spezies hinweg.
Protokoll
Das folgende Protokoll wurde mit Genehmigung der dänischen Aufsichtsbehörde für Tierversuche innerhalb des dänischen Ministeriums für Ernährung, Landwirtschaft und Fischerei, der dänischen Veterinär- und Lebensmittelbehörde durchgeführt (Genehmigungsnummer 2016-15-0201-00835).
1. Anästhesie- und Ultraschallmedium
- Betäuben Sie das Forschungstier.
HINWEIS: Art und Dosis der geeigneten Anästhesie sind stark artabhängig. Im Allgemeinen sind immersionsbasierte Anästhetika wie MS-222 (Ethyl-3-aminobenzoat-Methansulfonsäure), Benzocain (Ethyl-4-aminobenzoat) und Propofol (2,6-Diisopropylphenol) bei Fischen und Amphibien nützlich, die das Anästhetikum leicht über Kiemen oder Haut aufnehmen (z. B. 0,05 mg). L-1 Benzocain in Regenbogenforellen). Eine Reihe von gelösten Verbindungen, die intravenös, intramuskulär, intraperitoneal verabreicht werden können, ist für Amnioten verfügbar, ebenso wie Anästhetika auf Gasbasis. Alfaxalon, das intramuskulär verabreicht wird, ist bei Reptilien nützlich (z. B. 30 mg·kg-1 bei Eidechsen), und Isofluran, das als Gas verabreicht wird, ist bei Vögeln nützlich (z. B. 2% in Luft für Tauben). Einen vollständigen Überblick über die verfügbaren Anästhetika in allen Arten finden Sie in der veröffentlichten Literatur30,31,32. - Testen Sie Reflexe im Tier, um ein optimales Anästhesieniveau zu bestätigen. Stellen Sie sicher, dass das Tier während des Eingriffs völlig bewegungslos ist, da das strömungsverstärkte Ultraschallverfahren empfindlich auf Bewegungsgeräusche reagiert.
- Eine zu tiefe Anästhesie kann die Blutflussmuster verändern, also führen Sie eine Dosistitration in der Startphase eines Experiments durch.
- Erhöhen Sie die Anästhesiedosis in Schritten und beobachten Sie den Blutfluss im Auge, unterstützt durch Ultraschall im einfachen Helligkeitsmodus (B-Modus).
HINWEIS: Ein optimales Maß an Anästhesie wird erreicht, wenn das Tier bewegungslos ist (außer Atmung) mit sichtbarem okulärem Blutfluss.
- Wenn die Art / Dosis des Anästhetikums für Atembewegungen nicht zulässig ist, stellen Sie eine ausreichende Belüftung des Tieres sicher, z. B. mit einer Luftpumpe, um das Wasser für aquatische Arten mit Sauerstoff zu versorgen, oder einem Beatmungsgerät für luftatmende Arten.
- Positionieren Sie das Tier in einer Haltung, die einen direkten Zugang von oben zum Auge ermöglicht.
HINWEIS: Je nach Art kann sich dies entweder in Rückenlage oder seitlich befinden. Es kann sinnvoll sein, eine einfache Haltevorrichtung mit einem kleinen Stück nicht reaktivem Metall (z. B. Edelstahl) und losen Gummibändern zu konstruieren (siehe Abbildung 1). - Legen Sie ein geeignetes Ultraschallmedium auf das Auge des Tieres. Wenn geschuppte Augenlider (ultraschallundurchlässig) das Auge bedecken, dann verdrängen Sie diese vorsichtig mit einem Wattestäbchen.
HINWEIS: Für aquatische Arten ist das beste Ultraschallmedium sauberes Tankwasser, in dem das Tier normalerweise lebt. Bei terrestrischen Spezies sorgt eine großzügige Menge an Ultraschallgel für freie Bewegungen und Bildgebung des Ultraschallwandlers (d.h. der linearen Array-Sonde) über die gesamte Oberfläche des Auges. Tierarztsalbe auf dem kontralateralen Auge ist für terrestrische Arten erforderlich.
2. 2D- und 3D-Bilderfassung von Augenultraschall
- Positionieren Sie den Ultraschallwandler medial zum Auge entweder in einer dorsalen/ventralen oder rostralen/kaudalen Ausrichtung, abhängig von der gewünschten Bildausrichtung.
- Stellen Sie im B-Modus mit maximaler Schärfentiefe den medialen und tiefsten Teil des Auges ab und stellen Sie sicher, dass alle interessanten Strukturen im Bildfeld sichtbar sind.
HINWEIS: Bei einigen Arten nimmt die kristalline Linse einen vergleichsweise großen Anteil des Glaskörpers ein, der den Ultraschall absorbieren kann, insbesondere bei höheren Frequenzen. - Übersetzen Sie den Wandler langsam auf jede Seite, während Sie die Echtzeitbilder inspizieren. Stellen Sie sicher, dass alle interessanten Strukturen im Bildfeld sichtbar sind. Wenn nicht, wechseln Sie zu einem Wandler mit einer niedrigeren Frequenz und größerer Schärfentiefe.
HINWEIS: Die folgenden Mittenfrequenzen ermöglichen die folgende maximale Schärfentiefe: 21 MHz: 3 cm, 40 MHz: 1,5 cm, 50 MHz: 1 cm (siehe Tabelle 1). Diese maximalen Tiefenschärfewerte können jedoch deutlich niedriger sein, wenn das Auge verkalkte oder andere ultraschallundurchlässige Strukturen enthält. - Passen Sie die Bildtiefe, den Tiefenversatz (Abstand vom oberen Bildrand zur interessierenden Struktur), die Bildbreite sowie die Anzahl und Position der Fokuszonen an, um den gewünschten Interessenbereich in allen drei Raumdimensionen abzudecken (z. B. 1 cm Bildtiefe, 2 mm Tiefenversatz, 1 cm Bildbreite, eine Fokuszone).
HINWEIS: Obwohl die spezifische Benennung von Tasten, die diese Parameter anpassen, zwischen Ultraschallsystemen variieren kann, verfügen die meisten Systeme über Tasten mit logischen Namen für diese Anpassungen. Diese Bildparametereinstellungen wirken sich in der Regel auf den Bereich möglicher zeitlicher Auflösungen der Ultraschallerfassung aus. - Stellen Sie die Bildrate im Bereich von 50-120 Bildern·s-1 ein.
HINWEIS: Die zeitliche Auflösung (d.h. das Zeitintervall zwischen aufeinanderfolgenden B-Scans) muss ausreichend sein, um eine große Pixelintensitätsvariabilität in abgebildeten Blutgefäßen anzuzeigen, d.h. die zeitliche Auflösung darf nicht zu hoch sein. Auf der anderen Seite, um eine vollständige 3D-Aufnahme des Auges in einer angemessenen Zeit abzuschließen, kann die zeitliche Auflösung nicht zu niedrig sein. Eine zeitliche Auflösung von 50-120 Bildern·s-1 ist in der Regel für das strömungsverstärkte Verfahren bei den meisten Arten ausreichend. Bei einigen Ultraschallsystemen kann diese gewünschte zeitliche Auflösung durch Umschalten zwischen den Modi "allgemeine Bildgebung" (hohe räumliche/niedrige zeitliche Auflösung) und "Kardiologie" (niedrige räumliche/hohe zeitliche Auflösung) erreicht werden. - Passen Sie die 2D-Verstärkung auf einen Pegel (~ 5 dB) an, so dass anatomische Strukturen in der B-Mode-Erfassung gerade erst sichtbar sind, um das Signal-Rausch-Verhältnis in der anschließenden flussverstärkten Rekonstruktion zu erhöhen.
- Um ein 2D-Flow-verbessertes Bild an einer einzelnen Slice-Position zu erhalten, übersetzen Sie den Wandler in diese Position und fahren Sie mit Schritt 3.1 fort.
- Um eine 3D-Aufnahme einer ganzen Region von Interesse, z. B. der Netzhaut, zu erhalten, übersetzen Sie den Wandler auf ein Extrem der interessierenden Region.
- Um die genaue Position des äußersten Endes der interessierenden Region zu bestimmen, erhöhen Sie die 2D-Verstärkung kurz.
- Nachdem die korrekte Platzierung des Wandlers abgeschlossen ist, verringern Sie die 2D-Verstärkung vor der Aufnahme, um ein maximales Signal-Rausch-Verhältnis bei der anschließenden flussverstärkten Rekonstruktion zu gewährleisten.
- Erfassen Sie für jeden Schritt (Slice) in der 3D-Aufnahme ≥100 Frames (optimal ≥1000 Frames).
- Übersetzen Sie den Wandler mit einem Mikromanipulator oder einem eingebauten Wandlermotor über den gesamten Interessenbereich in Schritten von z. B. 25 μm oder 50 μm (denken Sie daran, die Schrittgröße zu beachten) und wiederholen Sie die Erfassung von ≥100 Bildern für jeden Schritt.
- Euthanasie das Forschungstier gemäß den Tierpflegerichtlinien der Einrichtung.
3. Flussverstärkte Bildrekonstruktion
- Exportieren Sie die Aufnahmen in das DICOM-Dateiformat (Digital Imaging and Communications in Medicine) (Little-Endian).
- Um ein einzelnes flussverstärktes Bild basierend auf einer Cine-Aufnahme mit ≥100 Bildern (T) zu erzeugen, berechnen Sie die Standardabweichung auf Pixelebene (STD(x,y)) mit der folgenden Formel:
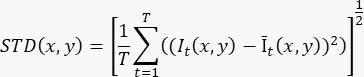
Dabei ist It(x,y) die Intensität des Pixels an der (x,y) Pixelkoordinate zum Zeitpunkt t, und Īt(x,y) ist der arithmetische Mittelwert von I im Zeitverlauf. - Wiederholen Sie Schritt 3.2 für jedes Segment in der 3D-Aufnahme.
- Um die STD-Berechnung und Bildrekonstruktion für mehrere Slices in einer 3D-Aufnahme zu automatisieren, führen Sie diesen Vorgang im Batch-Modus durch, z. B. mit ImageJ und dem ergänzenden Makroskript (Supplementary File 1).
- Kombinieren Sie alle rekonstruierten Slices in einem Image-Stack (Befehl "Images to Stack" in ImageJ).
- Geben Sie die Segmentdicke anhand der während der Aufnahme verwendeten Schrittgröße an (Befehl Eigenschaften in ImageJ).
- Speichern Sie den Bildstapel als 3D-TIF-Datei.
HINWEIS: Flussgewichtete dreidimensionale Aufzeichnungen von Augenblutgefäßen können anschließend verwendet werden, um Volumen-Renderings zu erstellen und digitale und physikalische anatomische Modelle von Gefäßstrukturen des Auges zu erstellen. Diese Bildverarbeitungsoptionen liegen außerhalb des Anwendungsbereichs dieses Protokolls. Weitere Informationen finden Sie in den zuvor veröffentlichten Artikeln33,34,35.
Ergebnisse
Die strömungsverstärkte Ultraschalltechnik zur Abbildung von Gefäßbetten des Auges kann bei einer Reihe von Arten angewendet werden und wird derzeit bei 46 verschiedenen Wirbeltierarten angewendet (Abbildung 1, Tabelle 1). Das Vorhandensein von kernhaltigen roten Blutkörperchen bei nicht-erwachsenen Säugetierwirbeltieren bietet einen positiven Kontrast des fließenden Blutes im Vergleich zu statischem Gewebe in Kinoaufzeichnungen (Supplementary File 2).
Diskussion
Die vaskuläre Bildgebung mit strömungsverstärktem Ultraschall bietet eine neue Methode für die nicht-invasive Bildgebung des Gefäßsystems des Auges, die mehrere Vorteile gegenüber derzeitigen Techniken bietet, aber ihre intrinsischen Grenzen hat. Der Hauptvorteil von strömungsverstärktem Ultraschall ist die Fähigkeit, Augenangiographien mit einer Schärfentiefe zu erzeugen, die das retinale Pigmentepithel übersteigt, was die Schärfentiefe in optischen Techniken einschränkt. In der Ultraschallbildgebung werde...
Offenlegungen
Die Autoren erklären, dass keine abschließenden Interessen bestehen.
Danksagungen
Diese Arbeit wurde von der Carlsberg Foundation finanziert (CF17-0778; CF18-0658), die Lundbeck-Stiftung (R324-2019-1470; R346-2020-1210), die Velux-Stiftungen (00022458), die A.P. Møller-Stiftung zur Förderung der medizinischen Wissenschaft, das Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Marie-Skłodowska-Curie-Finanzhilfevereinbarung (Nr. 754513) und die Forschungsstiftung der Universität Aarhus.
Materialien
| Name | Company | Catalog Number | Comments |
| MS-222 | Sigma | E10521-50G | |
| Benzocaine | Sigma | E-1501 | |
| Propofol | B Braun | 12260470_0320 | |
| Alfaxalon | Jurox | NA | |
| Isoflurane | Zoetis | 50019100 | |
| Ultrasound scanner | VisualSonics | Vevo 2100 |
Referenzen
- Yu, C. Q., Schwab, I. R., Dubielzig, R. R. Feeding the vertebrate retina from the Cambrian to the Tertiary. Journal of Zoology. 278 (4), 259-269 (2009).
- Yu, D. Y., Cringle, S. J. Oxygen distribution and consumption within the retina in vascularised and avascular retinas and in animal models of retinal disease. Progress in Retinal and Eye Research. 20 (2), 175-208 (2001).
- Country, M. W. Retinal metabolism: A comparative look at energetics in the retina. Brain Research. 1672, 50-57 (2017).
- Damsgaard, C., et al. Retinal oxygen supply shaped the functional evolution of the vertebrate eye. Elife. , 8 (2019).
- Buttery, R. G., Hinrichsen, C. F. L., Weller, W. L., Haight, J. R. How thick should a retina be? A comparative study of mammalian species with and without intraretinal vasculature. Vision Research. 31 (2), 169-187 (1991).
- Ames, A., Li, Y., Heher, E., Kimble, C. Energy metabolism of rabbit retina as related to function: high cost of Na+ transport. The Journal of Neuroscience. 12 (3), 840-853 (1992).
- Chase, J. The Evolution of retinal vascularization in mammals: A comparison of vascular and avascular retinae. Ophthalmology. 89 (12), 1518-1525 (1982).
- Johnson, G. L. Ophthalmoscopic studies on the eyes of mammals. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 254 (794), 207-220 (1968).
- Johnson, G. L. I. Contributions to the comparative anatomy of the mammalian eye, chiefly based on ophthalmoscopic examination. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 194 (194-206), 1-82 (1901).
- Rodriguez-Ramos Fernandez, J., Dubielzig, R. R. Ocular comparative anatomy of the family Rodentia. Veterinary Ophthalmology. 16, 94-99 (2013).
- Copeland, D. E. Functional vascularization of the teleost eye. Current Topics in Eye Research. 3, 219-280 (1980).
- Meyer, D. B., Crescitelli, F. . The Visual System in Vertebrates. Handbook of Sensory Physiology. 7, (1977).
- Potier, S., Mitkus, M., Kelber, A. Visual adaptations of diurnal and nocturnal raptors. Seminars in Cell & Developmental Biology. 106, 116-126 (2020).
- Wittenberg, J. B., Wittenberg, B. A. Active secretion of oxygen into the eye of fish. Nature. 194, 106-107 (1962).
- Damsgaard, C. Physiology and evolution of oxygen secreting mechanism in the fisheye. Comparative Biochemistry and Physiology. 252, 110840 (2021).
- Damsgaard, C., et al. A novel acidification mechanism for greatly enhanced oxygen supply to the fish retina. Elife. 9, (2020).
- Wittenberg, J. B., Haedrich, R. L. The choroid rete mirabile of the fish eye. II. Distribution and relation to the pseudobranch and to the swimbladder rete mirabile. Biological Bulletin. 146 (1), 137-156 (1974).
- Wittenberg, J. B., Wittenberg, B. A. The choroid rete mirabile of the fish eye. I. Oxygen secretion and structure: comparison with the swimbladder rete mirabile. Biological Bulletin. 146 (1), 116-136 (1974).
- Berenbrink, M. Historical reconstructions of evolving physiological complexity: O2 secretion in the eye and swimbladder of fishes. Journal of Experimental Biology. 210, 1641-1652 (2007).
- Berenbrink, M., Koldkjaer, P., Kepp, O., Cossins, A. R. Evolution of oxygen secretion in fishes and the emergence of a complex physiological system. Science. 307 (5716), 1752-1757 (2005).
- Keane, P. A., Sadda, S. R. Retinal imaging in the twenty-first century: State of the art and future directions. Ophthalmology. 121 (12), 2489-2500 (2014).
- Yung, M., Klufas, M. A., Sarraf, D. Clinical applications of fundus autofluorescence in retinal disease. International Journal of Retina and Vitreous. 2 (1), 12 (2016).
- Ang, M., et al. Optical coherence tomography angiography: a review of current and future clinical applications. Graefe's Archive for Clinical and Experimental Ophthalmology. 256 (2), 237-245 (2018).
- Spaide, R. F., Koizumi, H., Pozonni, M. C. Enhanced depth imaging spectral-domain optical coherence tomography. American Journal of Ophthalmology. 146 (4), 496-500 (2008).
- Shen, Q., et al. Magnetic resonance imaging of tissue and vascular layers in the cat retina. Journal of Magnetic Resonance Imaging. 23 (4), 465-472 (2006).
- Tan, G. X., Jamil, M., Tee, N. G., Zhong, L., Yap, C. H. 3D reconstruction of chick embryo vascular geometries using non-invasive high-frequency ultrasound for computational fluid dynamics studies. Annals of Biomedical Engineering. 43 (11), 2780-2793 (2015).
- Ho, S., Tan, G. X. Y., Foo, T. J., Phan-Thien, N., Yap, C. H. Organ dynamics and fluid dynamics of the HH25 chick embryonic cardiac ventricle as revealed by a novel 4D high-frequency ultrasound imaging technique and computational flow simulations. Annals of Biomedical Engineering. 45 (10), 2309-2323 (2017).
- Dittrich, A., Thygesen, M. M., Lauridsen, H. 2D and 3D echocardiography in the Axolotl (Ambystoma Mexicanum). Journal of Visualized Experiments: JoVE. (141), e57089 (2018).
- Jia, Y., et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography. Optics Express. 20 (4), 4710-4725 (2012).
- Clarke, K. W., Trim, C. M., Trim, C. M. . Veterinary Anaesthesia E-Book. , (2013).
- Flecknell, P. . Laboratory Animal Anaesthesia. , (2015).
- West, G., Heard, D., Caulkett, N. . Zoo Animal and Wildlife Immobilization and Anesthesia. , (2014).
- Lauridsen, H., Hansen, K., Nørgård, M. &. #. 2. 1. 6. ;., Wang, T., Pedersen, M. From tissue to silicon to plastic: three-dimensional printing in comparative anatomy and physiology. Royal Society Open Science. 3 (3), 150643 (2016).
- Lauridsen, H., et al. Inside out: Modern imaging techniques to reveal animal anatomy. PLoS One. 6 (3), 17879 (2011).
- Ruthensteiner, B., Heß, M. Embedding 3D models of biological specimens in PDF publications. Microscopy Research and Technique. 71 (11), 778-786 (2008).
- Damsgaard, C., Lauridsen, H. Deep vascular imaging in the eye with flow-enhanced ultrasound. bioRxiv. , 447055 (2021).
- Mueller, R. L., Ryan Gregory, T., Gregory, S. M., Hsieh, A., Boore, J. L. Genome size, cell size, and the evolution of enucleated erythrocytes in attenuate salamanders. Zoology. 111 (3), 218-230 (2008).
- Greis, C. Quantitative evaluation of microvascular blood flow by contrast-enhanced ultrasound (CEUS). Clinical Hemorheology and Microcirculation. 49, 137-149 (2011).
- Urs, R., Ketterling, J. A., Tezel, G., Silverman, R. H. Contrast-enhanced plane-wave ultrasound imaging of the rat eye. Experimental Eye Research. 193, 107986 (2020).
- Walls, G. L. . The vertebrate eye and its adaptive radiation. , (1942).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten