A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فحص الأنماط الجينية للتبغ لمقاومة النيكوتيانا النباتية
In This Article
Summary
هنا ، يتم تقديم بروتوكول للفحص الفعال والدقيق للأنماط الوراثية للتبغ لمقاومة Phytophthora nicotianae في الشتلات. هذا هو نهج عملي للتربية الدقيقة ، وكذلك أبحاث الآلية الجزيئية.
Abstract
الساق السوداء ، التي تسببها oomycetes Phytophthora nicotianae ، مدمرة للتبغ ، وهذا العامل الممرض شديد الإمراض للعديد من المحاصيل الباذنجانية. P. nicotianae تتكيف بشكل جيد مع درجات الحرارة المرتفعة. لذلك ، تكتسب الأبحاث حول هذا العامل الممرض أهمية في الزراعة في جميع أنحاء العالم بسبب الاحترار العالمي. عادة ما يتم فحص أنواع نباتات التبغ المقاومة ل P. nicotianae عن طريق التلقيح بحبوب الشوفان التي تستعمرها P. nicotianae ومراقبة أعراض المرض. ومع ذلك ، من الصعب تحديد كثافة التلقيح لأن التلقيح الدقيق أمر بالغ الأهمية في هذه الحالة. هدفت هذه الدراسة إلى تطوير طريقة فعالة وموثوقة لتقييم مقاومة التبغ للعدوى ببكتيريا P. nicotianae. تم استخدام هذه الطريقة بنجاح لتحديد الأصناف المقاومة ، وتم تأكيد كفاءة التلقيح بواسطة PCR في الوقت الفعلي. طريقة تقييم المقاومة المقدمة في هذه الدراسة فعالة وعملية للتربية الدقيقة ، وكذلك أبحاث الآلية الجزيئية.
Introduction
P. nicotianae مدمر للعديد من المحاصيل الباذنجانية. يمكن أن يسبب التبغ "عرقوب أسود"1 ، وتعفن أوراق البطاطس والدرنات 2 ، وتاج الطماطم والفلفل الحلو وتعفن الجذر3 ، وطوق غوجي وتعفن الجذر4. يمكن أن تهاجم P. nicotianae جميع أجزاء نباتات التبغ، بما في ذلك الجذور والسيقان والأوراق في أي مرحلة من مراحل النمو5. الأعراض الأكثر شيوعا للمرض هي القاعدة السوداء للساق. تكون الجذور مرئية في البداية على أنها غارقة في الماء ثم تصبح نخرية ، وتظهر الأوراق آفات دائرية كبيرة5. يمكن أن يكون هذا المرض مدمرا لنبات التبغ في الدفيئة ، وكذلك في الحقل6. الطريقة الأكثر عملية واقتصادية للسيطرة على P. nicotianae هي استخدام أصناف مقاومة7. ومع ذلك، يلزم وجود بروتوكول فحص فعال لتحديد المدخلات المقاومة للبكتيريا النيكوتيانية من مجموعات البلازما الوراثية للتبغ.
تم وصف طرق تحديد مختلفة لتقييم مقاومة P. nicotianae في التبغ7،8،9،10،11،12،13،14،15،16. وبوجه عام، استخدمت ثلاثة نهج رئيسية لتحديد الأنماط الجينية للتبغ المقاوم للبكتيريا النيكوتيانية. الأول يشمل خلط الفطريات مع وسط الأجار على ألواح بتري التي تحتوي على P. nicotianae. ثم تزرع الفطريات في الظلام في درجة حرارة الغرفة لمدة 2 أسابيع. يضاف 1 لتر من الماء منزوع الأيونات إلى الفطريات ويتجانس لمدة 30 ثانية. يتم الاحتفاظ بالتلقيح على الجليد حتى الحاجة إليه. يتم عمل ثقبين (قطرهما 1 سم وعمقهما 4-5 سم) على كل جانب من جوانب النبات ، ويتم سكب 10 مل من اللقاح في كل ثقب. ثم تمتلئ الثقوب بالتربة المحيطة بها ، ويتم مراقبة تطور المرض يوميا لمدة أسبوعين 8,10.
في الطريقة الثانية ، يتم تلقيح النباتات بالمسواك الموبوءة بمسببات الأمراض. لهذا النهج ، يجب استخدام النباتات بعد حوالي 6 أسابيع من الزرع ويجب أن يكون ارتفاعها 30 سم كحد أدنى. يتم وضع المسواك المعقمة على سطح الثقافات التي تحتوي على P. nicotianae mycelia. ثم يتم تخزين أطباق الثقافة تحت الضوء في درجة حرارة الغرفة لمدة 7 أيام. ثم ، يتم استخدام المسواك المستعمرة لتلقيح النباتات. يتم إدخال المسواك في سيقان التبغ بين العقدتين الرابعة والخامسة. تتم مراقبة النباتات يوميا لمدة 5 أيام9,15. هذه الطريقة غير قابلة للتطبيق على الشتلات الصغيرة. نظرا لأن اللقاح عبارة عن مسواك موبوء بمسببات الأمراض ، فلا يمكن التحكم في كثافة التلقيح بدقة.
النهج الأكثر استخداما ينطوي على حبوب الشوفان للتلقيح. في هذه الحالة ، يتم تحضير حبوب الشوفان عن طريق تعقيم 500 مل من الشوفان و 300 مل من الماء منزوع الأيونات عند 121 درجة مئوية لمدة 1 ساعة مرة واحدة يوميا لمدة 3 أيام. ثم ، تضاف حبوب الشوفان إلى وسط الثقافة المستعمر الممرض. يتم ختم الأطباق مع فيلم البارافين واحتضانها عند 25 درجة مئوية في الضوء لمدة 7-12 يوما. يتم إجراء أربعة ثقوب منفصلة بعمق 5 سم على تربة الأصيص ، على بعد 4 سم من كل نبات ، ويتم وضع حبة شوفان واحدة موبوءة بمسببات الأمراض في كل حفرة. يتم تحديد فترة الحضانة بناء على وقت حدوث أول عرض فوق سطح الأرض7,11,12,13,14,15,16. هذه الطريقة فعالة وقابلة للتطبيق لفحص المقاومة على نطاق واسع. ومع ذلك ، فإن أحد قيود هذا النهج هو أن اللقاح عبارة عن حبوب شوفان موبوءة بمسببات الأمراض ، وبالتالي لا يمكن التحكم في كثافة التلقيح بدقة.
ومع ذلك ، فإن العرض هنا هو طريقة أكثر دقة تنطبق على تقييم مقاومة غرفة النمو. بالمقارنة مع الأساليب الأخرى ، فإن اللقاح هو تعليق بوغ الحيوان ، وبالتالي فإن كثافة التلقيح قابلة للتحكم فيها وتعديلها. نظرا لأن نباتات التبغ في هذه الدراسة تزرع بدون تربة ، فمن الأسهل ملاحظة النتائج. وعلاوة على ذلك، فإن أخذ عينات من جذور النباتات من التربة يسبب دائما ضررا للجذور، مما يؤدي إلى سلسلة من الاستجابات الفسيولوجية17. في هذه الطريقة ، حيث تزرع النباتات بدون تربة ، يمكن القضاء على التدخل في تلف الجذر. في الختام ، هذه الطريقة أكثر عملية لأبحاث الآلية الجزيئية والتربية الدقيقة. باستخدام هذا البروتوكول ، يتم الحصول على البيانات عادة في غضون 5 أيام ، مع تقييم أكثر من 200 نبات في تجربة واحدة.
Protocol
1. المواد
- الحصول على أصناف التبغ.
ملاحظة: بالنسبة لهذه التجربة ، تم الحصول على "Beinhart1000-1" (مجموعة مختارة من Beinhart 1000) (BH) و "Xiaohuangjin1025" (XHJ) من بنك الجينات الوطني متوسط الأجل لمورد البلازما الوراثية للتبغ في الصين. BH مقاوم ، في حين أن XHJ عرضة لعدوى P. nicotianae16. تم استخدام عزل ميداني لسباق P. nicotianae 0 ، والذي تم الحفاظ عليه في معهد أبحاث التبغ التابع للأكاديمية الصينية للعلوم الزراعية ، لجميع عمليات التلقيح طوال فترة الدراسة.
2. زراعة الأنماط الوراثية للتبغ لتقييم مقاومة بكتيريا P. nicotianae
- امزج بذور التبغ مع الفيرميكوليت وبث البذور بلطف على تربة الأواني المعقمة. ضع الأواني في غرفة النمو. حافظ على درجة حرارة ثابتة تبلغ 25 درجة مئوية ، تحت 16 ساعة ضوء / 8 ساعات من الفترة الضوئية المظلمة.
- إعداد الأجهزة المائية مع الصواني وألواح الرغوة. بعد أن تنبت البذور ، قم بوخز الشتلات من تربة الأصيص ، واغسل الجذور بلطف بالماء المعقم منزوع الأيونات ، وزرعها في الأجهزة المائية.
- ضع الأجهزة في غرف المناخ عند 25 درجة مئوية تحت ضوء 16 ساعة / 8 ساعات من الفترة المظلمة لمدة 24 ساعة.
- تحضير محلول المغذيات Hoagland مسبقا (الجدول 1). زرع الشتلات إلى الأجهزة المائية باستخدام محلول المغذيات Hoagland (حوالي 125 مل لكل نبات).
- ضع الأجهزة في غرفة المناخ عند 25 درجة مئوية تحت ضوء 16 ساعة / 8 ساعات من الفترة المظلمة لمدة أسبوعين.
3. إعداد P. nicotianae تعليق الجراثيم الحيوانية
- تحضير دقيق الشوفان أجار المتوسط.
- يزن 33 غرام من دقيق الشوفان وينقل إلى الأواني الزجاجية ويضاف 1000 مل من الماء المعقم. تغلي على فرن موقد كهرومغناطيسي.
- بعد أن يصبح دقيق الشوفان لزجا ، قم بتصفية المحلول السائل من خلال قطعة من الشاش المعقم.
- صب المحلول السائل في أسطوانة متدرجة سعة 1000 مل واضبط الحجم إلى 1000 مل بالماء المعقم.
- صب المحلول السائل في زجاجة كاشف زجاجي وأضف 18 جم من الأجار. رج الخليط جيدا وأوتوكلافي (وسط أجار دقيق الشوفان) على حرارة 121 درجة مئوية لمدة 15 دقيقة. اتركيه في درجة حرارة الغرفة لمدة 30 دقيقة.
- صب حوالي 20 مل من وسط أجار الشوفان المعقم في كل طبق بتري. اترك أطباق بتري في درجة حرارة الغرفة لتبرد جيدا قبل زراعة الميسيل.
- تنفيذ زراعة mycelial.
- قم بإعداد اللكمات والمسواك التي يبلغ قطرها 1 سم مسبقا عن طريق تعقيمها عند 121 درجة مئوية لمدة 15 دقيقة.
- ثقب ثقوب في ثقافات الأجار Mycelial Mycelial P. nicotianae لصنع حصير mycelial مستدير.
- اختر الحصير الفطري ، وضع الجانب الفطري لأسفل على وسط أجار دقيق الشوفان ، واحتضن الميسيليوم عند 25 درجة مئوية في الظلام لمدة 14 يوما.
- إعداد P. nicotianae تعليق zoospore.
- أضف محلول KNO3 بنسبة 0.1٪ إلى كل زراعة فطرية (15 مل / طبق) ، متبوعا بالزراعة عند 4 درجات مئوية لمدة 20 دقيقة للحث على البوغ.
- احتفظ بالأطباق في درجة حرارة 25 درجة مئوية لمدة 25 دقيقة لإطلاق الجراثيم الحيوانية.
- جمع تعليق zoospore في دورق وقياس تركيز zoospore باستخدام المجهر ومقياس الدم.
- اضبط تركيز الجراثيم الحيوانية على 1 × 104 من الجراثيم الحيوانية / مل بالماء المعقم.
4- تحديد أصناف التبغ المقاومة للأمراض
- خذ الشتلات من محلول المغذيات Hoagland وتلقيحها عن طريق غمر الجذور في 20 مل من تعليق P. nicotianae zoospore في طبق بتري (90 ملم) عند 25 درجة مئوية لمدة 3 ساعات في الظلام.
- بعد التلقيح ، ضع شتلات التبغ في أطباق بتري جديدة مع 10 مل من الماء المعقم الذي يغمر الجذور. حافظ على رطوبة الجذور عن طريق تغطيتها بقطعتين من ورق الترشيح. حافظ على الأطباق في درجة حرارة 25 درجة مئوية مع فترة ضوئية مظلمة لمدة 16 ساعة / 8 ساعات.
- بعد 2-3 أيام ، لاحظ شدة المرض.
- للمعالجة الضابطة ، ضع شتلات التبغ مباشرة في أطباق بتري بماء معقم 10 مل يغمر الجذور ، وقم بتغطية الجذور بقطعتين من ورق الترشيح.
ملاحظة: كان لكل علاج ثلاثة تكرارات ، مع 8 نباتات لكل تجربة.
- للمعالجة الضابطة ، ضع شتلات التبغ مباشرة في أطباق بتري بماء معقم 10 مل يغمر الجذور ، وقم بتغطية الجذور بقطعتين من ورق الترشيح.
5. تقييم عدوى P. nicotianae
- تقييم شدة المرض بعد 4-5 أيام من التلقيح. استنادا إلى المعيار الوطني الصيني18 ، سجل شدة الأمراض النباتية الفردية على مقياس من 0 إلى 9 (الجدول 2 ، الشكل 1).
- احسب مؤشر المرض باستخدام الصيغة التالية18:
مؤشر المرض =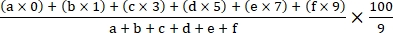
حيث أ ، ب ، ج ، د ، ه ، و و هي عدد النباتات في كل درجة من درجات شدة المرض.
ملاحظة: قسمت شدة المرض إلى 6 درجات18 (الجدول 3).
النتائج
تم تحدي النباتات التي يبلغ عمرها 4 أسابيع من الصنف المقاوم BH والصنف الحساس XHJ مع P. nicotianae باستخدام الطريقة المقدمة في هذه المقالة. تم تصميم التجربة مع ثلاث نسخ متماثلة ، كل منها يحتوي على 8 نباتات لكل مجموعة. ويرد في الشكل 2 عدوى P. nicotianae لنوعي التبغ، BH و XHJ. في 3 أيام بع?...
Discussion
تم استخدام مصادر مقاومة متعددة لتحسين مقاومة P. nicotianae في التبغ المزروع. تم إدخال جينات R المهيمنة المفردة ، Php و Phl ، من Nicotiana plumbaginifolia و Nicotiana longiflora ، على التوالي 10. يحتوي صنف تبغ السيجار Beinhart 1000 على أعلى مستوى تم الإبلاغ عنه من المقاومة الكمية ل P. nicotianae13....
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا البحث من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (31571738) وبرنامج الابتكار في العلوم والتكنولوجيا الزراعية في الصين (ASTIP-TRIC01).
Materials
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Sinopharm | 10002917 | Analytical Reagent |
| (NH4)6 Mo7O24•2 H2O | Sinopharm | XW131067681 | Analytical Reagent |
| 1.5 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120086 | Used for Sample Extarction |
| 2 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120094 | Used for Sample Extarction |
| Agar | MDBio, Inc | 9002-18-0 | Materials of Culture Medium |
| Analytical Balance | AOHAOSI | AX2202ZH | Equipment |
| Autoclave | Yamatuo | SQ510C | Equipment |
| Autoclave | YAMATUO | SQ510C | Equipment |
| Beaker | Bio Best | DHSB-2L | Materials of Culture Medium |
| Biological Incubator | JINGHONG | SHP-250 | Equipment |
| Ca(NO3)2•4 H2O | Sinopharm | 80029062 | Analytical Reagent |
| CaCl2 | Sinopharm | 10005817 | Analytical Reagent |
| CuSO4•5 H2O | Sinopharm | 10008218 | Analytical Reagent |
| Electromagnetic Oven | Bio Best | DHDCL | Equipment |
| FeSO4•7 H2O | Sinopharm | 10002918 | Analytical Reagent |
| Filter Paper | Bio Best | DHLZ-9CM | Material |
| Fluorescence Ration PCR Instrument | Roche | LightCycler96 | Equipment |
| Gauze | Bio Best | 17071202 | Materials of Culture Medium |
| H3BO3 | Phytotechnology | B210-500G | Analytical Reagent |
| Hemocytometer | Solarbio | 17072801 | Material for disease-resistant identification |
| K2SO4 | Sinopharm | 10017918 | Analytical Reagent |
| KNO3 | Sinopharm | 10017218 | Analytical Reagent |
| KT Foam Sheet | Bio Best | DHKTB | Material for Seedling |
| Low Constant Incubator | Jinghong | SHP-250 | Equipment |
| Measuring Cylinder | Bio Best | DHBLLT-1000ML | Materials of Culture Medium |
| MgSO4•7 H2O | Sinopharm | 10013080 | Analytical Reagent |
| Microscope | ECHO | RVL-100-G | Equipment |
| MnCl2•4 H2O | Sinopharm | G5468154 | Analytical Reagent |
| Na2-EDTA | Sinopharm | G21410-250 | Analytical Reagent |
| NaH2PO4•2 H2O | Sinopharm | 20040717 | Analytical Reagent |
| NH4NO3 | Sinopharm | B64586-100g | Analytical Reagent |
| Oatmeal | Bio Best | DHYMP-1.5KG | Materials of Culture Medium |
| Petri Dish | Bio Best | DHPYM-9CM | Material for disease-resistant identification |
| Pipettor | THERMO | S1 | Equipment |
| Potting | Bio Best | DHYCXHP-12CM | Material for Seedling |
| Potting Soil | Bio Best | DHYMJZ-50L | Seedling Material |
| Punch | Bio Best | DHDKW | Material |
| qRT-PCR Plate | Monad | MQ50401S | qRT-PCR Plate |
| SYBR Green Premix Pro Taq HS qPCR Kit | Accurate Biology | AG11718 | PCR Reagent |
| Toothpick | Bio Best | DHYQ-900 | Material |
| Total RNA Kit II | Omega | R6934-01 | PCR Reagent |
| TransScript® II One-Step gDNA Removal and cDNA Synthesis SuperMix | Transgen | AH311-02 | PCR Reagent |
| Trays | Bio Best | DHYMTP-90G | Material for Seedling |
| Vermiculite | Bio Best | DHZS | Seedling Material |
| Water Purification System | HEAL FORCE | HSE68-2 | Equipment |
| ZnSO4•7 H2O | Sinopharm | 10024018 | Analytical Reagent |
References
- Antonopoulos, D. F., Melton, T., Mila, A. L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco. Plant Disease. 94 (5), 613-620 (2010).
- Taylor, R. J., Pasche, J. S., Gallup, C. A., Shew, H. D., Gudmestad, N. C. A foliar blight and tuber rot of potato caused by Phytophthora nicotianae: New occurrences and characterization of isolates. Plant Disease. 92 (4), 492-503 (2008).
- Amalia, B. R., José, I. M. G., Miguel, D. C. G., Francisco, C. F., Julio, C. T. M. Pathogenicity of plant and soil isolates of Phytophthora parasitica on tomato and pepper. European Journal of Plant Pathology. 148 (3), 607-615 (2017).
- Corrado, C., Annamari, M., Leonardo, S., Antonio, I., Simona, M. S. First report of collar and root rot caused by Phytophthora nicotianae on Lycium barbarum. Journal of Plant Pathology. 100 (2), (2018).
- Meng, Y. L., Zhang, Q., Ding, W., Shan, W. X. Phytophthora parasitica.: a model oomycete plant pathogen. Mycology. 5 (2), 43-51 (2014).
- Biasi, A., Martin, F. N., Cacciola, S. O., Lio, G. M., Grunwald, N. J., Schena, L. Genetic analysis of Phytophthora nicotianae populations from different hosts using microsatellite markers. Phytopathology. 106 (9), 1006-1014 (2016).
- Sullivan, M. J., Melton, T. A., Shew, H. D. Fitness of races 0 and 1 of Phytophthora parasitica var. nicotianae. Plant Disease. 89 (11), 1220-1228 (2005).
- Carlson, S. R., Wolff, M. A. F., Shew, H. D., Wernsman, E. A. Inheritance of resistance to Race 0 of Phytophthora parasitica var. nicotianae from the flue-cured tobacco cultivar Coker 371-Gold. Plant Disease. 81 (11), 1269-1274 (1997).
- Csinos, A. S. Stem and root resistance to tobacco black shank. Plant Disease. 83 (8), 777-780 (1999).
- Johnson, E. S., Wolff, M. F., Wernsman, E. A., Atchley, W. R., Shew, H. D. Origin of the black shank resistance gene, Ph, in tobacco cultivar coker 371-Gold. Plant Disease. 86 (10), 1080-1084 (2002).
- Osmany, C., Ingrid, H., Roxana, P., Yunior, L., Merardo, P., Orlando, B. H. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 177 (3), 175-180 (2009).
- Hernández, I., et al. Black shank resistant tobacco by silencing of glutathione S-transferase. Biochemical and Biophysical Research Communications. 387 (2), 300-304 (2009).
- Vontimitta, V., Lewis, R. S. Growth chamber evaluation of a tobacco 'Beinhart 1000' × 'Hicks' mapping population for quantitative trait loci affecting resistance to multiple races of Phytophthora nicotianae. Crop Science. 52 (1), 91-98 (2012).
- Xiao, B., et al. Location of genomic regions contributing to Phytophthora nicotianae resistance in tobacco cultivar florida 301. Crop Science. 53 (2), 473-481 (2013).
- McCorkle, K., Lewis, R., Shew, D. Resistance to Phytophthora nicotianae in tobacco breeding lines derived from variety Beinhart 1000. Plant Disease. 97 (2), 252-258 (2013).
- Zhang, Y., et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1. The Crop Journal. 6 (3), 282-290 (2018).
- Yu, X., Feng, B., He, P., Shan, L. From chaos to harmony: responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology. 55, 109-137 (2017).
- Ren, G., et al. . GB/T 23222 Grade and Investigation Method of Tobacco Diseases and Insect Pests. , (2008).
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19 (11), 11-15 (1987).
- Yan, H. Z., Liou, R. F. Selection of internal control genes for real-time quantitative RT-PCR assays in the oomycete plant pathogen Phytophthora parasitica. Fungal Genetics and Biology. 43, 430-438 (2006).
- Chacón, O., Hernández, I., Portieles, R., López, Y., Pujol, M., Borrás-Hidalgo, O. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 117 (3), 175-180 (2009).
- Vijay, V., Ramsey, S. L. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 29 (1), 89-98 (2012).
- McCorkle, K. L., Drake-Stowe, K., Lewis, R. S., Shew, D. Characterization of Phytophthora nicotianae resistance conferred by the introgressed Nicotiana rustica region, Wz, in flue-cured tobacco. Plant Disease. 102 (2), 309-317 (2018).
- Drake, K. E., Moore, J. M., Bertrand, P., Fortnum, B., Peterson, P., Lewis, R. S. Black shank resistance and agronomic performance of flue-cured tobacco lines and hybrids carrying the introgressed Nicotiana rustica Region. Wz. Crop Science. 55 (1), 79-86 (2015).
- Kebdani, N., Pieuchot, L., Deleury, E., Panabières, F., Berre, J. -. Y. L., Gourgues, M. Cellular and molecular characterization of Phytophthora parasitica appressorium-mediated penetration. New Phytologist. 185 (1), 248-257 (2010).
- Huang, G., et al. An RXLR effector secreted by Phytophthora parasitica is a virulence factor and triggers cell death in various plants. Molecular Plant Pathology. 20 (3), 1-16 (2019).
- Agnès, A., Mathieu, G., Nicolas, C. -. T., Harald, K. The immediate activation of defense responses in Arabidopsis roots is not sufficient to prevent Phytophthora parasitica infection. New Phytologist. 187 (2), 229 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved