A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הקרנה של גנוטיפים טבק עבור התנגדות פיטופתורה nicotianae
In This Article
Summary
כאן, פרוטוקול מוצג עבור הקרנה יעילה ומדויקת של גנוטיפים טבק עבור Phytophthora nicotianae התנגדות שתילים. זוהי גישה מעשית לרבייה מדויקת, כמו גם מחקר מנגנון מולקולרי.
Abstract
שוק שחור, הנגרם על ידי oomycetes Phytophthora nicotianae, הוא הרסני לטבק, ופתוגן זה הוא מאוד פתוגניים לגידולים סולאנים רבים. P. nicotianae מותאם היטב לטמפרטורות גבוהות; לכן, מחקר על פתוגן זה צובר חשיבות בחקלאות ברחבי העולם בגלל ההתחממות הגלובלית. P. זנים עמידים nicotianae של צמחי טבק נבדקים בדרך כלל על ידי חיסון עם גרגרי שיבולת שועל מיושב על ידי P. nicotianae וניטור עבור תסמיני המחלה. עם זאת, קשה לכמת את עוצמת החיסון שכן חיסון מדויק הוא קריטי במקרה זה. מחקר זה נועד לפתח שיטה יעילה ואמינה להערכת ההתנגדות של טבק לזיהום עם P. nicotianae. שיטה זו שימשה בהצלחה לזיהוי זנים עמידים, ויעילות החיסון אושרה על ידי PCR בזמן אמת. שיטת הערכת ההתנגדות המוצגת במחקר זה יעילה ומעשית לרבייה מדויקת, כמו גם לחקר מנגנון מולקולרי.
Introduction
P. nicotianae הוא הרסני לגידולים סולאנים רבים. זה יכול לגרום טבק "שוק שחור"1, פוליאר תפוחי אדמה ו פקעת rot2, כתר עגבניות ופלפל מתוק ורוט שורש3, וצווארון גוג'י ורוט שורש4. P. nicotianae יכול לתקוף את כל חלקי צמחי הטבק, כולל השורשים, הגבעולים והעלים בכל שלב גידול5. הסימפטום הנפוץ ביותר של המחלה הוא הבסיס השחור של הגבעול. השורשים נראים בתחילה כמו ספוג מים ולאחר מכן להיות נמק, והעלים מראים נגעים מעגליים גדולים5. מחלה זו יכולה להיות הרסנית לצמח טבק בחממה, כמו גם בתחום6. השיטה המעשית והחסכונית ביותר לשליטה P. nicotianae היא השימוש זנים עמידים7. עם זאת, פרוטוקול סינון יעיל נדרש לזיהוי של P. nicotianae עמיד גישות מאוספי נבט טבק.
שיטות זיהוי שונות תוארו כדי להעריך עמידות P. nicotianae בטבק7,8,9,10,11,12,13,14,15,16. באופן כללי, שלוש גישות עיקריות שימשו לזיהוי של גנוטיפי טבק עמידים P. nicotianae. הראשון כולל ערבוב תפטירים עם מדיום אגר על צלחות פטרי המכילות P. nicotianae. התפטיר מעובד לאחר מכן בחושך בטמפרטורת החדר במשך שבועיים. 1 L של מים deionized מתווסף תפטיר הומוגני במשך 30 s. החיסון נשמר על קרח עד הצורך. שני חורים (בקוטר 1 ס"מ ועומק 4-5 ס"מ) מיוצרים בכל צד של הצמח, ו -10 מ"ל של אינוקולום נשפך לתוך כל חור. לאחר מכן החורים מלאים בקרקע שמסביב, והתפתחות המחלה מנוטרת מדי יום במשך שבועיים8,10.
בשיטה השנייה, הצמחים מחוסנים עם קיסמי שיניים שורצי פתוגן. עבור גישה זו, הצמחים יש להשתמש כ 6 שבועות לאחר ההשתלה צריך להיות בגובה מינימלי של 30 ס"מ. קיסמי שיניים משועבדים אוטומטית ממוקמים על פני השטח של תרבויות המכילות תפטיאני P. nicotianae תפטיאניה. מנות התרבות מאוחסנות לאחר מכן תחת האור בטמפרטורת החדר במשך 7 ימים. לאחר מכן, קיסמי שיניים קולוניאליים משמשים לחסן את הצמחים. קיסמי שיניים מוכנסים לתוך גבעולי הטבק בין הצמתים הרביעי והחמישי. הצמחים מנוטרים מדי יום במשך 5 ימים9,15. שיטה זו אינה ישימה עבור שתילים קטנים. מכיוון שהאינוקולום הוא קיסמי שיניים שורצי פתוגן, לא ניתן לשלוט במדויק בעוצמת החיסון.
הגישה הנפוצה ביותר כוללת גרגרי שיבולת שועל לחיסון. במקרה זה, גרגרי שיבולת שועל מוכנים על ידי autoclaving 500 מ"ל של שיבולת שועל ו 300 מ"ל של מים deionized ב 121 °C (65 °F) עבור 1 שעה פעם ביום במשך 3 ימים. לאחר מכן, גרגרי שיבולת שועל מתווספים למדיום התרבות קולוניאלית פתוגן. הכלים חתומים בסרט פרפין ודגרים בטמפרטורה של 25 מעלות צלזיוס לאור במשך 7-12 ימים. ארבעה חורים נפרדים בעומק 5 ס"מ מיוצרים על אדמת העציצים, 4 ס"מ מכל צמח, ודגר שיבולת שועל שורץ פתוגן אחד ממוקם בכל חור. תקופת הדגירה נקבעת על סמך מתי מתרחשת הסימפטום הראשון מעל פני הקרקע7,11,12,13,14,15,16. שיטה זו יעילה וישימה להקרנת התנגדות בקנה מידה גדול. עם זאת, מגבלה אחת של גישה זו היא כי inoculum הוא גרגרי שיבולת שועל שורץ פתוגן, ולכן עוצמת החיסון לא ניתן לשלוט במדויק.
עם זאת, מוצג כאן היא שיטה מדויקת יותר כי הוא ישים להערכת התנגדות תא הצמיחה. בהשוואה לגישות האחרות, החיסון הוא השעיית zoospore, ומכאן עוצמת החיסון ניתנת לשליטה ומכוונת. כמו צמחי הטבק במחקר זה מעובדים ללא אדמה, התוצאות קלות יותר לצפייה. יתר על כן, דגימת שורשי צמחים מהאדמה תמיד גורמת נזק לשורשים, מה שגורם לסדרה של תגובות פיזיולוגיות17. בשיטה זו, כמו צמחים מעובדים ללא אדמה, ההפרעה בנזק השורש ניתן לבטל. לסיכום, שיטה זו היא מעשית יותר למחקר מנגנון מולקולרי ורבייה מדויקת. באמצעות פרוטוקול זה, נתונים מתקבלים בדרך כלל בתוך 5 ימים, עם יותר מ 200 צמחים מוערכים בניסוי אחד.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. חומרים
- להשיג זני טבק.
הערה: עבור ניסוי זה "Beinhart1000-1" (מבחר של Beinhart 1000) (BH) ו "Xiaohuangjin1025" (XHJ) התקבלו מן Genbank הלאומי לטווח בינוני של משאב Germplasm טבק של סין. BH עמיד, ואילו XHJ רגיש לזיהום P. nicotianae16. שדה מבודד של P. nicotianae race 0, אשר נשמר במכון לחקר הטבק של האקדמיה הסינית למדעי החקלאות, שימש לכל החיסונים לאורך כל המחקר.
2. שתילת גנוטיפים טבק להערכת התנגדות P. nicotianae
- מערבבים זרעי טבק עם vermiculite ומשדרים את הזרעים בעדינות על אדמת העציץ המעוקרת. מניחים את הסירים בתא הצמיחה. לשמור על טמפרטורה קבועה של 25 °C (60 °F), תחת 16 שעות בהיר / 8 שעות פוטופריוד כהה.
- הכן התקנים הידרופוניים עם מגשים ויריעות קצף. לאחר הזרעים נובטים, דוקרים שתילים מאדמת העציצים, שוטפים את השורשים בעדינות במים סטריליים, ומשתילים אותם במכשירים ההידרופוניים.
- מקם את המכשירים בתאי אקלים ב 25 °C (50 °F) תחת 16 שעות אור / 8 שעות פוטופריוד כהה במשך 24 שעות.
- הכינו מראש את התמיסה התזונתית של הוגלנד (טבלה 1). להשתיל את השתילים למכשירים הידרופוניים עם פתרון מזין Hoagland (כ 125 מ"ל לכל צמח).
- מניחים את המכשירים בתא אקלים בטמפרטורה של 25 מעלות צלזיוס מתחת לפוטופריויד כהה של 16 שעות/8 שעות למשך שבועיים.
3. הכנת השעיית P. nicotianae zoospore
- הכינו מדיום אגר שיבולת שועל.
- שוקלים 33 גרם של שיבולת שועל ומעבירים לכלי זכוכית ומוסיפים 1,000 מ"ל של מים סטריליים. מרתיחים על תנור כיריים אלקטרומגנטי.
- לאחר שיבולת שועל הופך דביק, מסננים את התמיסה הנוזלית דרך חתיכת גזה סטרילית.
- יוצקים את התמיסה הנוזלית לצילינדר מדורג של 1,000 מ"ל ומתאימים את הנפח ל-1,000 מ"ל עם מים סטריליים.
- יוצקים את התמיסה הנוזלית לבקבוק ריאגנט זכוכית ומוסיפים 18 גרם אגר. לנער היטב autoclave את התערובת (שיבולת שועל אגר בינוני) ב 121 °C (50 °F) במשך 15 דקות. השאירו אותו בטמפרטורת החדר למשך 30 דקות.
- יוצקים סביב 20 מ"ל של מדיום אגר שיבולת שועל מעוקר לתוך כל צלחת פטרי. השאירו את מנות הפטרי בטמפרטורת החדר להתקרר ביסודיות לפני טיפוח התפטיר.
- בצעו טיפוח תפטיר.
- הכן אגרופים בקוטר 1 ס"מ וקיסמי שיניים מראש על ידי autoclaving אותם ב 121 °C (121 °C) במשך 15 דקות.
- ניקוב חורים בתרביות אגר תפטיר P. nicotianae כדי להפוך מחצלות תפטיר עגולות.
- בחרו את מחצלות התפטיר, הניחו את הצד התפטיר על מדיום אגר שיבולת השועל, ודגרו את התפטיר ב 25 מעלות צלזיוס בחושך במשך 14 ימים.
- הכן השעיית זוספור P. nicotianae .
- הוסף 0.1% פתרון KNO3 לכל טיפוח תפטיר (15 מ"ל / מנה), ואחריו culturing ב 4 °C (60 °F) במשך 20 דקות כדי לגרום ספורנגיום.
- שמור את הכלים ב 25 °C (50 °F) במשך 25 דקות כדי לשחרר zoospores.
- לאסוף את ההשעיה zoospore בכוס ולמדוד את ריכוז zoospore באמצעות מיקרוסקופ וhemocytometer.
- התאם את ריכוז zoospore ל 1 x 104 zoospores / mL עם מים סטריליים.
4. זיהוי זני טבק עמידים למחלות
- קח את השתילים מן הפתרון התזונתי Hoagland ולחסן אותם על ידי טבילת השורשים ב 20 מ"ל של P. nicotianae zoospore השעיה בצלחת פטרי (90 מ"מ) ב 25 °C (50 °F) עבור 3 שעות בחושך.
- לאחר החיסון, לשים את שתילי הטבק לתוך מנות פטרי חדשות עם 10 מ"ל של מים סטריליים טובלים את השורשים. שמור את השורשים לחים על ידי כיסוי עם שתי חתיכות של נייר סינון. שמור את הכלים ב 25 °C (50 °F) עם 16 שעות בהיר / 8 שעות פוטופריוד כהה.
- לאחר 2-3 ימים, שים לב לחומרת המחלה.
- לטיפול בקרה, לשים את שתילי הטבק ישירות בצלחות פטרי עם מים סטריליים 10 מ"ל טובל את השורשים, ולכסות את השורשים עם שתי חתיכות של נייר סינון.
הערה: בכל טיפול היו שלושה שכפולים, עם 8 צמחים לכל ניסוי.
- לטיפול בקרה, לשים את שתילי הטבק ישירות בצלחות פטרי עם מים סטריליים 10 מ"ל טובל את השורשים, ולכסות את השורשים עם שתי חתיכות של נייר סינון.
5. הערכה של זיהום P. nicotianae
- להעריך את חומרת המחלה 4-5 ימים לאחר החיסון. בהתבסס על התקן הלאומי הסיני18, ציון חומרת מחלות צמחים בודדות בסולם של 0 עד 9 (טבלה 2, איור 1).
- חשב את מדד המחלה באמצעות הנוסחה הבאה18:
מדד מחלות =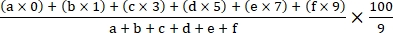
כאשר a, b, c, d, e ו- f הם מספר הצמחים בכל כיתה חומרת מחלה.
הערה: חומרת המחלה חולקה ל-6 כיתות18 (לוח 3).
Access restricted. Please log in or start a trial to view this content.
תוצאות
צמחים בני 4 שבועות של BH מגוון עמיד ומגוון רגיש XHJ אותגרו עם P. nicotianae באמצעות השיטה המוצגת במאמר זה. הניסוי תוכנן עם שלושה שכפולים, כל אחד עם 8 צמחים לכל קבוצה. P. nicotianae זיהום של שני זני הטבק, BH ו- XHJ, מוצג באיור 2. ב 3 ימים לאחר החיסון, עבור XHJ, נגעי גזע כיסו כמחצית מהיקף הגבע...
Access restricted. Please log in or start a trial to view this content.
Discussion
מקורות התנגדות מרובים שימשו כדי לשפר את P. nicotianae עמידות בטבק מעובד. גנים דומיננטיים יחידים R, Php ו- Phl, כבר מופנם מ Nicotiana plumbaginifolia ו Nicotiana longiflora, בהתאמה 10. מגוון טבק הסיגרים Beinhart 1000 יש את הרמה המדווחת הגבוהה ביותר של עמידות כמותית P. nicotianae13. נ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי הקרן הלאומית למדעי הטבע של סין (31571738) והתוכנית לחדשנות במדע וטכנולוגיה חקלאית של סין (ASTIP-TRIC01).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Sinopharm | 10002917 | Analytical Reagent |
| (NH4)6 Mo7O24•2 H2O | Sinopharm | XW131067681 | Analytical Reagent |
| 1.5 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120086 | Used for Sample Extarction |
| 2 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120094 | Used for Sample Extarction |
| Agar | MDBio, Inc | 9002-18-0 | Materials of Culture Medium |
| Analytical Balance | AOHAOSI | AX2202ZH | Equipment |
| Autoclave | Yamatuo | SQ510C | Equipment |
| Autoclave | YAMATUO | SQ510C | Equipment |
| Beaker | Bio Best | DHSB-2L | Materials of Culture Medium |
| Biological Incubator | JINGHONG | SHP-250 | Equipment |
| Ca(NO3)2•4 H2O | Sinopharm | 80029062 | Analytical Reagent |
| CaCl2 | Sinopharm | 10005817 | Analytical Reagent |
| CuSO4•5 H2O | Sinopharm | 10008218 | Analytical Reagent |
| Electromagnetic Oven | Bio Best | DHDCL | Equipment |
| FeSO4•7 H2O | Sinopharm | 10002918 | Analytical Reagent |
| Filter Paper | Bio Best | DHLZ-9CM | Material |
| Fluorescence Ration PCR Instrument | Roche | LightCycler96 | Equipment |
| Gauze | Bio Best | 17071202 | Materials of Culture Medium |
| H3BO3 | Phytotechnology | B210-500G | Analytical Reagent |
| Hemocytometer | Solarbio | 17072801 | Material for disease-resistant identification |
| K2SO4 | Sinopharm | 10017918 | Analytical Reagent |
| KNO3 | Sinopharm | 10017218 | Analytical Reagent |
| KT Foam Sheet | Bio Best | DHKTB | Material for Seedling |
| Low Constant Incubator | Jinghong | SHP-250 | Equipment |
| Measuring Cylinder | Bio Best | DHBLLT-1000ML | Materials of Culture Medium |
| MgSO4•7 H2O | Sinopharm | 10013080 | Analytical Reagent |
| Microscope | ECHO | RVL-100-G | Equipment |
| MnCl2•4 H2O | Sinopharm | G5468154 | Analytical Reagent |
| Na2-EDTA | Sinopharm | G21410-250 | Analytical Reagent |
| NaH2PO4•2 H2O | Sinopharm | 20040717 | Analytical Reagent |
| NH4NO3 | Sinopharm | B64586-100g | Analytical Reagent |
| Oatmeal | Bio Best | DHYMP-1.5KG | Materials of Culture Medium |
| Petri Dish | Bio Best | DHPYM-9CM | Material for disease-resistant identification |
| Pipettor | THERMO | S1 | Equipment |
| Potting | Bio Best | DHYCXHP-12CM | Material for Seedling |
| Potting Soil | Bio Best | DHYMJZ-50L | Seedling Material |
| Punch | Bio Best | DHDKW | Material |
| qRT-PCR Plate | Monad | MQ50401S | qRT-PCR Plate |
| SYBR Green Premix Pro Taq HS qPCR Kit | Accurate Biology | AG11718 | PCR Reagent |
| Toothpick | Bio Best | DHYQ-900 | Material |
| Total RNA Kit II | Omega | R6934-01 | PCR Reagent |
| TransScript® II One-Step gDNA Removal and cDNA Synthesis SuperMix | Transgen | AH311-02 | PCR Reagent |
| Trays | Bio Best | DHYMTP-90G | Material for Seedling |
| Vermiculite | Bio Best | DHZS | Seedling Material |
| Water Purification System | HEAL FORCE | HSE68-2 | Equipment |
| ZnSO4•7 H2O | Sinopharm | 10024018 | Analytical Reagent |
References
- Antonopoulos, D. F., Melton, T., Mila, A. L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco. Plant Disease. 94 (5), 613-620 (2010).
- Taylor, R. J., Pasche, J. S., Gallup, C. A., Shew, H. D., Gudmestad, N. C. A foliar blight and tuber rot of potato caused by Phytophthora nicotianae: New occurrences and characterization of isolates. Plant Disease. 92 (4), 492-503 (2008).
- Amalia, B. R., José, I. M. G., Miguel, D. C. G., Francisco, C. F., Julio, C. T. M. Pathogenicity of plant and soil isolates of Phytophthora parasitica on tomato and pepper. European Journal of Plant Pathology. 148 (3), 607-615 (2017).
- Corrado, C., Annamari, M., Leonardo, S., Antonio, I., Simona, M. S. First report of collar and root rot caused by Phytophthora nicotianae on Lycium barbarum. Journal of Plant Pathology. 100 (2), (2018).
- Meng, Y. L., Zhang, Q., Ding, W., Shan, W. X. Phytophthora parasitica.: a model oomycete plant pathogen. Mycology. 5 (2), 43-51 (2014).
- Biasi, A., Martin, F. N., Cacciola, S. O., Lio, G. M., Grunwald, N. J., Schena, L. Genetic analysis of Phytophthora nicotianae populations from different hosts using microsatellite markers. Phytopathology. 106 (9), 1006-1014 (2016).
- Sullivan, M. J., Melton, T. A., Shew, H. D. Fitness of races 0 and 1 of Phytophthora parasitica var. nicotianae. Plant Disease. 89 (11), 1220-1228 (2005).
- Carlson, S. R., Wolff, M. A. F., Shew, H. D., Wernsman, E. A. Inheritance of resistance to Race 0 of Phytophthora parasitica var. nicotianae from the flue-cured tobacco cultivar Coker 371-Gold. Plant Disease. 81 (11), 1269-1274 (1997).
- Csinos, A. S. Stem and root resistance to tobacco black shank. Plant Disease. 83 (8), 777-780 (1999).
- Johnson, E. S., Wolff, M. F., Wernsman, E. A., Atchley, W. R., Shew, H. D. Origin of the black shank resistance gene, Ph, in tobacco cultivar coker 371-Gold. Plant Disease. 86 (10), 1080-1084 (2002).
- Osmany, C., Ingrid, H., Roxana, P., Yunior, L., Merardo, P., Orlando, B. H. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 177 (3), 175-180 (2009).
- Hernández, I., et al. Black shank resistant tobacco by silencing of glutathione S-transferase. Biochemical and Biophysical Research Communications. 387 (2), 300-304 (2009).
- Vontimitta, V., Lewis, R. S. Growth chamber evaluation of a tobacco 'Beinhart 1000' × 'Hicks' mapping population for quantitative trait loci affecting resistance to multiple races of Phytophthora nicotianae. Crop Science. 52 (1), 91-98 (2012).
- Xiao, B., et al. Location of genomic regions contributing to Phytophthora nicotianae resistance in tobacco cultivar florida 301. Crop Science. 53 (2), 473-481 (2013).
- McCorkle, K., Lewis, R., Shew, D. Resistance to Phytophthora nicotianae in tobacco breeding lines derived from variety Beinhart 1000. Plant Disease. 97 (2), 252-258 (2013).
- Zhang, Y., et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1. The Crop Journal. 6 (3), 282-290 (2018).
- Yu, X., Feng, B., He, P., Shan, L. From chaos to harmony: responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology. 55, 109-137 (2017).
- Ren, G., et al. GB/T 23222 Grade and Investigation Method of Tobacco Diseases and Insect Pests. , China Standard Press. Beijing. (2008).
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19 (11), 11-15 (1987).
- Yan, H. Z., Liou, R. F. Selection of internal control genes for real-time quantitative RT-PCR assays in the oomycete plant pathogen Phytophthora parasitica. Fungal Genetics and Biology. 43, 430-438 (2006).
- Chacón, O., Hernández, I., Portieles, R., López, Y., Pujol, M., Borrás-Hidalgo, O. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 117 (3), 175-180 (2009).
- Vijay, V., Ramsey, S. L. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 29 (1), 89-98 (2012).
- McCorkle, K. L., Drake-Stowe, K., Lewis, R. S., Shew, D. Characterization of Phytophthora nicotianae resistance conferred by the introgressed Nicotiana rustica region, Wz, in flue-cured tobacco. Plant Disease. 102 (2), 309-317 (2018).
- Drake, K. E., Moore, J. M., Bertrand, P., Fortnum, B., Peterson, P., Lewis, R. S. Black shank resistance and agronomic performance of flue-cured tobacco lines and hybrids carrying the introgressed Nicotiana rustica Region. Wz. Crop Science. 55 (1), 79-86 (2015).
- Kebdani, N., Pieuchot, L., Deleury, E., Panabières, F., Berre, J. -Y. L., Gourgues, M. Cellular and molecular characterization of Phytophthora parasitica appressorium-mediated penetration. New Phytologist. 185 (1), 248-257 (2010).
- Huang, G., et al. An RXLR effector secreted by Phytophthora parasitica is a virulence factor and triggers cell death in various plants. Molecular Plant Pathology. 20 (3), 1-16 (2019).
- Agnès, A., Mathieu, G., Nicolas, C. -T., Harald, K. The immediate activation of defense responses in Arabidopsis roots is not sufficient to prevent Phytophthora parasitica infection. New Phytologist. 187 (2), 229(2010).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved