Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dépistage de la résistance à Phytophthora nicotianae des génotypes du tabac
Dans cet article
Résumé
Ici, un protocole est présenté pour le dépistage efficace et précis des génotypes de tabac pour la résistance à Phytophthora nicotianae chez les semis. Il s’agit d’une approche pratique pour la sélection de précision, ainsi que pour la recherche sur les mécanismes moléculaires.
Résumé
Le jarret noir, causé par les oomycètes Phytophthora nicotianae, est destructeur pour le tabac, et cet agent pathogène est hautement pathogène pour de nombreuses cultures solanacées. P. nicotianae est bien adapté aux températures élevées; par conséquent, la recherche sur cet agent pathogène gagne en importance dans l’agriculture du monde entier en raison du réchauffement climatique. Les variétés de plants de tabac résistantes à P. nicotianae sont généralement dépistées par inoculation avec des grains d’avoine colonisés par P. nicotianae et par surveillance des symptômes de la maladie. Cependant, il est difficile de quantifier l’intensité de l’inoculation car une inoculation précise est cruciale dans ce cas. Cette étude visait à développer une méthode efficace et fiable pour évaluer la résistance du tabac à l’infection par P. nicotianae. Cette méthode a été utilisée avec succès pour identifier les variétés résistantes, et l’efficacité de l’inoculation a été confirmée par PCR en temps réel. La méthode d’évaluation de la résistance présentée dans cette étude est efficace et pratique pour la sélection de précision, ainsi que pour la recherche sur les mécanismes moléculaires.
Introduction
P. nicotianae est destructeur pour de nombreuses cultures solanacées. Il peut causer la « jarret noir »1 du tabac, la pourriture foliaire et tuberculeuse de la pomme de terre2, la pourriture de la couronne et de la racine de la tomate et du poivron doux3, ainsi que la pourriture du collier et des racines de Goji4. P. nicotianae peut attaquer toutes les parties des plants de tabac, y compris les racines, les tiges et les feuilles à n’importe quel stade de croissance5. Le symptôme le plus courant de la maladie est la base noire de la tige. Les racines sont d’abord visibles comme imbibées d’eau, puis deviennent nécrotiques, et les feuilles présentent de grandes lésions circulaires5. Cette maladie peut être dévastatrice pour une plante de tabac dans la serre, ainsi que sur le terrain6. La méthode la plus pratique et la plus économique pour lutter contre P. nicotianae est l’utilisation de variétés résistantes7. Cependant, un protocole de dépistage efficace est nécessaire pour l’identification des accessions résistantes à P. nicotianae provenant des collections de matériel génétique du tabac.
Diverses méthodes d’identification ont été décrites pour évaluer la résistance à P. nicotianae dans le tabac7,8,9,10,11,12,13,14,15,16. En général, trois approches principales ont été utilisées pour l’identification des génotypes de tabac résistants à P. nicotianae. La première consiste à mélanger le mycélium avec un milieu agar sur des plaques de Petri contenant P. nicotianae. Les mycéliums sont ensuite cultivés dans l’obscurité à température ambiante pendant 2 semaines. 1 L d’eau désionisée est ajoutée au mycélium et homogénéisée pendant 30 s. L’inoculum est conservé sur la glace jusqu’à ce qu’il soit nécessaire. Deux trous (1 cm de diamètre et 4-5 cm de profondeur) sont faits de chaque côté de la plante, et 10 mL de l’inoculum sont versés dans chaque trou. Les trous sont ensuite remplis avec le sol environnant et le développement de la maladie est surveillé quotidiennement pendant 2 semaines8,10.
Dans la deuxième méthode, les plantes sont inoculées avec des cure-dents infestés d’agents pathogènes. Pour cette approche, les plantes doivent être utilisées environ 6 semaines après le repiquage et doivent avoir une hauteur minimale de 30 cm. Les cure-dents autoclavés sont placés à la surface des cultures contenant P. nicotianae mycelia. Les plats de culture sont ensuite conservés à la lumière à température ambiante pendant 7 jours. Ensuite, des cure-dents colonisés sont utilisés pour inoculer les plantes. Les cure-dents sont insérés dans les tiges de tabac entre les quatrième et cinquième nœuds. Les plantes sont surveillées quotidiennement pendant 5 jours9,15. Cette méthode ne s’applique pas aux petits semis. Comme l’inoculum est infesté de cure-dents infestés d’agents pathogènes, l’intensité de l’inoculation ne peut pas être contrôlée avec précision.
L’approche la plus fréquemment utilisée implique des grains d’avoine pour l’inoculation. Dans ce cas, les grains d’avoine sont préparés par autoclavage 500 mL d’avoine et 300 mL d’eau désionisée à 121 °C pendant 1 h une fois par jour pendant 3 jours. Ensuite, des grains d’avoine sont ajoutés au milieu de culture colonisé par un agent pathogène. Les plats sont scellés avec un film de paraffine et incubés à 25 ° C à la lumière pendant 7 à 12 jours. Quatre trous séparés de 5 cm de profondeur sont faits sur le terreau, à 4 cm de chaque plante, et un grain d’avoine infesté d’agents pathogènes est placé dans chaque trou. La période d’incubation est déterminée en fonction du moment où le premier symptôme en surface se produit7,11,12,13,14,15,16. Cette méthode est efficace et applicable pour le criblage de résistance à grande échelle. Cependant, l’une des limites de cette approche est que l’inoculum est constitué de grains d’avoine infestés d’agents pathogènes, de sorte que l’intensité de l’inoculation ne peut pas être contrôlée avec précision.
Cependant, présenté ici est une méthode plus précise qui est applicable à l’évaluation de la résistance de la chambre de croissance. Par rapport aux autres approches, l’inoculum est en suspension de zoospore, d’où l’intensité de l’inoculation est contrôlable et réglable. Comme les plants de tabac de cette étude sont cultivés sans sol, les résultats sont plus faciles à observer. De plus, l’échantillonnage des racines des plantes dans le sol endommage toujours les racines, ce qui induit une série de réponses physiologiques17. Dans cette méthode, comme les plantes sont cultivées sans sol, l’interférence dans les dommages aux racines peut être éliminée. En conclusion, cette méthode est plus pratique pour la recherche sur les mécanismes moléculaires et la sélection de précision. En utilisant ce protocole, les données sont généralement obtenues dans les 5 jours, avec plus de 200 plantes évaluées en une seule expérience.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Matériaux
- Obtenir des variétés de tabac.
NOTE: Pour cette expérience, « Beinhart1000-1 » (une sélection de Beinhart 1000) (BH) et « Xiaohuangjin1025 » (XHJ) ont été obtenus auprès de la Banque nationale de génétique à moyen terme de la ressource en matériel génétique du tabac de Chine. Bh est résistant, tandis que XHJ est sensible à l’infection à P. nicotianae16. Un isolat de champ de P. nicotianae race 0, qui a été conservé à l’Institut de recherche sur le tabac de l’Académie chinoise des sciences agricoles, a été utilisé pour toutes les inoculations tout au long de l’étude.
2. Plantation de génotypes de tabac pour l’évaluation de la résistance à P. nicotianae
- Mélanger les graines de tabac avec de la vermiculite et diffuser doucement les graines sur le terreau stérilisé. Placez les pots dans la chambre de croissance. Maintenir une température constante de 25 °C, sous une photopériode de 16 h de lumière/8 h d’obscurité.
- Préparez des appareils hydroponiques avec des plateaux et des feuilles de mousse. Une fois les graines germées, piquez les semis du terreau, lavez doucement les racines avec de l’eau désionisée stérile et transplantez-les dans les appareils hydroponiques.
- Placer les appareils dans des chambres climatiques à 25 °C sous une photopériode de 16 h de lumière/8 h d’obscurité pendant 24 h.
- Préparer la solution nutritive Hoagland à l’avance (tableau 1). Transplantez les semis dans des dispositifs hydroponiques avec une solution nutritive Hoagland (environ 125 mL par plante).
- Placez les appareils dans une chambre climatique à 25 °C sous une photopériode de 16 h de lumière/8 h d’obscurité pendant 2 semaines.
3. Préparation de la suspension de P. nicotianae zoospore
- Préparer le milieu de la gélose à l’avoine.
- Peser 33 g de flocons d’avoine et transférer dans la verrerie et ajouter 1 000 mL d’eau stérile. Faire bouillir sur une cuisinière électromagnétique.
- Une fois que la farine d’avoine devient collante, filtrer la solution liquide à travers un morceau de gaze stérile.
- Versez la solution liquide dans un cylindre gradué de 1 000 mL et réglez le volume à 1 000 mL avec de l’eau stérile.
- Versez la solution liquide dans un flacon de réactif en verre et ajoutez 18 g de gélose. Bien agiter et autoclaver le mélange (milieu de gélose à l’avoine) à 121 °C pendant 15 min. Laissez-le à température ambiante pendant 30 min.
- Versez environ 20 ml du milieu de gélose à l’avoine stérilisé dans chaque boîte de Pétri. Laissez les boîtes de Petri à température ambiante refroidir soigneusement avant la culture mycélienne.
- Effectuer la culture mycélienne.
- Préparez au préalable les poinçons et les cure-dents de 1 cm de diamètre en les autoclavant à 121 °C pendant 15 min.
- Percer des trous dans les cultures d’agar mycélienne P. nicotianae pour faire des tapis mycéliens ronds.
- Choisissez les tapis mycéliens, placez le côté mycélien vers le bas sur le milieu de la gélose à l’avoine et incubez le mycélium à 25 ° C dans l’obscurité pendant 14 jours.
- Préparer la suspension de P. nicotianae zoospore.
- Ajouter une solution de KNO3 à 0,1 % à chaque culture mycélienne (15 mL/plat), puis cultiver à 4 °C pendant 20 min pour induire le sporange.
- Conserver les plats à 25 °C pendant 25 min pour libérer les zoospores.
- Recueillir la suspension de zoospore dans un bécher et mesurer la concentration de zoospore à l’aide d’un microscope et d’un hémocytomètre.
- Ajuster la concentration de zoospores à 1 x 104 zoospores/mL avec de l’eau stérile.
4. Identification des variétés de tabac résistantes aux maladies
- Prenez les semis de la solution nutritive Hoagland et inoculez-les en immergeant les racines dans 20 mL de suspension zoospore de P. nicotianae dans une boîte de Pétri (90 mm) à 25 °C pendant 3 h dans l’obscurité.
- Après l’inoculation, mettez les plants de tabac dans de nouvelles boîtes de Pétri avec 10 mL d’eau stérile immergeant les racines. Gardez les racines humides en les recouvrant de deux morceaux de papier filtre. Conserver la vaisselle à 25 °C avec une photopériode de 16 h de lumière/8 h d’obscurité.
- Après 2-3 jours, observez la gravité de la maladie.
- Pour le traitement de contrôle, placez les plants de tabac directement dans les boîtes de Pétri avec 10 ml d’eau stérile immergeant les racines et recouvrez les racines de deux morceaux de papier filtre.
NOTE: Chaque traitement avait trois réplications, avec 8 plantes par expérience.
- Pour le traitement de contrôle, placez les plants de tabac directement dans les boîtes de Pétri avec 10 ml d’eau stérile immergeant les racines et recouvrez les racines de deux morceaux de papier filtre.
5. Évaluation de l’infection à P. nicotianae
- Évaluez la gravité de la maladie 4 à 5 jours après l’inoculation. Sur la base de la norme nationale chinoise18, évaluer la gravité de chaque maladie des plantes sur une échelle de 0 à 9 (tableau 2, figure 1).
- Calculez l’indice de maladie à l’aide de la formule suivante18 :
Indice de maladie =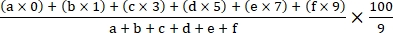
où a, b, c, d, e et f sont le nombre de plantes dans chaque grade de gravité de la maladie.
REMARQUE : La gravité de la maladie a été divisée en 6 grades18 (tableau 3).
Access restricted. Please log in or start a trial to view this content.
Résultats
Les plantes âgées de 4 semaines de la variété résistante BH et de la variété sensible XHJ ont été confrontées à P. nicotianae en utilisant la méthode présentée dans cet article. L’expérience a été conçue avec trois répliques, chacune avec 8 plantes par groupe. L’infection à P. nicotianae des deux variétés de tabac, BH et XHJ, est présentée à la figure 2. 3 jours après l’inoculation, pour XHJ, les lésions de la tige couvraient environ la moi...
Access restricted. Please log in or start a trial to view this content.
Discussion
De multiples sources de résistance ont été utilisées pour améliorer la résistance à P. nicotianae dans le tabac cultivé. Les gènes R dominants uniques, Php et Phl, ont été introduits à partir de Nicotiana plumbaginifolia et Nicotiana longiflora, respectivement10. La variété de tabac à cigares Beinhart 1000 a le plus haut niveau de résistance quantitative signalé à P. nicotianae13. De multiples expérien...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par la Fondation nationale des sciences naturelles de Chine (31571738) et le Programme d’innovation en sciences et technologies agricoles de Chine (ASTIP-TRIC01).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Sinopharm | 10002917 | Analytical Reagent |
| (NH4)6 Mo7O24•2 H2O | Sinopharm | XW131067681 | Analytical Reagent |
| 1.5 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120086 | Used for Sample Extarction |
| 2 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120094 | Used for Sample Extarction |
| Agar | MDBio, Inc | 9002-18-0 | Materials of Culture Medium |
| Analytical Balance | AOHAOSI | AX2202ZH | Equipment |
| Autoclave | Yamatuo | SQ510C | Equipment |
| Autoclave | YAMATUO | SQ510C | Equipment |
| Beaker | Bio Best | DHSB-2L | Materials of Culture Medium |
| Biological Incubator | JINGHONG | SHP-250 | Equipment |
| Ca(NO3)2•4 H2O | Sinopharm | 80029062 | Analytical Reagent |
| CaCl2 | Sinopharm | 10005817 | Analytical Reagent |
| CuSO4•5 H2O | Sinopharm | 10008218 | Analytical Reagent |
| Electromagnetic Oven | Bio Best | DHDCL | Equipment |
| FeSO4•7 H2O | Sinopharm | 10002918 | Analytical Reagent |
| Filter Paper | Bio Best | DHLZ-9CM | Material |
| Fluorescence Ration PCR Instrument | Roche | LightCycler96 | Equipment |
| Gauze | Bio Best | 17071202 | Materials of Culture Medium |
| H3BO3 | Phytotechnology | B210-500G | Analytical Reagent |
| Hemocytometer | Solarbio | 17072801 | Material for disease-resistant identification |
| K2SO4 | Sinopharm | 10017918 | Analytical Reagent |
| KNO3 | Sinopharm | 10017218 | Analytical Reagent |
| KT Foam Sheet | Bio Best | DHKTB | Material for Seedling |
| Low Constant Incubator | Jinghong | SHP-250 | Equipment |
| Measuring Cylinder | Bio Best | DHBLLT-1000ML | Materials of Culture Medium |
| MgSO4•7 H2O | Sinopharm | 10013080 | Analytical Reagent |
| Microscope | ECHO | RVL-100-G | Equipment |
| MnCl2•4 H2O | Sinopharm | G5468154 | Analytical Reagent |
| Na2-EDTA | Sinopharm | G21410-250 | Analytical Reagent |
| NaH2PO4•2 H2O | Sinopharm | 20040717 | Analytical Reagent |
| NH4NO3 | Sinopharm | B64586-100g | Analytical Reagent |
| Oatmeal | Bio Best | DHYMP-1.5KG | Materials of Culture Medium |
| Petri Dish | Bio Best | DHPYM-9CM | Material for disease-resistant identification |
| Pipettor | THERMO | S1 | Equipment |
| Potting | Bio Best | DHYCXHP-12CM | Material for Seedling |
| Potting Soil | Bio Best | DHYMJZ-50L | Seedling Material |
| Punch | Bio Best | DHDKW | Material |
| qRT-PCR Plate | Monad | MQ50401S | qRT-PCR Plate |
| SYBR Green Premix Pro Taq HS qPCR Kit | Accurate Biology | AG11718 | PCR Reagent |
| Toothpick | Bio Best | DHYQ-900 | Material |
| Total RNA Kit II | Omega | R6934-01 | PCR Reagent |
| TransScript® II One-Step gDNA Removal and cDNA Synthesis SuperMix | Transgen | AH311-02 | PCR Reagent |
| Trays | Bio Best | DHYMTP-90G | Material for Seedling |
| Vermiculite | Bio Best | DHZS | Seedling Material |
| Water Purification System | HEAL FORCE | HSE68-2 | Equipment |
| ZnSO4•7 H2O | Sinopharm | 10024018 | Analytical Reagent |
Références
- Antonopoulos, D. F., Melton, T., Mila, A. L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco. Plant Disease. 94 (5), 613-620 (2010).
- Taylor, R. J., Pasche, J. S., Gallup, C. A., Shew, H. D., Gudmestad, N. C. A foliar blight and tuber rot of potato caused by Phytophthora nicotianae: New occurrences and characterization of isolates. Plant Disease. 92 (4), 492-503 (2008).
- Amalia, B. R., José, I. M. G., Miguel, D. C. G., Francisco, C. F., Julio, C. T. M. Pathogenicity of plant and soil isolates of Phytophthora parasitica on tomato and pepper. European Journal of Plant Pathology. 148 (3), 607-615 (2017).
- Corrado, C., Annamari, M., Leonardo, S., Antonio, I., Simona, M. S. First report of collar and root rot caused by Phytophthora nicotianae on Lycium barbarum. Journal of Plant Pathology. 100 (2), (2018).
- Meng, Y. L., Zhang, Q., Ding, W., Shan, W. X. Phytophthora parasitica.: a model oomycete plant pathogen. Mycology. 5 (2), 43-51 (2014).
- Biasi, A., Martin, F. N., Cacciola, S. O., Lio, G. M., Grunwald, N. J., Schena, L. Genetic analysis of Phytophthora nicotianae populations from different hosts using microsatellite markers. Phytopathology. 106 (9), 1006-1014 (2016).
- Sullivan, M. J., Melton, T. A., Shew, H. D. Fitness of races 0 and 1 of Phytophthora parasitica var. nicotianae. Plant Disease. 89 (11), 1220-1228 (2005).
- Carlson, S. R., Wolff, M. A. F., Shew, H. D., Wernsman, E. A. Inheritance of resistance to Race 0 of Phytophthora parasitica var. nicotianae from the flue-cured tobacco cultivar Coker 371-Gold. Plant Disease. 81 (11), 1269-1274 (1997).
- Csinos, A. S. Stem and root resistance to tobacco black shank. Plant Disease. 83 (8), 777-780 (1999).
- Johnson, E. S., Wolff, M. F., Wernsman, E. A., Atchley, W. R., Shew, H. D. Origin of the black shank resistance gene, Ph, in tobacco cultivar coker 371-Gold. Plant Disease. 86 (10), 1080-1084 (2002).
- Osmany, C., Ingrid, H., Roxana, P., Yunior, L., Merardo, P., Orlando, B. H. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 177 (3), 175-180 (2009).
- Hernández, I., et al. Black shank resistant tobacco by silencing of glutathione S-transferase. Biochemical and Biophysical Research Communications. 387 (2), 300-304 (2009).
- Vontimitta, V., Lewis, R. S. Growth chamber evaluation of a tobacco 'Beinhart 1000' × 'Hicks' mapping population for quantitative trait loci affecting resistance to multiple races of Phytophthora nicotianae. Crop Science. 52 (1), 91-98 (2012).
- Xiao, B., et al. Location of genomic regions contributing to Phytophthora nicotianae resistance in tobacco cultivar florida 301. Crop Science. 53 (2), 473-481 (2013).
- McCorkle, K., Lewis, R., Shew, D. Resistance to Phytophthora nicotianae in tobacco breeding lines derived from variety Beinhart 1000. Plant Disease. 97 (2), 252-258 (2013).
- Zhang, Y., et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1. The Crop Journal. 6 (3), 282-290 (2018).
- Yu, X., Feng, B., He, P., Shan, L. From chaos to harmony: responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology. 55, 109-137 (2017).
- Ren, G., et al. GB/T 23222 Grade and Investigation Method of Tobacco Diseases and Insect Pests. , China Standard Press. Beijing. (2008).
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19 (11), 11-15 (1987).
- Yan, H. Z., Liou, R. F. Selection of internal control genes for real-time quantitative RT-PCR assays in the oomycete plant pathogen Phytophthora parasitica. Fungal Genetics and Biology. 43, 430-438 (2006).
- Chacón, O., Hernández, I., Portieles, R., López, Y., Pujol, M., Borrás-Hidalgo, O. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 117 (3), 175-180 (2009).
- Vijay, V., Ramsey, S. L. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 29 (1), 89-98 (2012).
- McCorkle, K. L., Drake-Stowe, K., Lewis, R. S., Shew, D. Characterization of Phytophthora nicotianae resistance conferred by the introgressed Nicotiana rustica region, Wz, in flue-cured tobacco. Plant Disease. 102 (2), 309-317 (2018).
- Drake, K. E., Moore, J. M., Bertrand, P., Fortnum, B., Peterson, P., Lewis, R. S. Black shank resistance and agronomic performance of flue-cured tobacco lines and hybrids carrying the introgressed Nicotiana rustica Region. Wz. Crop Science. 55 (1), 79-86 (2015).
- Kebdani, N., Pieuchot, L., Deleury, E., Panabières, F., Berre, J. -Y. L., Gourgues, M. Cellular and molecular characterization of Phytophthora parasitica appressorium-mediated penetration. New Phytologist. 185 (1), 248-257 (2010).
- Huang, G., et al. An RXLR effector secreted by Phytophthora parasitica is a virulence factor and triggers cell death in various plants. Molecular Plant Pathology. 20 (3), 1-16 (2019).
- Agnès, A., Mathieu, G., Nicolas, C. -T., Harald, K. The immediate activation of defense responses in Arabidopsis roots is not sufficient to prevent Phytophthora parasitica infection. New Phytologist. 187 (2), 229(2010).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon