È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Screening dei genotipi del tabacco per la resistenza a Phytophthora nicotianae
In questo articolo
Riepilogo
Qui viene presentato un protocollo per lo screening efficiente e accurato dei genotipi del tabacco per la resistenza a Phytophthora nicotianae nelle piantine . Questo è un approccio pratico per l'allevamento di precisione, così come la ricerca sui meccanismi molecolari.
Abstract
Il gambo nero, causato dall'oomiceti Phytophthora nicotianae, è distruttivo per il tabacco e questo agente patogeno è altamente patogeno per molte colture solanacee. P. nicotianae è ben adattato alle alte temperature; pertanto, la ricerca su questo agente patogeno sta guadagnando importanza in agricoltura in tutto il mondo a causa del riscaldamento globale. Le varietà di piante di tabacco resistenti a P. nicotianae sono comunemente sottoposte a screening mediante inoculazione con chicchi d'avena colonizzati da P. nicotianae e monitoraggio dei sintomi della malattia. Tuttavia, è difficile quantificare l'intensità dell'inoculazione poiché l'inoculazione accurata è cruciale in questo caso. Questo studio mirava a sviluppare un metodo efficiente e affidabile per valutare la resistenza del tabacco all'infezione da P. nicotianae. Questo metodo è stato utilizzato con successo per identificare varietà resistenti e l'efficienza dell'inoculazione è stata confermata dalla PCR in tempo reale. Il metodo di valutazione della resistenza presentato in questo studio è efficiente e pratico per l'allevamento di precisione, così come la ricerca sui meccanismi molecolari.
Introduzione
P. nicotianae è distruttivo per molte colture solanacee. Può causare tabacco "gambo nero"1, marciume fogliare e tubero di patate2, corona di pomodoro e peperone dolce e marciume radicale3 e colletto e marciume radicale di Goji4. P. nicotianae può attaccare tutte le parti delle piante di tabacco, comprese le radici, i gambi e le foglie in qualsiasi fase di crescita5. Il sintomo più comune della malattia è la base nera del gambo. Le radici sono inizialmente visibili come imbevute d'acqua e poi diventano necrotiche, e le foglie mostrano grandi lesioni circolari5. Questa malattia può essere devastante per una pianta di tabacco in serra, così come sul campo6. Il metodo più pratico ed economico per controllare P. nicotianae è l'uso di varietà resistenti7. Tuttavia, è necessario un protocollo di screening efficace per l'identificazione delle accessioni resistenti a P. nicotianae dalle collezioni di germoplasma del tabacco.
Sono stati descritti vari metodi di identificazione per valutare la resistenza a P. nicotianae nel tabacco7,8,9,10,11,12,13,14,15,16. In generale, sono stati utilizzati tre approcci principali per l'identificazione dei genotipi del tabacco resistenti a P. nicotianae. Il primo include la miscelazione di miceli con mezzo agar su piastre di Petri contenenti P. nicotianae. I miceli vengono poi coltivati al buio a temperatura ambiente per 2 settimane. 1 L di acqua deionizzata viene aggiunta ai miceli e omogeneizzata per 30 s. L'inoculo viene tenuto sul ghiaccio fino a quando non è necessario. Due fori (1 cm di diametro e 4-5 cm di profondità) sono fatti su ciascun lato della pianta, e 10 ml di inoculo vengono versati in ogni foro. I fori vengono quindi riempiti con il terreno circostante e lo sviluppo della malattia viene monitorato quotidianamente per 2 settimane8,10.
Nel secondo metodo, le piante vengono inoculate con stuzzicadenti infestati da agenti patogeni. Per questo approccio, le piante dovrebbero essere utilizzate circa 6 settimane dopo il trapianto e dovrebbero avere un'altezza minima di 30 cm. Gli stuzzicadenti autoclavati sono posti sulla superficie di colture contenenti miceli di P. nicotianae. I piatti di coltura vengono quindi conservati sotto la luce a temperatura ambiente per 7 giorni. Quindi, gli stuzzicadenti colonizzati vengono utilizzati per inoculare le piante. Gli stuzzicadenti vengono inseriti nei gambi del tabacco tra il quarto e il quinto nodo. Le piante sono monitorate quotidianamente per 5 giorni9,15. Questo metodo non è applicabile per piantine di piccole dimensioni. Poiché l'inoculo è costituito da stuzzicadenti infestati da agenti patogeni, l'intensità dell'inoculazione non può essere controllata con precisione.
L'approccio più frequentemente utilizzato coinvolge i chicchi d'avena per l'inoculazione. In questo caso, i chicchi d'avena vengono preparati in autoclave 500 mL di avena e 300 mL di acqua deionizzata a 121 °C per 1 ora una volta al giorno per 3 giorni. Quindi, i chicchi d'avena vengono aggiunti al terreno di coltura colonizzato dall'agente patogeno. Le piastre sono sigillate con film di paraffina e incubate a 25 °C alla luce per 7-12 giorni. Quattro fori separati profondi 5 cm sono fattisull'terriccio, 4 cm da ogni pianta, e un chicco d'avena infestato da agenti patogeni viene posto in ogni foro. Il periodo di incubazione è determinato in base a quando si verifica il primo sintomo fuori terra7,11,12,13,14,15,16. Questo metodo è efficiente e applicabile per lo screening della resistenza su larga scala. Tuttavia, una limitazione di questo approccio è che l'inoculo è costituito da chicchi d'avena infestati da agenti patogeni, quindi l'intensità dell'inoculazione non può essere controllata con precisione.
Tuttavia, qui è presentato un metodo più accurato applicabile alla valutazione della resistenza della camera di crescita. Rispetto agli altri approcci, l'inoculo è in sospensione di zoospore, quindi l'intensità dell'inoculazione è controllabile e regolabile. Poiché le piante di tabacco in questo studio sono coltivate senza terra, i risultati sono più facili da osservare. Inoltre, il campionamento delle radici delle piante dal terreno provoca sempre danni alle radici, il che induce una serie di risposte fisiologiche17. In questo metodo, poiché le piante vengono coltivate senza suolo, l'interferenza nel danno alle radici può essere eliminata. In conclusione, questo metodo è più pratico per la ricerca sui meccanismi molecolari e l'allevamento di precisione. Utilizzando questo protocollo, i dati vengono in genere ottenuti entro 5 giorni, con più di 200 piante valutate in un singolo esperimento.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Materiali
- Ottenere varietà di tabacco.
NOTA: Per questo esperimento "Beinhart1000-1" (una selezione di Beinhart 1000) (BH) e "Xiaohuangjin1025" (XHJ) sono stati ottenuti dalla National Medium-term Genbank of the Tobacco Germplasm Resource of China. BH è resistente, mentre XHJ è suscettibile all'infezione da P. nicotianae16. Un isolato di campo di P. nicotianae razza 0, che è stato conservato nell'Istituto di ricerca sul tabacco dell'Accademia cinese delle scienze agrarie, è stato utilizzato per tutte le vaccinazioni durante lo studio.
2. Piantare genotipi di tabacco per la valutazione della resistenza a P. nicotianae
- Mescolare i semi di tabacco con la vermiculite e trasmettere delicatamente i semi sul terriccio sterilizzato. Posiziona i vasi nella camera di crescita. Mantenere una temperatura costante di 25 °C, sotto un fotoperiodo scuro di 16 ore di luce/8 ore.
- Preparare dispositivi idroponici con vassoi e fogli di schiuma. Dopo che i semi germinano, pungere le piantine dal terriccio, lavare delicatamente le radici con acqua deionizzata sterile e trapiantarle nei dispositivi idroponici.
- Posizionare i dispositivi in camere climatiche a 25 °C sotto un fotoperiodo luminoso di 16 ore/8 ore di buio per 24 ore.
- Preparare in anticipo la soluzione nutritiva di Hoagland (Tabella 1). Trapiantare le piantine in dispositivi idroponici con soluzione nutritiva Hoagland (circa 125 ml per pianta).
- Posizionare i dispositivi in una camera climatica a 25 °C sotto un fotoperiodo scuro di 16 ore di luce/8 ore per 2 settimane.
3. Preparazione della sospensione di zoospore di P. nicotianae
- Preparare il mezzo di agar di farina d'avena.
- Pesare 33 g di farina d'avena e trasferirla in bicchieri e aggiungere 1.000 ml di acqua sterile. Far bollire su un forno elettromagnetico.
- Dopo che la farina d'avena diventa appiccicosa, filtrare la soluzione liquida attraverso un pezzo di garza sterile.
- Versare la soluzione liquida in un cilindro graduato da 1.000 ml e regolare il volume a 1.000 ml con acqua sterile.
- Versare la soluzione liquida in un flacone di reagente di vetro e aggiungere 18 g di agar. Agitare bene e autoclavare la miscela (agar medio di farina d'avena) a 121 °C per 15 min. Lasciare a temperatura ambiente per 30 min.
- Versare circa 20 ml di agar di farina d'avena sterilizzata in ogni capsula di Petri. Lasciare raffreddare accuratamente le piastre di Petri a temperatura ambiente prima della coltivazione miceliale.
- Effettuare la coltivazione miceliale.
- Preparare preventivamente punzoni e stuzzicadenti di 1 cm di diametro autoclavandoli a 121 °C per 15 min.
- Forare i fori nelle colture di agar miceliale di P. nicotianae per realizzare stuoie miceliali rotonde.
- Scegli le stuoie miceliali, posiziona il lato miceliale verso il basso sul mezzo di agar di farina d'avena e incuba il micelio a 25 ° C al buio per 14 giorni.
- Preparare la sospensione di zoospore di P. nicotianae .
- Aggiungere una soluzione di KNO3 allo 0,1% ad ogni coltivazione miceliale (15 ml/piatto), seguita da coltivazione a 4 °C per 20 minuti per indurre lo sporangio.
- Conservare i piatti a 25 °C per 25 minuti per rilasciare zoospore.
- Raccogliere la sospensione di zoospore in un becher e misurare la concentrazione di zoospore utilizzando un microscopio ed emocitometro.
- Regolare la concentrazione di zoospore a 1 x 104 zoospore/mL con acqua sterile.
4. Identificazione delle varietà di tabacco resistenti alle malattie
- Prelevare le piantine dalla soluzione nutritiva di Hoagland e inocularle immergendo le radici in 20 mL di sospensione di zoospore di P. nicotianae in una capsula di Petri (90 mm) a 25 °C per 3 ore al buio.
- Dopo l'inoculazione, mettere le piantine di tabacco in nuove piastre di Petri con 10 ml di acqua sterile immergendo le radici. Mantenere le radici umide coprendo con due pezzi di carta da filtro. Mantenere i piatti a 25 °C con un fotoperiodo luminoso di 16 ore/8 ore di buio.
- Dopo 2-3 giorni, osservare la gravità della malattia.
- Per il trattamento di controllo, mettere le piantine di tabacco direttamente nelle piastre di Petri con 10 ml di acqua sterile immergendo le radici e coprire le radici con due pezzi di carta da filtro.
NOTA: Ogni trattamento ha avuto tre repliche, con 8 piante per esperimento.
- Per il trattamento di controllo, mettere le piantine di tabacco direttamente nelle piastre di Petri con 10 ml di acqua sterile immergendo le radici e coprire le radici con due pezzi di carta da filtro.
5. Valutazione dell'infezione da P. nicotianae
- Valutare la gravità della malattia 4-5 giorni dopo l'inoculazione. Sulla base dello standard nazionale cinese18, valutare la gravità della malattia individuale delle piante su una scala da 0 a 9 (Tabella 2, Figura 1).
- Calcola l'indice di malattia usando la seguente formula18:
Indice di malattia =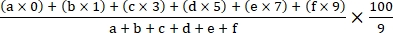
dove a, b, c, d, e e f sono il numero di piante in ciascun grado di gravità della malattia.
NOTA: La gravità della malattia è stata suddivisa in 6 gradi18 (Tabella 3).
Access restricted. Please log in or start a trial to view this content.
Risultati
Le piante di 4 settimane della varietà resistente BH e della varietà sensibile XHJ sono state sfidate con P. nicotianae utilizzando il metodo presentato in questo articolo. L'esperimento è stato progettato con tre repliche, ciascuna con 8 piante per gruppo. L'infezione da P. nicotianae delle due varietà di tabacco, BH e XHJ, è presentata nella Figura 2. A 3 giorni dopo l'inoculazione, per XHJ, le lesioni dello stelo coprivano circa la metà della circonferenza dello s...
Access restricted. Please log in or start a trial to view this content.
Discussione
Molteplici fonti di resistenza sono state utilizzate per migliorare la resistenza di P. nicotianae nel tabacco coltivato. Singoli geni R dominanti, Php e Phl, sono stati introgrediti da Nicotiana plumbaginifolia e Nicotiana longiflora, rispettivamente10. La varietà di tabacco da sigaro Beinhart 1000 ha il più alto livello riportato di resistenza quantitativa a P. nicotianae13. Molteplici esperimenti di mappatura degli ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata dalla National Natural Science Foundation of China (31571738) e dall'Agricultural Science and Technology Innovation Program of China (ASTIP-TRIC01).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Sinopharm | 10002917 | Analytical Reagent |
| (NH4)6 Mo7O24•2 H2O | Sinopharm | XW131067681 | Analytical Reagent |
| 1.5 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120086 | Used for Sample Extarction |
| 2 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120094 | Used for Sample Extarction |
| Agar | MDBio, Inc | 9002-18-0 | Materials of Culture Medium |
| Analytical Balance | AOHAOSI | AX2202ZH | Equipment |
| Autoclave | Yamatuo | SQ510C | Equipment |
| Autoclave | YAMATUO | SQ510C | Equipment |
| Beaker | Bio Best | DHSB-2L | Materials of Culture Medium |
| Biological Incubator | JINGHONG | SHP-250 | Equipment |
| Ca(NO3)2•4 H2O | Sinopharm | 80029062 | Analytical Reagent |
| CaCl2 | Sinopharm | 10005817 | Analytical Reagent |
| CuSO4•5 H2O | Sinopharm | 10008218 | Analytical Reagent |
| Electromagnetic Oven | Bio Best | DHDCL | Equipment |
| FeSO4•7 H2O | Sinopharm | 10002918 | Analytical Reagent |
| Filter Paper | Bio Best | DHLZ-9CM | Material |
| Fluorescence Ration PCR Instrument | Roche | LightCycler96 | Equipment |
| Gauze | Bio Best | 17071202 | Materials of Culture Medium |
| H3BO3 | Phytotechnology | B210-500G | Analytical Reagent |
| Hemocytometer | Solarbio | 17072801 | Material for disease-resistant identification |
| K2SO4 | Sinopharm | 10017918 | Analytical Reagent |
| KNO3 | Sinopharm | 10017218 | Analytical Reagent |
| KT Foam Sheet | Bio Best | DHKTB | Material for Seedling |
| Low Constant Incubator | Jinghong | SHP-250 | Equipment |
| Measuring Cylinder | Bio Best | DHBLLT-1000ML | Materials of Culture Medium |
| MgSO4•7 H2O | Sinopharm | 10013080 | Analytical Reagent |
| Microscope | ECHO | RVL-100-G | Equipment |
| MnCl2•4 H2O | Sinopharm | G5468154 | Analytical Reagent |
| Na2-EDTA | Sinopharm | G21410-250 | Analytical Reagent |
| NaH2PO4•2 H2O | Sinopharm | 20040717 | Analytical Reagent |
| NH4NO3 | Sinopharm | B64586-100g | Analytical Reagent |
| Oatmeal | Bio Best | DHYMP-1.5KG | Materials of Culture Medium |
| Petri Dish | Bio Best | DHPYM-9CM | Material for disease-resistant identification |
| Pipettor | THERMO | S1 | Equipment |
| Potting | Bio Best | DHYCXHP-12CM | Material for Seedling |
| Potting Soil | Bio Best | DHYMJZ-50L | Seedling Material |
| Punch | Bio Best | DHDKW | Material |
| qRT-PCR Plate | Monad | MQ50401S | qRT-PCR Plate |
| SYBR Green Premix Pro Taq HS qPCR Kit | Accurate Biology | AG11718 | PCR Reagent |
| Toothpick | Bio Best | DHYQ-900 | Material |
| Total RNA Kit II | Omega | R6934-01 | PCR Reagent |
| TransScript® II One-Step gDNA Removal and cDNA Synthesis SuperMix | Transgen | AH311-02 | PCR Reagent |
| Trays | Bio Best | DHYMTP-90G | Material for Seedling |
| Vermiculite | Bio Best | DHZS | Seedling Material |
| Water Purification System | HEAL FORCE | HSE68-2 | Equipment |
| ZnSO4•7 H2O | Sinopharm | 10024018 | Analytical Reagent |
Riferimenti
- Antonopoulos, D. F., Melton, T., Mila, A. L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco. Plant Disease. 94 (5), 613-620 (2010).
- Taylor, R. J., Pasche, J. S., Gallup, C. A., Shew, H. D., Gudmestad, N. C. A foliar blight and tuber rot of potato caused by Phytophthora nicotianae: New occurrences and characterization of isolates. Plant Disease. 92 (4), 492-503 (2008).
- Amalia, B. R., José, I. M. G., Miguel, D. C. G., Francisco, C. F., Julio, C. T. M. Pathogenicity of plant and soil isolates of Phytophthora parasitica on tomato and pepper. European Journal of Plant Pathology. 148 (3), 607-615 (2017).
- Corrado, C., Annamari, M., Leonardo, S., Antonio, I., Simona, M. S. First report of collar and root rot caused by Phytophthora nicotianae on Lycium barbarum. Journal of Plant Pathology. 100 (2), (2018).
- Meng, Y. L., Zhang, Q., Ding, W., Shan, W. X. Phytophthora parasitica.: a model oomycete plant pathogen. Mycology. 5 (2), 43-51 (2014).
- Biasi, A., Martin, F. N., Cacciola, S. O., Lio, G. M., Grunwald, N. J., Schena, L. Genetic analysis of Phytophthora nicotianae populations from different hosts using microsatellite markers. Phytopathology. 106 (9), 1006-1014 (2016).
- Sullivan, M. J., Melton, T. A., Shew, H. D. Fitness of races 0 and 1 of Phytophthora parasitica var. nicotianae. Plant Disease. 89 (11), 1220-1228 (2005).
- Carlson, S. R., Wolff, M. A. F., Shew, H. D., Wernsman, E. A. Inheritance of resistance to Race 0 of Phytophthora parasitica var. nicotianae from the flue-cured tobacco cultivar Coker 371-Gold. Plant Disease. 81 (11), 1269-1274 (1997).
- Csinos, A. S. Stem and root resistance to tobacco black shank. Plant Disease. 83 (8), 777-780 (1999).
- Johnson, E. S., Wolff, M. F., Wernsman, E. A., Atchley, W. R., Shew, H. D. Origin of the black shank resistance gene, Ph, in tobacco cultivar coker 371-Gold. Plant Disease. 86 (10), 1080-1084 (2002).
- Osmany, C., Ingrid, H., Roxana, P., Yunior, L., Merardo, P., Orlando, B. H. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 177 (3), 175-180 (2009).
- Hernández, I., et al. Black shank resistant tobacco by silencing of glutathione S-transferase. Biochemical and Biophysical Research Communications. 387 (2), 300-304 (2009).
- Vontimitta, V., Lewis, R. S. Growth chamber evaluation of a tobacco 'Beinhart 1000' × 'Hicks' mapping population for quantitative trait loci affecting resistance to multiple races of Phytophthora nicotianae. Crop Science. 52 (1), 91-98 (2012).
- Xiao, B., et al. Location of genomic regions contributing to Phytophthora nicotianae resistance in tobacco cultivar florida 301. Crop Science. 53 (2), 473-481 (2013).
- McCorkle, K., Lewis, R., Shew, D. Resistance to Phytophthora nicotianae in tobacco breeding lines derived from variety Beinhart 1000. Plant Disease. 97 (2), 252-258 (2013).
- Zhang, Y., et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1. The Crop Journal. 6 (3), 282-290 (2018).
- Yu, X., Feng, B., He, P., Shan, L. From chaos to harmony: responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology. 55, 109-137 (2017).
- Ren, G., et al. GB/T 23222 Grade and Investigation Method of Tobacco Diseases and Insect Pests. , China Standard Press. Beijing. (2008).
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19 (11), 11-15 (1987).
- Yan, H. Z., Liou, R. F. Selection of internal control genes for real-time quantitative RT-PCR assays in the oomycete plant pathogen Phytophthora parasitica. Fungal Genetics and Biology. 43, 430-438 (2006).
- Chacón, O., Hernández, I., Portieles, R., López, Y., Pujol, M., Borrás-Hidalgo, O. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 117 (3), 175-180 (2009).
- Vijay, V., Ramsey, S. L. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 29 (1), 89-98 (2012).
- McCorkle, K. L., Drake-Stowe, K., Lewis, R. S., Shew, D. Characterization of Phytophthora nicotianae resistance conferred by the introgressed Nicotiana rustica region, Wz, in flue-cured tobacco. Plant Disease. 102 (2), 309-317 (2018).
- Drake, K. E., Moore, J. M., Bertrand, P., Fortnum, B., Peterson, P., Lewis, R. S. Black shank resistance and agronomic performance of flue-cured tobacco lines and hybrids carrying the introgressed Nicotiana rustica Region. Wz. Crop Science. 55 (1), 79-86 (2015).
- Kebdani, N., Pieuchot, L., Deleury, E., Panabières, F., Berre, J. -Y. L., Gourgues, M. Cellular and molecular characterization of Phytophthora parasitica appressorium-mediated penetration. New Phytologist. 185 (1), 248-257 (2010).
- Huang, G., et al. An RXLR effector secreted by Phytophthora parasitica is a virulence factor and triggers cell death in various plants. Molecular Plant Pathology. 20 (3), 1-16 (2019).
- Agnès, A., Mathieu, G., Nicolas, C. -T., Harald, K. The immediate activation of defense responses in Arabidopsis roots is not sufficient to prevent Phytophthora parasitica infection. New Phytologist. 187 (2), 229(2010).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon