É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Triagem de Genótipos de Tabaco para Resistência de Phytophthora nicotianae
Neste Artigo
Resumo
Aqui, é apresentado um protocolo para a triagem eficiente e precisa dos genótipos do tabaco para resistência à Phytophthora nicotianae em mudas. Trata-se de uma abordagem prática para a reprodução de precisão, bem como para a pesquisa de mecanismos moleculares.
Resumo
A haste preta, causada pelos oomycetes Phytophthora nicotianae, é destrutiva para o tabaco, e este patógeno é altamente patogênico para muitas culturas solanáceos. P. nicotianae é bem adaptado a altas temperaturas; portanto, a pesquisa sobre esse patógeno está ganhando importância na agricultura mundial por causa do aquecimento global. As variedades resistentes à p. nicotianae de plantas de tabaco são comumente rastreadas pela inoculação com grãos de aveia colonizados por P. nicotianae e monitoramento dos sintomas da doença. No entanto, é difícil quantificar a intensidade da inoculação, uma vez que a inoculação precisa é crucial neste caso. Este estudo teve como objetivo desenvolver um método eficiente e confiável para avaliar a resistência do tabaco à infecção com P. nicotianae. Este método tem sido usado com sucesso para identificar variedades resistentes, e a eficiência da inoculação foi confirmada por PCR em tempo real. O método de avaliação de resistência apresentado neste estudo é eficiente e prático para a reprodução de precisão, bem como para a pesquisa de mecanismos moleculares.
Introdução
P. nicotianae é destrutivo para muitas culturas solanáceas. Pode causar tabaco "pernil preto"1, batata foliar e tuber rot2, tomate e pimenta doce coroa e raiz rot3, e goji colar e raiz rot4. P. nicotianae pode atacar todas as partes das plantas de tabaco, incluindo as raízes, caules e folhas em qualquer estágio de crescimento5. O sintoma mais comum da doença é a base negra do talo. As raízes são inicialmente visíveis como encharcadas de água e depois tornam-se necrosadas, e as folhas apresentam grandes lesões circulares5. Essa doença pode ser devastadora para uma planta de tabaco na estufa, bem como no campo6. O método mais prático e econômico para controlar p. nicotianae é o uso de variedades resistentes7. No entanto, é necessário um protocolo de triagem eficaz para a identificação de adesões resistentes à P. nicotianae a partir de coleções de germoplasma de tabaco.
Vários métodos de identificação foram descritos para avaliar a resistência à P. nicotianae no tabaco7,8,9,10,11,12,13,14,15,16. Em geral, três abordagens importantes têm sido utilizadas para a identificação de genótipos de tabaco resistentes à P. nicotianae. O primeiro inclui a mistura de micélia com meio de ágar em placas de Petri contendo P. nicotianae. As micélias são então cultivadas no escuro à temperatura ambiente por 2 semanas. 1 L de água deionizada é adicionado à micélia e homogeneizado para 30 s. O inóculo é mantido no gelo até que seja necessário. Dois orifícios (1 cm de diâmetro e 4-5 cm de profundidade) são feitos em cada lado da planta, e 10 mL do inóculo são derramados em cada orifício. Os buracos são então preenchidos com o solo circundante, e o desenvolvimento de doenças é monitorado diariamente por 2 semanas8,10.
No segundo método, as plantas são inoculadas com palitos infestados de patógenos. Para esta abordagem, as plantas devem ser utilizadas aproximadamente 6 semanas após o transplante e devem ter uma altura mínima de 30 cm. Palitos de dente autoclavados são colocados na superfície de culturas que contêm P. nicotianae mycelia. Os pratos de cultura são então armazenados sob a luz à temperatura ambiente por 7 dias. Então, palitos colonizados são usados para vacinar as plantas. Palitos de dente são inseridos nas hastes de tabaco entre o quarto e o quinto nós. As plantas são monitoradas diariamente durante 5 dias9,15. Este método não é aplicável para pequenas mudas. Como o inóculo é um palito infestado de patógenos, a intensidade da inoculação não pode ser precisamente controlada.
A abordagem mais utilizada envolve grãos de aveia para inoculação. Neste caso, os grãos de aveia são preparados por autoclaving 500 mL de aveia e 300 mL de água deionizada a 121 °C por 1h uma vez por dia durante 3 dias. Em seguida, os grãos de aveia são adicionados ao meio de cultura colonizada por patógenos. Os pratos são selados com filme de parafina e incubados a 25 °C em luz por 7-12 dias. Quatro buracos de 5 cm de profundidade separados são feitos no solo de vasos, 4 cm de cada planta, e um grão de aveia infestado de patógenos é colocado em cada orifício. O período de incubação é determinado com base em quando o primeiro sintoma acima do solo ocorre7,11,12,13,14,15,16. Este método é eficiente e aplicável para a triagem de resistência em larga escala. No entanto, uma limitação dessa abordagem é que o inóculo é de grãos de aveia infestados de patógenos, portanto a intensidade da inoculação não pode ser precisamente controlada.
No entanto, aqui apresentado é um método mais preciso que é aplicável à avaliação da resistência da câmara de crescimento. Em comparação com as outras abordagens, o inóculo é a suspensão do zoospore, portanto a intensidade da inoculação é controlável e ajustável. Como as plantas de tabaco neste estudo são cultivadas sem solo, os resultados são mais fáceis de observar. Além disso, a amostragem das raízes vegetais do solo sempre causa danos às raízes, o que induz uma série de respostas fisiológicas17. Neste método, como as plantas são cultivadas sem solo, a interferência no dano radicular pode ser eliminada. Em conclusão, este método é mais prático para pesquisa de mecanismos moleculares e criação de precisão. Usando este protocolo, os dados são normalmente obtidos dentro de 5 dias, com mais de 200 plantas avaliadas em um único experimento.
Protocolo
1. Materiais
- Obter variedades de tabaco.
NOTA: Para este experimento "Beinhart1000-1" (uma seleção de Beinhart 1000) (BH) e "Xiaohuangjin1025" (XHJ) foram obtidos do Genbank Nacional de Médio Prazo do Recurso de Germplasma do Tabaco da China. BH é resistente, enquanto XHJ é suscetível à infecção por P. nicotianae16. Um isolamento de campo da P. nicotianae race 0, que foi preservada no Instituto de Pesquisa do Tabaco da Academia Chinesa de Ciências Agrícolas, foi usado para todas as vacinas ao longo do estudo.
2. Plantio de genótipos de tabaco para avaliação de resistência p. nicotianae
- Misture as sementes de tabaco com vermiculite e transmita as sementes suavemente no solo esterilizado. Coloque os potes na câmara de crescimento. Mantenha uma temperatura constante de 25 °C, sob um fotoperíodo escuro de 16 h/8 h.
- Prepare dispositivos hidropônicos com bandejas e folhas de espuma. Após as sementes germinarem, pique as mudas do solo de vaso, lave as raízes suavemente com água deionizada estéril e transplante-as nos dispositivos hidropônicos.
- Coloque os dispositivos em câmaras climáticas a 25 °C sob um fotoperíodo escuro de 16 h/8 h por 24 h.
- Prepare a solução de nutrientes Hoagland com antecedência (Tabela 1). Transplante das mudas para dispositivos hidropônicos com solução de nutrientes Hoagland (aproximadamente 125 mL por planta).
- Coloque os dispositivos em uma câmara climática a 25 °C sob um fotoperíodo escuro de 16 h/8h por 2 semanas.
3. Preparação da suspensão do zoológico de P. nicotianae
- Prepare o ágar médio de aveia.
- Pesar 33 g de aveia e transferir para vidros e adicionar 1.000 mL de água estéril. Ferva em um forno de fogão eletromagnético.
- Depois que a aveia ficar pegajosa, coe a solução líquida através de um pedaço de gaze estéril.
- Despeje a solução líquida em um cilindro graduado de 1.000 mL e ajuste o volume para 1.000 mL com água estéril.
- Despeje a solução líquida em uma garrafa de reagente de vidro e adicione 18 g de ágar. Agite bem e autoclave a mistura (meio de áteis de aveia) a 121 °C por 15 min. Deixe em temperatura ambiente por 30 minutos.
- Despeje cerca de 20 mL do meio de ágar de aveia esterilizado em cada placa de Petri. Deixe as placas de Petri à temperatura ambiente para esfriar bem antes do cultivo micelial.
- Realize o cultivo de micélio.
- Prepare socos de 1 cm de diâmetro e palitos de dente de antemão, autoclavando-os a 121 °Cfor 15 min.
- Furos nas culturas mycelial mycelial P. nicotianae para fazer tapetes miceliais redondos.
- Escolha os tapetes de micrúbio, coloque o lado mycelial no meio de ágar de aveia e incuba o micélio a 25 °C no escuro por 14 dias.
- Prepare a suspensão do zoológico de P. nicotianae .
- Adicione 0,1% de solução KNO3 a cada cultivo micelial (15 mL/prato), seguido de cultivo a 4 °C por 20 min para induzir esporangium.
- Mantenha os pratos a 25 °C por 25 minutos para liberar zoospores.
- Colete a suspensão do zoospore em um béquer e meça a concentração de zoospore usando um microscópio ehemocímetro.
- Ajuste a concentração de zoospore para 1 x 104 zoospores/mL com água estéril.
4. Identificação de variedades de tabaco resistentes a doenças
- Pegue as mudas da solução de nutrientes Hoagland e inocula-as imergindo as raízes em 20 mL de suspensão zoospora P. nicotianae em uma placa de Petri (90 mm) a 25 °C por 3 h no escuro.
- Após a inoculação, coloque as mudas de tabaco em novas placas de Petri com 10 mL de água estéril imergindo as raízes. Mantenha as raízes úmidas cobrindo com dois pedaços de papel filtro. Mantenha os pratos a 25 °C com um fotoperíodo escuro de 16h/8 h.
- Após 2-3 dias, observe a gravidade da doença.
- Para o tratamento de controle, coloque as mudas de tabaco diretamente nas placas de Petri com água estéril de 10 mL imergindo as raízes, e cubra as raízes com dois pedaços de papel filtro.
NOTA: Cada tratamento teve três replicações, sendo 8 plantas por experimento.
- Para o tratamento de controle, coloque as mudas de tabaco diretamente nas placas de Petri com água estéril de 10 mL imergindo as raízes, e cubra as raízes com dois pedaços de papel filtro.
5. Avaliação da infecção por P. nicotianae
- Avalie a gravidade da doença de 4 a 5 dias após a inoculação. Com base no padrão nacional chinês18, escore a gravidade da doença vegetal individual em uma escala de 0 a 9 (Tabela 2, Figura 1).
- Calcule o índice da doença usando a seguinte fórmula18:
Índice da doença =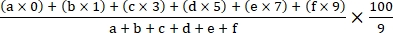
onde a, b, c, d, e, e e e f são o número de plantas em cada grau de gravidade da doença.
NOTA: A gravidade da doença foi dividida em 6 séries18 (Tabela 3).
Resultados
Plantas de 4 semanas de idade da variedade resistente BH e variedade suscetível XHJ foram desafiadas com P. nicotianae utilizando o método apresentado neste artigo. O experimento foi projetado com três réplicas, cada uma com 8 plantas por grupo. A infecção por P. nicotianae das duas variedades de tabaco, BH e XHJ, é apresentada na Figura 2. Aos 3 dias após a inoculação, para XHJ, as lesões do caule cobriram aproximadamente metade da cintura do caule, e metade da...
Discussão
Múltiplas fontes de resistência têm sido usadas para melhorar a resistência à P. nicotianae no tabaco cultivado. Os genes R dominantes únicos, Php e Phl, foram introgressados de Nicotiana plumbaginifolia e Nicotiana longiflora, respectivamente10. A variedade de tabaco de charuto Beinhart 1000 tem o maior nível de resistência quantitativa relatado a P. nicotianae13. Experimentos de mapeamento de intervalo múltipl...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi financiada pela Fundação Nacional de Ciência Natural da China (31571738) e pelo Programa de Inovação em Ciência e Tecnologia Agrícola da China (ASTIP-TRIC01).
Materiais
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Sinopharm | 10002917 | Analytical Reagent |
| (NH4)6 Mo7O24•2 H2O | Sinopharm | XW131067681 | Analytical Reagent |
| 1.5 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120086 | Used for Sample Extarction |
| 2 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120094 | Used for Sample Extarction |
| Agar | MDBio, Inc | 9002-18-0 | Materials of Culture Medium |
| Analytical Balance | AOHAOSI | AX2202ZH | Equipment |
| Autoclave | Yamatuo | SQ510C | Equipment |
| Autoclave | YAMATUO | SQ510C | Equipment |
| Beaker | Bio Best | DHSB-2L | Materials of Culture Medium |
| Biological Incubator | JINGHONG | SHP-250 | Equipment |
| Ca(NO3)2•4 H2O | Sinopharm | 80029062 | Analytical Reagent |
| CaCl2 | Sinopharm | 10005817 | Analytical Reagent |
| CuSO4•5 H2O | Sinopharm | 10008218 | Analytical Reagent |
| Electromagnetic Oven | Bio Best | DHDCL | Equipment |
| FeSO4•7 H2O | Sinopharm | 10002918 | Analytical Reagent |
| Filter Paper | Bio Best | DHLZ-9CM | Material |
| Fluorescence Ration PCR Instrument | Roche | LightCycler96 | Equipment |
| Gauze | Bio Best | 17071202 | Materials of Culture Medium |
| H3BO3 | Phytotechnology | B210-500G | Analytical Reagent |
| Hemocytometer | Solarbio | 17072801 | Material for disease-resistant identification |
| K2SO4 | Sinopharm | 10017918 | Analytical Reagent |
| KNO3 | Sinopharm | 10017218 | Analytical Reagent |
| KT Foam Sheet | Bio Best | DHKTB | Material for Seedling |
| Low Constant Incubator | Jinghong | SHP-250 | Equipment |
| Measuring Cylinder | Bio Best | DHBLLT-1000ML | Materials of Culture Medium |
| MgSO4•7 H2O | Sinopharm | 10013080 | Analytical Reagent |
| Microscope | ECHO | RVL-100-G | Equipment |
| MnCl2•4 H2O | Sinopharm | G5468154 | Analytical Reagent |
| Na2-EDTA | Sinopharm | G21410-250 | Analytical Reagent |
| NaH2PO4•2 H2O | Sinopharm | 20040717 | Analytical Reagent |
| NH4NO3 | Sinopharm | B64586-100g | Analytical Reagent |
| Oatmeal | Bio Best | DHYMP-1.5KG | Materials of Culture Medium |
| Petri Dish | Bio Best | DHPYM-9CM | Material for disease-resistant identification |
| Pipettor | THERMO | S1 | Equipment |
| Potting | Bio Best | DHYCXHP-12CM | Material for Seedling |
| Potting Soil | Bio Best | DHYMJZ-50L | Seedling Material |
| Punch | Bio Best | DHDKW | Material |
| qRT-PCR Plate | Monad | MQ50401S | qRT-PCR Plate |
| SYBR Green Premix Pro Taq HS qPCR Kit | Accurate Biology | AG11718 | PCR Reagent |
| Toothpick | Bio Best | DHYQ-900 | Material |
| Total RNA Kit II | Omega | R6934-01 | PCR Reagent |
| TransScript® II One-Step gDNA Removal and cDNA Synthesis SuperMix | Transgen | AH311-02 | PCR Reagent |
| Trays | Bio Best | DHYMTP-90G | Material for Seedling |
| Vermiculite | Bio Best | DHZS | Seedling Material |
| Water Purification System | HEAL FORCE | HSE68-2 | Equipment |
| ZnSO4•7 H2O | Sinopharm | 10024018 | Analytical Reagent |
Referências
- Antonopoulos, D. F., Melton, T., Mila, A. L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco. Plant Disease. 94 (5), 613-620 (2010).
- Taylor, R. J., Pasche, J. S., Gallup, C. A., Shew, H. D., Gudmestad, N. C. A foliar blight and tuber rot of potato caused by Phytophthora nicotianae: New occurrences and characterization of isolates. Plant Disease. 92 (4), 492-503 (2008).
- Amalia, B. R., José, I. M. G., Miguel, D. C. G., Francisco, C. F., Julio, C. T. M. Pathogenicity of plant and soil isolates of Phytophthora parasitica on tomato and pepper. European Journal of Plant Pathology. 148 (3), 607-615 (2017).
- Corrado, C., Annamari, M., Leonardo, S., Antonio, I., Simona, M. S. First report of collar and root rot caused by Phytophthora nicotianae on Lycium barbarum. Journal of Plant Pathology. 100 (2), (2018).
- Meng, Y. L., Zhang, Q., Ding, W., Shan, W. X. Phytophthora parasitica.: a model oomycete plant pathogen. Mycology. 5 (2), 43-51 (2014).
- Biasi, A., Martin, F. N., Cacciola, S. O., Lio, G. M., Grunwald, N. J., Schena, L. Genetic analysis of Phytophthora nicotianae populations from different hosts using microsatellite markers. Phytopathology. 106 (9), 1006-1014 (2016).
- Sullivan, M. J., Melton, T. A., Shew, H. D. Fitness of races 0 and 1 of Phytophthora parasitica var. nicotianae. Plant Disease. 89 (11), 1220-1228 (2005).
- Carlson, S. R., Wolff, M. A. F., Shew, H. D., Wernsman, E. A. Inheritance of resistance to Race 0 of Phytophthora parasitica var. nicotianae from the flue-cured tobacco cultivar Coker 371-Gold. Plant Disease. 81 (11), 1269-1274 (1997).
- Csinos, A. S. Stem and root resistance to tobacco black shank. Plant Disease. 83 (8), 777-780 (1999).
- Johnson, E. S., Wolff, M. F., Wernsman, E. A., Atchley, W. R., Shew, H. D. Origin of the black shank resistance gene, Ph, in tobacco cultivar coker 371-Gold. Plant Disease. 86 (10), 1080-1084 (2002).
- Osmany, C., Ingrid, H., Roxana, P., Yunior, L., Merardo, P., Orlando, B. H. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 177 (3), 175-180 (2009).
- Hernández, I., et al. Black shank resistant tobacco by silencing of glutathione S-transferase. Biochemical and Biophysical Research Communications. 387 (2), 300-304 (2009).
- Vontimitta, V., Lewis, R. S. Growth chamber evaluation of a tobacco 'Beinhart 1000' × 'Hicks' mapping population for quantitative trait loci affecting resistance to multiple races of Phytophthora nicotianae. Crop Science. 52 (1), 91-98 (2012).
- Xiao, B., et al. Location of genomic regions contributing to Phytophthora nicotianae resistance in tobacco cultivar florida 301. Crop Science. 53 (2), 473-481 (2013).
- McCorkle, K., Lewis, R., Shew, D. Resistance to Phytophthora nicotianae in tobacco breeding lines derived from variety Beinhart 1000. Plant Disease. 97 (2), 252-258 (2013).
- Zhang, Y., et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1. The Crop Journal. 6 (3), 282-290 (2018).
- Yu, X., Feng, B., He, P., Shan, L. From chaos to harmony: responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology. 55, 109-137 (2017).
- Ren, G., et al. . GB/T 23222 Grade and Investigation Method of Tobacco Diseases and Insect Pests. , (2008).
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19 (11), 11-15 (1987).
- Yan, H. Z., Liou, R. F. Selection of internal control genes for real-time quantitative RT-PCR assays in the oomycete plant pathogen Phytophthora parasitica. Fungal Genetics and Biology. 43, 430-438 (2006).
- Chacón, O., Hernández, I., Portieles, R., López, Y., Pujol, M., Borrás-Hidalgo, O. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 117 (3), 175-180 (2009).
- Vijay, V., Ramsey, S. L. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 29 (1), 89-98 (2012).
- McCorkle, K. L., Drake-Stowe, K., Lewis, R. S., Shew, D. Characterization of Phytophthora nicotianae resistance conferred by the introgressed Nicotiana rustica region, Wz, in flue-cured tobacco. Plant Disease. 102 (2), 309-317 (2018).
- Drake, K. E., Moore, J. M., Bertrand, P., Fortnum, B., Peterson, P., Lewis, R. S. Black shank resistance and agronomic performance of flue-cured tobacco lines and hybrids carrying the introgressed Nicotiana rustica Region. Wz. Crop Science. 55 (1), 79-86 (2015).
- Kebdani, N., Pieuchot, L., Deleury, E., Panabières, F., Berre, J. -. Y. L., Gourgues, M. Cellular and molecular characterization of Phytophthora parasitica appressorium-mediated penetration. New Phytologist. 185 (1), 248-257 (2010).
- Huang, G., et al. An RXLR effector secreted by Phytophthora parasitica is a virulence factor and triggers cell death in various plants. Molecular Plant Pathology. 20 (3), 1-16 (2019).
- Agnès, A., Mathieu, G., Nicolas, C. -. T., Harald, K. The immediate activation of defense responses in Arabidopsis roots is not sufficient to prevent Phytophthora parasitica infection. New Phytologist. 187 (2), 229 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados