JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Phytophthora nicotianae 저항성에 대한 담배 유전자형의 스크리닝
요약
여기에서, 묘목에서 Phytophthora nicotianae 저항성에 대한 담배 유전자형의 효율적이고 정확한 스크리닝을위한 프로토콜이 제시됩니다. 이것은 분자 메커니즘 연구뿐만 아니라 정밀 번식을위한 실용적인 접근 방식입니다.
초록
oomycetes Phytophthora nicotianae에 의해 야기 된 검은 생크는 담배에 파괴적이며,이 병원균은 많은 solanaceous 작물에 매우 병원성이 있습니다. P. nicotianae는 고온에 잘 적응합니다. 따라서이 병원균에 대한 연구는 지구 온난화로 인해 전 세계 농업에서 중요성이 커지고 있습니다. P. nicotianae 내성 품종의 담배 식물은 일반적으로 P. nicotianae에 의해 식민지화 된 귀리 곡물로 접종하고 질병 증상을 모니터링함으로써 선별됩니다. 그러나, 이 경우 정확한 접종이 중요하기 때문에 접종 강도를 정량화하는 것은 어렵다. 이 연구는 P. nicotianae 감염에 대한 담배의 내성을 평가하기위한 효율적이고 신뢰할 수있는 방법을 개발하는 것을 목표로했습니다. 이 방법은 내성 품종을 식별하는 데 성공적으로 사용되었으며, 접종 효율은 실시간 PCR로 확인되었습니다. 이 연구에서 제시된 저항 평가 방법은 분자 메커니즘 연구뿐만 아니라 정밀 육종에 효율적이고 실용적입니다.
서문
P. nicotianae는 많은 solanaceous 작물에 파괴적입니다. 그것은 담배 "검은 생크"1, 감자 잎과 괴경 썩음2, 토마토와 달콤한 고추 크라운과 뿌리 rot3, Goji 칼라와 뿌리 썩음4을 일으킬 수 있습니다. P. nicotianae는 성장하는 단계에서 뿌리, 줄기 및 잎을 포함하여 담배 식물의 모든 부분을 공격 할 수 있습니다5. 이 질병의 가장 흔한 증상은 줄기의 검은 색 기저부입니다. 뿌리는 처음에는 물에 젖은 다음 괴사가되어 잎이 큰 원형 병변을 보입니다5. 이 질병은 온실과 현장의 담배 공장에 치명적일 수 있습니다6. P. nicotianae 를 통제하는 가장 실용적이고 경제적 인 방법은 내성 품종의 사용입니다7. 그러나, 담배 생식 플라스마 수집물로부터의 P. nicotianae-resistant accessions의 확인을 위해 효과적인 스크리닝 프로토콜이 요구된다.
담배 7,8,9,10,11,12,13,14,15,16에서 P. nicotianae 내성을 평가하기 위해 다양한 동정 방법이 기술되었다. 일반적으로, P. nicotianae-resistant 담배 유전자형의 동정을 위해 세 가지 주요 접근법이 사용되었다. 첫 번째는 P. nicotianae를 함유 한 Petri 플레이트에 균사체와 한천 배지를 혼합하는 것을 포함합니다. 균사체는 실온에서 어둠 속에서 2 주 동안 재배됩니다. 1 L의 탈이온수를 균사체에 첨가하고 30 초 동안 균질화시킨다. 접종물은 필요할 때까지 얼음 위에 보관됩니다. 식물의 양쪽에 두 개의 구멍 (직경 1cm, 깊이 4-5cm)이 만들어지고 접종물 10mL를 각 구멍에 붓습니다. 그런 다음 구멍이 주변 토양으로 채워지고 질병 발생은 2 주 동안 매일 모니터링됩니다8,10.
두 번째 방법에서, 식물은 병원균에 감염된 이쑤시개로 접종됩니다. 이 접근법을 위해 식물은 이식 후 약 6 주 후에 사용되어야하며 최소 높이는 30cm이어야합니다. 오토클레이브 된 이쑤시개는 P. nicotianae mycelia를 함유 한 문화의 표면에 배치됩니다. 그런 다음 배양 접시를 실온에서 7 일 동안 빛 아래에 보관합니다. 그런 다음 식민지화 된 이쑤시개를 사용하여 식물을 접종합니다. 이쑤시개는 네 번째와 다섯 번째 노드 사이의 담배 줄기에 삽입됩니다. 식물은 5 일 동안 매일 모니터링됩니다.9,15. 이 방법은 작은 묘목에는 적용되지 않습니다. 접종액은 병원균에 감염된 이쑤시개이기 때문에 접종 강도를 정확하게 제어 할 수 없습니다.
가장 자주 사용되는 접근법은 접종을 위해 귀리 곡물을 포함합니다. 이 경우, 귀리 곡물은 귀리 500 mL와 탈이온수 300 mL를 121 °C에서 3 일 동안 1 일 동안 1 시간 동안 오토 클레이빙하여 제조한다. 이어서, 귀리 곡물은 병원체-콜로니화된 배양 배지에 첨가된다. 접시를 파라핀 필름으로 밀봉하고 7-12일 동안 광에서 25°C에서 인큐베이션한다. 포팅 토양에 4cm, 각 식물에서 4cm의 4cm 깊이의 구멍이 만들어지고 병원균에 감염된 귀리 곡물 하나가 각 구멍에 배치됩니다. 잠복기는 제1 지상 증상이 언제 발생했는지에 기초하여 결정된다7,11,12,13,14,15,16. 이 방법은 효율적이고 대규모 저항 스크리닝에 적용 할 수 있습니다. 그러나이 접근법의 한 가지 한계는 접종물이 병원균에 감염된 귀리 곡물이므로 접종 강도를 정확하게 제어 할 수 없다는 것입니다.
그러나, 여기에 제시된 것은 성장 챔버 저항 평가에 적용 가능한 보다 정확한 방법이다. 다른 접근법과 비교하여, 접종물은 동물원 포자 현탁액이며, 따라서 접종 강도는 조절가능하고 조절가능하다. 이 연구에서 담배 식물은 토양없이 재배되기 때문에 결과를 관찰하기가 더 쉽습니다. 또한, 토양에서 식물 뿌리를 샘플링하면 항상 뿌리에 손상을 입히고 일련의 생리적 반응을 유도합니다17. 이 방법에서는 식물이 토양없이 재배되기 때문에 뿌리 손상에 대한 간섭을 제거 할 수 있습니다. 결론적으로,이 방법은 분자 메커니즘 연구 및 정밀 육종에 더 실용적입니다. 이 프로토콜을 사용하여 데이터는 일반적으로 5 일 이내에 얻어지며 단일 실험에서 200 개 이상의 식물이 평가됩니다.
프로토콜
1. 재료
- 담배 품종을 얻으십시오.
참고 :이 실험을 위해 "Beinhart1000-1"(Beinhart 1000의 선택) (BH) 및 "Xiaohuangjin1025"(XHJ)는 중국의 담배 생식 플라스마 자원의 국립 중기 Genbank로부터 얻어졌습니다. BH는 내성이 있는 반면, XHJ는 P. 니코티아 나 감염에 취약하다16. 중국 농업 과학 아카데미의 담배 연구소에서 보존 된 P. nicotianae race 0의 현장 격리가 연구 전반에 걸쳐 모든 예방 접종에 사용되었습니다.
2. P. nicotianae 저항성 평가를 위한 담배 유전자형 심기
- 담배 씨앗을 질석과 섞어서 살균 된 화분 토양에 부드럽게 씨앗을 방송하십시오. 냄비를 성장 챔버에 넣으십시오. 16 h 빛/8 h 어두운 광주기 하에서 25 °C의 일정한 온도를 유지하십시오.
- 트레이와 폼 시트가있는 수경 재배 장치를 준비하십시오. 씨앗이 발아 한 후, 화분 토양에서 묘목을 찌르고, 멸균 된 탈 이온수로 뿌리를 부드럽게 씻어 수경 장치에 이식하십시오.
- 장치를 25 °C의 기후 챔버에 16 시간 빛 / 8 시간 어두운 광주기 하에서 24 시간 동안 두십시오.
- Hoagland 영양액을 미리 준비하십시오 (표 1). 묘목을 Hoagland 영양 용액 (식물 당 약 125 mL)으로 수경 장치에 이식하십시오.
- 장치를 2주 동안 16 h 빛/8 h 어두운 광주기 하에 25°C의 기후 챔버에 놓으십시오.
3. P. nicotianae 동물원 포자 현탁액의 제조
- 오트밀 한천 배지를 준비하십시오.
- 오트밀 33g의 무게를 측정하여 유리 그릇으로 옮기고 멸균수 1,000 mL를 첨가하십시오. 전자기 스토브 탑 오븐에서 끓입니다.
- 오트밀이 끈적 거리면 멸균 거즈 조각을 통해 액체 용액을 변형시킵니다.
- 액체 용액을 1,000 mL 눈금 실린더에 붓고 멸균수로 부피를 1,000 mL로 조정한다.
- 액체 용액을 유리 시약 병에 붓고 한천 18g을 넣으십시오. 잘 흔들어 혼합물을 오토클레이브(오트밀 한천 배지)를 121°C에서 15분 동안 오토클레이브한다. 실온에서 30 분 동안 그대로 두십시오.
- 멸균된 오트밀 한천 배지 약 20mL를 각 페트리 접시에 붓습니다. 균사 재배 전에 페트리 접시를 실온에서 완전히 식히십시오.
- 균사 재배를 수행하십시오.
- 직경 1cm 펀치와 이쑤시개를 121°C에서 15분 동안 오토클레이빙하여 미리 준비합니다.
- P. nicotianae 균사 한천 문화에 구멍을 뚫어 둥근 균사 매트를 만듭니다.
- 균사체 매트를 골라내고, 균사체 쪽을 오트밀 한천 배지 위에 내려놓고, 균사체를 어둠 속에서 25°C에서 14일 동안 인큐베이션한다.
- P. nicotianae 동물원 포자 현탁액을 준비하십시오.
- 각 균사 배양물(15 mL/dish)에 0.1% KNO3 용액을 첨가하고, 4°C에서 20분 동안 배양하여 포란슘을 유도하였다.
- 동물원 포자를 방출하기 위해 접시를 25 ° C에서 25 분 동안 유지하십시오.
- 비이커에서 동물원 포자 현탁액을 수집하고 현미경 및 혈구측정기를 사용하여 동물원 포자 농도를 측정한다.
- 멸균수로 동물원 포자 농도를 1 x 104 동물원 포자 / mL로 조정하십시오.
4. 질병에 강한 담배 품종의 확인
- Hoagland 영양 용액으로부터 묘목을 취하고, 암흑에서 3 h 동안 25°C에서 페트리 접시(90 mm)에 P. nicotianae zoospore 현탁액 20 mL에 뿌리를 침지하여 접종한다.
- 예방 접종 후, 담배 묘목을 뿌리에 담그는 멸균수 10mL로 새로운 페트리 접시에 넣으십시오. 두 장의 여과지로 덮어서 뿌리를 촉촉하게 유지하십시오. 접시를 25 ° C에서 16 시간 빛 / 8 시간 어두운 광주기로 유지하십시오.
- 2-3 일 후에 질병의 중증도를 관찰하십시오.
- 제어 처리를 위해 담배 묘목을 10 mL의 멸균 수로 페트리 접시에 직접 넣고 뿌리를 두 장의 여과지로 덮으십시오.
참고 : 각 처리에는 세 번의 복제가 있었으며 실험 당 8 개의 식물이 있습니다.
- 제어 처리를 위해 담배 묘목을 10 mL의 멸균 수로 페트리 접시에 직접 넣고 뿌리를 두 장의 여과지로 덮으십시오.
5. P. 니코티아네 감염의 평가
- 접종 4-5 일 후에 질병 중증도를 평가하십시오. 중국 국가 표준18에 기초하여, 0에서 9까지의 척도로 개별 식물 질환 중증도를 점수화한다(표 2, 그림 1).
- 다음 수식 18을 사용하여 질병 지수를 계산합니다.
질병 지수 =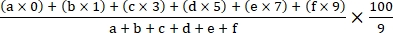
여기서 a, b, c, d, e 및 f는 각 질병 중증도 등급의 식물 수입니다.
주: 질병 중증도는 6 등급18 로 나뉘어졌다(표 3).
결과
내성 품종 BH 및 감수성 품종 XHJ의 4주령 식물은 본 기사에서 제시된 방법을 사용하여 P. nicotianae 로 도전하였다. 실험은 세 번의 반복실험으로 설계되었으며, 각각 그룹당 8개의 식물이 있었다. P. 두 담배 품종, BH 및 XHJ의 니코티아나 감염은 도 2에 제시되어 있다. 접종 후 3 일 후, XHJ의 경우, 줄기 병변은 줄기 둘레의 약 절반을 덮었고 잎의 절반은 약간 시들게되...
토론
재배 담배에서 P. nicotianae 저항성을 향상시키기 위해 여러 저항 소스가 사용되었습니다. 단일 지배적 인 R 유전자 인 Php와 Phl은 각각 Nicotiana plumbaginifolia와 Nicotiana longiflora에서 내성을 보였습니다10. 시가 담배 품종 Beinhart 1000은 P. nicotianae13에 대한 양적 저항성의 가장 높은 수준을보고했습니다. 다중 간격 매핑 실험은 적어...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (31571738)과 중국의 농업 과학 기술 혁신 프로그램 (ASTIP-TRIC01)이 자금을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Sinopharm | 10002917 | Analytical Reagent |
| (NH4)6 Mo7O24•2 H2O | Sinopharm | XW131067681 | Analytical Reagent |
| 1.5 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120086 | Used for Sample Extarction |
| 2 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120094 | Used for Sample Extarction |
| Agar | MDBio, Inc | 9002-18-0 | Materials of Culture Medium |
| Analytical Balance | AOHAOSI | AX2202ZH | Equipment |
| Autoclave | Yamatuo | SQ510C | Equipment |
| Autoclave | YAMATUO | SQ510C | Equipment |
| Beaker | Bio Best | DHSB-2L | Materials of Culture Medium |
| Biological Incubator | JINGHONG | SHP-250 | Equipment |
| Ca(NO3)2•4 H2O | Sinopharm | 80029062 | Analytical Reagent |
| CaCl2 | Sinopharm | 10005817 | Analytical Reagent |
| CuSO4•5 H2O | Sinopharm | 10008218 | Analytical Reagent |
| Electromagnetic Oven | Bio Best | DHDCL | Equipment |
| FeSO4•7 H2O | Sinopharm | 10002918 | Analytical Reagent |
| Filter Paper | Bio Best | DHLZ-9CM | Material |
| Fluorescence Ration PCR Instrument | Roche | LightCycler96 | Equipment |
| Gauze | Bio Best | 17071202 | Materials of Culture Medium |
| H3BO3 | Phytotechnology | B210-500G | Analytical Reagent |
| Hemocytometer | Solarbio | 17072801 | Material for disease-resistant identification |
| K2SO4 | Sinopharm | 10017918 | Analytical Reagent |
| KNO3 | Sinopharm | 10017218 | Analytical Reagent |
| KT Foam Sheet | Bio Best | DHKTB | Material for Seedling |
| Low Constant Incubator | Jinghong | SHP-250 | Equipment |
| Measuring Cylinder | Bio Best | DHBLLT-1000ML | Materials of Culture Medium |
| MgSO4•7 H2O | Sinopharm | 10013080 | Analytical Reagent |
| Microscope | ECHO | RVL-100-G | Equipment |
| MnCl2•4 H2O | Sinopharm | G5468154 | Analytical Reagent |
| Na2-EDTA | Sinopharm | G21410-250 | Analytical Reagent |
| NaH2PO4•2 H2O | Sinopharm | 20040717 | Analytical Reagent |
| NH4NO3 | Sinopharm | B64586-100g | Analytical Reagent |
| Oatmeal | Bio Best | DHYMP-1.5KG | Materials of Culture Medium |
| Petri Dish | Bio Best | DHPYM-9CM | Material for disease-resistant identification |
| Pipettor | THERMO | S1 | Equipment |
| Potting | Bio Best | DHYCXHP-12CM | Material for Seedling |
| Potting Soil | Bio Best | DHYMJZ-50L | Seedling Material |
| Punch | Bio Best | DHDKW | Material |
| qRT-PCR Plate | Monad | MQ50401S | qRT-PCR Plate |
| SYBR Green Premix Pro Taq HS qPCR Kit | Accurate Biology | AG11718 | PCR Reagent |
| Toothpick | Bio Best | DHYQ-900 | Material |
| Total RNA Kit II | Omega | R6934-01 | PCR Reagent |
| TransScript® II One-Step gDNA Removal and cDNA Synthesis SuperMix | Transgen | AH311-02 | PCR Reagent |
| Trays | Bio Best | DHYMTP-90G | Material for Seedling |
| Vermiculite | Bio Best | DHZS | Seedling Material |
| Water Purification System | HEAL FORCE | HSE68-2 | Equipment |
| ZnSO4•7 H2O | Sinopharm | 10024018 | Analytical Reagent |
참고문헌
- Antonopoulos, D. F., Melton, T., Mila, A. L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco. Plant Disease. 94 (5), 613-620 (2010).
- Taylor, R. J., Pasche, J. S., Gallup, C. A., Shew, H. D., Gudmestad, N. C. A foliar blight and tuber rot of potato caused by Phytophthora nicotianae: New occurrences and characterization of isolates. Plant Disease. 92 (4), 492-503 (2008).
- Amalia, B. R., José, I. M. G., Miguel, D. C. G., Francisco, C. F., Julio, C. T. M. Pathogenicity of plant and soil isolates of Phytophthora parasitica on tomato and pepper. European Journal of Plant Pathology. 148 (3), 607-615 (2017).
- Corrado, C., Annamari, M., Leonardo, S., Antonio, I., Simona, M. S. First report of collar and root rot caused by Phytophthora nicotianae on Lycium barbarum. Journal of Plant Pathology. 100 (2), (2018).
- Meng, Y. L., Zhang, Q., Ding, W., Shan, W. X. Phytophthora parasitica.: a model oomycete plant pathogen. Mycology. 5 (2), 43-51 (2014).
- Biasi, A., Martin, F. N., Cacciola, S. O., Lio, G. M., Grunwald, N. J., Schena, L. Genetic analysis of Phytophthora nicotianae populations from different hosts using microsatellite markers. Phytopathology. 106 (9), 1006-1014 (2016).
- Sullivan, M. J., Melton, T. A., Shew, H. D. Fitness of races 0 and 1 of Phytophthora parasitica var. nicotianae. Plant Disease. 89 (11), 1220-1228 (2005).
- Carlson, S. R., Wolff, M. A. F., Shew, H. D., Wernsman, E. A. Inheritance of resistance to Race 0 of Phytophthora parasitica var. nicotianae from the flue-cured tobacco cultivar Coker 371-Gold. Plant Disease. 81 (11), 1269-1274 (1997).
- Csinos, A. S. Stem and root resistance to tobacco black shank. Plant Disease. 83 (8), 777-780 (1999).
- Johnson, E. S., Wolff, M. F., Wernsman, E. A., Atchley, W. R., Shew, H. D. Origin of the black shank resistance gene, Ph, in tobacco cultivar coker 371-Gold. Plant Disease. 86 (10), 1080-1084 (2002).
- Osmany, C., Ingrid, H., Roxana, P., Yunior, L., Merardo, P., Orlando, B. H. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 177 (3), 175-180 (2009).
- Hernández, I., et al. Black shank resistant tobacco by silencing of glutathione S-transferase. Biochemical and Biophysical Research Communications. 387 (2), 300-304 (2009).
- Vontimitta, V., Lewis, R. S. Growth chamber evaluation of a tobacco 'Beinhart 1000' × 'Hicks' mapping population for quantitative trait loci affecting resistance to multiple races of Phytophthora nicotianae. Crop Science. 52 (1), 91-98 (2012).
- Xiao, B., et al. Location of genomic regions contributing to Phytophthora nicotianae resistance in tobacco cultivar florida 301. Crop Science. 53 (2), 473-481 (2013).
- McCorkle, K., Lewis, R., Shew, D. Resistance to Phytophthora nicotianae in tobacco breeding lines derived from variety Beinhart 1000. Plant Disease. 97 (2), 252-258 (2013).
- Zhang, Y., et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1. The Crop Journal. 6 (3), 282-290 (2018).
- Yu, X., Feng, B., He, P., Shan, L. From chaos to harmony: responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology. 55, 109-137 (2017).
- Ren, G., et al. . GB/T 23222 Grade and Investigation Method of Tobacco Diseases and Insect Pests. , (2008).
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19 (11), 11-15 (1987).
- Yan, H. Z., Liou, R. F. Selection of internal control genes for real-time quantitative RT-PCR assays in the oomycete plant pathogen Phytophthora parasitica. Fungal Genetics and Biology. 43, 430-438 (2006).
- Chacón, O., Hernández, I., Portieles, R., López, Y., Pujol, M., Borrás-Hidalgo, O. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 117 (3), 175-180 (2009).
- Vijay, V., Ramsey, S. L. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 29 (1), 89-98 (2012).
- McCorkle, K. L., Drake-Stowe, K., Lewis, R. S., Shew, D. Characterization of Phytophthora nicotianae resistance conferred by the introgressed Nicotiana rustica region, Wz, in flue-cured tobacco. Plant Disease. 102 (2), 309-317 (2018).
- Drake, K. E., Moore, J. M., Bertrand, P., Fortnum, B., Peterson, P., Lewis, R. S. Black shank resistance and agronomic performance of flue-cured tobacco lines and hybrids carrying the introgressed Nicotiana rustica Region. Wz. Crop Science. 55 (1), 79-86 (2015).
- Kebdani, N., Pieuchot, L., Deleury, E., Panabières, F., Berre, J. -. Y. L., Gourgues, M. Cellular and molecular characterization of Phytophthora parasitica appressorium-mediated penetration. New Phytologist. 185 (1), 248-257 (2010).
- Huang, G., et al. An RXLR effector secreted by Phytophthora parasitica is a virulence factor and triggers cell death in various plants. Molecular Plant Pathology. 20 (3), 1-16 (2019).
- Agnès, A., Mathieu, G., Nicolas, C. -. T., Harald, K. The immediate activation of defense responses in Arabidopsis roots is not sufficient to prevent Phytophthora parasitica infection. New Phytologist. 187 (2), 229 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유