このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
フィトフトラ・ニコチアナエ耐性に対するタバコ遺伝子型のスクリーニング
要約
ここでは、苗木における Phytophthora nicotianae 耐性についてのタバコ遺伝子型の効率的かつ正確なスクリーニングのためのプロトコルが提示される。これは、精密育種や分子機構研究のための実用的なアプローチです。
要約
卵菌類Phytophthora nicotianaeによって引き起こされる黒いシャンクは、タバコに対して破壊的であり、この病原体は多くのナス科作物に対して高病原性である。P.ニコチアナエは高温によく適応しています。したがって、この病原体の研究は、地球温暖化のために世界中の農業で重要性を増しています。タバコ植物のP. nicotianae耐性品種は、一般に、P. nicotianaeによってコロニー形成されたオート麦粒を接種し、疾患症状をモニタリングすることによってスクリーニングされる。しかし、この場合は正確な接種が重要であるため、接種強度を定量化することは困難である。この研究は、P. nicotianaeの感染に対するタバコの耐性を評価するための効率的で信頼性の高い方法を開発することを目的としていた。この方法は抵抗性品種の同定に成功しており、リアルタイムPCRにより接種効率が確認されました。本研究で提示した抵抗性評価方法は、精密育種や分子機構研究に効率的かつ実用的である。
概要
P. nicotianae は多くのナス科作物に破壊的です。タバコの「ブラックシャンク」1、ジャガイモの葉と塊茎の腐敗2、トマトとピーマンの冠と根腐れ3、ゴジカラーと根腐れ4を引き起こす可能性があります。 P. nicotianae は、任意の成長段階で根、茎、葉を含むタバコ植物のすべての部分を攻撃することができます5。この病気の最も一般的な症状は、茎の黒い基部です。根は最初は水に浸されたように見え、その後壊死し、葉は大きな円形の病変を示します5。この病気は、温室内のタバコ植物や畑のタバコ植物に壊滅的な影響を与える可能性があります6。 P. nicotianae を防除するための最も実用的で経済的な方法は、抵抗性品種の使用です7。しかしながら、タバコ生殖質コレクションからの P.ニコチアナエ耐性アクセッションの同定には、効果的なスクリーニングプロトコルが必要である。
タバコ中のニコチアナエ菌耐性を評価するために様々な同定方法が記載されている7、8、9、10、11、12、13、14、15、16。一般に、P. nicotianae耐性タバコ遺伝子型の同定には、3つの主要なアプローチが用いられてきた。第1は、菌糸体をP.ニコチアナエを含むペトリプレート上で寒天培地と混合することを含む。その後、菌糸体を室温で暗所で2週間培養する。1Lの脱イオン水を菌糸体に加え、30秒間均質化する。接種物は必要になるまで氷の上に保たれます。植物の両側に2つの穴(直径1cm、深さ4〜5cm)を作り、各穴に10mLの種菌を注ぐ。その後、穴は周囲の土壌で埋められ、病気の発症は2週間毎日監視されます8,10。
第2の方法では、植物に病原体が寄生した爪楊枝を接種する。このアプローチでは、移植後約6週間で植物を使用し、最低身長30cmにする必要があります。オートクレーブ処理された爪楊枝は、P. nicotianae菌糸体を含む培養物の表面に置かれる。次いで、培養皿を、室温で光の下で7日間保存する。次に、コロニー形成された爪楊枝を使用して植物を接種する。爪楊枝は、第4節と第5節の間のタバコ茎に挿入される。植物は毎日5日間監視されています9,15。この方法は、小さな苗には適用できません。接種源は病原体が蔓延する爪楊枝であるため、接種強度を正確に制御することはできません。
最も頻繁に使用されるアプローチは、接種のためのオート麦穀物を含む。この場合、オート麦粒は、500mLのオートクレーブおよび300mLの脱イオン水を121°Cで1日1回、3日間オートクレーブ処理することによって調製される。次いで、オート麦粒が病原体コロニー形成培養培地に添加される。ディッシュをパラフィンフィルムで密封し、光中25°Cで7〜12日間インキュベートした。鉢植えの土壌に4つの別々の5cmの深さの穴が作られ、各植物から4cm、病原体が蔓延するオート麦粒が各穴に1つ入れられます。潜伏期間は、最初の地上の症状がいつ発生したかに基づいて決定されます7、11、12、13、14、15、16。この方法は効率的で、大規模な抵抗スクリーニングに適用できます。しかし、このアプローチの1つの制限は、接種物が病原体に寄生するオート麦粒であるため、接種強度を正確に制御できないことである。
しかし、ここで提示されるのは、成長チャンバ抵抗評価に適用可能なより正確な方法である。他のアプローチと比較して、接種物は遊走子懸濁液であり、したがって接種強度は制御可能かつ調整可能である。この研究のタバコ植物は土壌なしで栽培されているため、結果は観察しやすい。さらに、土壌から植物の根をサンプリングすると、常に根に損傷を与え、一連の生理学的反応を誘発する17。この方法では、植物を土壌なしで栽培するので、根の損傷における干渉を排除することができる。結論として、この方法は分子メカニズム研究および精密育種にとってより実用的である。このプロトコルを使用すると、データは通常5日以内に得られ、1回の実験で200以上の植物が評価されます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 素材
- タバコの品種を入手してください。
注:この実験のために、 "Beinhart1000-1"(Beinhart 1000の選択)(BH)と "Xiaohuangjin1025"(XHJ)は中国のタバコ生殖質資源の国家中期Genbankから入手しました。BHは耐性であるのに対し、XHJは ニコチアナエ菌 感染を受けやすい16。中国農業科学院タバコ研究所に保存されている P. nicotianae race 0のフィールド単離物が、研究を通してすべての接種に使用された。
2. P. ニコチアナエ 抵抗性評価のための植え付けタバコ遺伝子型
- タバコの種とバーミキュライトを混ぜ合わせ、滅菌した鉢植えの土に優しく種を吹き付けます。成長室にポットを置きます。16時間の光/8時間の暗光周期の下で、25°Cの一定温度を維持します。
- トレイと発泡シートを備えた水耕栽培装置を準備する。種子が発芽したら、鉢植えの土から苗を刺し、滅菌脱イオン水で根を優しく洗い流し、水耕栽培装置に移植する。
- デバイスを 25 °C の気候室に 16 時間の光/8 時間の暗黒光周期下で 24 時間置きます。
- ホーグランド養液を予め調製しておく(表1)。ホーグランド養液(植物あたり約125mL)で苗を水耕栽培装置に移植する。
- デバイスを25°Cの気候チャンバーに入れ、16時間の明光/8時間の暗光周期下で2週間置きます。
3. P. nicotianae遊走子懸濁液の調製
- オートミール寒天培地を調製する。
- オートミール33gの重さを量り、ガラス製品に移し、1,000mLの滅菌水を加える。電磁コンロオーブンで沸騰させる。
- オートミールが粘着性になったら、滅菌ガーゼを通して液体溶液をこすります。
- 液体溶液を1,000 mLのメスシリンダーに注ぎ、滅菌水で体積を1,000 mLに調整する。
- 液体溶液をガラス試薬瓶に注ぎ、18gの寒天を加える。この混合物(オートミール寒天培地)を121°Cで15分間よく振とうした。室温で30分間放置する。
- 滅菌オートミール寒天培地の約20mLを各ペトリ皿に注ぐ。菌糸栽培の前にペトリ皿を室温で放置して十分に冷却する。
- 菌糸栽培を行う。
- 直径1cmのパンチと爪楊枝を121°Cで15分間オートクレーブ処理して予め用意しておきます。
- P. nicotianae菌糸寒天培養物に穴を開けて丸い菌糸マットを作る。
- 菌糸マットを取り出し、菌糸体側を下に置いたオートミール寒天培地の上に置き、菌糸体を暗所で25°Cで14日間インキュベートする。
- P. nicotianae 遊走子懸濁液を準備する。
- 各菌糸体培養液(15mL/ディッシュ)に0.1%KNO3溶液を加え、4°Cで20分間培養して胞子嚢を誘導した。
- 食器を25°Cで25分間保持し、遊走子を放出する。
- 遊走子懸濁液をビーカーに集め、顕微鏡及び血球計を用いて遊走子濃度を測定する。
- 遊走子濃度を滅菌水で1 x 104遊 走子/ mLに調整します。
4. 耐病性タバコ品種の同定
- Hoagland養液から苗を取り、ペトリ皿(90mm)の 中のP. nicotianae 遊走子懸濁液20mLに根を浸して接種し、暗所で25°Cで3時間。
- 接種後、タバコの苗を新しいペトリ皿に入れ、10mLの滅菌水で根を浸します。2枚のろ紙で覆って根を湿らせてください。皿を25°Cに保ち、16時間の明光/8時間の暗光周期で保管してください。
- 2〜3日後、疾患の重症度を観察する。
- 防除処理のために、タバコの苗木を10mLの滅菌水でシャーレに直接入れて根を浸し、2枚のろ紙で根を覆う。
注:各処理は3つの複製を有し、実験ごとに8つの植物であった。
- 防除処理のために、タバコの苗木を10mLの滅菌水でシャーレに直接入れて根を浸し、2枚のろ紙で根を覆う。
5. ニコチアナエ 菌感染の評価
- 接種後4〜5日後に疾患の重症度を評価する。中国の国家標準18に基づいて、個々の植物病害の重症度を0〜9のスケールでスコアリングする(表2、 図1)。
- 次の式18を使用して疾患指数を計算します。
疾患指数 =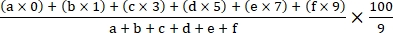
ここで、a、b、c、d、e、および f は、各疾患重症度グレードの植物の数です。
注:疾患の重症度は6つのグレード18 に分けた(表3)。
Access restricted. Please log in or start a trial to view this content.
結果
抵抗性品種BHおよび感受性品種XHJの4週齢の植物を、本稿で提示された方法を用いて P. nicotianae で挑戦した。実験は3回の反復で計画され、それぞれに1群あたり8本の植物がいた。2つのタバコ品種、BHおよびXHJの P.ニコチアナエ 感染を、 図2に提示する。接種後3日目に、XHJの場合、茎病変は茎の胴回りの約半分を覆い、葉の半分はわずかにしおれた。耐性品種...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
栽培タバコにおけるP. nicotianae耐性を改善するために、複数の抵抗性源が用いられてきた。単一の優性R遺伝子であるPhpおよびPhlは、それぞれニコチアナ・プラムバギニフォリアおよびニコチアナ・ロンギフローラから侵入されている10。葉巻タバコ品種のBeinhart 1000は、P. nicotianae13に対する定量的耐性の報告された最?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、中国国家自然科学財団(31571738)と中国農業科学技術イノベーションプログラム(ASTIP-TRIC01)から資金提供を受けました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| (NH4)2SO4 | Sinopharm | 10002917 | Analytical Reagent |
| (NH4)6 Mo7O24•2 H2O | Sinopharm | XW131067681 | Analytical Reagent |
| 1.5 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120086 | Used for Sample Extarction |
| 2 ml Safe-lock Microcentrifuge Tubes | Eppendorf | 30120094 | Used for Sample Extarction |
| Agar | MDBio, Inc | 9002-18-0 | Materials of Culture Medium |
| Analytical Balance | AOHAOSI | AX2202ZH | Equipment |
| Autoclave | Yamatuo | SQ510C | Equipment |
| Autoclave | YAMATUO | SQ510C | Equipment |
| Beaker | Bio Best | DHSB-2L | Materials of Culture Medium |
| Biological Incubator | JINGHONG | SHP-250 | Equipment |
| Ca(NO3)2•4 H2O | Sinopharm | 80029062 | Analytical Reagent |
| CaCl2 | Sinopharm | 10005817 | Analytical Reagent |
| CuSO4•5 H2O | Sinopharm | 10008218 | Analytical Reagent |
| Electromagnetic Oven | Bio Best | DHDCL | Equipment |
| FeSO4•7 H2O | Sinopharm | 10002918 | Analytical Reagent |
| Filter Paper | Bio Best | DHLZ-9CM | Material |
| Fluorescence Ration PCR Instrument | Roche | LightCycler96 | Equipment |
| Gauze | Bio Best | 17071202 | Materials of Culture Medium |
| H3BO3 | Phytotechnology | B210-500G | Analytical Reagent |
| Hemocytometer | Solarbio | 17072801 | Material for disease-resistant identification |
| K2SO4 | Sinopharm | 10017918 | Analytical Reagent |
| KNO3 | Sinopharm | 10017218 | Analytical Reagent |
| KT Foam Sheet | Bio Best | DHKTB | Material for Seedling |
| Low Constant Incubator | Jinghong | SHP-250 | Equipment |
| Measuring Cylinder | Bio Best | DHBLLT-1000ML | Materials of Culture Medium |
| MgSO4•7 H2O | Sinopharm | 10013080 | Analytical Reagent |
| Microscope | ECHO | RVL-100-G | Equipment |
| MnCl2•4 H2O | Sinopharm | G5468154 | Analytical Reagent |
| Na2-EDTA | Sinopharm | G21410-250 | Analytical Reagent |
| NaH2PO4•2 H2O | Sinopharm | 20040717 | Analytical Reagent |
| NH4NO3 | Sinopharm | B64586-100g | Analytical Reagent |
| Oatmeal | Bio Best | DHYMP-1.5KG | Materials of Culture Medium |
| Petri Dish | Bio Best | DHPYM-9CM | Material for disease-resistant identification |
| Pipettor | THERMO | S1 | Equipment |
| Potting | Bio Best | DHYCXHP-12CM | Material for Seedling |
| Potting Soil | Bio Best | DHYMJZ-50L | Seedling Material |
| Punch | Bio Best | DHDKW | Material |
| qRT-PCR Plate | Monad | MQ50401S | qRT-PCR Plate |
| SYBR Green Premix Pro Taq HS qPCR Kit | Accurate Biology | AG11718 | PCR Reagent |
| Toothpick | Bio Best | DHYQ-900 | Material |
| Total RNA Kit II | Omega | R6934-01 | PCR Reagent |
| TransScript® II One-Step gDNA Removal and cDNA Synthesis SuperMix | Transgen | AH311-02 | PCR Reagent |
| Trays | Bio Best | DHYMTP-90G | Material for Seedling |
| Vermiculite | Bio Best | DHZS | Seedling Material |
| Water Purification System | HEAL FORCE | HSE68-2 | Equipment |
| ZnSO4•7 H2O | Sinopharm | 10024018 | Analytical Reagent |
参考文献
- Antonopoulos, D. F., Melton, T., Mila, A. L. Effects of chemical control, cultivar resistance, and structure of cultivar root system on black shank incidence of tobacco. Plant Disease. 94 (5), 613-620 (2010).
- Taylor, R. J., Pasche, J. S., Gallup, C. A., Shew, H. D., Gudmestad, N. C. A foliar blight and tuber rot of potato caused by Phytophthora nicotianae: New occurrences and characterization of isolates. Plant Disease. 92 (4), 492-503 (2008).
- Amalia, B. R., José, I. M. G., Miguel, D. C. G., Francisco, C. F., Julio, C. T. M. Pathogenicity of plant and soil isolates of Phytophthora parasitica on tomato and pepper. European Journal of Plant Pathology. 148 (3), 607-615 (2017).
- Corrado, C., Annamari, M., Leonardo, S., Antonio, I., Simona, M. S. First report of collar and root rot caused by Phytophthora nicotianae on Lycium barbarum. Journal of Plant Pathology. 100 (2), (2018).
- Meng, Y. L., Zhang, Q., Ding, W., Shan, W. X. Phytophthora parasitica.: a model oomycete plant pathogen. Mycology. 5 (2), 43-51 (2014).
- Biasi, A., Martin, F. N., Cacciola, S. O., Lio, G. M., Grunwald, N. J., Schena, L. Genetic analysis of Phytophthora nicotianae populations from different hosts using microsatellite markers. Phytopathology. 106 (9), 1006-1014 (2016).
- Sullivan, M. J., Melton, T. A., Shew, H. D. Fitness of races 0 and 1 of Phytophthora parasitica var. nicotianae. Plant Disease. 89 (11), 1220-1228 (2005).
- Carlson, S. R., Wolff, M. A. F., Shew, H. D., Wernsman, E. A. Inheritance of resistance to Race 0 of Phytophthora parasitica var. nicotianae from the flue-cured tobacco cultivar Coker 371-Gold. Plant Disease. 81 (11), 1269-1274 (1997).
- Csinos, A. S. Stem and root resistance to tobacco black shank. Plant Disease. 83 (8), 777-780 (1999).
- Johnson, E. S., Wolff, M. F., Wernsman, E. A., Atchley, W. R., Shew, H. D. Origin of the black shank resistance gene, Ph, in tobacco cultivar coker 371-Gold. Plant Disease. 86 (10), 1080-1084 (2002).
- Osmany, C., Ingrid, H., Roxana, P., Yunior, L., Merardo, P., Orlando, B. H. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 177 (3), 175-180 (2009).
- Hernández, I., et al. Black shank resistant tobacco by silencing of glutathione S-transferase. Biochemical and Biophysical Research Communications. 387 (2), 300-304 (2009).
- Vontimitta, V., Lewis, R. S. Growth chamber evaluation of a tobacco 'Beinhart 1000' × 'Hicks' mapping population for quantitative trait loci affecting resistance to multiple races of Phytophthora nicotianae. Crop Science. 52 (1), 91-98 (2012).
- Xiao, B., et al. Location of genomic regions contributing to Phytophthora nicotianae resistance in tobacco cultivar florida 301. Crop Science. 53 (2), 473-481 (2013).
- McCorkle, K., Lewis, R., Shew, D. Resistance to Phytophthora nicotianae in tobacco breeding lines derived from variety Beinhart 1000. Plant Disease. 97 (2), 252-258 (2013).
- Zhang, Y., et al. Identification of stably expressed QTL for resistance to black shank disease in tobacco (Nicotiana tabacum L.) line Beinhart 1000-1. The Crop Journal. 6 (3), 282-290 (2018).
- Yu, X., Feng, B., He, P., Shan, L. From chaos to harmony: responses and signaling upon microbial pattern recognition. Annual Review of Phytopathology. 55, 109-137 (2017).
- Ren, G., et al. GB/T 23222 Grade and Investigation Method of Tobacco Diseases and Insect Pests. , China Standard Press. Beijing. (2008).
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19 (11), 11-15 (1987).
- Yan, H. Z., Liou, R. F. Selection of internal control genes for real-time quantitative RT-PCR assays in the oomycete plant pathogen Phytophthora parasitica. Fungal Genetics and Biology. 43, 430-438 (2006).
- Chacón, O., Hernández, I., Portieles, R., López, Y., Pujol, M., Borrás-Hidalgo, O. Identification of defense-related genes in tobacco responding to black shank disease. Plant Science. 117 (3), 175-180 (2009).
- Vijay, V., Ramsey, S. L. Mapping of quantitative trait loci affecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000. Molecular Breeding. 29 (1), 89-98 (2012).
- McCorkle, K. L., Drake-Stowe, K., Lewis, R. S., Shew, D. Characterization of Phytophthora nicotianae resistance conferred by the introgressed Nicotiana rustica region, Wz, in flue-cured tobacco. Plant Disease. 102 (2), 309-317 (2018).
- Drake, K. E., Moore, J. M., Bertrand, P., Fortnum, B., Peterson, P., Lewis, R. S. Black shank resistance and agronomic performance of flue-cured tobacco lines and hybrids carrying the introgressed Nicotiana rustica Region. Wz. Crop Science. 55 (1), 79-86 (2015).
- Kebdani, N., Pieuchot, L., Deleury, E., Panabières, F., Berre, J. -Y. L., Gourgues, M. Cellular and molecular characterization of Phytophthora parasitica appressorium-mediated penetration. New Phytologist. 185 (1), 248-257 (2010).
- Huang, G., et al. An RXLR effector secreted by Phytophthora parasitica is a virulence factor and triggers cell death in various plants. Molecular Plant Pathology. 20 (3), 1-16 (2019).
- Agnès, A., Mathieu, G., Nicolas, C. -T., Harald, K. The immediate activation of defense responses in Arabidopsis roots is not sufficient to prevent Phytophthora parasitica infection. New Phytologist. 187 (2), 229(2010).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved