A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخدام كريستال البنفسجي لتحسين البصرية Cytopathic تأثير القائم على القراءة ل Titration الفيروسية باستخدام TCID50 المقايسات
In This Article
Summary
يظهر هذا البروتوكول نهجا دقيقا وموضوعيا لتصور المعايرة الفيروسية باستخدام اللون البنفسجي البلوري ، من خلال مقارنتها بالفحص المجهري البصري والتلوين الكيميائي المناعي.
Abstract
المعايرة الفيروسية هي المقايسة الرئيسية لأبحاث الفيروسات. الكشف عن تأثير الخلايا (CPE) عن طريق المقايسات TCID50 ووحدات تشكيل البلاك (PFU) المقايسات هي الطريقتين الرئيسيتين لحساب titer من مخزون الفيروس وغالبا ما تستند إلى الكشف المجهري أو تلطيخ الخلايا للتصور. في حالة اختبار TCID50 ، يستند التصور الموضوعي عادة إلى تلطيخ المناعة الكيميائية (ICC) للفيروس داخل الخلايا لحساب الثديات جنبا إلى جنب مع الكشف البصري عن CPE عن طريق المجهر. ومع ذلك ، فإن تلطيخ المحكمة الجنائية الدولية مكلف ويستغرق وقتا طويلا. في هذه الدراسة، قارنا المراقبة البصرية CPE عن طريق المجهر، تلطيخ المحكمة الجنائية الدولية وتلطيخ الكريستال البنفسجي لتحديد الثدي من اثنين من الفيروسات تشكيل CPE، فيروس الأنفلونزا A (IAV) من أصل الخنازير وفيروس متلازمة بورسين التناسلية والتنفسية (PRRSV). نظهر أن كل من الكريستال البنفسجي وتلطيخ ICC هي أكثر دقة من الكشف عن CPE البصرية، وتقديم مستويات متطابقة تقريبا من الدقة على كل من IAV وPRRSV. لهذا السبب، نقدم هنا تلطيخ الكريستال البنفسجي كوسيلة أسرع وأكثر بأسعار معقولة لتحديد المعايرة الفيروسية على المقايسة TCID50 للفيروسات تشكيل CPE titrated في خطوط الخلية.
Introduction
المعايرة الفيروسية عن طريق TCID50 المقايسة هي تقنية شائعة الاستخدام في أبحاث الأمراض المعدية1. على الرغم من أن الاختلافات في الرياضيات وراء هذه الطريقة قد اقترحت على مدى الوقت1,2,3,4, تعتمد الطرق المطبقة حاليا للكشف عن العدوى على تأكيد بصري من خلال وجود تأثير الاعتلال الخلوي (CPE) باستخدام المجهر5. لتأكيد التصور CPE أكثر موضوعية على المقايسات TCID50، immunocytochemical (ICC) تلطيخ داخل الخلايا التي تستهدف بروتينات الفيروس هي واحدة من الطرق الأكثر استخداما6 كما يمكن للفيروسات المختلفة تنتج أشكال مختلفة من CPE. في حالتنا ، فإن التغيرات المورفولوجية للخلايا متشابهة عند إصابتها بكل من فيروس الأنفلونزا A (IAV) وفيروس متلازمة بورسين التناسلية والتنفسية (PRRSV) ، حيث تتراكم الخلايا المصابة وتنفصل عن اللوحة. في حالة PRRSV ، فإنه يسبب CPE المعروفة باسم "التدمير الكامل" ، حيث ينتهي الأمر بجميع الخلايا إلى الانفصال عن البئر. IAV من ناحية أخرى، يمكن أن تقدم كل من التدمير الكامل وCPE إضافية تعرف باسم "تدمير المجموع الفرعي" حيث عدد قليل من الخلايا لا تنفصل بعد العدوى7. ومع ذلك، تستغرق هذه التقنية وقتا طويلا في الأداء وتتطلب استخدام الكواشف المكلفة نسبيا. من المهم ملاحظة أن المحكمة الجنائية الدولية لا تسمي CPE ، بل عدد الخلايا المصابة بنجاح بالفيروس. وهذا يعني أن الخلايا التي أصيبت بنجاح بحلول نهاية الحضانة سينظر إليها على أنها إيجابية حتى لو لم تسبب العدوى CPE حتى الآن ، وبالتالي ، من المتوقع أن تكون نسبة أعلى من الخلايا الإيجابية للمحكمة الجنائية الدولية مقارنة ب CPE. لهذا السبب، في هذه الدراسة نصف طريقة تكميلية للكشف البصري عن CPE في اختبار TCID50 على أساس البنفسجي الكريستال، وهي مادة كيميائية مع تهمة إيجابية التي تعلق على أغشية الخلايا ويستخدم لتلطخ الخلايا الملتصقة. وغالبا ما يستخدم الكريستال البنفسجي في بحوث علم الفيروسات لقياس وحدات تشكيل البلاك، من بين أمور أخرى8.
في هذه الدراسة، نقارن حساسية الكشف عن ال CPE المجهر غير الملون مع تلطيخ الكريستال البنفسجي وتلطيخ المناعة الكيميائية على أساس التعرف على البروتين الفيروسي، والذي هو معروف أن يكون أكثر موضوعية نظرا لحساسية عالية. وتبين هذه الدراسة أن كل من الكريستال البنفسجي وتلطيخ الكيميائية المناعية هي أكثر دقة من الكشف عن CPE البصرية القائمة على المجهر ويمكن استخدامها لتحديد موضوعي الآبار المصابة في المعايرة TCID50. نظرا لقدرتها على الوصول إلى مستوى مماثل تقريبا من الدقة على الفيروسات الباثاثية اختبارها في خطوط الخلية، يتم تقديم الكريستال البنفسجي كوسيلة أسرع وأكثر بأسعار معقولة لتحديد المعايرة الفيروسية على المقايسة TCID50. الطريقة المقترحة باستخدام الكريستال البنفسجي تلطيخ يستغرق ما مجموعه 40 دقيقة لأداء، مع 15 دقيقة لاحتضان paraformaldehyde (PFA)، 5 دقائق لاحتضان الكريستال البنفسجي والحد الأقصى من 15 دقيقة لإعداد المواد، يغسل العازلة، والتجفيف. بروتوكول الكيمياء المناعية المطبق للمقارنة يستغرق متوسط الوقت 4 ساعة 30 دقيقة، وكان يؤديها كما هو موضح سابقا9،10. وتهدف الطريقة المقترحة إلى المساعدة في تصور المعايرة الفيروسية المكتملة. يمكن إجراء العدوى وأوقات الحضانة مع تخطيط مختلف اعتمادا على الفيروس. هنا اختبرنا اثنين من فيروسات الحمض النووي الريبي مع تأثير cytopathic على خطوط الخلية.
Protocol
1. بروتوكول المعايرة
ملاحظة: استخدام فيروس cytopathic تصيب الخلايا الملتصقة. لهذه المظاهرة، فيروس الأنفلونزا A (IAV) من أصل الخنازير (A/California/07/2009/(H1N1)) وفيروس متلازمة بورسين التناسلية والتنفسية (PRRSV) نوع 2، سلالة NC 1-7-4 استخدمت.
- يسوي هذه الفيروسات في 96 لوحة بئر لمدة 7 أيام في خزانة السلامة الحيوية الموجودة في مختبر السلامة البيولوجية المستوى 2 (BSL-2).
- لتنفيذ هذه المعايرة، البذور 96 لوحات البئر مع خط الخلية المطلوبة. بالنسبة ل PRRSV، استخدم خط الخلية MA-104 ول IAV استخدم خط الخلية MDCK. لثقافة الخلية، استخدم DMEM المتوسطة تكملها مع 10٪ FBS، L-الجلوتامين وبينيسيلين-ستريبتوميسين وتنمو الخلايا إلى التقاء.
- قبل الإصابة، اغسل الخلايا باستخدام 200 ميكرولتر من برنامج تلفزيوني.
- تمييع مخزون الفيروس باستخدام سلسلة تخفيف 10 أضعاف عن طريق خلط 900 ميكرولتر من الوسائط و 100 ميكرولتر من الفيروس. تأكد من دوامة أنبوب بشكل صحيح لضمان الخلط السليم للوسط والفيروس وتجنب أخطاء التخفيف.
- وضع علامة تخطيط لوحة على الغطاء. غسل الآبار مع 1x الفوسفات المالحة العازلة (PBS). إضافة 50 ميكرولتر من inoculum في الآبار المقابلة التالية أساليب المعايرة الموصوفة سابقا2،3.
- حضانة عند 37 درجة مئوية في حاضنة ثاني أكسيد الكربون 5٪ لمدة 7 أيام.
2. تقييم التأثير الخلوي (CPE) عن طريق المجهر
- بعد الحضانة لمدة 7 أيام ، اغسل جميع الآبار ب 200 ميكرولتر من 1x PBS مرتين.
- تقييم جميع آبار اللوحة تحت المجهر الضوئي للكشف بصريا CPE. وفي حالة كل من PRRSV و IAV، يتكون CPE من موت الخلية والانفصال اللاحق عن اللوحة، مما يؤدي إلى تعطيل أحادي الطبقة. ومع ذلك، قد تقدم فيروسات أخرى أنواع مختلفة من CPE.
3. بروتوكول تلطيخ
ملاحظة: تم تقييم التأثير الخلوي (CPE) عن طريق تلطيخ الكريستال البنفسجي.
- بعد الحضانة لمدة 7 أيام ، اغسل جميع الآبار باستخدام 200 ميكرولتر من 1x PBS مرتين.
- إصلاح الخلايا عن طريق إضافة 50 ميكرولتر / بئر من 4٪ بارافورمالديهايد (PFA) في برنامج تلفزيوني 1x واحتضان لمدة 15 دقيقة في درجة حرارة الغرفة (RT).
- بعد الحضانة، اغسل الخلايا مرتين مع 200 ميكرولتر من برنامج تلفزيوني 1x. ثم، إضافة 50 ميكرولتر / بئر من الكريستال البنفسجي المخفف إلى 4٪ في الماء واحتضان لمدة 5 دقائق في RT.
ملاحظة: البقع الكيميائية البلورية البنفسجية الخلايا التي لا تزال تعلق على لوحة في وقت التثبيت، وترك أجزاء من البئر حيث الخلايا منفصلة كما غير ملطخة. - وأخيرا، يستنشق البنفسجي الكريستال من الآبار وترك اختياريا لوحات لتجف الهواء لمدة 2-5 دقيقة في RT أو غسل لوحة مع 200 ميكروغرام من الماء لإزالة وصمة عار الزائدة قبل التصور.
- استخدام أساليب وصفها سابقا لحساب رياضيا titer. هنا، تم تطبيق صيغة كاربر وصيغة موينش لPRRSV و IAV، على التوالي2،3. وترد تفاصيل هذه المعادلات في قسم النتائج التمثيلية.
4. الوسم الكيميائي المناعي (ICC)
ملاحظة: تم إجراء وضع العلامات على الكيمياء المناعية لكلا الفيروسين باتباع الطرق الموصوفة سابقا9,10,11.
- بعد حضانة 7 أيام من المعايرة، إصلاح الخلايا باستخدام PFA كما هو موضح في الخطوة 3.2.
- غسل لوحات مع حل تتألف من 100 مل من 1 M تريس هيدروكلوريد، 1 غرام من سابونين، و 8.5 غرام من NaCl في 900 مل من H2O. ثم، إكمال اثنين يغسل إضافية مع خليط من 1x برنامج تلفزيوني و 5٪ مصل البقر الجنيني (FBS) واحتضان مع أن تريس سابونين-NaCl الحل في درجة حرارة الغرفة (RT) لمدة 20 دقيقة.
- احتضان جميع الآبار مع الأجسام المضادة الأولية لمدة 2 ساعة في RT.
ملاحظة: كان حجم الأجسام المضادة الأولية لكل فيروس 100 ميكرولتر وتم إعداده باستخدام تخفيف 1:300 من 2٪ FBS في برنامج تلفزيوني 1x. - غسل الخلايا مرتين مع الحل تريس، سابونين، وNaCl أعدت في الخطوة 4.2.
- احتضان جميع الآبار مع الأجسام المضادة الثانوية لمدة 1 ساعة في RT.
ملاحظة: كان حجم الأجسام المضادة الثانوية 100 ميكرولتر وتم إعداده باستخدام تخفيف 1:250 بنسبة 2٪ FBS في برنامج تلفزيوني 1x. - غسل الخلايا مع تريس، سابونين، وNaCl التخفيف كما هو موضح في الخطوة 4.2.
- أسبيرات التخفيف السابق واحتضان لوحات مع 200 ميكرولتر / بئر من كاربازول الأمينيثيل (AEC) الحل في التخفيف النهائي من 1:50 في الماء وفقا لتوجيهات الشركة المصنعة لمدة 30 دقيقة في RT.
- بعد الحضانة، تجاهل محلول AEC وإضافة 100 ميكرولتر/بئر من برنامج تلفزيوني 1x للتصوير عن طريق المجهر.
- رياضيا اشتقاق titer كما هو موضح في الخطوة 3.5.
النتائج
المعادلات المستخدمة لحساب رياضيا titer وصفت سابقا2،3.
باختصار، بالنسبة ل PRRSV، نطبق طريقة Karber:
تيتر (TCID50) = 10 T + 1.3 حيث:
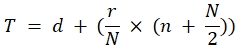
في هذه الصيغة د = سجل سلبي من التخفيف الأخ...
Discussion
وتستخدم المعايرة الفيروسية بشكل روتيني في أبحاث الفيروسات، مع الكشف عن PFU وتقيايس TCID50 الأكثر استخداما1،2،3،4. تعتمد كلتا الطريقتين على اكتشاف CPE في الخلايا المصابة ، وعلى الرغم من أنه يمكن تقييمها بصريا عن طريق المج...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ويود المؤلفون أن يعترفوا بالدكتور فرانك شولي لتعليقاته المفيدة في المخطوطة، وكلوي ماريانت لمساعدتها في تصوير المجهر وتيريزا م. تيدج لتنقيحها المفيد للغة الإنجليزية.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
References
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved