Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Utilisation de Crystal Violet pour améliorer la lecture visuelle basée sur les effets cytopathiques pour la tittration virale à l’aide des tests TCID50
Dans cet article
Résumé
Ce protocole montre une approche précise et objective pour visualiser les titrages viraux à l’aide de violet cristallin, en le comparant à la microscopie optique et à la coloration immunocytochimique.
Résumé
La titration virale est un test clé pour la recherche en virologie. La détection de l’effet cytopathique (CPE) via les tests TCID50 et les tests d’unités formant de plaque (PFU) sont les deux principales méthodes pour calculer le titre d’un stock de virus et sont souvent basées sur la détection par microscopie ou la coloration cellulaire pour la visualisation. Dans le cas du test TCID50, la visualisation objective est généralement basée sur la coloration immunocytochimique (ICC) du virus intracellulaire pour calculer les titres combinés à la détection visuelle du CPE par microscopie. Cependant, la coloration ICC est coûteuse et prend beaucoup de temps. Dans cette étude, nous avons comparé l’observation visuelle du CPE par microscopie, la coloration ICC et la coloration violette cristalline pour déterminer les titres de deux virus formant des CPE, le virus de la grippe A (IAV) d’origine porcine et le virus du syndrome reproducteur et respiratoire porcin (SDRP). Nous montrons que la coloration au violet cristallin et à l’ICC est plus précise que la détection visuelle du CPE, présentant des niveaux de précision presque identiques sur l’IAV et le PRRSV. Pour cette raison, nous présentons ici la coloration violette cristalline comme un moyen plus rapide et plus abordable de déterminer les titrages viraux sur un test TCID50 pour les virus formant des CPE titrés dans des lignées cellulaires.
Introduction
La titration virale par dosage TCID50 est une technique couramment utilisée dans la recherche sur les maladies infectieuses1. Bien que des variations sur les mathématiques derrière cette méthode aient été proposées au fil du temps1,2,3,4, les méthodes actuellement appliquées de détection des infections reposent sur la confirmation visuelle par la présence d’effet cytopathique (CPE) à l’aide de la microscopie5. Pour confirmer la visualisation du CPE de manière plus objective sur les tests TCID50, la coloration intracellulaire immunocytochimique (ICC) ciblant les protéines du virus est l’une des méthodes les plus couramment utilisées6, car différents virus peuvent produire différentes formes de CPE. Dans notre cas, les changements morphologiques cellulaires sont similaires lorsqu’ils sont infectés à la fois par le virus de la grippe A (IAV) et le virus du syndrome reproducteur et respiratoire porcin (SDRP), où les cellules infectées s’arrondissent et se détachent de la plaque. Dans le cas du SDRP, il provoque un CPE connu sous le nom de « destruction totale », où toutes les cellules finissent par se détacher du puits. D’autre part, l’IAV peut présenter à la fois une destruction totale et un CPE supplémentaire connu sous le nom de « destruction sous-totale » où un petit nombre de cellules ne se détachent pas après l’infection7. Cependant, cette technique prend beaucoup de temps à réaliser et nécessite l’utilisation de réactifs relativement coûteux. Il est important de noter que l’ICC n’étiquette pas le CPE, mais plutôt le nombre de cellules infectées avec succès par le virus. Cela implique que les cellules qui ont été infectées avec succès à la fin de l’incubation seront considérées comme positives même si l’infection n’a pas encore causé de CPE, et donc, un pourcentage plus élevé de cellules ICC positives par rapport à CPE est attendu. Pour cette raison, dans cette étude, nous décrivons une méthode complémentaire de détection visuelle du CPE dans un test TCID50 à base de violet cristallin, un produit chimique à charge positive qui se fixe aux membranes cellulaires et est utilisé pour colorer les cellules adhérentes. Le violet cristallin est souvent utilisé dans la recherche en virologie pour mesurer les unités formant la plaque, entre autres8.
Dans cette étude, nous comparons la sensibilité de la détection de CPE par microscopie non colorée avec la coloration violette cristalline et la coloration immunocytochimique basée sur la reconnaissance des protéines virales, qui est connue pour être plus objective en raison de sa sensibilité élevée. Cette étude montre que le violet cristallin et la coloration immunocytochimique sont plus précis que la détection CPE basée sur la microscopie visuelle et peuvent être utilisés pour identifier objectivement les puits infectés dans un titrage TCID50. Compte tenu de leur capacité à atteindre un niveau de précision presque identique sur les virus cytopathiques testés dans les lignées cellulaires, le violet cristallin est présenté comme un moyen plus rapide et plus abordable de déterminer les titrages viraux sur un test TCID50. La méthode proposée utilisant la coloration violette cristalline prend un temps total de 40 minutes à effectuer, avec 15 minutes pour l’incubation du paraformaldéhyde (PFA), 5 minutes pour l’incubation du violet cristallin et un maximum de 15 minutes pour la préparation du matériau, les lavages tampons et le séchage. Le protocole d’immunocytochimie appliqué pour la comparaison prend un temps moyen de 4 h 30 min et a été effectué comme décrit précédemment9,10. La méthode proposée vise à aider à visualiser un titrage viral terminé. Les temps d’infection et d’incubation peuvent être effectués avec une disposition différente en fonction du virus. Ici, nous avons testé deux virus à ARN ayant un effet cytopathique sur les lignées cellulaires.
Protocole
1. Protocole de titrage
REMARQUE: Utilisez un virus cytopathique infectant les cellules adhérentes. Pour cette démonstration, le virus de la grippe A (IAV) d’origine porcine (A/California/07/2009/(H1N1)) et le virus du syndrome reproducteur et respiratoire porcin (SDRP) de type 2, souche NC 1-7-4 ont été utilisés.
- Titrer ces virus dans 96 plaques de puits pendant 7 jours dans une armoire de biosécurité située dans un laboratoire de niveau de biosécurité 2 (BSL-2).
- Pour effectuer ces titrages, ensemencez 96 plaques de puits avec la lignée cellulaire requise. Pour le SDRP, utilisez la lignée cellulaire MA-104 et pour l’IAV, utilisez la lignée cellulaire MDCK. Pour la culture cellulaire, utilisez un milieu DMEM complété par 10% de FBS, de L-Glutamine et de pénicilline-streptomycine et cultivez les cellules jusqu’à la confluence.
- Avant l’infection, lavez les cellules à l’aide de 200 μL de PBS.
- Diluer les stocks de virus à l’aide de séries de dilutions 10 fois en mélangeant 900 μL de milieu et 100 μL de virus. Assurez-vous de bien vortexer le tube pour assurer un bon mélange du milieu et du virus et éviter les erreurs de dilution.
- Marquez la disposition de la plaque sur le couvercle. Lavez les puits avec 1x tampon salin phosphate (PBS). Ajouter 50 μL de l’inoculum dans les puits correspondants en suivant les méthodes de titrage décrites précédemment2,3.
- Incuber à 37 °C dans un incubateur à 5 % de CO2 pendant 7 jours.
2. Évaluation de l’effet cytopathique (EPC) par microscopie
- Après l’incubation de 7 jours, lavez deux fois tous les puits avec 200 μL de 1x PBS.
- Évaluez tous les puits de la plaque au microscope optique pour détecter visuellement le CPE. Dans le cas du SDRP et de l’IAV, leur CPE consiste en la mort cellulaire et le détachement ultérieur de la plaque, ce qui entraîne une perturbation monocouche. Cependant, d’autres virus peuvent présenter différents types de CPE.
3. Protocole de coloration
REMARQUE: L’effet cytopathique (CPE) a été évalué par coloration violette cristalline.
- Après l’incubation de 7 jours, lavez tous les puits en utilisant 200 μL de 1x PBS deux fois.
- Fixez les cellules en ajoutant 50 μL/puits de 4 % de paraformaldéhyde (PFA) dans 1x PBS et incubez pendant 15 min à température ambiante (RT).
- Après l’incubation, lavez les cellules deux fois avec 200 μL de 1x PBS. Ensuite, ajouter 50 μL/puits de violet cristallin dilué à 4% dans l’eau et incuber pendant 5 min à TA.
REMARQUE: Le violet cristallin colore les cellules qui restent attachées à la plaque au moment de la fixation, laissant les sections du puits où les cellules se sont détachées comme non colorées. - Enfin, aspirez le cristal violet des puits et laissez éventuellement les plaques sécher à l’air libre pendant 2 à 5 minutes à RT ou lavez la plaque avec 200 μL d’eau pour éliminer l’excès de tache avant la visualisation.
- Utilisez des méthodes décrites précédemment pour calculer mathématiquement le titre. Ici, la formule de Karber et la formule de Muench ont été appliquées pour le SDRP et l’IAV, respectivement2,3. Les détails de ces équations sont présentés dans la section des résultats représentatifs.
4. Marquage immunocytochimique (ICC)
REMARQUE: Le marquage immunocytochimique pour les deux virus a été effectué selon les méthodes décrites précédemment9,10,11.
- Après l’incubation de 7 jours du titrage, fixez les cellules à l’aide de PFA comme décrit à l’étape 3.2.
- Laver les plaques avec une solution composée de 100 mL de 1 M de chlorhydrate de Tris, 1 g de Saponine et 8,5 g de NaCl dans 900 mL de H2O. Ensuite, effectuez deux lavages supplémentaires avec un mélange de 1x PBS et de 5% de sérum fœtal bovin (FBS) et incubez avec cette solution de Tris-Saponine-NaCl à température ambiante (RT) pendant 20 min.
- Incuber tous les puits avec l’anticorps primaire pendant 2 h à TA.
REMARQUE: Le volume d’anticorps primaires pour chaque virus était de 100 μL et a été préparé en utilisant une dilution 1:300 de 2% FBS dans 1x PBS. - Lavez les cellules deux fois avec la solution de Tris, saponine et NaCl préparée à l’étape 4.2.
- Incuber tous les puits avec l’anticorps secondaire pendant 1 h à TA.
REMARQUE: Le volume d’anticorps secondaire était de 100 μL et a été préparé en utilisant une dilution 1:250 de 2% FBS dans 1x PBS. - Lavez les cellules avec la dilution Tris, Saponin et NaCl comme décrit à l’étape 4.2.
- Aspirer la dilution précédente et incuber les plaques avec 200 μL/puits de solution d’aminoéthylcarazole (AEC) à une dilution finale de 1:50 dans l’eau en suivant les instructions du fabricant pendant 30 min à TA.
- Après l’incubation, jeter la solution AEC et ajouter 100 μL/puits de 1x PBS pour l’imagerie par microscopie.
- Dérivez mathématiquement le titre comme décrit à l’étape 3.5.
Résultats
Les équations utilisées pour calculer mathématiquement le titre ont été décrites précédemment2,3.
En bref, pour le SDRP, nous appliquons la méthode Karber :
Titre (TCID50) = 10 T + 1,3 où:
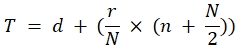
Dans cette formule d = log négatif de la dernière dilution avec réponse vir...
Discussion
Les titrages viraux sont couramment utilisés dans la recherche en virologie, la détection de l’UFC et les tests TCID50 étant les plus couramment utilisés1,2,3,4. Les deux méthodes reposent sur la détection du CPE dans les cellules infectées, et même si elles peuvent être évaluées visuellement par microscopie, une coloration est généralement appliquée pour obtenir un ré...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier le Dr Frank Scholle pour ses commentaires utiles dans le manuscrit, Chloe Mariant pour son aide avec les images de microscopie et Teresa M. Tiedge pour sa révision utile en anglais.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
Références
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon