Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Использование кристаллической фиалки для улучшения визуального цитопатического эффекта для титрования вируса с использованием анализов TCID50
В этой статье
Резюме
Этот протокол показывает точный и объективный подход к визуализации титрования вируса с использованием кристаллического фиолетового, сравнивая его с оптической микроскопией и иммуноцитохимическим окрашиванием.
Аннотация
Титрование вируса является ключевым анализом для вирусологических исследований. Обнаружение цитопатического эффекта (CPE) с помощью анализов TCID50 и анализов бляшечно-образующих единиц (PFU) являются двумя основными методами расчета титра запаса вируса и часто основаны на микроскопическом обнаружении или окрашивании клеток для визуализации. В случае анализа TCID50 объективная визуализация обычно основана на иммуноцитохимическом (ICC) окрашивании внутриклеточного вируса для расчета титров в сочетании с визуальным обнаружением CPE с помощью микроскопии. Однако окрашивание ICC является дорогостоящим и трудоемким. В этом исследовании мы сравнили визуальное наблюдение CPE с помощью микроскопии, окрашивания ICC и кристаллического фиолетового окрашивания для определения титров двух CPE-образующих вирусов, вируса гриппа A (IAV) свиного происхождения и вируса репродуктивного и респираторного синдрома свиней (PRRSV). Мы показываем, что как кристаллическое фиолетовое, так и ICC окрашивание являются более точными, чем визуальное обнаружение CPE, обеспечивая почти одинаковые уровни точности как на IAV, так и на PRRSV. По этой причине здесь мы представляем кристаллическое фиолетовое окрашивание как более быстрый и доступный способ определения титрования вируса на анализе TCID50 для CPE-образующих вирусов, титрованных в клеточных линиях.
Введение
Титрование вируса с помощью анализа TCID50 является широко используемым методом в исследованиях инфекционных заболеваний1. Хотя вариации математики, лежащей в основе этого метода, были предложены с течением времени1,2,3,4, применяемые в настоящее время методы обнаружения инфекции основаны на визуальном подтверждении через наличие цитопатического эффекта (CPE) с использованием микроскопии5. Чтобы подтвердить визуализацию CPE более объективно на анализах TCID50, иммуноцитохимическое (ICC) внутриклеточное окрашивание, нацеленное на белки вируса, является одним из наиболее часто используемых методов6, поскольку различные вирусы могут продуцировать различные формы CPE. В нашем случае клеточные морфологические изменения аналогичны при заражении как вирусом гриппа А (IAV), так и вирусом репродуктивного и респираторного синдрома свиней (PRRSV), где инфицированные клетки округляются и отделяются от пластины. В случае PRRSV он вызывает CPE, известный как «полное разрушение», когда все клетки в конечном итоге отделяются от колодца. IAV, с другой стороны, может представлять как полное разрушение, так и дополнительный CPE, известный как «субтотальное разрушение», когда небольшое количество клеток не отделяется после заражения7. Однако этот метод занимает много времени и требует использования относительно дорогостоящих реагентов. Важно отметить, что ICC не маркирует CPE, а скорее количество клеток, успешно инфицированных вирусом. Это означает, что клетки, которые были успешно инфицированы к концу инкубации, будут рассматриваться как положительные, даже если инфекция еще не вызвала CPE, и, таким образом, ожидается более высокий процент положительных клеток ICC по сравнению с CPE. По этой причине в этом исследовании мы описываем дополнительный метод визуального обнаружения CPE в анализе TCID50 на основе кристаллического фиолетового, химического вещества с положительным зарядом, которое прикрепляется к клеточным мембранам и используется для окрашивания адгезивных клеток. Кристаллическая фиалка часто используется в вирусологических исследованиях для измерения бляшечных единиц, среди прочих8.
В этом исследовании мы сравниваем чувствительность обнаружения CPE в неокрашенной микроскопии с окрашиванием кристаллического фиолетового цвета и иммуноцитохимическим окрашиванием на основе распознавания вирусного белка, которое, как известно, является более объективным из-за его высокой чувствительности. Это исследование показывает, что как кристаллическое фиолетовое, так и иммуноцитохимическое окрашивание являются более точными, чем обнаружение CPE на основе визуальной микроскопии, и могут быть использованы для объективной идентификации инфицированных скважин при титровании TCID50. Учитывая их способность достигать почти одинакового уровня точности на цитопатических вирусах, протестированных в клеточных линиях, кристаллический фиолетовый представлен как более быстрый и доступный способ определения титрования вируса на анализе TCID50. Предлагаемый способ с использованием кристаллического фиолетового окрашивания занимает в общей сложности 40 мин для выполнения, с 15 мин для инкубации параформальдегида (PFA), 5 мин для инкубации кристаллической фиалки и максимум 15 мин для подготовки материала, буферной промывки и сушки. Протокол иммуноцитохимии, применяемый для сравнения, занимает в среднем 4 ч 30 мин и был выполнен так, как описано ранее9,10. Предложенный метод направлен на то, чтобы помочь визуализировать завершенное титрование вируса. Время заражения и инкубации может быть выполнено с различной компоновкой в зависимости от вируса. Здесь мы протестировали два РНК-вируса с цитопатическим действием на клеточные линии.
протокол
1. Протокол титрования
ПРИМЕЧАНИЕ: Используйте цитопатический вирус, заражающий адгезивные клетки. Для этой демонстрации использовались вирус гриппа А (IAV) свиного происхождения (A/California/07/2009/(H1N1)) и вирус репродуктивно-респираторного синдрома свиней (PRRSV) типа 2, штамм NC 1-7-4.
- Титруйте эти вирусы в 96 луночных пластинах в течение 7 дней в шкафу биобезопасности, расположенном в лаборатории уровня биобезопасности 2 (BSL-2).
- Для выполнения этих титрований засейте 96 луночных пластин необходимой клеточной линией. Для PRRSV используйте клеточную линию MA-104, а для IAV используйте клеточную линию MDCK. Для клеточной культуры используйте среду DMEM, дополненную 10% FBS, L-глутамином и пенициллин-стрептомицином, и выращивайте клетки до слияния.
- Перед заражением промывайте клетки, используя 200 мкл PBS.
- Разбавляют запасы вируса с помощью 10-кратного серии разбавлений путем смешивания 900 мкл среды и 100 мкл вируса. Убедитесь, что трубка правильно вихре, чтобы обеспечить правильное смешивание среды и вируса и избежать ошибок разбавления.
- Отметьте расположение пластины на крышке. Промывайте колодцы 1x фосфатным солевым буфером (PBS). Добавьте 50 мкл инокулята в соответствующие скважины, следуя ранее описанным методам титрования2,3.
- Инкубировать при 37 °C в 5% CO2 инкубаторе в течение 7 дней.
2. Оценка цитопатического эффекта (CPE) с помощью микроскопии
- После 7-дневной инкубации дважды промыть все колодцы 200 мкл 1x PBS.
- Оцените все колодцы пластины под световым микроскопом, чтобы визуально обнаружить CPE. В случае как PRRSV, так и IAV, их CPE состоит из гибели клеток и последующего отрыва от пластины, что приводит к разрушению монослоя. Однако другие вирусы могут представлять различные типы CPE.
3. Протокол окрашивания
ПРИМЕЧАНИЕ: Цитопатический эффект (CPE) оценивали с помощью кристаллического фиолетового окрашивания.
- После 7-дневной инкубации промыть все колодцы, используя 200 мкл 1x PBS дважды.
- Зафиксируйте клетки, добавив 50 мкл/лунку 4% параформальдегида (PFA) в 1x PBS и инкубируйте в течение 15 мин при комнатной температуре (RT).
- После инкубации промыть клетки дважды 200 мкл 1x PBS. Затем добавляют 50 мкл/лунку кристаллической фиалки, разведенной до 4% в воде, и инкубируют в течение 5 мин при РТ.
ПРИМЕЧАНИЕ: Кристалло-фиолетовый химический окрашивает клетки, которые остаются прикрепленными к пластине в момент фиксации, оставляя участки колодца, где ячейки отделяются, как незапятнанные. - Наконец, аспирируйте кристалл фиолетового цвета из лунок и необязательно оставьте пластины сушиться на воздухе в течение 2-5 минут на RT или промыть пластину 200 мкл воды, чтобы удалить лишнее пятно перед визуализацией.
- Используйте ранее описанные методы для математического вычисления титра. Здесь формула Карбера и формула Мюнха были применены для PRRSV и IAV соответственно2,3. Подробная информация об этих уравнениях представлена в разделе репрезентативных результатов.
4. Иммуноцитохимическая (ICC) маркировка
ПРИМЕЧАНИЕ: Иммуноцитохимическую маркировку для обоих вирусов проводили по ранее описанным способам9,10,11.
- После 7-дневной инкубации титрования зафиксируйте клетки с помощью PFA, как описано в шаге 3.2.
- Промыть пластины раствором, состоящим из 100 мл 1 М триса гидрохлорида, 1 г сапонина и 8,5 г NaCl в 900 мл H2O. Затем завершите две дополнительные промывки смесью 1x PBS и 5% фетальной бычьей сыворотки (FBS) и инкубируйте с этим раствором Tris-Saponin-NaCl при комнатной температуре (RT) в течение 20 минут.
- Инкубируют все лунки с первичным антителом в течение 2 ч при РТ.
ПРИМЕЧАНИЕ: Объем первичных антител для каждого вируса составлял 100 мкл и был получен с использованием разведения 1:300 2% FBS в 1x PBS. - Промыть клетки дважды раствором Tris, Saponin и NaCl, приготовленным на этапе 4.2.
- Инкубируют все лунки с вторичным антителом в течение 1 ч при РТ.
ПРИМЕЧАНИЕ: Объем вторичного антитела составлял 100 мкл и был получен с использованием разведения 1:250 2% FBS в 1x PBS. - Промыть клетки разбавлением Tris, Saponin и NaCl, как описано в шаге 4.2.
- Аспирировать предыдущее разведение и инкубировать пластины с 200 мкл/лунку раствора аминоэтилкарбазола (АЭК) при окончательном разведении 1:50 в воде по указанию производителя в течение 30 мин при РТ.
- После инкубации отбросьте раствор AEC и добавьте 100 мкл/лунку 1x PBS для визуализации с помощью микроскопии.
- Математически выведите титр, как описано в шаге 3.5.
Результаты
Уравнения, используемые для математического вычисления титра, были ранее описаны2,3.
Вкратце, для PRRSV мы применяем метод Карбера:
Титр (TCID50) = 10 T + 1,3 где:
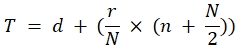
В ...
Обсуждение
Титрование вирусов обычно используется в вирусологических исследованиях, при этом наиболее часто используются определения PFU и анализы TCID501,2,3,4. Оба метода основаны на обнаружении CPE в инфицированных клетках, и хотя ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить доктора Фрэнка Шолле за его полезные комментарии в рукописи, Хлою Мариант за ее помощь с микроскопическими изображениями и Терезу М. Тидже за ее полезную английскую редакцию.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
Ссылки
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены