É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uso de Crystal Violet para melhorar a leitura baseada em efeito citopático visual para titulação viral usando ensaios TCID50
Neste Artigo
Resumo
Este protocolo mostra uma abordagem precisa e objetiva para visualizar as titulações virais usando violeta cristalina, comparando-a com microscopia óptica e coloração imunocitômica.
Resumo
A titulação viral é um ensaio fundamental para a pesquisa de virologia. A detecção do efeito citopático (CPE) via ensaios TCID50 e ensaios de unidades formadoras de placas (PFU) são os dois principais métodos para calcular o título de um estoque de vírus e muitas vezes são baseados na detecção de microscopia ou coloração celular para visualização. No caso do ensaio TCID50, a visualização objetiva é comumente baseada na coloração imunocytoquímica (ICC) do vírus intracelular para calcular titers combinados com a detecção visual de CPE via microscopia. No entanto, a coloração do ICC é cara e demorada. Neste estudo, comparamos a observação visual do CPE por meio de microscopia, coloração de ICC e coloração violeta cristalina para determinar os de dois vírus formadores de CPE, o vírus influenza A (IAV) de origem suína e o vírus da Síndrome Reprodutiva e Respiratória Porcine (PRRSV). Mostramos que tanto as manchas de cristal violeta quanto a icc são mais precisas do que a detecção visual de CPE, apresentando níveis quase idênticos de precisão tanto no IAV quanto no PRRSV. Por essa razão, aqui apresentamos a coloração violeta cristalina como uma maneira mais rápida e acessível de determinar as titulações virais em um ensaio TCID50 para vírus formadores de CPE titulados em linhas celulares.
Introdução
A titulação viral via ensaio TCID50 é uma técnica comumente utilizada em pesquisas de doenças infecciosas1. Embora as variações na matemática por trás desse método tenham sido propostas ao longo do tempo1,2,3,4, os métodos atualmente aplicados de detecção de infecções dependem da confirmação visual através da presença de efeito citopático (CPE) utilizando microscopia5. Para confirmar a visualização do CPE de forma mais objetiva nos ensaios do TCID50, a coloração intracelular imunocytoquímica (ICC) direcionada às proteínas do vírus é um dos métodos mais utilizados6, pois diferentes vírus podem produzir formas variadas de CPE. No nosso caso, as alterações morfológicas celulares são semelhantes quando infectadas tanto com o vírus influenza A (IAV) quanto com o Vírus da Síndrome Reprodutiva e Respiratória porcina (PRRSV), onde as células infectadas se põem e se desprendem da placa. No caso do PRRSV, causa um CPE conhecido como "destruição total", onde todas as células acabam se desprendendo do poço. O IAV, por outro lado, pode apresentar destruição total e um CPE adicional conhecido como "destruição subtotal" onde um pequeno número de células não se desprendem após a infecção7. No entanto, essa técnica é demorada para ser exetoada e requer o uso de reagentes relativamente caros. É importante notar que o ICC não rotula CPE, mas sim o número de células infectadas com sucesso pelo vírus. Isso implica que as células que foram infectadas com sucesso ao final da incubação serão vistas como positivas mesmo que a infecção ainda não tenha causado CPE e, portanto, um percentual maior de células positivas do ICC em comparação com o CPE é esperado. Por essa razão, neste estudo descrevemos um método complementar de detecção visual de CPE em um ensaio TCID50 baseado em violeta cristalina, um produto químico com uma carga positiva que se liga às membranas celulares e é usado para manchar células aderentes. O violeta cristalina é frequentemente utilizado em pesquisas de virologia para medir unidades formadoras de placas, entre outros8.
Neste estudo, comparamos a sensibilidade da detecção de CPE de microscopia não manchada com a coloração violeta cristalina e a coloração imunocitômica baseada no reconhecimento de proteínas virais, que é conhecida por ser mais objetiva devido à sua alta sensibilidade. Este estudo mostra que tanto as manchas cristalinas e imunocitômicas são mais precisas do que a detecção de CPE baseada em microscopia visual e podem ser usadas para identificar objetivamente poços infectados em uma titulação TCID50. Dada a sua capacidade de atingir um nível quase idêntico de precisão nos vírus citopáticos testados em linhas celulares, o cristal violeta é apresentado como uma maneira mais rápida e acessível de determinar as titulações virais em um ensaio TCID50. O método proposto utilizando coloração violeta cristalina leva um tempo total de 40 minutos para ser realizado, com 15 min para incubação de paraformaldeído (PFA), 5 min para incubação violeta cristalina e um máximo de 15 minutos para preparação do material, lavagem tampão e secagem. O protocolo de imunocitoquímica aplicado para comparação leva um tempo médio de 4h 30 min e foi realizado como descrito anteriormente9,10. O método proposto visa ajudar a visualizar uma titulação viral completa. Os tempos de infecção e incubação podem ser realizados com layout diferente, dependendo do vírus. Aqui testamos dois vírus de RNA com efeito citopático nas linhas celulares.
Protocolo
1. Protocolo de titulação
NOTA: Use um vírus citopático infectando células aderentes. Para esta demonstração, foram utilizados vírus influenza A (IAV) de origem suína (A/Califórnia/07/2009/(H1N1)) e Vírus da Síndrome Reprodutiva e Respiratória Suína (PRRSV) Tipo 2, cepa NC 1-7-4.
- Titula esses vírus em 96 placas de poço por 7 dias em um armário de biossegurança localizado em um laboratório de Biossegurança Nível 2 (BSL-2).
- Para realizar essas titulações, semente 96 placas de bem com a linha celular necessária. Para PRRSV, use a linha de células MA-104 e para iav use linha de célula MDCK. Para a cultura celular, use o meio DMEM suplementado com 10% de FBS, L-Glutamina e Penfilina-Estreptomicina e cresça as células para confluência.
- Antes da infecção, lave as células usando 200 μL de PBS.
- Diluir os estoques de vírus usando séries de diluições de 10 dobras misturando 900 μL de mídia e 100 μL de vírus. Certifique-se de obter o vórtice adequado do tubo para garantir a mistura adequada do meio e do vírus e para evitar erros de diluição.
- Marque o layout da placa na tampa. Lave os poços com 1x tampão salino fosfato (PBS). Adicione 50 μL do inóculo nos poços correspondentes seguindo métodos de titulação descritos anteriormente2,3.
- Incubar a 37 °C em uma incubadora de CO2 de 5% durante 7 dias.
2. Avaliação do efeito citopático (CPE) via microscopia
- Após a incubação de 7 dias, lave todos os poços com 200 μL de 1x PBS duas vezes.
- Avalie todos os poços da placa sob um microscópio leve para detectar visualmente cpe. No caso de PRRSV e IAV, seu CPE consiste em morte celular e descolamento subsequente da placa, levando à interrupção da monocamada. No entanto, outros vírus podem apresentar diferentes tipos de CPE.
3. Protocolo de coloração
NOTA: O efeito citopático (CPE) foi avaliado por meio de coloração violeta cristalina.
- Após a incubação de 7 dias, lave todos os poços usando 200 μL de 1x PBS duas vezes.
- Fixar as células adicionando 50 μL/well de 4% de paraformaldeído (PFA) em 1x PBS e incubar por 15 min à temperatura ambiente (RT).
- Após a incubação, lave as células duas vezes com 200 μL de 1x PBS. Em seguida, adicione 50 μL/poço de violeta cristalina diluída a 4% em água e incubar por 5 min no RT.
NOTA: A química cristalina mancha as células que permanecem presas à placa no momento da fixação, deixando as seções do poço onde as células se destacavam como não manchadas. - Por fim, aspire o cristal violeta dos poços e, opcionalmente, deixe as placas secarem por 2-5 min na RT ou lave a placa com 200 μL de água para remover o excesso de mancha antes da visualização.
- Use métodos descritos anteriormente para calcular matematicamente o título. Aqui, a fórmula karber e a fórmula muench foram aplicadas para PRRSV e IAV, respectivamente 2,3. Os detalhes dessas equações são apresentados na seção de resultados representativos.
4. Rotulagem imunocitoquímica (ICC)
NOTA: A rotulagem imunocytoquímica para ambos os vírus foi realizada seguindo métodos descritos anteriormente9,10,11.
- Após a incubação de 7 dias da titulação, fixar as células usando PFA conforme descrito na etapa 3.2.
- Lave as placas com uma solução composta por 100 mL de cloridrato tris de 1 M, 1 g de Saponin e 8,5 g de NaCl em 900 mL de H2O. Em seguida, complete duas lavagens adicionais com uma mistura de 1x PBS e 5% de Soro Bovino Fetal (FBS) e incubar com essa solução Tris-Saponin-NaCl à temperatura ambiente (RT) por 20 minutos.
- Incubar todos os poços com o anticorpo primário por 2 h na RT.
NOTA: O volume de anticorpos primários para cada vírus foi de 100 μL e foi preparado utilizando-se uma diluição de 1:300 de 2% de FBS em 1x PBS. - Lave as células duas vezes com a solução Tris, Saponin e NaCl preparadas na etapa 4.2.
- Incubar todos os poços com o anticorpo secundário por 1 h na RT.
NOTA: O volume de anticorpos secundários foi de 100 μL e foi preparado utilizando-se uma diluição de 1:250 de 2% de FBS em 1x PBS. - Lave as células com a diluição tris, saponina e nacl, conforme descrito na etapa 4.2.
- Aspire a diluição anterior e incuba as placas com 200 μL/poço de solução de carbazole de aminoetil (AEC) em uma diluição final de 1:50 na água seguindo as instruções do fabricante por 30 min na RT.
- Após a incubação, descarte a solução AEC e adicione 100 μL/well de 1x PBS para imagem via microscopia.
- Deriva matematicamente o título como descrito na etapa 3.5.
Resultados
As equações utilizadas para calcular matematicamente o título foram descritas anteriormente2,3.
Brevemente, para PRRSV, aplicamos o método Karber:
Titer (TCID50) = 10 T + 1,3 onde:
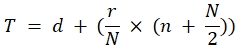
Nesta fórmula d = registro negativo da última diluição com resposta completa positiva do...
Discussão
As titulações virais são rotineiramente utilizadas em pesquisas de virologia, com detecção de PFU e ensaios TCID50 mais comumente utilizados1,2,3,4. Ambos os métodos dependem da detecção de CPE em células infectadas, e mesmo que possam ser avaliados visualmente via microscopia, uma coloração geralmente é aplicada para obter um resultado mais objetivo ou até mesmo reduzir o...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de reconhecer o Dr. Frank Scholle por seus comentários úteis no manuscrito, Chloe Mariant por sua ajuda com as imagens de microscopia e Teresa M. Tiedge por sua revisão útil em inglês.
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
Referências
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados