需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用晶体紫改善使用 TCID50 检测法进行病毒滴定的基于视觉细胞病变效应的读数
摘要
该协议显示了一种准确客观的方法,通过将晶体紫与光学显微镜和免疫细胞化学染色进行比较,可视化病毒滴定。
摘要
病毒滴定是病毒学研究的关键检测方法。 通过 TCID50 检测和斑块形成单元 (PFU) 检测细胞病变效应 (CPE) 是计算病毒储备滴度的两种主要方法,通常基于显微镜检测或细胞染色进行可视化。在 TCID50 测定的情况下,客观可视化通常基于细胞内病毒的免疫细胞化学 (ICC) 染色,以计算滴度, 并通过显微镜进行 视觉 CPE 检测。然而,ICC染色既昂贵又耗时。在这项研究中,我们比较了 通过 显微镜,ICC染色和结晶紫染色的视觉CPE观察,以确定两种CPE形成病毒的滴度,猪源性甲型流感病毒(IAV)和猪繁殖和呼吸综合征病毒(PRRSV)。我们表明,结晶紫和ICC染色都比视觉CPE检测更准确,在IAV和PRRSV上呈现几乎相同的精度水平。出于这个原因,在这里,我们将结晶紫染色作为一种更快,更实惠的方法,用于在TCID50测定中测定细胞系中滴定的CPE形成病毒。
引言
通过 TCID50 测定进行病毒滴定是传染病研究中常用的技术1。尽管随着时间的推移,已经提出了该方法背后的数学变化1,2,3,4,但目前应用的感染检测方法依赖于通过使用显微镜的细胞病变效应(CPE)的存在进行视觉确认5。为了在 TCID50 测定中更客观地确认 CPE 可视化,靶向病毒蛋白的免疫细胞化学 (ICC) 细胞内染色是最常用的方法之一6,因为不同的病毒可以产生不同形式的 CPE。在我们的例子中,当感染甲型流感病毒(IAV)和猪繁殖与呼吸综合征病毒(PRRSV)时,细胞形态变化是相似的,其中受感染的细胞从板中聚集并分离。在PRRSV的情况下,它会导致称为"完全破坏"的CPE,其中所有细胞最终都从孔中分离出来。另一方面,IAV可以同时存在完全破坏和称为"次级破坏"的额外CPE,其中少量细胞在感染后不会分离7。然而,这种技术执行起来非常耗时,并且需要使用相对昂贵的试剂。重要的是要注意,ICC不标记CPE,而是标记被病毒成功感染的细胞数量。这意味着,即使感染尚未引起CPE,在孵育结束时成功感染的细胞也将被视为阳性,因此,与CPE相比,ICC阳性细胞的比例更高。出于这个原因,在这项研究中,我们描述了一种基于晶体紫的TCID50测定中CPE视觉检测的补充方法,晶体紫是一种具有正电荷的化学物质,附着在细胞膜上并用于染色贴壁细胞。晶体紫通常用于病毒学研究,以测量斑块形成单位等8。
在这项研究中,我们将非染色显微镜CPE检测与基于病毒蛋白识别的结晶紫染色和免疫细胞化学染色的灵敏度进行了比较,由于其高灵敏度,已知其更客观。该研究表明,结晶紫染色和免疫细胞化学染色都比基于视觉显微镜的CPE检测更准确,可用于在TCID50滴定中客观地鉴定感染孔。鉴于它们在细胞系中测试的细胞病变病毒上能够达到几乎相同的准确度,因此晶体紫被呈现为在TCID50测定中测定病毒滴定更快,更实惠的方法。所提出的使用晶体紫染色的方法需要40分钟的总时间,多聚甲醛(PFA)孵育15分钟,晶体紫孵育5分钟,材料制备,缓冲液洗涤和干燥最长15分钟。用于比较的免疫细胞化学方案平均需要4小时30分钟的时间,并如前所述进行9,10。所提出的方法旨在帮助可视化完成的病毒滴定。感染和潜伏时间可以根据病毒的不同布局进行。在这里,我们测试了两种对细胞系具有细胞病变作用的RNA病毒。
研究方案
1. 滴定方案
注意:使用感染贴壁细胞的细胞病变病毒。在本次演示中,使用了猪源性甲型流感病毒(IAV)(A/California/07/2009/(H1N1))和猪繁殖与呼吸综合征病毒(PRRSV)2型NC 1-7-4。
- 在位于生物安全2级(BSL-2)实验室的生物安全柜中,在96孔板中滴定这些病毒7天。
- 为了进行这些滴定,用所需的细胞系接种96孔板。对于 PRRSV,使用 MA-104 细胞系,对于 IAV,使用 MDCK 细胞系。对于细胞培养,使用补充有10%FBS,L-谷氨酰胺和青霉素 - 链霉素的DMEM培养基,并将细胞培养至汇合。
- 感染前,使用200μLPBS洗涤细胞。
- 通过混合900μL培养基和100μL病毒,使用10倍稀释系列稀释病毒储备。确保正确涡旋管,以确保培养基和病毒的适当混合,并避免稀释错误。
- 在盖子上标记盘子的布局。用1x磷酸盐盐缓冲液(PBS)洗涤孔。按照前面描述的滴定方法,在相应的孔中加入50μL接种物2,3。
- 在37°C下在5%CO 2 培养箱中孵育7天。
2. 通过 显微镜检查进行细胞病变效应(CPE)评估
- 7天孵育后,用200μL1x PBS洗涤所有孔两次。
- 在光学显微镜下评估板的所有孔,以目测CPE。在PRRSV和IAV的情况下,它们的CPE包括细胞死亡和随后从板中脱离,导致单层破坏。然而,其他病毒可能出现不同类型的CPE。
3. 染色方案
注意: 通过 结晶紫染色评估细胞病变效应(CPE)。
- 孵育7天后,使用200μL1x PBS洗涤所有孔两次。
- 通过在1x PBS中加入50μL/孔4%多聚甲醛(PFA)并在室温(RT)下孵育15分钟来固定细胞。
- 孵育后,用200μL1x PBS洗涤细胞两次。然后,在水中加入50μL/孔稀释至4%的结晶紫,并在室温下孵育5分钟。
注意:结晶紫化学染色在固定时仍然附着在板上的细胞,使细胞分离的孔部分未染色。 - 最后,从孔中吸取结晶紫,并任选地将板在室温下风干2-5分钟,或用200μL水洗涤板以除去多余的污渍,然后再可视化。
- 使用前面描述的方法以数学方式计算滴度。其中,将Karber公式和Muench公式分别应用于PRRSV和IAV2,3。这些方程的详细信息在代表性结果部分中提供。
4. 免疫细胞化学(ICC)标记
注意:两种病毒的免疫细胞化学标记均按照先前描述的方法进行9,10,11。
- 滴定7天孵育后,按照步骤3.2中所述使用PFA固定细胞。
- 用由100mL 1M Tris盐酸盐,1g皂苷和8.5gNaCl在900mL H 2 O中组成的溶液洗涤板。然后,用1x PBS和5%胎牛血清(FBS)的混合物完成两次额外的洗涤,并在室温(RT)下用Tris-皂苷-NaCl溶液孵育20分钟。
- 在室温下用一抗孵育所有孔2小时。
注意:每种病毒的一抗体积为100μL,并使用1:300稀释的2%FBS在1x PBS中制备。 - 用步骤4.2中制备的Tris,皂苷和NaCl溶液洗涤细胞两次。
- 用二抗在室温下孵育所有孔1小时。
注:二抗的体积为100μL,使用1:250稀释液2%FBS在1x PBS中制备。 - 用Tris,皂苷和NaCl稀释液洗涤细胞,如步骤4.2中所述。
- 吸取先前的稀释,并按照制造商的指示在室温下用200μL/孔氨基乙基咔唑(AEC)溶液在水中以1:50的最终稀释度孵育板30分钟。
- 孵育后,弃去AEC溶液,加入100μL/孔1x PBS ,通过 显微镜进行成像。
- 从数学上推导出滴度,如步骤 3.5 中所述。
结果
用于数学计算滴度的方程之前已有描述2,3。
简而言之,对于PRRSV,我们应用Karber方法:
滴度 (TCID50) = 10 T + 1.3 其中:
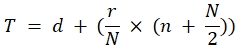
在此公式中,d = 具有完全阳性病毒反应的最后稀释的负对数:五个阳性重复;r = 稀释范围对数...
讨论
病毒滴定法通常用于病毒学研究,最常用的是PFU检测和TCID50测定1,2,3,4。这两种方法都依赖于感染细胞中CPE的检测,即使 可以通过显微镜对 它们进行视觉评估,通常也要进行染色以获得更客观的结果,甚至减少孵育时间。就 TCID50 而言,ICC 染色是视觉 CPE 检测最常用的替代方法之一,可提?...
披露声明
作者没有什么可透露的。
致谢
作者要感谢Frank Scholle博士在手稿中的有益评论,Chloe Mariant对显微镜图像的帮助以及Teresa M. Tiedge对她有用的英文修订。
材料
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
参考文献
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。