A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש קריסטל ויולט כדי לשפר קריאה חזותית אפקט ציטוטופתי מבוסס עבור טיטציה ויראלית באמצעות TCID50 Assays
In This Article
Summary
פרוטוקול זה מציג גישה מדויקת ואובייקטיבית לדמיין טיטריוציות ויראליות באמצעות סגול קריסטל, על ידי השוואתו עם מיקרוסקופיה אופטית וכתמים אימונוציטוכימיים.
Abstract
טיטציה ויראלית היא בדיקת מפתח למחקר וירולוגיה. זיהוי של אפקט ציטוטופתי (CPE) באמצעות בדיקות TCID50 ויחידות יוצרות פלאק (PFU) הן שתי השיטות העיקריות לחישוב טיטר של מלאי וירוסים ומבוססות לעתים קרובות על זיהוי מיקרוסקופיה או כתמי תאים להדמיה. במקרה של TCID50 assay, ויזואליזציה אובייקטיבית מבוססת בדרך כלל על כתמים אימונוציטוכימיים (ICC) של וירוס תאי לחישוב titers בשילוב עם זיהוי CPE חזותי באמצעות מיקרוסקופיה. עם זאת, כתמי בית הדין הפלילי הבינלאומי יקרים וגוזלים זמן רב. במחקר זה, השווינו תצפית CPE חזותית באמצעות מיקרוסקופיה, כתמי ICC וכתמים סגול קריסטל כדי לקבוע את titers של שני וירוסים יוצרי CPE, וירוס שפעת A (IAV) ממוצא חזירים ווירוס הרבייה והנשימה חזירית (PRRSV). אנו מראים כי הן הכתמת קריסטל סגול ו- ICC מדויקות יותר מזיהוי CPE חזותי, ומציגות רמות דיוק כמעט זהות הן ב- IAV והן ב- PRRSV. מסיבה זו, כאן אנו מציגים כתמים סגול קריסטל כדרך מהירה ובמחיר סביר יותר לקבוע titrations ויראלי על TCID50 assay עבור וירוסים יוצרי CPE titrated בשורות התא.
Introduction
טיטציה ויראלית באמצעות TCID50 assay היא טכניקה נפוצה במחקר מחלות זיהומיות1. למרות וריאציות על המתמטיקה מאחורי שיטה זו הוצעו לאורך זמן1,2,3,4, השיטות המיושמות כיום של זיהוי זיהום מסתמכות על אישור חזותי באמצעות נוכחות של אפקט ציטוטופתי (CPE) באמצעות microscopy5. כדי לאשר הדמיה CPE אובייקטיבית יותר על TCID50 assays, immunocytochemical (ICC) כתמים תאיים מיקוד החלבונים של הנגיף היא אחת השיטות הנפוצות ביותר6 כמו וירוסים שונים יכולים לייצר צורות שונות של CPE. במקרה שלנו, השינויים המורפולוגיים של התא דומים כאשר נגועים הן בנגיף שפעת A (IAV) והן בווירוס הרבייה והתסמונת הנשימתית החזירית (PRRSV), שם תאים נגועים אוספים ומתנתקים מהצלחת. במקרה של PRRSV, זה גורם CPE המכונה "הרס מוחלט", שבו כל התאים בסופו של דבר ניתוק מן הבאר. IAV לעומת זאת, יכול להציג הן הרס מוחלט והן CPE נוסף המכונה "הרס סכום ביניים" שבו מספר קטן של תאים אינם מתנתקים לאחר זיהום7. עם זאת, טכניקה זו גוזלת זמן רב לביצוע ודורש שימוש ריאגנטים יקרים יחסית. חשוב לציין כי ICC אינו מתייג CPE, אלא את מספר התאים שנדבקו בהצלחה על ידי הנגיף. משמעות הדבר היא כי התאים שנדבקו בהצלחה עד סוף הדגירה ייראו כחיוביים גם אם הזיהום עדיין לא גרם ל- CPE, ולכן, צפוי אחוז גבוה יותר של תאים חיוביים של ICC בהשוואה ל- CPE. מסיבה זו, במחקר זה אנו מתארים שיטה משלימה של זיהוי חזותי של CPE ב TCID50 assay המבוסס על סגול קריסטל, כימי עם מטען חיובי המתחבר קרום התא ומשמש להכתים תאים דבקים. סגול קריסטל משמש לעתים קרובות במחקר וירולוגיה כדי למדוד יחידות יוצרות פלאק, בין היתר8.
במחקר זה, אנו משווים את הרגישות של זיהוי CPE מיקרוסקופי לא מוכתם עם כתמים סגול קריסטל וכתמים אימונוציטוכימיים המבוססים על זיהוי חלבון ויראלי, אשר ידוע להיות אובייקטיבי יותר בשל הרגישות הגבוהה שלה. מחקר זה מראה כי הן סגול קריסטל וחיסון כתמים מדויקים יותר מאשר זיהוי CPE מבוסס מיקרוסקופיה חזותית וניתן להשתמש בהם כדי לזהות באופן אובייקטיבי בארות נגועות TCID50 titration. בהתחשב ביכולתם להגיע לרמת דיוק כמעט זהה על וירוסים ציטוטופתיים שנבדקו בקווי תאים, סגול קריסטל מוצג כדרך מהירה ובמחיר סביר יותר לקבוע טיטריוציות ויראליות על TCID50 assay. השיטה המוצעת באמצעות כתמים סגול קריסטל לוקח זמן כולל של 40 דקות לבצע, עם 15 דקות עבור דגירה paraformaldehyde (PFA), 5 דקות עבור דגירה סגול קריסטל מקסימום של 15 דקות להכנת חומר, שחיץ, וייבוש. פרוטוקול אימונוציטוכימיה שהוחל להשוואה לוקח זמן ממוצע של 4 שעות 30 דקות ובוצע כפי שתואר בעבר9,10. השיטה המוצעת נועדה לעזור לדמיין טיטציה ויראלית שהושלמה. זמני זיהום ודגרה יכולים להתבצע בפריסה שונה בהתאם לנגיף. כאן בדקנו שני וירוסי RNA עם השפעה ציטוטפתית על קווי התא.
Protocol
1. פרוטוקול טיטריון
הערה: השתמש בווירוס ציטוטופתי המדביק תאים חסידים. להדגמה זו, וירוס שפעת A (IAV) ממוצא חזירים (A / קליפורניה / 07/2009 /(H1N1)) ווירוס הרבייה והנשימה חזירית (PRRSV) סוג 2, זן NC 1-7-4 שימשו.
- טירט וירוסים אלה ב 96 לוחות היטב במשך 7 ימים בארון בטיחות ביולוגית הממוקם במעבדה Biosafety רמה 2 (BSL-2).
- כדי לבצע titrations אלה, זרע 96 לוחות היטב עם קו התא הנדרש. עבור PRRSV, השתמש בקו תא MA-104 ו עבור IAV השתמש בקו תא MDCK. עבור תרבית התא, להשתמש במדיום DMEM בתוספת 10% FBS, L-גלוטמין ופניצילין-סטרפטומיצין ולהגדיל את התאים למפגש.
- לפני ההדבקה, לשטוף את התאים באמצעות 200 μL של PBS.
- לדלל את מלאי הווירוס באמצעות סדרת דילול פי 10 על ידי ערבוב 900 μL של מדיה ו 100 μL של וירוס. הקפד למערבולת כראוי את הצינור כדי להבטיח ערבוב נכון של המדיום והוירוס כדי למנוע שגיאות דילול.
- סמן את פריסת הצלחת על המכסה. לשטוף את בארות עם 1x חוצץ מלוח פוספט (PBS). הוסף 50 μL של inoculum בבארות המתאימות לאחר שיטות טיטריון שתוארו בעבר2,3.
- דגירה ב 37 °C (5° C) אינקובטור CO2 במשך 7 ימים.
2. הערכת אפקט ציטוטופתי (CPE) באמצעות מיקרוסקופיה
- לאחר הדגירה של 7 ימים, לשטוף את כל הבארות עם 200 μL של 1x PBS פעמיים.
- להעריך את כל הבארות של הלוח תחת מיקרוסקופ אור כדי לזהות חזותית CPE. במקרה של PRRSV ו- IAV, CPE שלהם מורכב מוות תא וניתוק לאחר מכן מהצלחת, מה שמוביל להפרעה monolayer. עם זאת, וירוסים אחרים עשויים להציג סוגים שונים של CPE.
3. פרוטוקול הכתמת
הערה: אפקט ציטופתי (CPE) הוערך באמצעות כתמים סגול קריסטל.
- לאחר הדגירה של 7 ימים, לשטוף את כל הבארות באמצעות 200 μL של 1x PBS פעמיים.
- תקן את התאים על ידי הוספת 50 μL / באר של 4% paraformaldehyde (PFA) ב 1x PBS ודגרה במשך 15 דקות בטמפרטורת החדר (RT).
- לאחר הדגירה, לשטוף את התאים פעמיים עם 200 μL של 1x PBS. לאחר מכן, להוסיף 50 μL / באר של סגול קריסטל מדולל ל 4% במים ודגרה במשך 5 דקות ב RT.
הערה: כימיקל סגול קריסטל מכתים את התאים שנותרו מחוברים לצלחת בזמן הקיבעון, ומשאירים את חלקי הבאר שבהם התאים מנותקים ללא מוכתמים. - לבסוף, לשאוף סגול קריסטל מן בארות ובאופן אופציונלי להשאיר את הצלחות לאוויר יבש במשך 2-5 דקות ב RT או לשטוף את הצלחת עם 200 μL של מים כדי להסיר כתם עודף לפני הדמיה.
- השתמש בשיטות שתוארו בעבר כדי לחשב מתמטית את הטיטר. כאן, נוסחת קרבר ונוסחת Muench הוחלו על PRRSV ו- IAV, בהתאמה 2,3. פרטים של משוואות אלה מוצגים בסעיף התוצאה הייצוגית.
4. תיוג אימונוציטוכימי (ICC)
הערה: תיוג אימונוציטוכימיה עבור שני הווירוסים בוצע בעקבות שיטות שתוארו בעבר9,10,11.
- לאחר הדגירה של 7 ימים של titration, לתקן את התאים באמצעות PFA כמתואר בשלב 3.2.
- לשטוף את הצלחות עם פתרון המורכב על ידי 100 מ"ל של 1 M טריס הידרוכלוריד, 1 גרם של סאפונין, ו 8.5 גרם של NaCl ב 900 מ"ל של H2O. לאחר מכן, להשלים שתי שטיפות נוספות עם תערובת של 1x PBS ו 5% סרום בקר עוברי (FBS) ודגורה עם פתרון טריס-סאפונין-NaCl בטמפרטורת החדר (RT) במשך 20 דקות.
- לדגור את כל הבארות עם הנוגדן העיקרי עבור 2 שעות ב RT.
הערה: נפח הנוגדנים העיקריים עבור כל וירוס היה 100 μL והוכן באמצעות דילול 1:300 של 2% FBS ב 1x PBS. - לשטוף את התאים פעמיים עם פתרון טריס, סאפונין, ו NaCl מוכן בשלב 4.2.
- לדגור את כל בארות עם הנוגדן המשני עבור 1 שעה ב RT.
הערה: נפח הנוגדן המשני היה 100 μL והוכן באמצעות דילול של 1:250 של 2% FBS ב- 1x PBS. - לשטוף את התאים עם דילול טריס, סאפונין, ו NaCl כמתואר בשלב 4.2.
- שאפו לדילול הקודם ודגרו את הלוחות עם 200 μL / באר של תמיסה אמינואתיל קרבזול (AEC) בדילול סופי של 1:50 במים בעקבות הוראות היצרן במשך 30 דקות ב RT.
- לאחר הדגירה, להשליך את פתרון AEC ולהוסיף 100 μL / באר של 1x PBS עבור הדמיה באמצעות מיקרוסקופיה.
- נגזר מתמטית את טיטר כמתואר בשלב 3.5.
תוצאות
המשוואות ששימשו לחישוב מתמטי של הטיטר תוארו בעבר2,3.
בקצרה, עבור PRRSV, אנו מיישמים את שיטת קארבר:
טיטר (TCID50) = 10 T + 1.3 שבו:
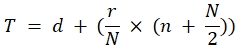
בנוסחה זו d = יומן שלילי של הדילול האחר...
Discussion
טייטציות ויראליות משמשות באופן שגרתי במחקר וירולוגיה, עם זיהוי PFU וביקורי TCID50 הנפוצים ביותר 1,2,3,4. שתי השיטות מסתמכות על זיהוי CPE בתאים נגועים, ולמרות שניתן להעריך אותם חזותית באמצעות מיקרוסקופיה, כתמים מוחלים בדרך ...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות לד"ר פרנק שולר על הערותיו המועילות בכתב היד, קלואי מריאנט על עזרתה בתמונות המיקרוסקופיה ותרזה מ. טדג' על הגרסה האנגלית המועילה שלה.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
References
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved