Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Uso de crystal violet para mejorar la lectura basada en el efecto citopático visual para la valoración viral utilizando ensayos TCID50
En este artículo
Resumen
Este protocolo muestra un enfoque preciso y objetivo para visualizar las valoraciones virales utilizando cristal violeta, comparándolo con la microscopía óptica y la tinción inmunocitoquímica.
Resumen
La titulación viral es un ensayo clave para la investigación en virología. La detección del efecto citopático (CPE) a través de ensayos TCID50 y ensayos de unidades formadoras de placa (PFU) son los dos métodos principales para calcular el título de un stock de virus y a menudo se basan en la detección de microscopía o tinción celular para la visualización. En el caso del ensayo TCID50, la visualización objetiva se basa comúnmente en la tinción inmunocitoquímica (ICC) del virus intracelular para calcular los títulos combinados con la detección visual de CPE a través de microscopía. Sin embargo, la tinción ICC es costosa y requiere mucho tiempo. En este estudio, comparamos la observación visual de CPE a través de microscopía, tinción ICC y tinción violeta cristalina para determinar los títulos de dos virus formadores de CPE, el virus de la influenza A (IAV) de origen porcino y el virus del síndrome reproductivo y respiratorio porcino (PRRSV). Demostramos que tanto la tinción violeta cristalina como la ICC son más precisas que la detección visual de CPE, presentando niveles casi idénticos de precisión tanto en IAV como en PRRSV. Por esta razón, aquí presentamos la tinción violeta cristalina como una forma más rápida y asequible de determinar las valoraciones virales en un ensayo TCID50 para virus formadores de CPE titulados en líneas celulares.
Introducción
La titulación viral mediante ensayo TCID50 es una técnica de uso común en la investigación de enfermedades infecciosas1. Aunque a lo largo del tiempo se han propuesto variaciones en las matemáticas detrás de este método1,2,3,4, los métodos de detección de infecciones actualmente aplicados se basan en la confirmación visual a través de la presencia de efecto citopático (CPE) mediante microscopía5. Para confirmar la visualización de CPE de manera más objetiva en los ensayos TCID50, la tinción intracelular inmunocitoquímica (ICC) dirigida a las proteínas del virus es uno de los métodos más utilizados6, ya que diferentes virus pueden producir diferentes formas de CPE. En nuestro caso, los cambios morfológicos celulares son similares cuando se infectan tanto con el virus de la influenza A (IAV) como con el virus del síndrome reproductivo y respiratorio porcino (PRRSV), donde las células infectadas se redondean y se desprenden de la placa. En el caso del PRRSV, provoca un CPE conocido como "destrucción total", donde todas las células acaban desprendiéndose del pozo. La IAV, por otro lado, puede presentar tanto destrucción total como un CPE adicional conocido como "destrucción subtotal" donde un pequeño número de células no se desprenden después de la infección7. Sin embargo, esta técnica requiere mucho tiempo para realizarse y requiere el uso de reactivos relativamente costosos. Es importante tener en cuenta que ICC no etiqueta CPE, sino más bien el número de células infectadas con éxito por el virus. Esto implica que las células que se infectaron con éxito al final de la incubación se verán como positivas incluso si la infección aún no ha causado CPE y, por lo tanto, se espera un mayor porcentaje de células ICC positivas en comparación con CPE. Por esa razón, en este estudio describimos un método complementario de detección visual de CPE en un ensayo TCID50 basado en cristal violeta, un químico con una carga positiva que se adhiere a las membranas celulares y se utiliza para teñir las células adherentes. El violeta cristalino se utiliza a menudo en la investigación virológica para medir las unidades formadoras de placa, entre otros8.
En este estudio, comparamos la sensibilidad de la detección de CPE por microscopía no teñida con la tinción violeta cristalina y la tinción inmunocitoquímica basada en el reconocimiento de proteínas virales, que se sabe que es más objetiva debido a su alta sensibilidad. Este estudio muestra que tanto la tinción violeta cristalina como la inmunocitoquímica son más precisas que la detección de CPE basada en microscopía visual y se pueden usar para identificar objetivamente los pozos infectados en una titulación TCID50. Dada su capacidad para alcanzar un nivel casi idéntico de precisión en los virus citopáticos probados en líneas celulares, el violeta cristalino se presenta como una forma más rápida y asequible de determinar las valoraciones virales en un ensayo TCID50. El método propuesto que utiliza la tinción violeta cristalina tarda un tiempo total de 40 minutos en realizarse, con 15 minutos para la incubación de paraformaldehído (PFA), 5 minutos para la incubación de violeta cristalina y un máximo de 15 minutos para la preparación del material, los lavados tampón y el secado. El protocolo de inmunocitoquímica aplicado para la comparación tiene un tiempo medio de 4 h 30 min y se realizó como se describió anteriormente9,10. El método propuesto tiene como objetivo ayudar a visualizar una titulación viral completa. Los tiempos de infección e incubación se pueden realizar con diferentes diseños dependiendo del virus. Aquí probamos dos virus de ARN con efecto citopático en líneas celulares.
Protocolo
1. Protocolo de valoración
NOTA: Use un virus citopático que infecte las células adherentes. Para esta demostración se utilizaron el Virus de la Influenza A (IAV) de origen porcino (A/California/07/2009/(H1N1)) y el Virus del Síndrome Reproductivo y Respiratorio Porcino (PRRSV) Tipo 2, cepa NC 1-7-4.
- Titule estos virus en 96 placas de pozo durante 7 días en un gabinete de bioseguridad ubicado en un laboratorio de Nivel de Bioseguridad 2 (BSL-2).
- Para realizar estas valoraciones, sembra 96 placas de pozo con la línea celular requerida. Para PRRSV, use la línea celular MA-104 y para IAV use la línea celular MDCK. Para el cultivo celular, use el medio DMEM suplementado con 10% fbs, L-glutamina y penicilina-estreptomicina y haga crecer las células hasta la confluencia.
- Antes de la infección, lave las células con 200 μL de PBS.
- Diluir las existencias de virus utilizando series de diluciones de 10 veces mezclando 900 μL de medios y 100 μL de virus. Asegúrese de vórtice correctamente el tubo para garantizar una mezcla adecuada del medio y el virus y para evitar errores de dilución.
- Marque el diseño de la placa en la tapa. Lave los pocillos con 1 tampón salino de fosfato (PBS). Añadir 50 μL del inóculo en los pozos correspondientes siguiendo los métodos de titulación previamente descritos2,3.
- Incubar a 37 °C en una incubadora de CO2 al 5% durante 7 días.
2. Evaluación del efecto citopático (CPE) mediante microscopía
- Después de la incubación de 7 días, lave todos los pocillos con 200 μL de 1x PBS dos veces.
- Evalúe todos los pocillos de la placa bajo un microscopio de luz para detectar visualmente el CPE. En el caso tanto del PRRSV como del IAV, su CPE consiste en la muerte celular y el posterior desprendimiento de la placa, lo que lleva a la interrupción de la monocapa. Sin embargo, otros virus pueden presentar diferentes tipos de CPE.
3. Protocolo de tinción
NOTA: El efecto citopático (CPE) se evaluó mediante tinción violeta cristalina.
- Después de la incubación de 7 días, lave todos los pocillos con 200 μL de 1x PBS dos veces.
- Fije las células agregando 50 μL/pocillo de paraformaldehído al 4% (PFA) en 1x PBS e incube durante 15 min a temperatura ambiente (RT).
- Después de la incubación, lave las células dos veces con 200 μL de 1x PBS. Luego, agregue 50 μL / pozo de violeta cristalina diluida al 4% en agua e incube durante 5 min a RT.
NOTA: El cristal violeta químico tiñe las células que permanecen adheridas a la placa en el momento de la fijación, dejando las secciones del pozo donde las células se desprenden como no teñidas. - Finalmente, aspire el cristal violeta de los pocillos y, opcionalmente, deje que las placas se sequen al aire durante 2-5 minutos a RT o lave la placa con 200 μL de agua para eliminar el exceso de manchas antes de la visualización.
- Utilice los métodos descritos anteriormente para calcular matemáticamente el título. Aquí, se aplicaron la fórmula de Karber y la fórmula de Muench para PRRSV e IAV, respectivamente2,3. Los detalles de estas ecuaciones se presentan en la sección de resultados representativos.
4. Etiquetado inmunocitoquímico (ICC)
NOTA: El etiquetado inmunocitoquímico para ambos virus se realizó siguiendo los métodos descritos anteriormente9,10,11.
- Después de la incubación de 7 días de la titulación, fije las células usando PFA como se describe en el paso 3.2.
- Lavar las placas con una solución compuesta por 100 mL de 1 M de clorhidrato de Tris, 1 g de Saponina y 8,5 g de NaCl en 900 mL de H2O. Luego, complete dos lavados adicionales con una mezcla de 1x PBS y 5% fetal Bovine Serum (FBS) e incube con esa solución de Tris-Saponin-NaCl a temperatura ambiente (RT) durante 20 min.
- Incubar todos los pocillos con el anticuerpo primario durante 2 h en RT.
NOTA: El volumen de anticuerpos primarios para cada virus fue de 100 μL y se preparó utilizando una dilución de 1:300 de FBS al 2% en 1x PBS. - Lave las células dos veces con la solución Tris, Saponin y NaCl preparada en el paso 4.2.
- Incubar todos los pocillos con el anticuerpo secundario durante 1 h en RT.
NOTA: El volumen de anticuerpo secundario fue de 100 μL y se preparó utilizando una dilución 1:250 de FBS al 2% en 1x PBS. - Lave las células con la dilución de Tris, Saponina y NaCl como se describe en el paso 4.2.
- Aspire la dilución anterior e incube las placas con 200 μL/pocillo de solución de aminoetil carbazol (AEC) a una dilución final de 1:50 en agua siguiendo las instrucciones del fabricante durante 30 min en RT.
- Después de la incubación, deseche la solución de AEC y agregue 100 μL/pocillo de 1x PBS para obtener imágenes mediante microscopía.
- Derivar matemáticamente el título como se describe en el paso 3.5.
Resultados
Las ecuaciones utilizadas para calcular matemáticamente el título fueron descritas previamente2,3.
Brevemente, para PRRSV, aplicamos el método Karber:
Título (TCID50) = 10 T + 1.3 donde:
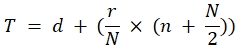
En esta fórmula d = registro negativo de la última dilución con respuesta positiva ...
Discusión
Las valoraciones virales se utilizan habitualmente en la investigación virológica, siendo la detección de PFU y los ensayos TCID50 los más utilizados1,2,3,4. Ambos métodos se basan en la detección de CPE en células infectadas, y aunque se pueden evaluar visualmente mediante microscopía, se suele aplicar una tinción para obtener un resultado más objetivo o incluso para reducir...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer al Dr. Frank Scholle por sus útiles comentarios en el manuscrito, a Chloe Mariant por su ayuda con las imágenes de microscopía y a Teresa M. Tiedge por su útil revisión en inglés.
Materiales
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
Referencias
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados