Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
TCID50 Tahlilleri Kullanarak Viral Titrasyon için Görsel Sitopatik Etki Tabanlı Okumayı Geliştirmek için Kristal Menekşe Kullanımı
Bu Makalede
Özet
Bu protokol, viral titrasyonları optik mikroskopi ve immünositokimyasal boyama ile karşılaştırarak kristal mor kullanarak görselleştirmek için doğru ve objektif bir yaklaşım göstermektedir.
Özet
Viral titrasyon viroloji araştırmaları için önemli bir testtir. TCID50 tahlilleri ve plak oluşturan birimler (PFU) tahlilleri ile sitopatik etkinin (CPE) tespiti, bir virüs stoğunun titresini hesaplamak için iki ana yöntemdir ve genellikle görselleştirme için mikroskopi tespiti veya hücre boyamaya dayanır. TCID50 tahlilinde objektif görselleştirme genellikle mikroskopi ile görsel CPE tespiti ile birlikte titrleri hesaplamak için hücre içi virüsün immünosimyasal (ICC) lekelenmesine dayanır. Bununla birlikte, ICC boyama maliyetli ve zaman alıcıdır. Bu çalışmada, domuz kökenli influenza A virüsü (IAV) ve Porcine Üreme ve Solunum Sendromu virüsü (PRRSV) olmak üzere iki CPE oluşturan virüsün titrelerini belirlemek için mikroskopi, ICC boyama ve kristal mor boyama yoluyla görsel CPE gözlemini karşılaştırdık. Hem kristal mor hem de ICC boyamanın görsel CPE algılamasından daha doğru olduğunu ve hem IAV hem de PRRSV'de neredeyse aynı hassasiyet seviyelerini sunduğunu gösteriyoruz. Bu nedenle, burada kristal mor boyamayı, hücre çizgilerinde titreyen CPE oluşturan virüsler için bir TCID50 testinde viral titrasyonları belirlemenin daha hızlı ve daha uygun fiyatlı bir yolu olarak sunuyoruz.
Giriş
TCID50 tahlil yoluyla viral titrasyon, bulaşıcı hastalık araştırmalarında yaygın olarak kullanılan bir tekniktir1. Bu yöntemin arkasındaki matematikte zamanla varyasyonlar önerilmiş olsa da1,2,3,4, şu anda uygulanan enfeksiyon tespit yöntemleri mikroskopi5 kullanılarak sitopatik etki (CPE) varlığı ile görsel teyide dayanır. TCID50 tahlillerinde CPE görselleştirmesini daha objektif bir şekilde doğrulamak için, virüsün proteinlerini hedefleyen immünositokimyasal (ICC) hücre içi boyama, farklı virüsler farklı CPE formları üretebildiğinden en sık kullanılan yöntemlerden biridir6. Olgumuzda, hücre morfolojik değişiklikleri hem Influenza A virüsü (IAV) hem de enfekte hücrelerin toplandığı ve plakadan çıktığı Porcine Üreme ve Solunum Sendromu Virüsü (PRRSV) ile enfekte olduğunda benzerdir. PRRSV durumunda, tüm hücrelerin kuyudan çıktığı "toplam yıkım" olarak bilinen bir CPE'ye neden olur. Öte yandan, IAV hem toplam yıkımı hem de az sayıda hücrenin enfeksiyondan sonra kopmadığı "subtotal yıkım" olarak bilinen ek bir CPE sunabilir7. Ancak, bu tekniğin gerçekleştirilmesi zaman alıcıdır ve nispeten maliyetli reaktiflerin kullanılmasını gerektirir. ICC'nin CPE'yi etiketlemediğini, aksine virüsün başarıyla enfekte ettiği hücre sayısını not etmek önemlidir. Bu, inkübasyonun sonunda başarılı bir şekilde enfekte olan hücrelerin, enfeksiyon henüz CPE'ye neden olmamış olsa bile pozitif olarak görüleceği anlamına gelir ve böylece CPE'ye kıyasla daha yüksek bir ICC pozitif hücre yüzdesi beklenir. Bu nedenle, bu çalışmada, hücre zarlarına bağlanan ve yapışan hücreleri lekelendirmek için kullanılan pozitif yüke sahip bir kimyasal olan kristal menekşeye dayanan bir TCID50 testinde CPE'nin tamamlayıcı bir görsel algılama yöntemini açıklıyoruz. Kristal mor genellikle viroloji araştırmalarında plak oluşturan birimleri ölçmek için kullanılır, diğerleri arasında8.
Bu çalışmada lekesiz mikroskopi CPE saptanmasının hassasiyetini, yüksek duyarlılığı nedeniyle daha objektif olduğu bilinen viral protein tanımaya dayalı kristal mor boyama ve immünosimyasal lekeleme ile karşılaştırıyoruz. Bu çalışma, hem kristal mor hem de immünositokimyasal lekelemenin görsel mikroskopi bazlı CPE tespitinden daha doğru olduğunu ve bir TCID50 titrasyonunda enfekte kuyuları objektif olarak tanımlamak için kullanılabileceğini göstermektedir. Hücre çizgilerinde test edilen sitopatik virüslerde neredeyse aynı doğruluk seviyesine ulaşma yetenekleri göz önüne alındığında, kristal mor, bir TCID50 testinde viral titrasyonları belirlemenin daha hızlı ve daha uygun fiyatlı bir yolu olarak sunulmaktadır. Kristal mor boyama kullanılarak önerilen yöntemin gerçekleştirilmesi toplam 40 dakika sürer, paraformaldehit (PFA) inkübasyonu için 15 dakika, kristal mor inkübasyon için 5 dakika ve malzeme hazırlama, tampon yıkama ve kurutma için maksimum 15 dakika. Karşılaştırma için uygulanan immünostimya protokolü ortalama 4 saat 30 dk sürer ve daha önce açıklandığı gibi 9,10 olarak gerçekleştirildi. Önerilen yöntem, tamamlanmış bir viral titrasyonu görselleştirmeye yardımcı olmayı amaçlamaktadır. Enfeksiyon ve kuluçka süreleri virüse bağlı olarak farklı düzende gerçekleştirilebilir. Burada hücre hatları üzerinde sitopatik etkisi olan iki RNA virüsünü test ettik.
Protokol
1. Titrasyon protokolü
NOT: Yapışık hücreleri enfekte eden sitopatik bir virüs kullanın. Bu gösteri için domuz kökenli influenza A Virüsü (IAV) (A/California/07/2009/(H1N1)) ve Porcine Üreme ve Solunum Sendromu Virüsü (PRRSV) Tip 2, NC 1-7-4 suşu kullanılmıştır.
- Biyogüvenlik Seviye 2 (BSL-2) laboratuvarında bulunan bir biyogüvenlik kabininde 7 gün boyunca bu virüsleri 96 kuyu plakasında titratlayın.
- Bu titrasyonları yapmak için, gerekli hücre hattına sahip tohum 96 kuyu plakaları. PRRSV için MA-104 hücre hattını, IAV için ise MDCK hücre hattını kullanın. Hücre kültürü için% 10 FBS, L-Glutamin ve Penisilin-Streptomisidin ile desteklenmiş DMEM ortamını kullanın ve hücreleri izdiah edecek şekilde büyütün.
- Enfeksiyondan önce, hücreleri 200 μL PBS kullanarak yıkayın.
- 900 μL ortam ve 100 μL virüs karıştırarak 10 kat seyreltme serisi kullanarak virüs stoklarını seyreltin. Ortamın ve virüsün düzgün bir şekilde karıştırılmasını sağlamak ve seyreltme hatalarını önlemek için tüpü düzgün bir şekilde girdapladığınızdan emin olun.
- Kapağın üzerindeki plakanın düzenini işaretleyin. Kuyuları 1x fosfat salin tamponu (PBS) ile yıkayın. Daha önce açıklanan titrasyon yöntemlerini takiben ilgili kuyulara 50 μL inoculum ekleyin2,3.
- 7 gün boyunca% 5 CO2 inkübatörde 37 ° C'de kuluçkaya yatır.
2. Mikroskopi ile sitopatik etki (CPE) değerlendirmesi
- 7 günlük inkübasyondan sonra, tüm kuyuları 200 μL 1x PBS ile iki kez yıkayın.
- CPE'yi görsel olarak algılamak için plakanın tüm kuyularını hafif bir mikroskop altında değerlendirin. Hem PRRSV hem de IAV durumunda, CPE'leri hücre ölümü ve plakadan daha sonra kopmasından oluşur ve monolayer bozulmasına yol ederim. Bununla birlikte, diğer virüsler farklı CPE türleri sunabilir.
3. Boyama protokolü
NOT: Sitopatik etki (CPE) kristal mor boyama ile değerlendirildi.
- 7 günlük inkübasyondan sonra, tüm kuyuları 200 μL 1x PBS kullanarak iki kez yıkayın.
- 1x PBS'de %4 paraformaldehit (PFA) 50 μL/kuyu ekleyerek hücreleri sabitlayın ve oda sıcaklığında (RT) 15 dakika kuluçkaya yatırın.
- Kuluçkadan sonra, hücreleri 200 μL 1x PBS ile iki kez yıkayın. Ardından, suda% 4'e seyreltilmiş 50 μL / kuyu kristal mor ekleyin ve RT'de 5 dakika kuluçkaya yatırın.
NOT: Kristal mor kimyasal, sabitleme anında plakaya bağlı kalan hücreleri lekeler ve kuyunun hücrelerin ayrıldığı bölümlerini yersiz bırakır. - Son olarak, kuyulardan kristal menekşeyi epire edin ve isteğe bağlı olarak plakaları RT'de 2-5 dakika kurumaya bırakın veya görselleştirmeden önce fazla lekeyi gidermek için plakayı 200 μL suyla yıkayın.
- Titreyi matematiksel olarak hesaplamak için önceden tanımlanmış yöntemleri kullanın. Burada PRRSV ve IAV için sırasıyla Karber formülü ve Muench formülü uygulanmıştır 2,3. Bu denklemlerin ayrıntıları temsili sonuç bölümünde sunulmuştur.
4. İmmünostokimyasal (ICC) etiketleme
NOT: Her iki virüs için immünosyatokinoloji etiketlemesi daha önce açıklanan yöntemler9,10,11'i izleyerek gerçeklendi.
- Titrasyonun 7 günlük inkübasyonundan sonra, 3.2 adımında açıklandığı gibi PFA kullanarak hücreleri sabitleyin.
- Plakaları 900 mL H2O'da 100 mL 1 M Tris hidroklorür, 1 g Saponin ve 8,5 g NaCl ile oluşan bir çözelti ile yıkayın. Ardından, 1x PBS ve% 5 Fetal Sığır Serumu (FBS) karışımı ile iki ek yıkamayı tamamlayın ve Oda sıcaklığında (RT) Tris-Saponin-NaCl çözeltisi ile 20 dakika kuluçkaya yatırın.
- RT'de 2 saat boyunca birincil antikor ile tüm kuyuları kuluçkaya yatırın.
NOT: Her virüs için primer antikorların hacmi 100 μL idi ve 1x PBS'de% 2 FBS'nin 1:300 seyreltilmesi kullanılarak hazırlandı. - 4.2. adımda hazırlanan Tris, Saponin ve NaCl çözeltisi ile hücreleri iki kez yıkayın.
- RT'de 1 saat boyunca ikincil antikor ile tüm kuyuları kuluçkaya yatırın.
NOT: sekonder antikor hacmi 100 μL idi ve 1x PBS'de % 2 FBS'nin 1:250 seyreltilmesi kullanılarak hazırlandı. - Hücreleri adım 4.2'de açıklandığı gibi Tris, Saponin ve NaCl seyreltmesi ile yıkayın.
- Önceki seyreltme işlemine devam edin ve rt'de 30 dakika boyunca üreticinin talimatlarını takip ederek 1:50 su ile 200 μL / kuyu aminoetil karbazol (AEC) çözeltisi ile plakaları kuluçkaya yayalım.
- İnkübasyondan sonra, AEC çözeltisini atın ve mikroskopi ile görüntüleme için 100 μL / kuyu 1x PBS ekleyin.
- Adım 3.5'te açıklandığı gibi titreyi matematiksel olarak türet.
Sonuçlar
Titreyi matematiksel olarak hesaplamak için kullanılan denklemler daha önce tanımlanmıştı2,3.
Kısaca, PRRSV için Karber yöntemini uyguluyoruz:
Titer (TCID50) = 10 T + 1.3 burada:
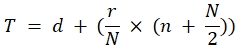
Bu formülde d = tam pozitif virüs yanıtı ile son seyreltme negatif günlüğü: beş...
Tartışmalar
Viral titrasyonlar rutin olarak viroloji araştırmalarında kullanılır, PFU tespiti ve TCID50 tahlilleri en sık kullanılan 1,2,3,4. Her iki yöntem de enfekte hücrelerde CPE'nin tespitine dayanır ve mikroskopi ile görsel olarak değerlendirilebilseler de, genellikle daha objektif bir sonuç elde etmek veya hatta kuluçka sürelerini azaltmak için bir boyama uygulanır. TCID50 ...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, makaledeki yararlı yorumları için Dr. Frank Scholle'u, mikroskopi görüntülerine yardım eden Chloe Mariant'ı ve yardımcı İngilizce revizyonu için Teresa M. Tiedge'yi kabul etmek istiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plates | Genesee | 25-221 | Clear, flat bottom |
| AEC solution | Thermo Fisher | 1122 | |
| Crystal violet | Thermo Fisher | C581-25; C581-100 | |
| DMEM | Corning | 10-017-CV | |
| Fetal bovine serum | BioWest | S1480 | |
| Paraformaldehide | Thermo Fisher | J19943 | |
| Primary Influenza Antibody | Bioss | BS-0344R | |
| Primary PRRSV Antibody | Bioss | BS-10043R | |
| Saponin | Thermo Scientific | AAA1882014 | |
| Secondaty antibody | Invitrogen | 31460 | |
| Tris Hydrochloride | Thermo Scientific | AM9856 |
Referanslar
- Kärber, G. Contribution to the collective treatment of pharmacological series experiments. Naunyn-Schmiedeberg's Archive for Experimental Pathology and Pharmacology. 162 (4), 480-483 (1931).
- Ramakrishnan, M. A. Determination of 50% endpoint titer using a simple formula. World Journal of Virology. 5 (2), 85-86 (2016).
- Reed, L. J., Muench, H. A simple method of estimating fifty per cent endpoints. American Journal of Epidemiology. 27 (3), 493-497 (1938).
- Spearman, C. The method of right and wrong cases (constant stimuli) without Gauss's formulae. British Journal of Psychology. 2 (3), 227 (1908).
- Darling, A. J., Boose, J. A., Spaltro, J. Virus assay methods: accuracy and validation. Biologicals. 26 (2), 105-110 (1998).
- Kim, J., Chae, C. A comparison of virus isolation, polymerase chain reaction, immunohistochemistry, and in situ hybridization for the detection of porcine circovirus 2 and porcine parvovirus in experimentally and naturally coinfected pigs. Journal of Veterinary Diagnostic Investigation. 16 (1), 45-50 (2004).
- Suchman, E., Blair, C. Cytopathic effects of viruses protocols. American Society of Microbiology. , (2007).
- Karakus, U., Crameri, M., Lanz, C., Yángüez, E. . Influenza Virus. , 59-88 (2018).
- Tingstedt, J. -. E., Nielsen, J. Cellular immune responses in the lungs of pigs infected in utero with PRRSV: an immunohistochemical study. Viral Immunology. 17 (4), 558-564 (2004).
- Guarner, J., et al. Immunohistochemical and in situ hybridization studies of influenza A virus infection in human lungs. American Journal of Clinical Pathology. 114 (2), 227-233 (2000).
- Nicholls, J. M., et al. Detection of highly pathogenic influenza and pandemic influenza virus in formalin fixed tissues by immunohistochemical methods. Journal of Virological Methods. 179 (2), 409-413 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır