Method Article
بروتوكول التعرض لرائحة القطط الذي لا مفر منه لدراسة تكييف التهديدات الفطرية والسياقية في الفئران
In This Article
Summary
يوفر التعرض لرائحة جلد / فراء القطط طريقة موثوقة للتحقيق في الدوائر العصبية وآليات الاستجابات الدفاعية في القوارض وقد يقدم نظرة ثاقبة للآليات التي تتوسط الخوف لدى البشر. هنا ، نصف بروتوكولا للتحقيق في دور قشرة الحساسية الداخلية في استجابات التهديد في الفئران.
Abstract
تستجيب للمواقف المهددة من خلال إظهار عدد من السلوكيات الدفاعية ، بما في ذلك التجنب والتجميد وتقييم المخاطر. يقدم النموذج الحيواني ذو النهج الأخلاقي نظرة أعمق على الآليات البيولوجية الكامنة وراء الاستجابات للتهديدات. تصف هذه الورقة منهجية لقياس السلوكيات الدفاعية تجاه كل من المحفزات الفطرية والمكتسبة في الفئران. تعرضت بشكل فردي لرائحة المفترس في غرفة لا مفر منها لاستنباط حالة دفاعية قابلة للقياس ومستدامة. تضمن التصميم التجريبي وضع فأر في غرفة مألوفة لمدة 10 دقائق متبوعا بالتعرض لرائحة القطط لمدة 10 دقائق أخرى في نفس السياق. في اليوم التالي ، أعيد تعريض الفئران لمدة 10 دقائق إلى نفس غرفة السياق حيث حدث التعرض لرائحة القطط. تم تسجيل الجلسات بالفيديو وتم تقييم السلوكيات الدفاعية في كلا اليومين.
اقترن الاختبار السلوكي بتقنيات التعطيل الوظيفي القابل للانعكاس والكيمياء المناعية c-Fos لتحديد دور القشرة التحسية في استجابات التهديد. أظهرت الفئران التي تعرضت لرائحة القطط في اليوم الأول وأعيد تعرضها لغرفة السياق في اليوم الثاني مستويات أعلى من السلوكيات الدفاعية ، وأثارت رائحة القطط زيادة قوية في النشاط العصبي للقشرة الداخلية. علاوة على ذلك ، أدى تعطيل muscimol لقشرة الإدراك الداخلي إلى تقليل التعبير عن السلوكيات الدفاعية استجابة لرائحة القطط وضعف ذاكرة التهديد السياقي. تظهر هذه النتائج أن هذا الاختبار السلوكي هو أداة مفيدة لدراسة الآليات العصبية للسلوكيات الدفاعية وقد يقدم نظرة ثاقبة للآليات التي تتوسط الخوف لدى البشر والاضطرابات المرتبطة به.
Introduction
تحدث السلوكيات الدفاعية استجابة للمنبهات التي تشير إلى تهديد محتمل لبقاء. يتم الحفاظ على هذه السلوكيات بشكل كبير عبر الثدييات وترتبط بسرعة بالمحفزات أو الظروف المتعلقة بالتهديد1،2،3. في الطبيعة ، المحفزات المهددة لمعظم هي المفترسة. لذلك ، فإن اكتشاف إشارات المفترس ، مثل إشارات الرائحة ، مفيد بشكل خاص لتجنب الافتراس. تم التحقيق على نطاق واسع في الاستجابات السلوكية لإشارات المفترس في القوارض.
على سبيل المثال ، تعمل المحفزات ، مثل فرو القطط الطبيعي أو روائح الجلد ، على تنشيط حاسة الشم ونظام الحمض ، مما يؤدي إلى مستويات عالية من السلوكيات الدفاعية4. هذه المحفزات مصحوبة بتغيرات في نشاط الخلايا العصبية والغدد الصماء5،6،7،8 ، وهي محفزات قوية وغير مشروطة ومكروهة لتكييف التهديد السياقي في الفئران7،8،9،10،11. أظهرت الدراسات أنه بعد 24 ساعة على الأقل من التعرض لإشارات المفترس الطبيعية ، تظهر الفئران حالات قوية وطويلة الأمد تشبه القلق7،12،13. هذه الظاهرة ذات أهمية خاصة لتطوير نماذج أكثر واقعية لاضطراب ما بعد الصدمة (PTSD) 14،15،16،17 ، واضطراب القلق العام (GAD) 5 ، واضطراب الهلع (PD) 18،19.
في البيئات المختبرية ، يقاس سلوك الخوف على أنه رحلة أو تجنب (على سبيل المثال ، التراجع أو الاختباء) أو التجميد. بالإضافة إلى ذلك ، يمكن قياس القلق على أنه أوضاع تمدد ومسح يقظ موجه نحو مراقبة حافز مفترس - مجموعة من الاستجابات تعرف على نطاق واسع باسم سلوكيات تقييم المخاطر6،9،20. أظهرت الدراسات أن سلوك التجميد هو الإستراتيجية الدفاعية السائدة في الفئران لتهديد لا مفر منه ، بينما يتم ملاحظة تقييم المخاطر عندما يكون التهديد غامضا أو غير موضعي12،21،32. على الرغم من أنه من المعروف أن الحافز الفطري أو المكتسب يمكن أن يثير سلوكيات دفاعية ، إلا أن هناك نقصا في النماذج السلوكية المختبرية التي تلتقط الاستجابات الدفاعية بشكل موثوق في سياق أكثر أخلاقيا. لسد هذه الفجوة ، صممنا بروتوكولا بنهج أخلاقي يسمح بقياس سلوكيات التهديد الفطرية والسياقية المستدامة جنبا إلى جنب مع استجابات الدماغ لمحفزات التهديد الطبيعية.
تسبب التجارب المجهدة ، مثل التعرض لرائحة مفترس لا مفر منها ، تغيرات دائمة في الاستجابة السلوكية والفسيولوجية لدى الفئران14،22،23. تعكس هذه التعديلات ملف تعريف الأعراض الذي لوحظ في الخوف والاضطرابات المرتبطة بالقلق مثل اضطراب ما بعد الصدمة. في النموذج الحالي ، يتم استخدام غرفة اختبار بدون منطقة اختباء آمنة لتعريض الفئران لحدث تهديد لا مفر منه وبالتالي تعزيز الاستجابات الدفاعية. أظهرت الفئران سلوكيات تجميد وتقييم مخاطر قوية استجابة لكل من رائحة القطط وسياق الاختبار. تدعم هذه النتائج استخدام هذا البروتوكول كطريقة موثوقة وصالحة لاستكشاف الآليات البيولوجية الكامنة وراء السلوكيات الدفاعية وتطوير وتحسين استراتيجيات جديدة لعلاج اضطرابات الخوف لدى البشر.
Protocol
تم تنفيذ الإجراء التالي وفقا لتوصيات المبادئ التوجيهية المؤسسية من قبل دليل المعاهد الوطنية للصحة (الولايات المتحدة الأمريكية) لرعاية واستخدام المختبر (منشور المعاهد الوطنية للصحة رقم 80-23 ، تمت مراجعته عام 1996). وافقت اللجنة المؤسسية للسلامة البيولوجية والأخلاقيات في الجامعة البابوية الكاثوليكية في شيلي على جميع الإجراءات. تم إجراء جميع الجلسات التجريبية خلال المرحلة النشطة للفئران (المرحلة المظلمة).
1. إعداد غرفة الاختبار وغرفة الاختبار
ملاحظة: تظهر نظرة عامة على الجهاز في الشكل 1. تم تطوير غرفة الاختبار وتعديلها وفقا للدراسات السابقة24،25.
- استخدم غرفة اختبار بولي مستطيلة شفافة (ميثيل ميثاكريلات) بالأبعاد التالية: 60 سم (طول) × 40 سم (عرض) × 40 سم (ارتفاع). قم بتغطية الجدران الجانبية والخلفية لغرفة الاختبار بأي ورق أسود. تأكد من أن الجزء الأمامي من غرفة الاختبار شفاف لتسجيل سلوكيات.
- قم بتثبيت قوس فولاذي على الأرض في الزاوية اليمنى السفلية من غرفة الاختبار ، واستخدمه لإرفاق أطواق القطط لإجراءات الاختبار.
- نظف غرفة الاختبار باستخدام 5٪ (v / v) من الإيثانول قبل وبعد الاختبارات لإزالة أي أدلة رائحة تركتها الفئران المعنية وتجنب استجابة النفور من الفئران. اترك 5 دقائق بين كل جلسة حتى يتبخر الإيثانول بالكامل.
- قم بإجراء جلسة الاختبار في غرفة هادئة مضاءة بشكل خافت بمصباح إضاءة أحمر بقدرة 80 واط يقع على ارتفاع 20 سم فوق غرفة الاختبار. استخدم كاميرا فيديو موجودة أمام الغرفة لتسجيل سلوك.
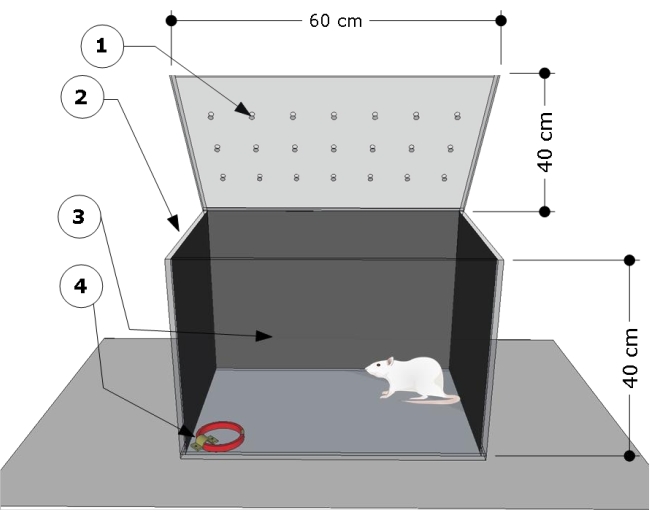
الشكل 1: نظرة عامة تخطيطية لغرفة الاختبار. يتكون الجهاز من حجرة اختبار بها: (1) فتحات تهوية ، (2) جانبية ، و (3) جدران خلفية مظلمة ، وقوس فولاذي مغلق في أرضية الزاوية اليسرى (4) لربط طوق القط (الأبعاد: العرض 15 مم ، السماكة 5 مم ، الطول 300 مم). يشار إلى أبعاد الغرفة على الرسوم المتحركة (60 طول × 40 عرض × 40 ارتفاع سم). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تحضير رائحة القط
- احصل على طوق قطة بوجه داخلي مبطن باللباد لاحتجاز رائحة القطة بشكل أفضل. تأكد من توفر العديد من الياقات لاستخدامها كطوق تحكم (بدون رائحة) أو طوق اختبار (رائحة القطط).
ملاحظة: النقطة الحاسمة هي أن طوق القط يجب أن يحتوي على بطانة داخلية لجمع الروائح وحبسها. - ضع طوقا على قطة منزلية مكيلة المبيض واسمح للقطة بارتداء الياقة لمدة أسبوع قبل الاختبار. حاول إبقاء أنثى القطة في الداخل أثناء ارتداء طوق الاختبار.
ملاحظة: استخدم نفس القطة طوال الدراسة. - احتفظ بطوق القط البالي في وعاء بلاستيكي محكم الغلق وقم بتخزينه في درجة حرارة 4 درجات مئوية. استبدل طوق القط البالي بطوق يحتوي على رائحة قطة منعشة كل ثلاثة أيام.
3. تحضير الفئران للإجراء التجريبي
- استخدم ذكور فئران Sprague-Dawley البالغة التي تزن 270-290 جم. إيوهم في أقفاص فردية مع توفر الطعام والمياه المتاحة.
- [اختياري] تحضير الفئران للإجراء الجراحي (اختياري)
- إجراء الجراحة في ظروف معقمة. قم بتنظيف وتطهير منطقة العمل بمحلول 70٪ من الإيثانول وتعقيم جميع المواد والأدوات الجراحية.
- تخدير الفئران بمزيج داخل الصفاق من الكيتامين (100 مجم / كغ) والزيلازين (20 مجم / كجم). انتظر حتى يتم تحقيق مستوى التخدير المناسب عندما لا يستجيب الجرذ لتحفيز قرصة إصبع القدم أو تحفيز القرنية. للحفاظ على حالة التخدير طوال الجراحة، قم بإعطاء جرعة إضافية من كوكتيل التخدير كل 45 دقيقة.
- احلق رأس الفئران برفق من خلف الأذن إلى ما بين العينين ، وقم بتطهير المنطقة الجراحية بقطعة تحضير معقمة للكحول متبوعة بمحلول بوفيدون اليود. ضع مرهم العين المزيق لتجنب جفاف القرنية أثناء العملية الجراحية.
- ضع الجرذ في جهاز تجسيمي ، وامسك الرأس عن طريق وضع قضبان الأذن بشكل صحيح في قنوات الأذن. بعد ذلك ، أدخل قواطع الفئران برفق في قضيب القاطع وقم بتأمين مشبك الأنف.
- ضع قنية توجيه معقمة من الفولاذ المقاوم للصدأ 26 جم في الحامل التجسيمي. خذ مشرطا وقم بعمل شق خط الوسط على طول فروة الرأس. ضع 2 أو أكثر من المشابك حول الشق (2-3 سم).
- قم بتنظيف الجمجمة تماما من الأنسجة حتى تظهر خيوط الجمجمة البريجما واللامدا.
- تحقق من الوضع المتماثل للرأس عن طريق محاذاة المحور الظهري البطني والأمامي الخلفي للجمجمة باستخدام القواطع وقضبان الأذن ، على التوالي. تحديد إحداثيات قنية الدليل لمنطقة الدماغ التي تهمها. احتفظ بالبريغما واللامدا في نفس المستوى الأفقي باستخدام قضيب القاطعة.
- احسب إحداثيات موقع زرع قنية الدليل في منطقة الاهتمام باتباع الإحداثيات التجسيمية ل Paxinos and Watson26 أو Swanson atlas27.
ملاحظة: بالنسبة للقشرة المعزولة الأولية للإدراك الداخلي ، تم استخدام الإحداثيات التجسيمية التالية: بريجما -0.51 مم ، خط الوسط 5.0 مم ، العمق من سطح الجمجمة 4.5 مم ، بزاوية 10 درجات وسطيا من الرأسي. - تحقق من إحداثيات زرع قنية التوجيه عن طريق إنزالها حتى تلامس الجمجمة ، ثم قم بحفر ثقب في الجمجمة في الموقع الذي تم التحقق منه. حفر 3 ثقوب إضافية حول المنطقة المستهدفة لوضع 3 براغي في الجمجمة.
- أدخل القنية في منطقة الدماغ التي تهم واستخدم البراغي والأكريليك للأسنان لتثبيت القنية في الجمجمة. صب أكريليك الأسنان على الجمجمة الجافة وتأكد من أنه يغطي البراغي لتثبيت القنية في مكانها. اسمح لأسنان الأكريليك بالتصلب ثم قم بإزالة الذراع التجسيمية بعناية ، مع ترك قنية التوجيه في مكانها.
ملاحظة: يعمل هذا الإجراء على شل حركة القنية المزروعة ويسمح للمجربين بإجراء حقن مجهرية متعددة في منطقة الاهتمام. - أدخل نصفة من الفولاذ المقاوم للصدأ في قنية التوجيه لتجنب الانسداد والتلوث.
- في نهاية الجراحة، يتم إعطاء جرعة واحدة من المضاد الحيوي (إنروفلوكساسين 5٪؛ 19 ملغم/كغ المثبط الداخلي) ومضاد للالتهابات (كيتوفين 0.2 ملغم/كغ). كرر هذه الخطوة لمدة ثلاثة أيام متتالية بعد الجراحة.
- اسمح للفئران بالتعافي تماما لمدة أسبوع على الأقل قبل بدء التجارب.
- احتفظ بالفئران تحت دورة إضاءة / ظلام معكوسة لمدة 12/12 ساعة (الأضواء مضاءة في الساعة 7:00 مساء) لمدة عشرة أيام على الأقل قبل بدء التجارب (الشكل 2).
ملاحظة: إذا احتاج المجرب إلى إجراء أي إجراء جراحي ، فسيكون من الضروري القيام بذلك قبل عكس دورة الضوء المظلم. هذا يسمح بتقليل التوتر بعد الجراحة. - تعامل مع جميع الفئران لمدة 20 دقيقة / يوم لمدة 2-3 أيام. خذ فأرا واحدا في كل مرة ، وامسك بإحكام من الجذع (وليس من الذيل) ، وداعبه خلال هذا الوقت. إذا ظهرت على علامات الإجهاد ، فتعامل معها لفترات طويلة.
ملاحظة: هذه الخطوة ضرورية لتقليل إجهاد المناولة الذي قد يؤثر على الخطوات التالية. - قم بتعريض مسبقا لغرفة الاختبار (غرفة رائحة القطط مع طوق قطة غير ملبس) لمدة 30 دقيقة / يوم لمدة ثلاثة أيام قبل التجارب للسماح للحيوانات بالتأقلم مع سياق الاختبار.
ملاحظة: يقترح ألا يرتدي المجرب العطور أو المستحضرات المعطرة. - بعد وضع في الغرفة ، انتظر لمدة 10-15 دقيقة تقريبا ، وأدخل ذراعا في غرفة الاختبار ، واستبدل طوق القطة بطوق قطة آخر بنفس الميزات.
ملاحظة: هذه الخطوة ضرورية لمحاكاة ، بأكبر قدر ممكن ، كل خطوة من خطوات الإجراءات السلوكية لتقليل التوتر ، مما قد يؤثر على الأداء السلوكي للفئران في آخر 10 دقائق من الاختبار. - نظف غرفة الاختبار باستخدام 5٪ (حجم / حجم) من الإيثانول بين الجلسات.
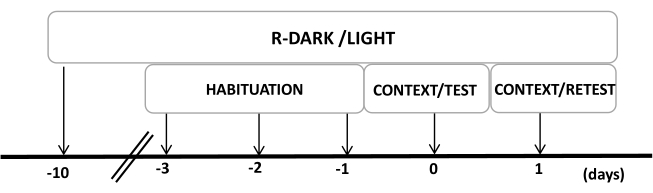
الشكل 2: الجدول الزمني للتصميم التجريبي. تعرضت الفئران لدورة ضوء مظلم معكوسة لمدة 10 أيام ثم اعتادت على غرفة الاختبار التي تحتوي على طوق قطة تحكم (غير ملبوس) لمدة 30 دقيقة خلال الأيام الثلاثة الماضية. في اليوم 0 ، تعرضت الفئران لأول مرة لغرفة اختبار مألوفة (CONTEXT) لمدة 10 دقائق ثم تعرضت لياقة برائحة قطة أو بدونه لفترة إضافية مدتها 10 دقائق (TEST) في نفس السياق. في اليوم الأول ، أعيدت الفئران التي تعرضت لرائحة القطط (TEST) في اليوم 0 إلى نفس غرفة الاختبار لمدة 10 دقائق (CONTEXT) وأعيد تعرضها لرائحة القطط (RETEST) لمدة إضافية مدتها 10 دقائق. تم تعديل هذا الرقم من 8. الاختصار: R-Dark / Light = دورة الضوء الداكن العكسي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إجراءات اختبار رائحة القطط
- في اليوم 0 من البروتوكول التجريبي ، قم بتقييم استجابات التهديد لرائحة القطط.
- إذا لزم الأمر، قم بإعطاء الحقن القشرية قبل الاختبارات السلوكية باتباع الطريقة الموضحة أدناه. إذا كنت تقوم بتنفيذ بروتوكول سلوكي فقط، فتخط هذه الخطوة وانتقل إلى الخطوة 4.3.
- أدخل قنية حقن معقمة 33 جم مقترنة بحقنة هاميلتون سعة 1 ميكرولتر في قنية التوجيه بعد إزالة الاحتجاز.
- املأ حقنة هاميلتون بمحلول ملحي معقم (فئران التحكم) أو ناهض مستقبلات GABA-A ، muscimol (الفئران العلاجية) ، وحقن 0.5 ميكرولتر / نصف الكرة الأرضية على مدى دقيقتين. انتظر لمدة دقيقتين للسماح بانتشار الدواء ، وقم بإزالة قنية الحقن ببطء ، وأدخل الانسداد على الفور.
ملاحظة: قم بتنفيذ هذه الخطوة في هادئ ومستيقظ وحقن الأدوية ببطء لتقليل ارتعاش قنية الحقن وما يترتب على ذلك من انتشار في مناطق الدماغ المجاورة. - بمجرد اكتمال الحقن القشري / نصف الكرة الأرضية ، انتظر لمدة 30 دقيقة وانتقل إلى الخطوة التالية.
- ضع في غرفة الاختبار لمدة 20 دقيقة. خلال أول 10 دقائق ، قم بتعريض لياقة مألوفة غير ملبوسة. أدخل الطوق المشبع برائحة القطط (TEST) أو طوق مألوف غير بالي (CONTEXT) بحلول ال 10 دقائق التالية (الشكل 3).
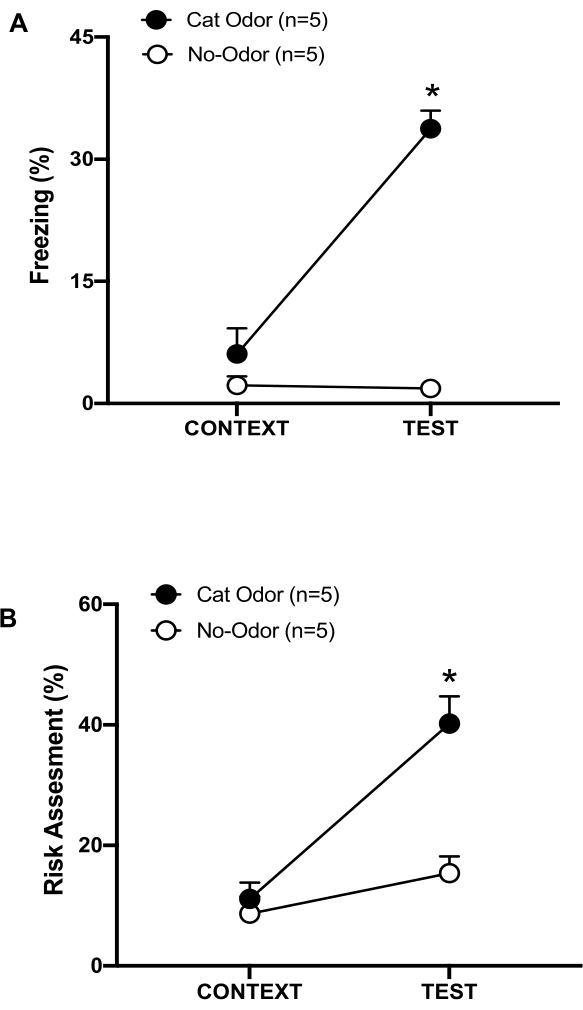
الشكل 3: مواجهة رائحة القطط تزيد من السلوكيات الدفاعية الفطرية. (أ ، ب) تعرضت الفئران لأول مرة لغرفة الاختبار المألوفة (CONTEXT) لمدة 10 دقائق ثم تعرضت لياقة برائحة القطط (مجموعة رائحة القطط ، دوائر سوداء) أو بدون رائحة القطط (مجموعة خالية من الرائحة ، دوائر مفتوحة) لفترة إضافية مدتها 10 دقائق (اختبار) في نفس السياق. تظهر الدوائر النسبة المئوية للوقت الذي يقضيه في التجميد (B) وتقييم المخاطر (C) الذي تعرضه الفئران الساذجة. يتم التعبير عن البيانات بوسائل + SEM. * ص < 0.05. تم تعديل هذا الرقم من 8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- ضع كاميرا فيديو أمام غرفة الاختبار وسجل سلوك لتسجيل السلوك لاحقا بواسطة مجرب أعمى عن الظروف التجريبية.
- في نهاية جلسة رائحة القطط ، أعد إلى أقفاصها المنزلية وأعدها إلى منشأة حتى الجلسة التالية.
- نظف غرفة الاختبار باستخدام 5٪ (حجم / حجم) من الإيثانول بين الجلسات.
- بعد أربع وعشرين ساعة من جلسة رائحة القطط (اليوم 1) ، قم بتقييم الاستجابات الدفاعية لسياق الاختبار.
- إذا لزم الأمر، كرر الخطوة 4.2 قبل التعرض للسياق.
- أعد الفئران إلى نفس غرفة الاختبار ذات الياقة المألوفة غير البالية ، وسجل السلوكيات الدفاعية لقياس ذاكرة التهديد السياقي خلال 10 دقائق (الشكل 4).
- ضع كاميرا فيديو أمام غرفة الاختبار وسجل سلوك لتسجيل السلوك لاحقا بواسطة مجرب أعمى عن الظروف التجريبية.
- خلال ال 10 دقائق التالية ، استبدل الطوق المألوف غير البالي ، وأعد تعريض لطوق برائحة القطط ، وقم بقياس السلوكيات الدفاعية.
- بعد التعرض الثاني لرائحة القطط ، أعد إلى قفص منزله ، ونظف غرفة الاختبار بنسبة 5٪ (v / v) من الإيثانول. أعد الجرذ إلى منشأة.
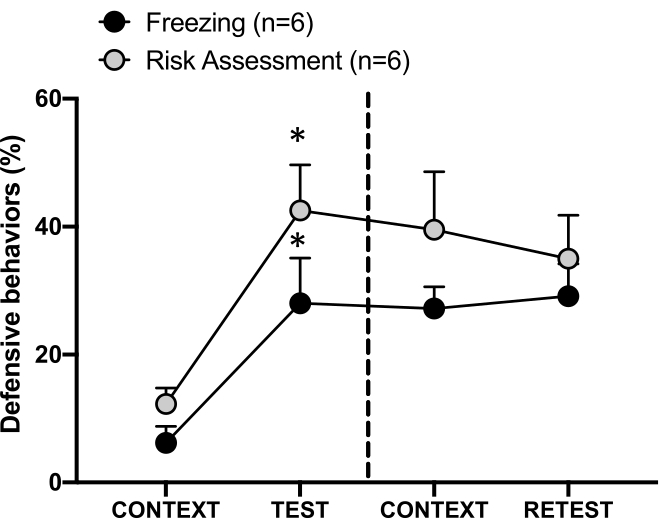
الشكل 4: مواجهة رائحة القطط تحفز على تعلم التهديدات السياقية. تظهر الدوائر النسبة المئوية للوقت الذي يقضيه في التجميد (الدوائر السوداء) وسلوك تقييم المخاطر (الدوائر الرمادية). يفصل الخط المتقطع اختبار الخوف الفطري (اليوم 0 ، يسار) عن اختبار الخوف السياقي (اليوم 1 ، يمين). يتم التعبير عن البيانات كوسائل + SEM. * ص < 0.05. تم تعديل هذا الرقم من 8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. الإجراءات الكيميائية المناعية
- تخدير بمزيج داخل الصفاق من الكيتامين (0.45 مجم / كجم) والزيلازين (0.05 مجم / كجم) بعد 90 دقيقة من الانتهاء من التجارب. ثم ، قتل الفئران عن طريق التروية عبر القلب مع 4٪ بارافورمالدهايد.
ملاحظة: إذا كان من الضروري تقييم التعرض الأول لرائحة القطط ، أو الاستجابة المشروطة للسياق ، أو إعادة التعرض لرائحة القطط ، فقم بتنفيذ هذه الخطوة بعد كل من هذه المواقف التجريبية. ارتد قفازات ومعطف مختبر وتعامل مع بارافورمالدهيد بحذر تحت غطاء الدخان الكيميائي. - بعد التروية ، قم بإصلاح الدماغ في نفس المحلول المثبت لمدة ساعتين ثم انقله إلى 30٪ سكروز مع 0.02٪ أزيد الصوديوم في محلول ملحي مخزن بالفوسفات (PBS) حتى يغرق الدماغ في القاع. قم بتخزين الدماغ عند 4 درجات مئوية.
- قم بتجميد الدماغ باستخدام الثلج الجاف وقطعه إلى أقسام إكليلية تسلسلية بسمك 50 ميكرومتر على ميكروتوم منزلق. اجمع ثلاث مجموعات من أقسام الدماغ في منطقة الاهتمام ، مع ترك واحدة للتحقق من وضع القنية ومجموعتين للإجراء الكيميائي المناعي.
- احتضان أقسام الدماغ العائمة الحرة في 0.3٪ H2O2 في PBS لمدة 30 دقيقة ، واغسلها في PBS ، وانقل هذه الأقسام إلى محلول الحجب (0.4٪ Triton X-100 ، 0.02٪ أزيد الصوديوم ، 3٪ مصل الماعز العادي في PBS) لمدة 1 ساعة.
- انقل الأقسام إلى محلول حضانة الجسم المضاد الأساسي الذي يحتوي على الجسم المضاد c-Fos المخفف 1: 20,000 في محلول مانع واتركها طوال الليل في درجة حرارة الغرفة.
- اشطف الأقسام في PBS لمدة ساعة واحدة ثم احتضنها في محلول الأجسام المضادة الثانوية المخفف 1: 1,000 في 0.4٪ Triton X-100 و 1.5٪ مصل الماعز العادي في PBS.
- اشطف الأقسام لمدة 40 دقيقة واحتضانها لمدة ساعة واحدة في نظام البيروكسيديز القائم على أفيدين / البيوتين (انظر جدول المواد) ، المخفف 1: 500 في PBS.
- شطف واحتضان الأقسام في محلول 0.05٪ من 3-3′ ديامينوبنزين هيدروكلوريد (DAB) تحتوي على 0.003٪ H2O2 و 0.05٪ كلوريد النيكل للحصول على منتج تفاعل أزرق داكن.
6. عد الخلايا
- افحص الأقسام الموجودة أسفل الكاميرا lucida باستخدام هدف منخفض الطاقة (10x) لتوطين تلطيخ c-Fos punctiform في نوى الخلايا العصبية (الشكل 5).
- استخدم شبكة عد متعلقة بحجم منطقة الاهتمام. بالنسبة ل pIC ، على سبيل المثال ، من Bregma 0.95 إلى -0.26 ، استخدم شبكة عد 0.25 مم × 1 مم ؛ من Bregma -0.51 إلى -2.45 مم ، استخدم شبكة عد 0.5 مم × 1 مم.
- حدد عدد الخلايا التفاعلية المناعية c-Fos (Fos-ir) لكل قسم باستخدام عداد يدوي رقمي.
- عد جميع الأقسام الإكليلية ذات الأهمية مرتين وتأكد من أن نفس المراقب ، أعمى عن الظروف التجريبية ، يقوم بالعد.
- التقط صورة فوتوغرافية باستخدام مجهر مقترن بكاميرا رقمية.
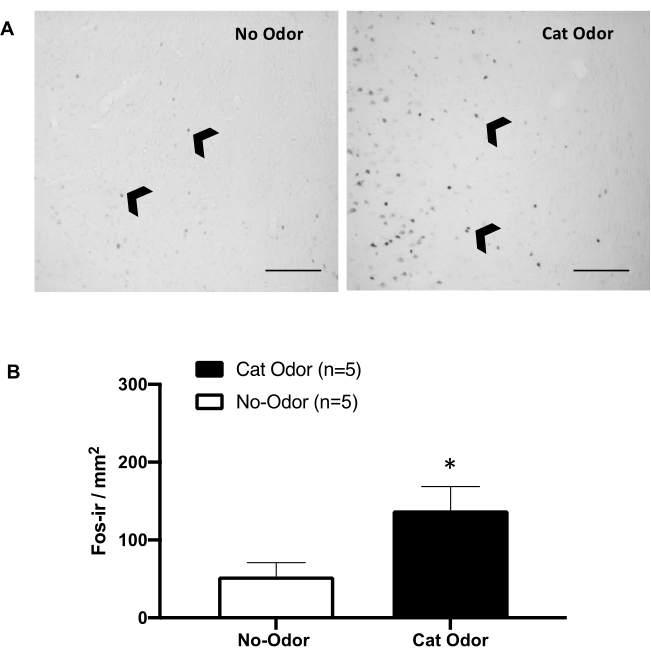
الشكل 5: تثير رائحة القط التنشيط العصبي في القشرة الأولية للإدراك الداخلي. (أ) تصوير مجهري تمثيلي ل pIC يظهر غياب شبه شبه لخلايا c-Fos-ir (رؤوس سهام سوداء) في الفئران المعرضة لطوق قطة غير ملبس (بدون رائحة ، يسار) مقارنة بعدد متزايد بشكل ملحوظ من خلايا c-Fos-ir في الفئران المعرضة لرائحة القطط (يمين). (ب) القياس الكمي لخلايا c-Fos-ir في pIC في كلتا الحالتين التجريبيتين. يتم التعبير عن البيانات كوسائل + SEM. * ص < 0.05. أشرطة المقياس = 200 ميكرومتر. تم تعديل هذا الرقم من 8. الاختصارات: pIC = قشرة الحساسية الابتدائية. ج-فوس-الأشعة تحت الحمراء = ج-فوس المناعي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
7. تحليل البيانات
- تسجيل السلوكيات الدفاعية من التجارب المسجلة بالفيديو وتحليلها باستخدام البرامج الإحصائية.
- قم بتقييم التجميد عن طريق نوبات التوقيت ، معبرا عنها كنسبة مئوية من الوقت الذي يقضيه في التجميد خلال 10 دقائق. احسب النسبة المئوية للتجميد باستخدام المعادلة (1).
التجميد = (الثواني المستغرقة في التجميد/600 ثانية) × 100 (1)
ملاحظة: تم تعريف التجميد على أنه النقص التام في الحركة باستثناء التنفس لمدة 1 ثانية28 على الأقل. - تقييم المخاطر عن طريق توقيت نوبات المسح اليقظة والتعبير عنها كنسبة مئوية من الوقت المستغرق في تقييم المخاطر خلال 10 دقائق. احسب النسبة المئوية لتقييم المخاطر باستخدام المعادلة (2).
النسبة المئوية لتقييم المخاطر = (الثواني المستغرقة في تقييم المخاطر / 600 ثانية) × 100 (2)
ملاحظة: تم تعريف سلوك تقييم المخاطر على أنه مسح يقظ (مرصد، حركات رأس من جانب إلى آخر، دون تحديد الموقع) لمدة 1 ثانية29 على الأقل. - قم بتسجيل هذه المعلمات السلوكية يدويا وتأكد من حسابها بواسطة مجرب أعمى عن الظروف التجريبية (أي ظروف الرائحة والأدوية). اعتمادا على طبيعتها لمجموعات البيانات، استخدم الاختبارات البارامترية أو غير المعلمية لمقارنة مجموعتين أو أكثر.
ملاحظة: في هذه الدراسة ، تم إجراء جميع الاختبارات الإحصائية باستخدام برنامج SPSS.- استخدم اختبار Kruskal-Wallis H مع اختبار Mann-Whitney U للمقارنات الزوجية بين المجموعات.
- تحليل المقارنات داخل المجموعة بمرور الوقت باستخدام اختبار فريدمان متبوعا باختبار ويلكوكسون الموقع للمقارنات الزوجية.
ملاحظة: في جميع الأشكال ، تم تعيين مستويات الدلالة على p < 0.05 (*) و p < 0.01 (**).
- لتحليل تعبير c-Fos في مناطق معينة من الدماغ ، احسب عدد الخلايا الإيجابية ل c-Fos لكل قسم عن طريق حساب كثافة خلايا c-Fos-ir لكل مم2 ، وقارن متوسط الرقم بين ظروف التحكم (بدون رائحة) والظروف المحفزة (رائحة القطط).
- اعتمادا على طبيعية البيانات ، استخدم اختبار t للطالب غير المقترن أو اختبار Mann-Whitney U.
ملاحظة: في هذه الدراسة ، تم استخدام اختبار Mann-Whitney U. اعتبرت الاختلافات ذات دلالة إحصائية إذا < P 0.05 (*).
- اعتمادا على طبيعية البيانات ، استخدم اختبار t للطالب غير المقترن أو اختبار Mann-Whitney U.
النتائج
في هذا البروتوكول ، تم قياس النسب المئوية للتجميد وتقييم المخاطر كمؤشرات للخوف والحالات الشبيهة بالقلق في الفئران ، على التوالي. يظهر الجدول الزمني للتصميم التجريبي في الشكل 2. يتم عرض نتائج المعرضة لرائحة القطط في اليوم 0 في الشكل 3. أظهرت الفئران مستويات أعلى بكثير من التجميد (الشكل 2 أ ، مجموعة رائحة القطط ، اختبار Wilcoxon Signed-ranks ، Z = -2.201 ، p = 0.028) وتقييم المخاطر (الشكل 2 ب ، مجموعة رائحة القطط ، اختبار Wilcoxon Signed-ranks Z = -2.336 p = 0.018) استجابة لرائحة القطط (TEST) مقارنة بالسياق المألوف (CONTEXT). لوحظت مستويات منخفضة من التجميد (الشكل 2 أ ، مجموعة عدم وجود رائحة ، اختبار Wilcoxon Signed-ranks ، Z = -0.184 ، p = 0.854) وتقييم المخاطر (الشكل 2 ب ، مجموعة عدم الرائحة ، اختبار Wilcoxon Signed-ranks ، Z = -1.753 ، p = 0.08) في الفئران المعرضة لياقة غير ملبوسة خلال الجزء الثاني من الاختبار.
كشف تحليل إضافي أن مستويات التجميد (الشكل 2 أ ، اختبار مان ويتني ، U = 0.000 ، ص = 0.004) وتقييم المخاطر (الشكل 2 ب ، اختبار مان ويتني ، U = 4.000 ، ص = 0.025) كانت أعلى في مجموعة رائحة القطط من مجموعة عدم وجود رائحة خلال الجزء الثاني من الاختبار. لم تكن هناك فروق ذات دلالة إحصائية في التجميد (الشكل 2 أ ، اختبار مان ويتني ، U = 11.000 ، ص = 0.256) وتقييم المخاطر (الشكل 2 ب ، اختبار مان ويتني ، U = 15.00 ، ص = 0.627) بين المجموعتين خلال أول 10 دقائق من التعرض لسياق مألوف (السياق). توضح هذه النتائج أن البروتوكول مناسب لاختبار السلوكيات الدفاعية استجابة لرائحة فرو / جلد القطط.
تظهر الاستجابة المشروطة للتهديد لسياق الاختبار (CONTEXT) في اليوم 1 في الشكل 4. أعيدت الفئران المعرضة لرائحة القطط إلى غرفة الاختبار بعد 24 ساعة من أول مواجهة لرائحة المفترس. في اليوم الأول ، أظهرت مستويات تجميد أعلى (اختبار Wilcoxon Signed-ranks ، Z = -2.366 ، p = 0.018) وتقييم المخاطر (اختبار Wilcoxon Signed-ranks ، Z = -2.201 ، p = 0.028) استجابة لسياق الاختبار مقارنة باليوم 0. بالإضافة إلى ذلك ، لم تكن هناك فروق في مستويات التجميد (اختبار Wilcoxon Signed-ranks ، Z = -0.841 ، p = 0.400) أو تقييم المخاطر (اختبار Wilcoxon Signed-ranks ، Z = -0.943 ، p = 0.345) بين CONTEXT و RETEST. أظهرت الفئران نفس مستويات التجميد (اختبار Wilcoxon Signed-ranks ، Z = -0.105 ، p = 0.917) وتقييم المخاطر (اختبار Wilcoxon Signed-ranks ، Z = -0.980 ، p = 0.327) أثناء RETEST و TEST. أظهرت هذه النتائج أن التعرض لرائحة فراء / جلد القطط لمدة 10 دقائق أدى إلى استجابة تهديد مكتسبة للسياق الذي واجهت فيه رائحة المفترس.
يوضح الشكل 5 والشكل 6 مجموعتين من التجارب باستخدام البروتوكول المقدم في هذه المقالة. اختبرنا ما إذا كانت القشرة الإدراكية الأولية (pIC) ، وهي منطقة دماغية تشارك في معالجة المشاعر8،30،31،32 ، ضرورية للتعبير عن السلوكيات الدفاعية. تم تقييم التنشيط العصبي الناجم عن رائحة القطط في pIC عن طريق حساب خلايا c-Fos-ir في مجموعات حيوانية منفصلة: ظروف عدم وجود رائحة ورائحة القطط. تم قتل هذه الفئران رحيما بعد 90 دقيقة من الانتهاء من الاختبار. لوحظت زيادة كبيرة في عدد الخلايا العصبية c-Fos-ir في pIC في مجموعة رائحة القطط (اختبار مان ويتني ، U = 3.000 ، ص = 0.016) مقارنة بالمجموعة الضابطة (الشكل 5).
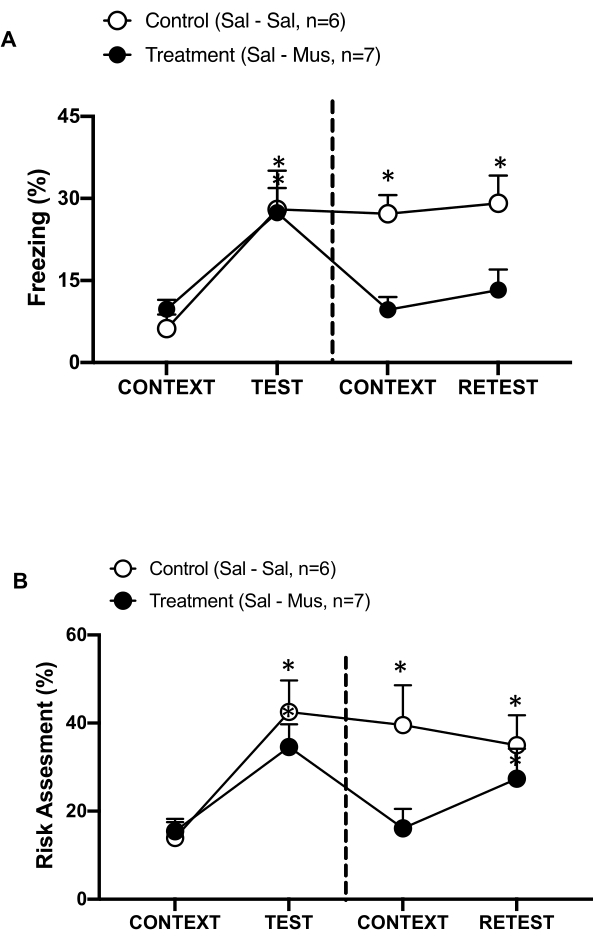
الشكل 6: يؤدي تعطيل Muscimol للقشرة القبلية الأولية إلى إضعاف ذاكرة التهديد السياقية. (أ ، ب) تم حقن مجموعة العلاج بالمحلول الملحي في اليوم 0 وموسيمول في اليوم 1 في pIC (مجموعة العلاج). تم حقن الفئران الضابطة بالمحلول الملحي في pIC في كلا اليومين. في اليوم الأول ، أعيدت إلى غرفة الاختبار المألوفة وتعرضت ل CONTEXT لمدة 10 دقائق وأعيد تعريضها لرائحة القطط (RETEST) لمدة إضافية مدتها 10 دقائق. تظهر الدوائر النسبة المئوية للوقت الذي يقضيه في التجميد (الدوائر السوداء) وسلوك تقييم المخاطر (الدوائر المفتوحة). يفصل الخط المتقطع اختبار الخوف الفطري (اليوم 0 ، يسار) عن اختبار الخوف السياقي (اليوم 1 ، يمين). يتم التعبير عن البيانات كوسائل + SEM. * ص < 0.05. تم تعديل هذا الرقم من 8. الاختصارات: pIC = قشرة الحساسية الابتدائية. Sal-Sal = محلول ملحي يتم حقنه في اليوم 0 واليوم 1 ؛ Sal-Mus = محلول ملحي يتم حقنه في اليوم 0 وموسيمول في اليوم 1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
قمنا أيضا بقياس تأثير تعطيل muscimol ل pIC على ذاكرة التهديد السياقي (الشكل 6). تلقت مجموعة العلاج (الفئران sal-mus) حقنة ملحية في pIC في اليوم 0 و GABA-A ناهض muscimol في اليوم 1. لم تظهر هذه المجموعة من أي اختلافات في التجميد (الشكل 6 أ ، اختبار Wilcoxon Signed-ranks ، Z = -0.140 ، p = 0.889) أو تقييم المخاطر (الشكل 6 ب ، اختبار Wilcoxon Signed-ranks ، Z = -0.700 ، p = 0.484) في اليوم 1 استجابة للسياق المألوف مقارنة باليوم 0 ، مما يشير إلى ضعف في ذاكرة التهديد السياقي. ومن المثير للاهتمام ، أن التجميد (الشكل 6 أ ، اختبار Wilcoxon Signed-ranks ، Z = -2.100 ، p = 0.036) ، ولكن ليس تقييم المخاطر (الشكل 6 ب ، اختبار Wilcoxon Signed-ranks ، Z = -0.980 ، p = 0.327) ، تم انخفاضه بشكل كبير أثناء RETEST مقارنة ب TEST. تشير هذه النتيجة الأخيرة إلى أن إسكات pIC في اليوم الأول أضعف بشكل انتقائي استجابة الخوف ، ولكن ليس القلق ، لرائحة المفترس. مجتمعة ، تدعم هذه النتائج أن البروتوكول التجريبي الموصوف أعلاه مناسب لدراسة الاستجابات الدفاعية الفطرية والمكتسبة للتهديدات المفترسة.
Discussion
يقدم البروتوكول الموصوف هنا نهجا مبتكرا لتقييم السلوكيات الدفاعية التي تثيرها المحفزات الفطرية والمكروهة. تم استخدام غرفة اختبار بدون منطقة اختباء آمنة (الشكل 1) وطوق مشرب برائحة الجلد / الفراء من قطة منزلية أنثى مبايض لإثارة حالة تهديد قوية ومستدامة في الفئران قد تكون مفيدة للتحقيق في الدوائر العصبية الكامنة وراء ردود الفعل الدفاعية التكيفية وغير القادرة على التكيف.
من المعروف أن عرض ردود الفعل الدفاعية المحددة يعتمد على ميزات كل من محفز التهديد والموقف / البيئة التي يواجه فيها21،33. يعد التجنب وتقييم المخاطر والتجميد جزءا من ذخيرة واسعة من ردود الفعل الدفاعية للحيوانات التي يمكن استثارتها من خلال المحفزات المهددة9،19. ومع ذلك ، فإن اختيار رد الفعل الدفاعي السائد يعتمد على الظروف البيئية مثل المسافة من التهديد33 أو وجود مكان آمن داخل غرفة الاختبار21 ، 33. على سبيل المثال ، عندما يتم وضع الفئران في الساحة مع صندوق الاختباء ، في وجود رائحة القطط ، فإنها تظهر سلوكيات دفاعية مثل مواقف التمدد / الحضور ، وإخراج الرأس من صندوق الإخفاء ، والتجنب6،24،25. في المقابل ، يتم استنباط سلوك التجميد والمسح اليقظ ومواقف التمدد / الحضور بقوة في المواقف التي لا يكون فيها الهروب ممكنا ، والمسافة إلى التهديد ليست قصيرة للغاية33،34.
أظهرت الدراسات أن التعرض لضغوط لا يمكن السيطرة عليها ينتج عنه مجموعة متنوعة من العواقب السلوكية التي تختلف عن تلك التي تحدث عندما يكون الضغط قابلا للسيطرةعليه 35،36،37،38. على سبيل المثال ، تؤدي صدمة الذيل التي لا مفر منها ، ولكنها لا يمكن تجنبها ، إلى زيادات كبيرة في السيروتونين في نواة الراف الظهرية35 والسلوكيات الشبيهة بالقلق التي تم قياسها بعد 24 ساعة من التجربة البغيضة36. علاوة على ذلك ، فإن الضغوطات التي لا يمكن السيطرة عليها تعزز تكييف الخوف في36،37 والبشر38. كان الأساس المنطقي الأولي لتطوير البروتوكول هو تعريض الفئران لموقف لا يمكنهم فيه التحكم في الحافز المكروه، وبالتالي إظهار استجابات قوية ومستدامة للتهديد وتطوير تعلم سياقي محسن بعد التعرض لرائحة قطط واحدة وقصيرة.
في التصميم التجريبي الموصوف هنا ، أثار عدم وجود صندوق اختباء حالة دفاعية قوية ومستدامة تتناوب بين التجميد (أي الجمود التام باستثناء التنفس28) وتقييم المخاطر (أي المسح اليقظ ومواقف التمدد / الحضور29) ، والتي تعتبر عادة مظاهر سلوكية للخوف وحالات شبيهة بالقلق في القوارض ، على التوالي (الشكل 3). والجدير بالذكر أن نفس النمط من ردود الفعل الدفاعية حدث بعد 24 ساعة عندما أعيد تعرض الفئران لسياق الاختبار ، مما يشير إلى أن التعرض لرائحة فراء / جلد القطط لمدة 10 دقائق يكفي للحث على تعلم التهديدات السياقية طويلة الأمد ، كما ورد سابقا7،10،11،14،15،34،39 (الشكل 4).
تم استخدام طوق قطة مع بطانة داخلية لباد لجمع الروائح / الروائح وحبسها بكفاءة وبالتالي الحصول على عينة موثوقة من محفز التهديد لإثارة استجابة دفاعية قوية. استخدم الباحثون محفزات مكروهة مثل براز القطط أو البول أو ثلاثي ميثيل ثيازولين (TMT ، أحد مكونات براز الثعلب) في عمل مماثل. ومع ذلك ، يبدو أن هذه المحفزات أقل تنبؤا بالوجود الفوري للحيوان المفترس لأنها أقل قدرة على إحداث التعلم السياقي40،41. وفقا للنتائج السابقة2،4،8،9،10،11،20،34،39 ، فإن رائحة القطط هي حافز فطري مكروهة موثوق به يمكن أن يحفز ردود فعل دفاعية مستدامة وذاكرة تهديد سياقية في الفئران. على مر السنين ، استحوذ هذا النوع من النموذج السلوكي السلوكي الحيواني بشكل متزايد على اهتمام الباحثين لدراسة الإجهاد والاضطرابات المرتبطةبالإجهاد 13،14،15،16،17،23،42 مثل تلك المرتبطة بذكريات الخوف غير القادرة على التكيف مثل اضطراب ما بعد الصدمة.
يهدف هذا البروتوكول إلى استخدامه جنبا إلى جنب مع مجموعة متنوعة من التقنيات التجريبية ، بما في ذلك ، على سبيل المثال ، مناهج البيولوجيا الجزيئية والخلوية والفيزيولوجيا الكهربية في المستيقظة والمتكيفة ، والتي توفر الفرصة للإجابة على الأسئلة المفتوحة وتحسين فهمنا للاستجابات التكيفية للتهديدات غير القادرة على التكيف. في هذه الدراسة ، اختبرنا فكرة أن pIC ، وهي منطقة دماغية تشارك في معالجة المشاعر ، ضرورية للتعبير عن السلوكيات الدفاعية. اقترنت التجارب السلوكية بالكيمياء الحصيجية المناعية c-Fos لرسم خريطة لأنماط النشاط العصبي في pIC استجابة لرائحة القطط والحقن داخل المخ لناهض مستقبلات GABA-A ، muscimol ، لإسكات pIC بشكل عكسي وتحديد مشاركتها في ردود الفعل التهديدية الفطرية والمكتسبة لرائحة المفترس. كشفت هذه النتائج أن رائحة القطط أثارت زيادة في النشاط العصبي في pIC (الشكل 5) ، وأن إسكات pIC أدى إلى عجز حاد في ذاكرة التهديد السياقي (الشكل 6).
على الرغم من أن البروتوكول الموصوف هنا سهل التنفيذ والتنفيذ من الناحية الفنية ، فقد تنشأ بعض المضاعفات. على سبيل المثال ، قد يحدث تلوث متبادل لرائحة القطط إذا لامس الطوق غير البالي طوق القط البالي. وبالتالي ، يجب الاحتفاظ بالياقات بشكل منفصل أثناء جميع الإجراءات ، ويجب تغيير القفازات بعد وضع الياقة البالية في غرفة الاختبار. إذا أراد المجرب إجراء ظروف الرائحة والرائحة باستخدام نفس غرفة الاختبار ، فيجب إجراء التجارب في أيام مختلفة. يمكن استخدام غرفتي اختبار متطابقتين لهذهالتجارب 34 ، ويجب الاحتفاظ بالفئران في غرف منفصلة لتجنب التواصل الاجتماعي43. قد يكون الإجهاد الناجم عن التعرض لمحفزات جديدة في بيئات غير مألوفة مشكلة أيضا. وبالتالي ، يجب أن يكون لدى ثلاثة أيام على الأقل من التعود على بيئة الاختبار والإجراءات لتقليل الإجهاد والدفاعية التي تظهرها الفئران عادة في المواقف الجديدة. بالإضافة إلى ذلك ، يجب أن يكون الوقت المطلوب لفترة التعود أطول من فترة الاختبار. على سبيل المثال ، إذا استغرق الاختبار 10 دقائق ، فيجب تخصيص 20 أو 30 دقيقة لفترة التعود.
أخيرا ، يفضل تقييم السلوكيات الدفاعية خلال المرحلة المظلمة من الدورة ، عندما تكون الفئران نشطة. يجب الحفاظ على الفئران تحت دورة إضاءة / ظلام عكسية للسماح بتنفيذ الإجراءات التجريبية بينما يكون كل من الجرذ والمجرب في مرحلتهما النشطة34. لا يستغرق التغيير في دورة الضوء / الظلام أكثر من 10 أيام حتى يتم تسويته ، وبناء على التجربة ، تستجيب معظم الفئران في ظل هذه الحالة بشكل مناسب لرائحة القطط. ومع ذلك ، هناك بعض الدراسات التي تظهر أن فئران Sprague-Dawley أقل عرضة للتهديدات طويلة الأمد والقلق من فئرانWistar 44. وبالتالي ، من الممكن أن يؤدي استخدام فئران Wistar بدلا من فئران سلالة Sprague-Dawley إلى نتائج أكثر قوة.
في الختام ، رائحة القطط هي حافز تهديد ذو صلة عاطفية يثير استجابات عصبية وغدد صماء وسلوكية موثوقة في الفئران. تؤدي مواجهة رائحة القطط في غرفة لا مفر منها إلى استجابة قوية وطويلة الأمد للخوف / القلق في الفئران ، مما يؤدي إلى تعلم سريع ودائم للتهديدات السياقية. يمكن أن يكون البروتوكول الموصوف أعلاه أداة مفيدة لدراسة الخوف وآليات ترميز ذاكرة التهديد التكيفية وغير القادرة على التكيف.
Disclosures
لا يمتلك مؤلفو هذه المخطوطة مصالح مالية متنافسة أو تضارب مصالح آخر للإفصاح عنه.
Acknowledgements
يعرب المؤلفون عن امتنانهم لمارسيلا غونزاليس للمساعدة في الإجراءات المختبرية ، ومابيل ماتامالا لمساهمتها في تصميم البروتوكول ، وميغيل روخاس للمساعدة في الرسم التوضيحي.
Materials
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
References
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682(2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283(2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. , Elsevier Academic Press. Amsterdam. 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, Chapter 9, Unit 9 45(2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16(2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , Chapter 8, Unit 8.19 (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91(2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , Academic Press. San Diego. (1997).
- Swanson, L. W. Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , Elsevier. (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377(1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292(2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132(2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041(2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved