Method Article
Un protocolo ineludible de exposición al olor de gato para estudiar el condicionamiento de amenazas innatas y contextuales en ratas
En este artículo
Resumen
La exposición al olor de la piel y el pelaje de los gatos proporciona un método fiable para investigar los circuitos neuronales y los mecanismos de las respuestas defensivas en los roedores, y puede ofrecer información sobre los mecanismos que median el miedo en los humanos. Aquí, describimos un protocolo para investigar el papel de la corteza interoceptiva en las respuestas de amenaza en ratas.
Resumen
Los animales responden a situaciones amenazantes exhibiendo una serie de comportamientos defensivos, que incluyen la evitación, la congelación y la evaluación de riesgos. Un modelo animal con un enfoque etológico ofrece una visión más profunda de los mecanismos biológicos que subyacen a las respuestas a las amenazas. Este artículo describe una metodología para medir los comportamientos defensivos hacia estímulos aversivos innatos y aprendidos en ratas. Los animales fueron expuestos individualmente al olor de los depredadores en una cámara ineludible para provocar un estado defensivo medible, sostenido y medible. El diseño experimental consistió en colocar una rata en una cámara familiar durante 10 minutos, seguida de una exposición al olor de gato durante otros 10 minutos en el mismo contexto. Al día siguiente, las ratas fueron reexpuestas durante 10 minutos a la misma cámara de contexto donde se produjo la exposición al olor de gato. Las sesiones fueron grabadas en video y se evaluaron los comportamientos defensivos en ambos días.
La prueba conductual se combinó con técnicas de inactivación funcional reversible e inmunohistoquímica c-Fos para determinar el papel de la corteza interoceptiva en las respuestas a las amenazas. Las ratas expuestas al olor de gato el primer día y reexpuestas a la cámara de contexto el segundo día mostraron niveles más altos de comportamientos defensivos, y ese olor a gato provocó un aumento robusto en la actividad neuronal de la corteza interoceptiva. Además, la inactivación de muscimol de la corteza interoceptiva redujo la expresión de comportamientos defensivos en respuesta al olor de gato y alteró la memoria contextual de amenazas. Estos resultados muestran que este ensayo conductual es una herramienta útil para estudiar los mecanismos neuronales de los comportamientos defensivos y puede ofrecer información sobre los mecanismos que median el miedo en los seres humanos y sus trastornos relacionados.
Introducción
Los comportamientos defensivos ocurren en respuesta a estímulos que señalan una amenaza potencial para la supervivencia de un animal. Estos comportamientos están altamente conservados en todos los mamíferos y se asocian rápidamente con estímulos o circunstancias relacionadas con la amenaza 1,2,3. En la naturaleza, los estímulos amenazantes para la mayoría de los animales son los depredadores; Por lo tanto, la detección de señales de depredadores, como las señales de olor, es particularmente ventajosa para evitar la depredación. Las respuestas conductuales a las señales de los depredadores han sido ampliamente investigadas en roedores.
Por ejemplo, los estímulos, como el pelaje natural de gato o los olores de la piel, activan el sistema olfativo y el vomeronasal, induciendo altos niveles de comportamientosdefensivos. Estos estímulos se acompañan de cambios en la actividad neuronal y endocrina 5,6,7,8, y son estímulos fuertes, incondicionados y aversivos para el condicionamiento de amenazas contextuales en ratas 7,8,9,10,11. Los estudios han demostrado que al menos 24 horas después de la exposición a las señales naturales de los depredadores, las ratas muestran estados condicionados robustos y duraderos similares a la ansiedad 7,12,13. Este fenómeno es de particular interés para desarrollar modelos más realistas del trastorno de estrés postraumático (TEPT)14,15,16,17, el trastorno de ansiedad generalizada (TAG)5 y el trastorno de pánico (TP)18,19.
En entornos de laboratorio, el comportamiento de miedo se mide como huida, evitación (p. ej., retirada, escondite) o congelación. Además, la ansiedad se puede medir como posturas de estiramiento y exploración vigilante dirigida a monitorear un estímulo depredador, un conjunto de respuestas ampliamente conocidas como comportamientos de evaluación de riesgos 6,9,20. Los estudios han demostrado que el comportamiento de congelación es la estrategia defensiva predominante en ratas frente a una amenaza ineludible, mientras que la evaluación del riesgo se observa cuando la amenaza es ambigua o no localizada 12,21,32. Aunque se sabe que un estímulo innato o aprendido puede provocar comportamientos defensivos, hay una falta de paradigmas conductuales de laboratorio que capturen de manera confiable las respuestas defensivas en un contexto más etológico. Para llenar este vacío, diseñamos un protocolo con un enfoque etológico que permite la medición de comportamientos de amenaza innatos y contextuales sostenidos junto con las respuestas cerebrales a estímulos de amenaza naturalistas.
Las experiencias estresantes, como la exposición a un olor ineludible de depredador, causan alteraciones perdurables en la respuesta conductual y fisiológica en ratas 14,22,23. Estas alteraciones reflejan el perfil sintomático observado en los trastornos relacionados con el miedo y la ansiedad, como el TEPT. En el modelo actual, se utiliza una cámara de prueba sin un área de escondite segura para exponer a las ratas a un evento de amenaza ineludible y, por lo tanto, mejorar las respuestas defensivas. Las ratas mostraron comportamientos robustos de congelación y evaluación de riesgos en respuesta tanto al olor de los gatos como al contexto de la prueba. Estos hallazgos respaldan el uso de este protocolo como un método confiable y válido para explorar los mecanismos biológicos que subyacen a los comportamientos defensivos y desarrollar y refinar nuevas estrategias para el tratamiento de los trastornos del miedo en humanos.
Protocolo
El siguiente procedimiento se llevó a cabo de acuerdo con las recomendaciones de las Directrices Institucionales de la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud (EE.UU.) (Publicación NIH Nº 80-23, revisada en 1996). El Comité Institucional de Bioseguridad y Ética de la Pontificia Universidad Católica de Chile aprobó todos los procedimientos. Todas las sesiones experimentales se llevaron a cabo durante la fase activa de la rata (fase oscura).
1. Preparación de la sala de pruebas y la cámara de pruebas
NOTA: La descripción general del aparato se muestra en la Figura 1. La cámara de pruebas fue desarrollada y modificada de acuerdo con estudios previos24,25.
- Utilice una cámara de prueba rectangular transparente de polietileno (metacrilato) con las siguientes dimensiones: 60 cm (largo) x 40 cm (ancho) x 40 cm (alto). Cubra las paredes laterales y traseras de la cámara de prueba con papel negro. Asegúrese de que la parte frontal de la cámara de pruebas sea transparente para registrar los comportamientos de los animales.
- Fije un soporte de acero al piso en la esquina inferior derecha de la cámara de prueba y utilícelo para sujetar los collares de gato para los procedimientos de prueba.
- Limpie la cámara de prueba con etanol al 5% (v/v) antes y después de las pruebas para eliminar cualquier rastro de olor dejado por las ratas en cuestión y evitar la respuesta de aversión de la rata. Deje pasar 5 minutos entre cada sesión para que el etanol se evapore por completo.
- Realice la sesión de prueba en una habitación tranquila tenuemente iluminada por una bombilla de luz roja de 80 W ubicada a 20 cm por encima de la cámara de prueba. Use una cámara de video ubicada frente a la cámara para grabar el comportamiento de los animales.
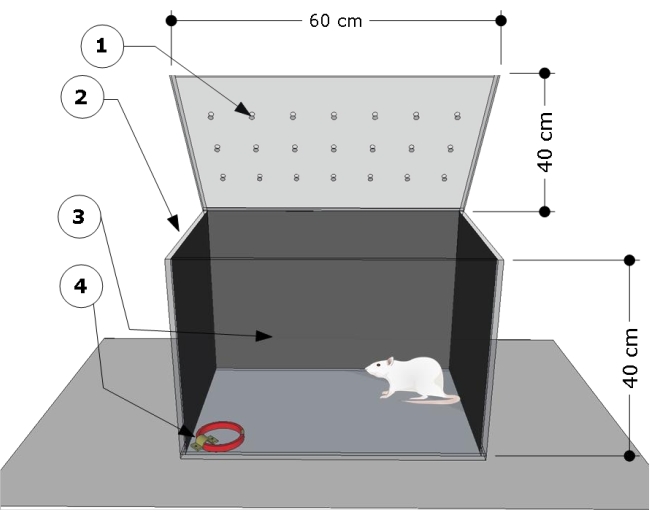
Figura 1: Vista general esquemática de la cámara de pruebas. El aparato consta de un compartimento de prueba con: (1) orificios de ventilación, (2) paredes laterales y (3) traseras oscurecidas, y un soporte de acero bloqueado en el piso de la esquina izquierda (4) para sujetar el collar del gato (dimensiones: ancho 15 mm, espesor 5 mm, largo 300 mm). Las dimensiones de la cámara se indican en el cartón (60 L x 40 W x 40 H cm). Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación para el olor de gato
- Consigue un collar para gatos con una cara interior forrada de fieltro para atrapar mejor el olor del gato. Asegure la disponibilidad de varios collares para su uso como collar de control (sin olor) o collar de prueba (olor a gato).
NOTA: El punto crucial es que el collar para gatos debe tener un forro interno para recoger y atrapar olores. - Coloque un collar en una gata doméstica ovariectomizada y permita que la gata use el collar durante una semana antes de la prueba. Trate de mantener a la gata dentro de casa mientras usa el collar de prueba.
NOTA: Use el mismo gato durante todo el estudio. - Guarde el collar de gato usado en un recipiente de plástico hermético y guárdelo a 4 °C. Reemplace el collar de gato desgastado por un collar que contenga un olor fresco a gato cada tres días.
3. Preparación de las ratas para el procedimiento experimental
- Utilice ratas Sprague-Dawley macho adultas que pesen entre 270 y 290 g. Alójelos en jaulas individuales con comida y agua disponibles ad libitum.
- [Opcional] Preparación de ratas para el procedimiento quirúrgico (opcional)
- Realizar la cirugía en condiciones estériles. Limpiar y desinfectar el área de trabajo con una solución de etanol al 70% y esterilizar todos los materiales e instrumentos quirúrgicos.
- Anestesiar a la rata con una mezcla intraperitoneal de ketamina (100 mg/kg) y xilacina (20 mg/kg). Espere hasta que se alcance el plano adecuado de anestesia cuando la rata no responde a un estímulo de pellizco del dedo del pie o estimulación de la córnea. Para mantener la condición anestésica durante toda la cirugía, administre una dosis adicional del cóctel anestésico cada 45 min.
- Afeita suavemente la cabeza de la rata desde detrás de la oreja hasta entre los ojos, y desinfecta el área quirúrgica con una almohadilla estéril de preparación de alcohol seguida de una solución de povidona yodada. Aplique ungüento lubricante para los ojos para evitar la sequedad de la córnea durante el procedimiento quirúrgico.
- Coloque a la rata en un aparato estereotáxico y sostenga la cabeza colocando correctamente las barras de los oídos en los canales auditivos. Luego, inserte suavemente los incisivos de la rata en la barra de incisivos y asegure la pinza nasal.
- Coloque una cánula guía estéril de acero inoxidable de 26 G en el soporte estereotáxico. Tome un bisturí y haga una incisión en la línea media a lo largo del cuero cabelludo. Coloque 2 o más pinzas alrededor de la incisión (2-3 cm).
- Limpie el cráneo completamente de tejido hasta que las suturas craneales de bregma y lambda sean visibles.
- Verificar la posición simétrica de la cabeza mediante la alineación de los ejes dorsoventral y anteroposterior del cráneo utilizando las barras de los incisivos y de la oreja, respectivamente. Identifique las coordenadas de la cánula guía para la región cerebral de interés. Mantenga el bregma y la lambda en el mismo plano horizontal usando la barra de incisivos.
- Calcular las coordenadas del sitio de implantación de la cánula guía en el área de interés siguiendo las coordenadas estereotáxicas de Paxinos y Watson26 o Swanson atlas27.
NOTA: Para la corteza insular interoceptiva primaria, se utilizaron las siguientes coordenadas estereotáxicas: Bregma -0,51 mm, línea media 5,0 mm, profundidad desde la superficie craneal 4,5 mm, ángulo medial 10° desde la vertical. - Verifique las coordenadas de implantación de la cánula guía bajándola hasta que toque el cráneo y luego perfore un orificio a través del cráneo en el sitio verificado. Taladre 3 agujeros adicionales alrededor del área objetivo para colocar 3 tornillos en el cráneo.
- Inserte la cánula en el área del cerebro de interés y use tornillos y acrílico dental para anclar la cánula al cráneo. Vierta acrílico dental sobre el cráneo seco y asegúrese de que cubra los tornillos para fijar la cánula en su lugar. Deje que el dental acrílico se endurezca y luego retire el brazo estereotáxico con cuidado, dejando la cánula guía en su lugar.
NOTA: Este procedimiento inmoviliza la cánula implantada y permite a los experimentadores realizar múltiples microinyecciones en el área de interés. - Inserte un estilete de acero inoxidable en la cánula guía para evitar obstrucciones y contaminación.
- Al final de la cirugía, administrar una dosis única de antibiótico (enrofloxacino 5%; 19 mg/kg i.p.) y antiinflamatorio (cetofén 0,2 mg/kg i.p.). Repita este paso durante tres días consecutivos después de la cirugía.
- Permita que las ratas se recuperen por completo durante al menos una semana antes de comenzar los experimentos.
- Mantenga a las ratas bajo un ciclo inverso de luz/oscuridad de 12/12 h (las luces se encienden a las 7:00 p.m.) durante al menos diez días antes del inicio de los experimentos (Figura 2).
NOTA: Si el experimentador necesita realizar algún procedimiento quirúrgico, sería necesario hacerlo antes de revertir el ciclo de luz y oscuridad. Esto permite la reducción del estrés después de la cirugía. - Manipule todas las ratas durante 20 minutos al día durante 2-3 días. Tome una rata a la vez, sostenga al animal firmemente por el torso (no por la cola) y acarímetelo durante este tiempo. Si los animales muestran signos de estrés, manéjelos durante períodos prolongados.
NOTA: Este paso es fundamental para minimizar el estrés de manipulación que puede afectar a los siguientes pasos. - Preexponga a los animales a la cámara de prueba (cámara de olor de gato con un collar de gato sin usar) durante 30 minutos al día durante tres días antes de los experimentos para permitir que los animales se aclimaten al contexto de prueba.
NOTA: Se sugiere que el experimentador no use perfumes o lociones perfumadas. - Después de colocar al animal en la cámara, espere aproximadamente 10-15 minutos, introduzca un brazo en la cámara de prueba y cambie el collar para gatos por otro collar para gatos con las mismas características.
NOTA: Este paso es crítico para simular, lo más fielmente posible, cada paso de los procedimientos conductuales para minimizar el estrés, que puede afectar el rendimiento conductual de la rata en los últimos 10 minutos de la prueba. - Limpie la cámara de prueba con etanol al 5% (v/v) entre sesiones.
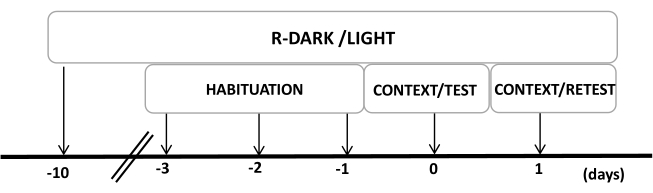
Figura 2: Cronología del diseño experimental. Las ratas fueron expuestas a un ciclo inverso de luz oscura durante 10 días y luego se habituaron a la cámara de prueba que contenía un collar de gato de control (sin usar) durante 30 minutos durante los últimos tres días. El día 0, las ratas fueron expuestas primero a una cámara de prueba familiar (CONTEXT) durante 10 minutos y luego expuestas a un collar con o sin olor a gato durante un período adicional de 10 min (TEST) en el mismo contexto. El día 1, las ratas expuestas al olor de gato (TEST) del día 0 fueron devueltas a la misma cámara de prueba durante 10 min (CONTEXT) y reexpuestas al olor de gato (RETEST) durante un período adicional de 10 min. Esta cifra ha sido modificada de 8. Abreviatura: R-Dark/light = ciclo inverso de oscuridad-luz. Haga clic aquí para ver una versión más grande de esta figura.
4. Procedimientos de prueba de olor de gato
- En el día 0 del protocolo experimental, evalúe las respuestas de amenaza al olor del gato.
- Si es necesario, administre inyecciones corticales antes de las pruebas de comportamiento siguiendo el método descrito a continuación. Si solo realiza un protocolo de comportamiento, omita este paso y continúe con el paso 4.3.
- Inserte una cánula de inyección estéril de 33 G acoplada a una jeringa Hamilton de 1 μL en la cánula guía después de retirar el oclusor.
- Llene la jeringa Hamilton con solución salina estéril (ratas de control) o el agonista del receptor GABA-A, muscimol (ratas de tratamiento), e inyecte 0,5 μL/hemisferio durante 2 minutos. Espere 2 minutos para permitir la difusión del fármaco, retire lentamente la cánula de inyección e inserte inmediatamente los oclusores.
NOTA: Realice este paso en un animal tranquilo y despierto e inyecte los medicamentos lentamente para minimizar la fluctuación de la cánula de inyección y la consiguiente difusión a las áreas cerebrales adyacentes. - Una vez completada la inyección cortical/hemisferio, espere 30 minutos y continúe con el siguiente paso.
- Coloque los animales en la cámara de pruebas durante 20 min. Durante los primeros 10 minutos, exponga a los animales a un collar familiar que no haya usado. Introduzca el collar impregnado con olor a gato (TEST) o un collar familiar sin usar (CONTEXT) en los próximos 10 minutos (Figura 3).
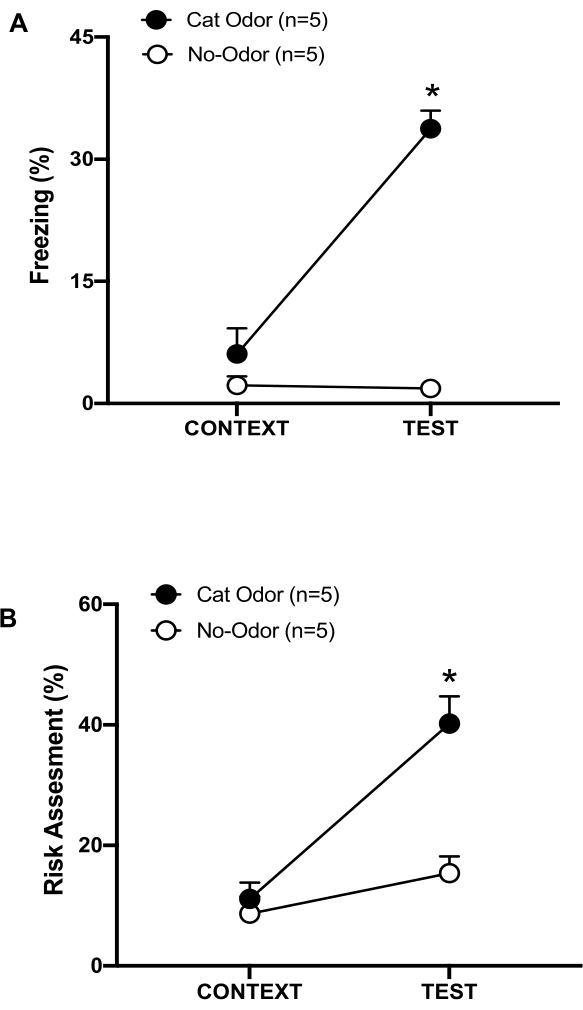
Figura 3: El encuentro con el olor de gato aumenta los comportamientos defensivos innatos. (A, B) Las ratas fueron expuestas primero a la cámara de prueba familiar (CONTEXT) durante 10 minutos y luego expuestas a un collar con olor a gato (grupo de olor a gato, círculos negros) o sin olor a gato (grupo sin olor, círculos abiertos) durante un período adicional de 10 minutos (TEST) en el mismo contexto. Los círculos muestran el porcentaje de tiempo dedicado a la congelación (B) y la evaluación de riesgos (C) que muestran las ratas ingenuas. Los datos se expresan como medias +SEM. *p < 0,05. Esta cifra ha sido modificada de 8. Haga clic aquí para ver una versión más grande de esta figura.
- Coloque una cámara de video frente a la cámara de pruebas y grabe el comportamiento del animal para su posterior calificación del comportamiento por parte de un experimentador ciego a las condiciones experimentales.
- Al final de la sesión de olor a gato, regrese a los animales a sus jaulas de casa y vuelva a colocarlos en el animalario hasta la próxima sesión.
- Limpie la cámara de prueba con etanol al 5% (v/v) entre sesiones.
- Veinticuatro horas después de la sesión de olor del gato (Día 1), evalúe las respuestas defensivas al contexto de la prueba.
- Si es necesario, repita el paso 4.2 antes de la exposición al contexto.
- Regrese las ratas a la misma cámara de prueba con el collar familiar sin usar y puntúe los comportamientos defensivos para medir la memoria contextual de amenazas durante 10 minutos (Figura 4).
- Coloque una cámara de video frente a la cámara de pruebas y grabe el comportamiento del animal para su posterior calificación del comportamiento por parte de un experimentador ciego a las condiciones experimentales.
- Durante los próximos 10 minutos, reemplace el collar familiar que no haya usado, vuelva a exponer al animal a un collar con olor a gato y mida los comportamientos defensivos.
- Después de la segunda exposición al olor de gato, regrese al animal a su jaula de origen y limpie la cámara de prueba con etanol al 5% (v/v). Vuelve a colocar a la rata en el animalario.
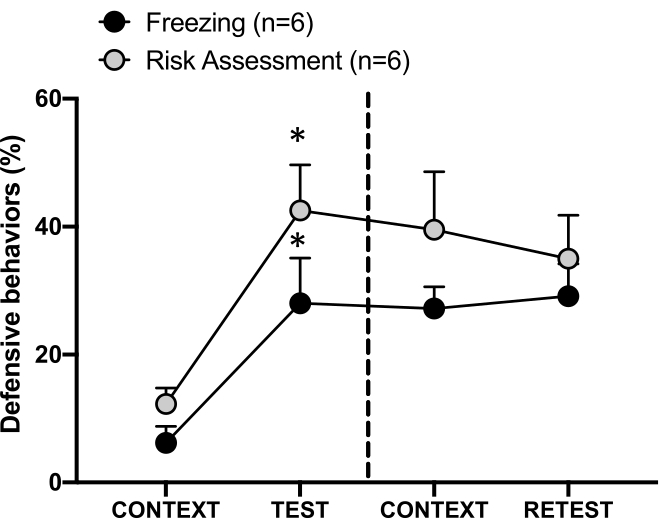
Figura 4: El encuentro con el olor de un gato induce un aprendizaje contextual de amenazas. Los círculos muestran el porcentaje de tiempo que se pasa en la congelación (círculos negros) y el comportamiento de evaluación de riesgos (círculos grises). La línea discontinua separa la prueba de miedo innato (Día 0, izquierda) de la prueba de miedo contextual (Día 1, derecha). Los datos se expresan como medias + SEM. *p < 0,05. Esta cifra ha sido modificada de 8. Haga clic aquí para ver una versión más grande de esta figura.
5. Procedimientos inmunohistoquímicos
- Anestesiar al animal con una mezcla intraperitoneal de ketamina (0,45 mg/kg) y xilacina (0,05 mg/kg) 90 minutos después de completar los experimentos. A continuación, eutanasiar a la rata por perfusión transcardíaca con paraformaldehído al 4%.
NOTA: Si es necesario evaluar la primera exposición al olor del gato, la respuesta condicionada al contexto o la reexposición al olor del gato, realice este paso después de cada una de estas situaciones experimentales. Use guantes y bata de laboratorio y manipule el paraformaldehído con cuidado debajo de una campana de gases químicos. - Después de la perfusión, fije el cerebro en la misma solución fijadora durante 2 h y luego transfiéralo a sacarosa al 30% con azida de sodio al 0,02% en solución salina tamponada con fosfato (PBS) hasta que el cerebro se hunda hasta el fondo. Almacene el cerebro a 4 °C.
- Congele el cerebro con hielo seco y córtelo en secciones coronales seriadas de 50 μm de espesor en un micrótomo deslizante. Recoja tres juegos de secciones cerebrales del área de interés, dejando uno para la verificación de la colocación de la cánula y dos juegos para el procedimiento inmunohistoquímico.
- Incubar las secciones de cerebro que flotan libremente en 0,3% H2O2 en PBS durante 30 min, lavar en PBS y transferir estas secciones a la solución de bloqueo (0,4% de Triton X-100, 0,02% de azida de sodio, 3% de suero de cabra normal en PBS) durante 1 h.
- Transfiera las secciones a la solución de incubación de anticuerpos primarios que contenga anticuerpo c-Fos diluido 1:20.000 en solución bloqueante y déjelas toda la noche a temperatura ambiente.
- Enjuague las secciones en PBS durante 1 h y luego incube en la solución de anticuerpos secundaria diluida 1:1,000 en Triton X-100 al 0,4% y suero de cabra normal al 1,5% en PBS.
- Enjuagar las secciones durante 40 min e incubarlas durante 1 h en el sistema peroxidasa a base de avidina/biotina (ver Tabla de Materiales), diluido 1:500 en PBS.
- Enjuague e incube las secciones en una solución al 0,05% de clorhidrato de diaminobenzidina (DAB) 3-3' que contenga 0,003% deH2O2 y 0,05% de cloruro de níquel para obtener un producto de reacción azul oscuro.
6. Recuento de células
- Examinar secciones bajo una cámara lúcida utilizando un objetivo de baja potencia (10x) para localizar la tinción puntiforme de c-Fos en los núcleos de las neuronas (Figura 5).
- Utilice una cuadrícula de conteo relacionada con el tamaño del área de interés. Para el pIC, por ejemplo, de Bregma 0,95 a -0,26, utilice una cuadrícula de recuento de 0,25 mm x 1 mm; de Bregma -0,51 a -2,45 mm, utilice una rejilla de recuento de 0,5 mm x 1 mm.
- Cuantifique el número de células inmunorreactivas c-Fos (Fos-ir) por sección utilizando un contador manual de dígitos.
- Cuente todas las secciones coronales de interés dos veces y asegúrese de que el mismo observador, ciego a las condiciones experimentales, realice el conteo.
- Tome una fotografía usando un microscopio acoplado a una cámara digital.
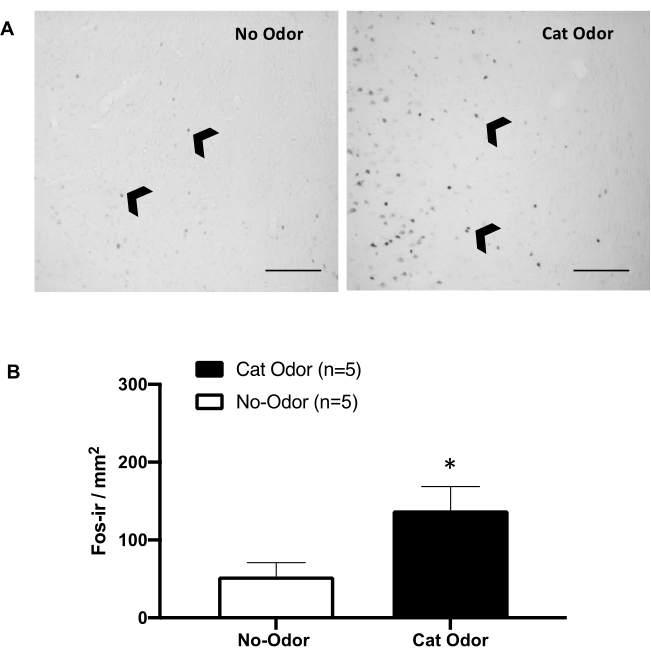
Figura 5: El olor a gato provoca la activación neuronal en la corteza interoceptiva primaria. (A) Fotomicrografía representativa del pIC que muestra una casi ausencia de células c-Fos-ir (puntas de flecha negras) en ratas expuestas a un collar de gato sin usar (sin olor, izquierda) en comparación con un número notablemente mayor de células c-Fos-ir en ratas expuestas al olor de gato (derecha). (B) Cuantificación de células c-Fos-ir en el pIC en ambas condiciones experimentales. Los datos se expresan como medias + SEM. *p < 0,05. Barras de escala = 200 μm. Esta cifra ha sido modificada de 8. Abreviaturas: pIC = corteza interoceptiva primaria; c-fos-ir = c-Fos-inmunorreactivo. Haga clic aquí para ver una versión más grande de esta figura.
7. Análisis de datos
- Puntúe los comportamientos defensivos de los experimentos grabados en vídeo y analícelos utilizando software estadístico.
- Evalúe la congelación por episodios de tiempo, expresados como un porcentaje del tiempo dedicado a la congelación durante 10 minutos. Calcule el porcentaje de congelación usando la Ec (1).
Congelación = (segundos de congelación/600 s) × 100 (1)
NOTA: La congelación se definió como la ausencia total de movimiento, excepto la respiración durante al menos 1 s28. - Califique la evaluación de riesgos cronometrando los episodios de exploración vigilante y expréselo como un porcentaje del tiempo dedicado a la evaluación de riesgos durante 10 minutos. Calcule el porcentaje de evaluación de riesgos utilizando la Ec (2).
% Evaluación de riesgos = (segundos invertidos en la evaluación de riesgos/600 s) × 100 (2)
NOTA: El comportamiento de evaluación de riesgos se definió como un escaneo vigilante (observador, movimientos de la cabeza de lado a lado, sin locomización) durante al menos 1 s29. - Califique estos parámetros de comportamiento manualmente y asegúrese de que sean contados por un experimentador ciego a las condiciones experimentales (es decir, las condiciones de olor y drogas). Dependiendo de la normalidad de los conjuntos de datos, utilice pruebas paramétricas o no paramétricas para comparar dos o más grupos.
NOTA: En este estudio, todas las pruebas estadísticas se realizaron con el software SPSS.- Utilice la prueba H de Kruskal-Wallis con la prueba U de Mann-Whitney para realizar comparaciones por pares entre grupos.
- Analice las comparaciones intragrupales a lo largo del tiempo con la prueba de Friedman seguida de la prueba de rangos con signo de Wilcoxon para comparaciones por pares.
NOTA: En todas las figuras, los niveles de significancia se establecieron en p < 0,05 (*) y p < 0,01 (**).
- Para el análisis de la expresión de c-Fos en áreas específicas del cerebro, cuente el número de células c-Fos positivas por sección calculando la densidad de células c-Fos-ir pormm2, y compare el número medio entre las condiciones de control (sin olor) y estimuladas (olor a gato).
- Dependiendo de la normalidad de los datos, utilice la prueba t de Student no emparejada o la prueba U de Mann-Whitney.
NOTA: En este estudio se utilizó la prueba U de Mann-Whitney; Las diferencias se consideraron significativas si p < 0,05 (*).
- Dependiendo de la normalidad de los datos, utilice la prueba t de Student no emparejada o la prueba U de Mann-Whitney.
Resultados
En este protocolo, se midieron los porcentajes de congelación y evaluación de riesgos como indicadores de estados similares al miedo y la ansiedad en ratas, respectivamente. La línea de tiempo del diseño experimental se muestra en la Figura 2. Los resultados de los animales expuestos al olor de gato en el día 0 se presentan en la Figura 3. Las ratas mostraron niveles significativamente más altos de congelación (Figura 2A, grupo de olor a gato, prueba de rangos con signo de Wilcoxon, Z = -2,201, p = 0,028) y evaluación de riesgos (Figura 2B, grupo de olor a gato, prueba de rangos con signo de Wilcoxon, Z = -2,336, p = 0,018) en respuesta al olor de gato (TEST) que al contexto familiar (CONTEXT). Se observaron bajos niveles de congelación (Figura 2A, grupo sin olor, prueba de Wilcoxon Signed-ranks, Z = -0,184, p = 0,854) y de evaluación de riesgos (Figura 2B, grupo sin olor, prueba Wilcoxon Signed-ranks, Z = -1,753, p = 0,08) en ratas expuestas a un collar sin usar durante la segunda parte de la prueba.
Un análisis adicional reveló que los niveles de congelación (Figura 2A, prueba de Mann-Whitney, U = 0,000, p = 0,004) y la evaluación de riesgos (Figura 2B, prueba de Mann-Whitney, U = 4,000, p = 0,025) fueron más altos en el grupo de olor a gato que en el grupo sin olor durante la segunda parte de la prueba. No hubo diferencias significativas en la congelación (Figura 2A, prueba de Mann-Whitney, U = 11.000, p = 0.256) y la evaluación del riesgo (Figura 2B, prueba de Mann-Whitney, U = 15.00, p = 0.627) entre los dos grupos durante los primeros 10 minutos de exposición a un contexto familiar (CONTEXT). Estos resultados demuestran que el protocolo es adecuado para probar comportamientos defensivos en respuesta al olor de la piel y el pelaje del gato.
En la Figura 4 se muestra la respuesta condicionada a la amenaza al contexto de prueba (CONTEXT) en el día 1. Las ratas expuestas al olor de gato fueron devueltas a la cámara de pruebas 24 horas después del primer encuentro con el olor del depredador. El día 1, los animales exhibieron niveles más altos de congelación (prueba de Wilcoxon Signed-ranks, Z = -2.366, p = 0.018) y evaluación de riesgos (prueba Wilcoxon Signed-ranks, Z = -2.201, p = 0.028) en respuesta al contexto de la prueba que en el día 0. Además, no hubo diferencias en los niveles de congelación (prueba de Wilcoxon Signed-ranks, Z = -0,841, p = 0,400) o en la evaluación de riesgos (Wilcoxon Signed-ranks test, Z = -0,943, p = 0,345) entre CONTEXT y RETEST. Las ratas mostraron los mismos niveles de congelación (prueba de rangos con signo de Wilcoxon, Z = -0,105, p = 0,917) y evaluación de riesgos (prueba de rangos con signo de Wilcoxon, Z = -0,980, p = 0,327) durante RETEST y TEST. Estos resultados demostraron que una sola exposición de 10 minutos al olor del pelaje o la piel del gato resultó en una respuesta de amenaza aprendida al contexto en el que los animales se enfrentaron al olor del depredador.
Las figuras 5 y 6 muestran dos conjuntos de experimentos utilizando el protocolo presentado en este artículo. Probamos si la corteza interoceptiva primaria (pIC), una región del cerebro involucrada en el procesamiento de las emociones 8,30,31,32, es necesaria para la expresión de comportamientos defensivos. La activación neuronal inducida por el olor del gato se evaluó en el pIC mediante el recuento de células c-Fos-ir en grupos de animales separados: condiciones de ausencia de olor y olor de gato. Estas ratas fueron sacrificadas 90 minutos después de la finalización de la TEST. Se observó un aumento significativo en el número de neuronas c-Fos-ir en el pIC en el grupo de olor de gato (prueba de Mann-Whitney, U = 3,000, p = 0,016) en comparación con el grupo control (Figura 5).
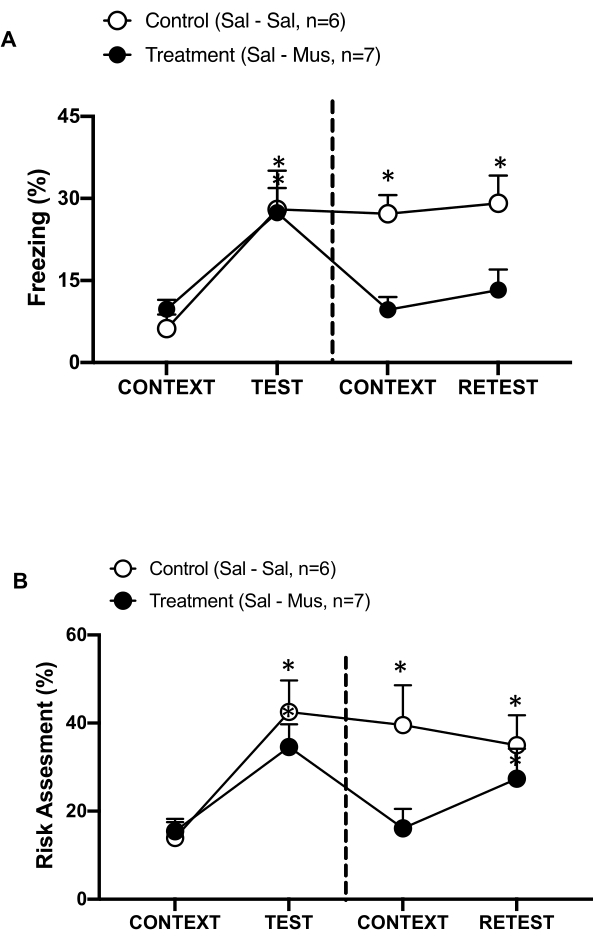
Figura 6: La inactivación de muscimol de la corteza interoceptiva primaria afecta la memoria de amenaza contextual. (A, B) Al grupo de tratamiento se le inyectó solución salina el día 0 y muscimol el día 1 en el pIC (grupo de tratamiento). A las ratas control se les inyectó solución salina en el pIC en ambos días. El día 1, los animales fueron devueltos a la cámara de prueba familiar y expuestos al CONTEXT durante 10 minutos y reexpuestos al olor a gato (RETEST) durante un período adicional de 10 minutos. Los círculos muestran el porcentaje de tiempo dedicado a la congelación (círculos negros) y el comportamiento de evaluación de riesgos (círculos abiertos). La línea discontinua separa la prueba de miedo innato (Día 0, izquierda) de la prueba de miedo contextual (Día 1, derecha). Los datos se expresan como medias + SEM. *p < 0,05. Esta cifra ha sido modificada de 8. Abreviaturas: pIC = corteza interoceptiva primaria; Sal-Sal = solución salina inyectada el día 0 y el día 1; Sal-Mus = solución salina inyectada el día 0 y muscimol el día 1. Haga clic aquí para ver una versión más grande de esta figura.
También medimos el efecto de la inactivación del pIC por muscimol en la memoria contextual de amenazas (Figura 6). El grupo de tratamiento (ratas sal-mus) recibió una inyección de solución salina en el pIC el día 0 y muscimol con agonista GABA-A el día 1. Este grupo de animales no mostró ninguna diferencia en los niveles de congelación (Figura 6A, prueba de rangos con signo de Wilcoxon, Z = -0,140, p = 0,889) o en la evaluación de riesgos (Figura 6B, prueba de rangos con signo de Wilcoxon, Z = -0,700, p = 0,484) en el día 1 en respuesta al contexto familiar en comparación con el día 0, lo que indica un deterioro en la memoria contextual de amenazas. Curiosamente, la congelación (Figura 6A, prueba de rangos con signo de Wilcoxon, Z = -2,100, p = 0,036), pero no la evaluación de riesgos (Figura 6B, prueba de rangos con signo de Wilcoxon, Z = -0,980, p = 0,327), se redujo significativamente durante la RETEST en comparación con la TEST. Este último hallazgo indica que silenciar el pIC en el día 1 afectó selectivamente la respuesta de miedo, pero no de ansiedad, al olor del depredador. Tomados en conjunto, estos resultados apoyan que el protocolo experimental descrito anteriormente es adecuado para el estudio de las respuestas defensivas innatas y aprendidas a las amenazas depredadoras.
Discusión
El protocolo descrito aquí ofrece un enfoque innovador para evaluar las conductas defensivas evocadas por estímulos aversivos innatos y aprendidos. Se utilizó una cámara de pruebas sin un área de escondite segura (Figura 1) y un collar impregnado con olor a piel/pelaje de una gata doméstica ovariectomizada para provocar un estado de amenaza fuerte y sostenido en ratas que puede ser útil para investigar los circuitos neuronales subyacentes a las reacciones defensivas adaptativas y desadaptativas.
Es bien sabido que la manifestación de reacciones defensivas específicas depende de las características tanto del estímulo de amenaza como de la situación/entorno en el que se encuentra el animal 21,33. La evitación, la evaluación de riesgos y la congelación forman parte de un vasto repertorio de reacciones defensivas de los animales que pueden ser evocadas por estímulos amenazantes 9,19. Sin embargo, la selección de la reacción defensiva predominante depende de las condiciones ambientales, como la distancia de la amenaza33 o la presencia de un lugar seguro dentro de la cámara de pruebas21,33. Por ejemplo, cuando las ratas se colocan en la arena con una caja para esconderse, en presencia de olor a gato, muestran comportamientos defensivos como posturas de estiramiento/atención, caja de salida de la cabeza y evitación 6,24,25. Por el contrario, el comportamiento de congelación, la exploración atenta y las posturas de estiramiento/atención se provocan fuertemente en situaciones en las que no es posible escapar y la distancia a la amenaza no es demasiado corta33,34.
Los estudios han demostrado que la exposición a un factor estresante incontrolable produce una variedad de consecuencias conductuales que son diferentes de las que ocurren cuando el factor estresante es controlable 35,36,37,38. Por ejemplo, el choque de cola ineludible, pero no escapable, conduce a grandes aumentos de serotonina en el núcleo dorsal del rafe35 y comportamientos similares a la ansiedad medidos 24 h después de la experiencia aversiva36. Además, los factores estresantes incontrolables aumentan el condicionamiento del miedo en animales36,37 y humanos38. Nuestra justificación inicial para desarrollar el protocolo fue exponer a las ratas a una situación en la que no pueden controlar el estímulo aversivo y, por lo tanto, muestran respuestas de amenaza fuertes y sostenidas y desarrollan un aprendizaje contextual mejorado después de una exposición única y corta al olor de gato.
En el diseño experimental descrito aquí, la ausencia de una caja de escondite evocó un estado defensivo fuerte y sostenido que alternaba entre comportamientos de congelación (es decir, inmovilidad completa excepto la respiración28) y de evaluación de riesgos (es decir, exploración vigilante y posturas de estiramiento/atención29), que generalmente se consideran como manifestaciones conductuales de estados similares al miedo y la ansiedad en roedores, respectivamente (Figura 3). En particular, el mismo patrón de reacciones defensivas ocurrió 24 horas más tarde cuando las ratas fueron reexpuestas al contexto de prueba, lo que indica que una sola exposición de 10 minutos al olor de la piel o el pelaje de gato es suficiente para inducir un aprendizaje de amenazas contextuales duradero, como se informó anteriormente 7,10,11,14,15,34,39 (Figura 4).
Se utilizó un collar de gato con un forro interno de fieltro para recoger y atrapar olores/olores de manera eficiente y así obtener una muestra confiable del estímulo de amenaza para evocar una fuerte respuesta defensiva. Los investigadores han utilizado estímulos aversivos como las heces de gato, la orina o la trimetiltiazolina (TMT, un componente de las heces de zorro) en trabajos similares. Sin embargo, estos estímulos parecen ser menos predictivos de la presencia inmediata de un depredador porque son menos capaces de inducir el aprendizaje contextual40,41. De acuerdo con hallazgos previos 2,4,8,9,10,11,20,34,39, el olor de gato es un estímulo aversivo innato confiable que puede inducir reacciones defensivas sostenidas y memoria de amenaza contextual en ratas. A lo largo de los años, este tipo de modelo animal etológico conductual ha captado cada vez más el interés de los investigadores para estudiar el estrés y los trastornos relacionados con el estrés 13,14,15,16,17,23,42 como los asociados con los recuerdos de miedo desadaptativos, como el trastorno de estrés postraumático.
Este protocolo está destinado a ser utilizado junto con una variedad de técnicas experimentales, incluyendo, por ejemplo, enfoques de biología molecular y celular y electrofisiología en animales despiertos y que se comportan, que ofrecen la oportunidad de responder preguntas abiertas y mejorar nuestra comprensión de las respuestas a amenazas adaptativas y desadaptativas. En este estudio, probamos la idea de que el pIC, una región del cerebro involucrada en el procesamiento de emociones, es necesaria para la expresión de comportamientos defensivos. Los experimentos conductuales se combinaron con la inmunohistoquímica c-Fos para mapear los patrones de actividad neuronal en el pIC en respuesta al olor de gato y las infusiones intracerebrales del agonista del receptor GABA-A, muscimol, para silenciar reversiblemente el pIC y determinar su participación en las reacciones de amenaza innatas y aprendidas al olor de los depredadores. Estos hallazgos revelaron que el olor a gato provocaba un aumento en la actividad neuronal en el pIC (Figura 5), y que el silenciamiento del pIC conducía a un déficit severo de la memoria contextual de amenazas (Figura 6).
Aunque el protocolo descrito aquí es técnicamente sencillo de implementar y realizar, pueden surgir algunas complicaciones. Por ejemplo, puede producirse una contaminación cruzada por olor a gato si el collar sin usar entra en contacto con el collar de gato desgastado. Por lo tanto, los collares deben mantenerse separados durante todos los procedimientos, y los guantes deben cambiarse después de colocar el collar usado en la cámara de prueba. Si el experimentador desea realizar condiciones de olor y ausencia de olor utilizando la misma cámara de prueba, los experimentos deben realizarse en días diferentes. Dos cámaras de prueba idénticas podrían ser utilizadas para estos experimentos34, y las ratas deberían ser mantenidas en habitaciones separadas para evitar la comunicación social43. El estrés provocado por la exposición a estímulos nuevos en entornos desconocidos también puede ser un problema. Por lo tanto, los animales deben tener al menos tres días de habituación al entorno de prueba y a los procedimientos para reducir el estrés y la actitud defensiva que suelen mostrar las ratas en situaciones nuevas. Además, el tiempo requerido para el período de habituación debe ser mayor que el período de prueba. Por ejemplo, si la prueba dura 10 minutos, se deben asignar 20 o 30 minutos para el período de habituación.
Finalmente, los comportamientos defensivos deben evaluarse preferiblemente durante la fase oscura del ciclo, cuando las ratas están activas. Las ratas deben mantenerse bajo un ciclo inverso de luz/oscuridad para permitir que se realicen los procedimientos experimentales mientras tanto la rata como el experimentador se encuentran en sus fases activas34. El cambio en el ciclo de luz/oscuridad no tarda más de 10 días en establecerse y, según la experiencia, la mayoría de las ratas en esta condición responden adecuadamente al olor del gato. Sin embargo, hay algunos estudios que muestran que las ratas Sprague-Dawley son menos vulnerables al condicionamiento de amenazas y la ansiedad a largo plazoque las ratas Wistar. Por lo tanto, es posible que el uso de ratas Wistar en lugar de ratas de la cepa Sprague-Dawley pueda producir resultados más sólidos.
En conclusión, el olor de gato es un estímulo amenazante etológicamente relevante que provoca respuestas neuronales, endocrinas y conductuales confiables en ratas. El encuentro con el olor de gato en una cámara ineludible conduce a una respuesta de miedo/ansiedad robusta y prolongada en las ratas, lo que resulta en un aprendizaje rápido y duradero de las amenazas contextuales. El protocolo descrito anteriormente podría ser una herramienta útil para estudiar el miedo y los mecanismos de codificación de la memoria de amenazas adaptativos y desadaptativos.
Divulgaciones
Los autores de este manuscrito no tienen intereses financieros contrapuestos ni otros conflictos de intereses que divulgar.
Agradecimientos
Los autores agradecen a Marcela González por ayudar con los procedimientos de laboratorio, a Mabel Matamala por contribuir al diseño del protocolo y a Miguel Rojas por ayudar con la ilustración.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
Referencias
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682 (2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283 (2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J., Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. , 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, 45 (2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16 (2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91 (2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1997).
- Swanson, L. W. . Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377 (1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292 (2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132 (2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041 (2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados