Method Article
Um Protocolo Inescapável de Exposição a Odores de Gatos para Estudar o Condicionamento de Ameaças Inatas e Contextuais em Ratos
Neste Artigo
Resumo
A exposição ao odor da pele/pelo do gato fornece um método confiável para investigar circuitos neurais e mecanismos de respostas defensivas em roedores e pode oferecer informações sobre os mecanismos que medeiam o medo em humanos. Aqui, descrevemos um protocolo para investigar o papel do córtex interoceptivo nas respostas a ameaças em ratos.
Resumo
Os animais respondem a situações ameaçadoras exibindo uma série de comportamentos defensivos, incluindo evitação, congelamento e avaliação de risco. Um modelo animal com uma abordagem etológica oferece uma visão mais profunda dos mecanismos biológicos subjacentes às respostas às ameaças. Este artigo descreve uma metodologia para medir comportamentos defensivos em relação a estímulos aversivos inatos e aprendidos em ratos. Os animais foram expostos individualmente ao odor do predador em uma câmara inescapável para provocar um estado defensivo mensurável e sustentado. O projeto experimental envolveu a colocação de um rato em uma câmara familiar por 10 minutos, seguido de exposição ao odor do gato por mais 10 minutos no mesmo contexto. No dia seguinte, os ratos foram reexpostos por 10 minutos à mesma câmara de contexto onde ocorreu a exposição ao odor do gato. As sessões foram gravadas em vídeo e os comportamentos defensivos foram avaliados em ambos os dias.
O teste comportamental foi acoplado a técnicas de inativação funcional reversível e imuno-histoquímica c-Fos para determinar o papel do córtex interoceptivo nas respostas à ameaça. Ratos expostos ao odor de gato no primeiro dia e reexpostos à câmara de contexto no segundo dia exibiram níveis mais altos de comportamentos defensivos, e esse odor de gato provocou um aumento robusto na atividade neural do córtex interoceptivo. Além disso, a inativação do córtex interoceptivo pelo muscimol reduziu a expressão de comportamentos defensivos em resposta ao odor do gato e à memória de ameaça contextual prejudicada. Esses resultados mostram que este ensaio comportamental é uma ferramenta útil para estudar mecanismos neurais de comportamentos defensivos e pode oferecer informações sobre os mecanismos que medeiam o medo em humanos e seus distúrbios relacionados.
Introdução
Os comportamentos defensivos ocorrem em resposta a estímulos que sinalizam uma ameaça potencial à sobrevivência de um animal. Esses comportamentos são altamente conservados em mamíferos e rapidamente associados a estímulos ou circunstâncias relacionadas à ameaça 1,2,3. Na natureza, os estímulos ameaçadores para a maioria dos animais são predadores; portanto, a detecção de pistas de predadores, como pistas de odor, é particularmente vantajosa para evitar a predação. As respostas comportamentais a pistas de predadores têm sido amplamente investigadas em roedores.
Por exemplo, estímulos, como pêlo natural de gato ou odores de pele, ativam o sistema olfativo e vomeronasal, induzindo altos níveis de comportamentos defensivos4. Esses estímulos são acompanhados por alterações na atividade neuronal e endócrina 5,6,7,8 e são estímulos fortes, incondicionados e aversivos para o condicionamento de ameaças contextuais em ratos 7,8,9,10,11. Estudos mostraram que pelo menos 24 h após a exposição a sinais naturais de predadores, os ratos exibem estados de ansiedade condicionados robustos e duradouros 7,12,13. Esse fenômeno é de particular interesse para o desenvolvimento de modelos mais realistas de transtorno de estresse pós-traumático (TEPT)14,15,16,17, transtorno de ansiedade generalizada (TAG)5 e transtorno de pânico (TP)18,19.
Em ambientes de laboratório, o comportamento do medo é medido como fuga, evitação (por exemplo, retirada, esconderijo) ou congelamento. Além disso, a ansiedade pode ser medida como posturas de alongamento e varredura vigilante direcionada ao monitoramento de um estímulo predatório - um conjunto de respostas amplamente conhecido como comportamentos de avaliação de risco 6,9,20. Estudos têm demonstrado que o comportamento de congelamento é a estratégia defensiva predominante em ratos para uma ameaça inescapável, enquanto a avaliação de risco é observada quando a ameaça é ambígua ou não localizada 12,21,32. Embora se saiba que um estímulo inato ou aprendido pode provocar comportamentos defensivos, faltam paradigmas comportamentais de laboratório que capturem de forma confiável as respostas defensivas em um contexto mais etológico. Para preencher essa lacuna, projetamos um protocolo com uma abordagem etológica que permite a medição de comportamentos de ameaça inatos e contextuais sustentados, juntamente com respostas cerebrais a estímulos de ameaça naturalistas.
Experiências estressantes, como a exposição a um odor de predador inescapável, causam alterações duradouras na resposta comportamental e fisiológica em ratos 14,22,23. Essas alterações refletem o perfil de sintomas observado em transtornos relacionados ao medo e à ansiedade, como o TEPT. No modelo atual, uma câmara de teste é usada sem uma área de esconderijo segura para expor os ratos a um evento de ameaça inevitável e, assim, melhorar as respostas defensivas. Os ratos exibiram comportamentos robustos de congelamento e avaliação de risco em resposta ao odor do gato e ao contexto de teste. Essas descobertas apóiam o uso deste protocolo como um método confiável e válido para explorar os mecanismos biológicos subjacentes aos comportamentos defensivos e desenvolver e refinar novas estratégias para o tratamento de transtornos de medo em humanos.
Protocolo
O procedimento a seguir foi conduzido de acordo com as recomendações das diretrizes institucionais do National Institutes of Health (USA) Guide for the Care and Use of Laboratory Animals (NIH Publication No. 80-23, revisado em 1996). O Comitê Institucional de Biossegurança e Ética da Pontifícia Universidade Católica do Chile aprovou todos os procedimentos. Todas as sessões experimentais foram realizadas durante a fase ativa do rato (fase escura).
1. Preparação da sala de testes e da câmara de testes
NOTA: O overview do aparelho é mostrado na Figura 1. A câmara de teste foi desenvolvida e modificada de acordo com estudos anteriores24,25.
- Utilizar uma câmara de ensaio retangular transparente de poli (metacrilato de metilo) com as seguintes dimensões: 60 cm (comprimento) x 40 cm (largura) x 40 cm (altura). Cubra as paredes laterais e traseiras da câmara de teste com qualquer papel preto. Certifique-se de que a frente da câmara de teste seja transparente para registrar o comportamento dos animais.
- Fixe um suporte de aço no chão no canto inferior direito da câmara de teste e use-o para prender as coleiras de gato para os procedimentos de teste.
- Limpe a câmara de teste com etanol a 5% (v / v) antes e depois dos testes para remover quaisquer pistas de cheiro deixadas pelos ratos sujeitos e evitar a resposta de aversão do rato. Aguarde 5 minutos entre cada sessão para que o etanol evapore completamente.
- Realizar a sessão de ensaio numa sala silenciosa e mal iluminada por uma lâmpada vermelha de 80 W situada 20 cm acima da câmara de ensaio. Use uma câmera de vídeo localizada na frente da câmara para registrar o comportamento dos animais.
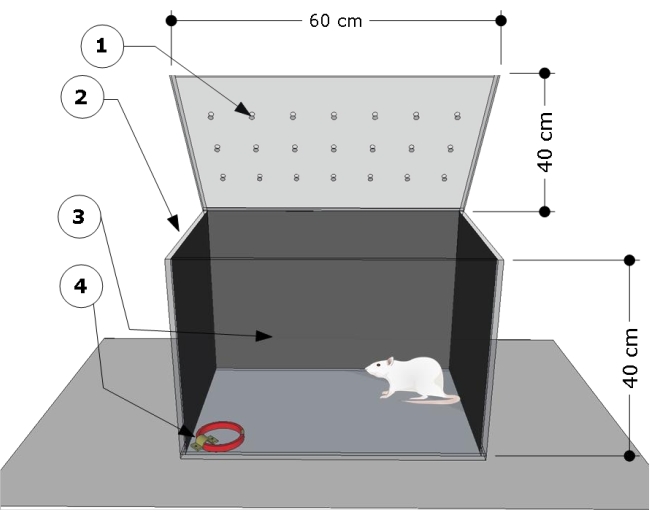
Figura 1: Visão geral esquemática da câmara de teste. O aparelho consiste em um compartimento de teste com: (1) orifícios de ventilação, (2) paredes laterais e (3) traseiras escurecidas e um suporte de aço travado no canto esquerdo do piso (4) para prender a coleira do gato (dimensões: largura 15 mm, espessura 5 mm, comprimento 300 mm). As dimensões da câmara são indicadas no desenho animado (60 L x 40 W x 40 H cm). Clique aqui para ver uma versão maior desta figura.
2. Preparação de odor de gato
- Obtenha uma coleira de gato com uma face interna forrada de feltro para reter melhor o odor do gato. Certifique-se da disponibilidade de várias coleiras para uso como coleira de controle (sem odor) ou coleira de teste (odor de gato).
NOTA: O ponto crucial é que a coleira do gato deve ter um forro interno para coletar e reter odores. - Coloque uma coleira em uma gata doméstica ovariectomizada e deixe a gata usar a coleira por uma semana antes do teste. Tente manter a gata dentro de casa enquanto usa a coleira de teste.
NOTA: Use o mesmo gato durante todo o estudo. - Mantenha a coleira de gato gasta em um recipiente de plástico hermético e guarde-a a 4 °C. Substitua a coleira de gato desgastada por uma coleira contendo um odor de gato fresco a cada três dias.
3. Preparação de ratos para o procedimento experimental
- Use ratos Sprague-Dawley machos adultos que pesam 270-290 g. Aloje-os em gaiolas individuais com ração e água disponíveis ad libitum.
- [Opcional] Preparando ratos para procedimento cirúrgico (opcional)
- Realize a cirurgia em condições estéreis. Limpe e desinfete a área de trabalho com uma solução de etanol a 70% e esterilize todos os materiais e instrumentos cirúrgicos.
- Anestesiar o rato com uma mistura intraperitoneal de cetamina (100 mg/kg) e xilazina (20 mg/kg). Espere até que o plano adequado de anestesia seja alcançado quando o rato não responder a um estímulo de pinça do dedo do pé ou estimulação da córnea. Para manter a condição anestésica durante toda a cirurgia, administre uma dose adicional do coquetel anestésico a cada 45 min.
- Raspe suavemente a cabeça do rato de trás da orelha até entre os olhos e desinfete a área cirúrgica com uma almofada de preparação de álcool estéril seguida por uma solução de iodopovidona. Aplique pomada lubrificante para os olhos para evitar o ressecamento da córnea durante o procedimento cirúrgico.
- Coloque o rato em um aparelho estereotáxico e segure a cabeça posicionando corretamente as barras auriculares nos canais auditivos. Em seguida, insira suavemente os incisivos do rato na barra incisiva e prenda a pinça nasal.
- Coloque uma cânula guia de aço inoxidável estéril de 26 G no suporte estereotáxico. Pegue um bisturi e faça uma incisão na linha média ao longo do couro cabeludo. Coloque 2 ou mais grampos ao redor da incisão (2-3 cm).
- Limpe o crânio completamente de tecido até que as suturas cranianas bregma e lambda sejam visíveis.
- Verificar o posicionamento simétrico da cabeça pelo alinhamento do eixo dorsoventral e ântero-posterior do crânio utilizando as barras dos incisivos e das orelhas, respectivamente. Identifique as coordenadas da cânula guia para a região cerebral de interesse. Mantenha o bregma e o lambda no mesmo plano horizontal usando a barra incisiva.
- Calcular as coordenadas do local de implantação da cânula guia na área de interesse seguindo as coordenadas estereotáxicas de Paxinos e Watson26 ou Swanson atlas27.
NOTA: Para o córtex insular interoceptivo primário, foram utilizadas as seguintes coordenadas estereotáxicas: Bregma -0,51 mm, linha média 5,0 mm, profundidade da superfície craniana 4,5 mm, ângulo de 10° medialmente a partir da vertical. - Verifique as coordenadas de implantação da cânula guia abaixando-a até tocar o crânio e, em seguida, faça um furo no crânio no local verificado. Faça 3 furos adicionais ao redor da área alvo para colocar 3 parafusos no crânio.
- Insira a cânula na área de interesse do cérebro e use parafusos e acrílico dental para ancorar a cânula ao crânio. Despeje acrílico dental no crânio seco e certifique-se de que ele cubra os parafusos para fixar a cânula no lugar. Deixe o dental acrílico endurecer e, em seguida, remova o braço estereotáxico com cuidado, deixando a cânula guia no lugar.
NOTA: Este procedimento imobiliza a cânula implantada e permite que os experimentadores realizem várias microinjeções na área de interesse. - Insira um estilete de aço inoxidável na cânula guia para evitar obstrução e contaminação.
- Ao final da cirurgia, administrar uma dose única de antibiótico (enrofloxacino 5%; 19 mg/kg i.p.) e anti-inflamatório (cetofeno 0,2 mg/kg i.p.). Repita esta etapa por três dias consecutivos após a cirurgia.
- Permita que os ratos se recuperem totalmente por pelo menos uma semana antes de iniciar os experimentos.
- Manter os ratos em um ciclo claro/escuro invertido de 12/12 h (luzes acesas às 19h00) por pelo menos dez dias antes do início dos experimentos (Figura 2).
NOTA: Se o experimentador precisar realizar algum procedimento cirúrgico, seria necessário fazê-lo antes de reverter o ciclo de luz escura. Isso permite a redução do estresse após a cirurgia. - Manuseie todos os ratos por 20 min/dia por 2-3 dias. Pegue um rato de cada vez, segure o animal com segurança pelo tronco (não pela cauda) e acaricie-o durante esse período. Se os animais mostrarem sinais de estresse, manuseie-os por longos períodos.
NOTA: Esta etapa é fundamental para minimizar o estresse de manuseio que pode afetar as etapas a seguir. - Pré-exponha os animais à câmara de teste (câmara de odor de gato com coleira de gato não usada) por 30 min/dia por três dias antes dos experimentos para permitir que os animais se adaptem ao contexto de teste.
NOTA: Sugere-se que o experimentador não use perfumes ou loções perfumadas. - Depois de colocar o animal na câmara, aguarde aproximadamente 10-15 min, introduza um braço na câmara de teste e troque a coleira por outra coleira com as mesmas características.
NOTA: Esta etapa é fundamental para simular, o mais próximo possível, cada etapa dos procedimentos comportamentais para minimizar o estresse, o que pode afetar o desempenho comportamental do rato nos últimos 10 min do teste. - Limpe a câmara de teste com etanol a 5% (v/v) entre as sessões.
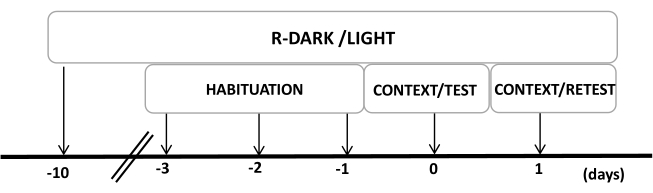
Figura 2: Linha do tempo do projeto experimental. Os ratos foram expostos a um ciclo reverso de luz escura por 10 dias e, em seguida, habituados à câmara de teste contendo uma coleira de controle (não usada) por 30 minutos nos últimos três dias. No dia 0, os ratos foram primeiro expostos a uma câmara de teste familiar (CONTEXTO) por 10 min e depois expostos a uma coleira com ou sem odor de gato por um período adicional de 10 min (TESTE) no mesmo contexto. No dia 1, ratos expostos ao odor de gato (TESTE) no dia 0 foram devolvidos à mesma câmara de teste por 10 min (CONTEXTO) e reexpostos ao odor de gato (RETESTE) por um período adicional de 10 min. Este número foi modificado de 8. Abreviatura: R-Dark/light = ciclo reverso de luz escura. Clique aqui para ver uma versão maior desta figura.
4. Procedimentos de teste de odor de gato
- No dia 0 do protocolo experimental, avalie as respostas de ameaça ao odor do gato.
- Se necessário, administrar injeções corticais antes dos testes comportamentais seguindo o método descrito abaixo. Se estiver executando apenas um protocolo comportamental, pule esta etapa e prossiga para a etapa 4.3.
- Insira uma cânula de injeção estéril de 33 G acoplada a uma seringa Hamilton de 1 μL na cânula guia após remover o oclusor.
- Encha a seringa de Hamilton com solução salina estéril (ratos de controle) ou o agonista do receptor GABA-A, muscimol (ratos de tratamento) e injete 0,5 μL / hemisfério durante 2 min. Aguarde 2 minutos para permitir a difusão do medicamento, remova lentamente a cânula de injeção e insira imediatamente os oclusores.
NOTA: Execute esta etapa em um animal quieto e acordado e injete os medicamentos lentamente para minimizar o tremor da cânula de injeção e a consequente difusão para áreas cerebrais adjacentes. - Assim que a injeção cortical/hemisfério estiver concluída, aguarde 30 minutos e prossiga para a próxima etapa.
- Colocar os animais na câmara de ensaio durante 20 min. Durante os primeiros 10 minutos, exponha os animais a uma coleira familiar não usada. Introduza a coleira impregnada com odor de gato (TESTE) ou uma coleira familiar não usada (CONTEXTO) pelos próximos 10 minutos (Figura 3).
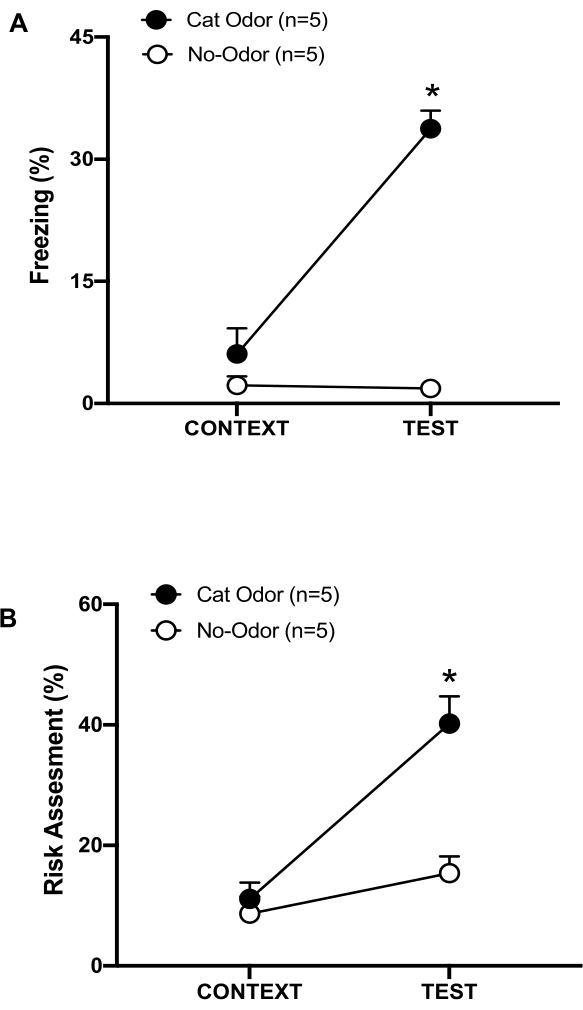
Figura 3: O encontro com odor de gato aumenta os comportamentos defensivos inatos. (A, B) Os ratos foram primeiro expostos à câmara de teste familiar (CONTEXTO) por 10 min e depois expostos a uma coleira com odor de gato (grupo de odor de gato, círculos pretos) ou sem odor de gato (grupo sem odor, círculos abertos) por um período adicional de 10 min (TESTE) no mesmo contexto. Os círculos mostram a porcentagem de tempo gasto no congelamento (B) e avaliação de risco (C) exibida por ratos ingênuos. Os dados são expressos como média +EPM. *p < 0,05. Este número foi modificado de 8. Clique aqui para ver uma versão maior desta figura.
- Coloque uma câmera de vídeo na frente da câmara de teste e registre o comportamento do animal para posterior pontuação comportamental por um experimentador cego para as condições experimentais.
- No final da sessão de odor do gato, devolva os animais às gaiolas de origem e coloque-os de volta no biotério até a próxima sessão.
- Limpe a câmara de teste com etanol a 5% (v/v) entre as sessões.
- Vinte e quatro horas após a sessão de odor do gato (Dia 1), avalie as respostas defensivas ao contexto de teste.
- Se necessário, repita a etapa 4.2 antes da exposição ao contexto.
- Retorne os ratos para a mesma câmara de teste com a coleira familiar não usada e marque os comportamentos defensivos para medir a memória contextual da ameaça durante 10 minutos (Figura 4).
- Coloque uma câmera de vídeo na frente da câmara de teste e registre o comportamento do animal para posterior pontuação comportamental por um experimentador cego para as condições experimentais.
- Durante os próximos 10 minutos, substitua a coleira familiar não usada, exponha novamente o animal a uma coleira com odor de gato e meça os comportamentos defensivos.
- Após a segunda exposição ao odor do gato, retorne o animal à sua gaiola de origem e limpe a câmara de teste com etanol a 5% (v/v). Coloque o rato de volta no biotério.
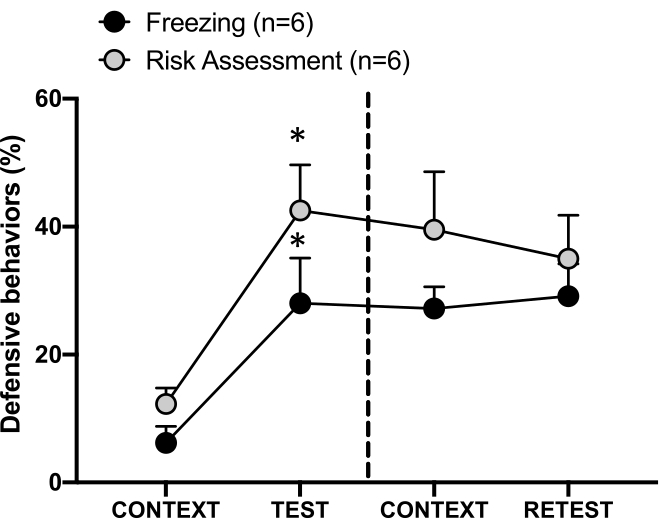
Figura 4: O encontro de odor de gato induz o aprendizado contextual de ameaças. Os círculos mostram a porcentagem de tempo gasto no congelamento (círculos pretos) e o comportamento de avaliação de risco (círculos cinza). A linha tracejada separa o teste de medo inato (Dia 0, à esquerda) do teste de medo contextual (Dia 1, à direita). Os dados são expressos como média + EPM. *p < 0,05. Este número foi modificado de 8. Clique aqui para ver uma versão maior desta figura.
5. Procedimentos imuno-histoquímicos
- Anestesiar o animal com uma mistura intraperitoneal de cetamina (0,45 mg/kg) e xilazina (0,05 mg/kg) 90 min após a conclusão dos experimentos. Em seguida, eutanasiar o rato por perfusão transcárdica com paraformaldeído a 4%.
NOTA: Se for necessário avaliar a primeira exposição ao odor do gato, a resposta condicionada ao contexto ou a reexposição ao odor do gato, execute esta etapa após cada uma dessas situações experimentais. Use luvas e jaleco e manuseie o paraformaldeído com cuidado sob um exaustor químico. - Após a perfusão, fixe o cérebro na mesma solução fixadora por 2 h e depois transfira para sacarose a 30% com azida sódica a 0,02% em solução salina tamponada com fosfato (PBS) até que o cérebro afunde para o fundo. Armazenar o cérebro a 4 °C.
- Congele o cérebro usando gelo seco e corte-o em seções coronais seriais de 50 μm de espessura em um micrótomo deslizante. Colete três conjuntos de seções cerebrais da área de interesse, deixando um para verificação da colocação da cânula e dois conjuntos para o procedimento imuno-histoquímico.
- Incube as seções cerebrais flutuantes em 0,3% H2O2 em PBS por 30 min, lave em PBS e transfira essas seções para a solução de bloqueio (0,4% Triton X-100, 0,02% azida de sódio, 3% de soro de cabra normal em PBS) por 1 h.
- Transfira as seções para a solução de incubação de anticorpos primários contendo o anticorpo c-Fos diluído 1:20.000 em solução de bloqueio e deixe-as durante a noite em temperatura ambiente.
- Enxágue as seções em PBS por 1 h e depois incube-as na solução de anticorpo secundário diluída 1:1.000 em Triton X-100 a 0,4% e soro de cabra normal a 1,5% em PBS.
- Enxágue as seções por 40 min e incube-as por 1 h no sistema de peroxidase à base de avidina/biotina (consulte a Tabela de Materiais), diluído 1:500 em PBS.
- Enxágue e incube as seções em uma solução a 0.05% de cloridrato de diaminobenzidina 3-3 ′ (DAB) contendo 0.003% H2O2 e 0.05% de cloreto de níquel para obter um produto de reação azul escuro.
6. Contagem de células
- Examine as seções sob uma câmera lúcida usando uma objetiva de baixa potência (10x) para localizar a coloração puntiforme c-Fos nos núcleos dos neurônios (Figura 5).
- Use uma grade de contagem relacionada ao tamanho da área de interesse. Para o pIC, por exemplo, de Bregma 0,95 a -0,26, use uma grade de contagem de 0,25 mm x 1 mm; de Bregma -0,51 a -2,45 mm, use uma grade de contagem de 0,5 mm x 1 mm.
- Quantifique o número de células imunorreativas c-Fos (Fos-ir) por seção usando um contador manual de dígitos.
- Conte todas as seções coronais de interesse duas vezes e certifique-se de que o mesmo observador, cego para as condições experimentais, realize a contagem.
- Tire uma fotografia usando um microscópio acoplado a uma câmera digital.
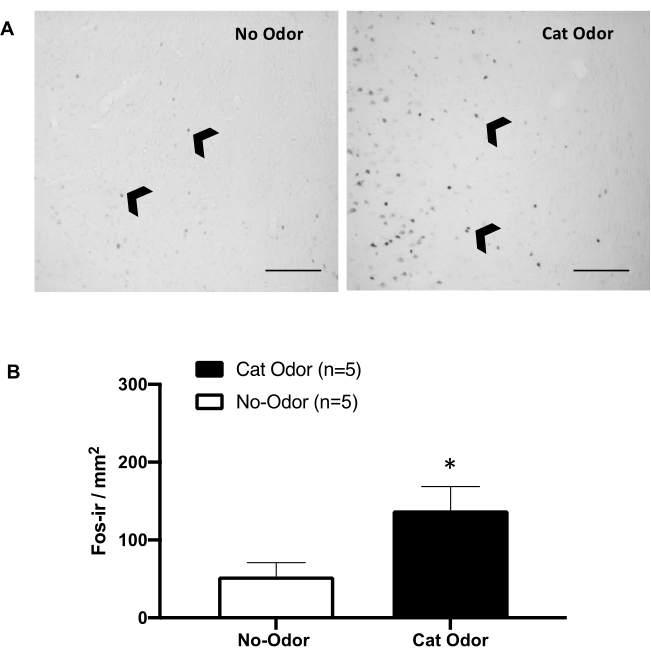
Figura 5: O odor do gato provoca ativação neuronal no córtex interoceptivo primário. (A) Fotomicrografia representativa do pIC mostrando uma quase ausência de células c-Fos-ir (pontas de setas pretas) em ratos expostos a uma coleira de gato não usada (sem odor, à esquerda) em comparação com um número notavelmente aumentado de células c-Fos-ir em ratos expostos ao odor de gato (à direita). (B) Quantificação de células c-Fos-ir no pIC em ambas as condições experimentais. Os dados são expressos como média + EPM. *p < 0,05. Barras de escala = 200 μm. Este número foi modificado de 8. Abreviaturas: pIC = córtex interoceptivo primário; c-fos-ir = c-Fos-imunorreativo. Clique aqui para ver uma versão maior desta figura.
7. Análise dos dados
- Pontue os comportamentos defensivos dos experimentos gravados em vídeo e analise-os usando software estatístico.
- Avalie o congelamento cronometrando as lutas, expressas como uma porcentagem do tempo gasto congelando durante 10 min. Calcule a porcentagem de congelamento usando Eq (1).
Congelamento = (segundos gastos congelando/600 s) × 100 (1)
NOTA: O congelamento foi definido como a completa falta de movimento, exceto para respiração por pelo menos 1 s28. - Pontue a avaliação de risco cronometrando sessões de varredura vigilantes e expresse-a como uma porcentagem do tempo gasto na avaliação de risco durante 10 minutos. Calcular a percentagem de avaliação dos riscos utilizando a Eq (2).
% Avaliação de risco = (segundos gastos na avaliação de risco/600 s) × 100 (2)
NOTA: O comportamento de avaliação de risco foi definido como varredura vigilante (observatório, movimentos de cabeça de um lado para o outro, sem locomoção) por pelo menos 1 s29. - Pontue esses parâmetros comportamentais manualmente e certifique-se de que eles sejam contados por um experimentador cego para as condições experimentais (ou seja, odor e condições de drogas). Dependendo da normalidade dos conjuntos de dados, use testes paramétricos ou não paramétricos para comparar dois ou mais grupos.
NOTA: Neste estudo, todos os testes estatísticos foram realizados usando o software SPSS.- Use o teste H de Kruskal-Wallis com o teste U de Mann-Whitney para comparações pareadas entre os grupos.
- Analise as comparações intragrupo ao longo do tempo com o teste de Friedman seguido pelo teste de postos sinalizados de Wilcoxon para comparações pareadas.
NOTA: Em todas as figuras, os níveis de significância foram estabelecidos em p < 0,05 (*) e p < 0,01 (**).
- Para a análise da expressão de c-Fos em áreas cerebrais específicas, conte o número de células c-Fos-positivas por seção calculando a densidade de células c-Fos-ir por mm2 e compare o número médio entre as condições de controle (sem odor) e estimuladas (odor de gato).
- Dependendo da normalidade dos dados, use o teste t de Student não pareado ou o teste U de Mann-Whitney.
NOTA: Neste estudo, foi utilizado o teste U de Mann-Whitney; As diferenças foram consideradas significativas se p < 0,05 (*).
- Dependendo da normalidade dos dados, use o teste t de Student não pareado ou o teste U de Mann-Whitney.
Resultados
Nesse protocolo, os percentuais de congelamento e avaliação de risco foram medidos como indicadores de estados de medo e ansiedade em ratos, respectivamente. A linha do tempo do projeto experimental é mostrada na Figura 2. Os resultados dos animais expostos ao odor de gato no dia 0 são apresentados na Figura 3. Os ratos apresentaram níveis significativamente mais altos de congelamento (Figura 2A, grupo Cat Odor, teste Wilcoxon Signed-ranks, Z = -2,201, p = 0,028) e avaliação de risco (Figura 2B, grupo Cat Odor, teste Wilcoxon Signed-rank Z = -2,336 p = 0,018) em resposta ao odor de gato (TEST) do que ao contexto familiar (CONTEXT). Baixos níveis de congelamento (Figura 2A, grupo sem odor, teste de Wilcoxon Signed-ranks, Z = -0,184, p = 0,854) e avaliação de risco (Figura 2B, grupo sem odor, teste de Wilcoxon Signed-ranks, Z = -1,753, p = 0,08) foram observados em ratos expostos a uma coleira não usada durante a segunda parte do teste.
Análises adicionais revelaram que os níveis de congelamento (Figura 2A, teste de Mann-Whitney, U = 0,000, p = 0,004) e avaliação de risco (Figura 2B, teste de Mann-Whitney, U = 4,000, p = 0,025) foram maiores no grupo Cat Odor do que no grupo sem odor durante a segunda parte do teste. Não houve diferenças significativas no congelamento (Figura 2A, teste de Mann-Whitney, U = 11,000, p = 0,256) e avaliação de risco (Figura 2B, teste de Mann-Whitney, U = 15,00, p = 0,627) entre os dois grupos durante os primeiros 10 minutos de exposição a um contexto familiar (CONTEXTO). Esses resultados demonstram que o protocolo é adequado para testar comportamentos defensivos em resposta ao odor de pelo/pele de gato.
A resposta condicionada à ameaça ao contexto de teste (CONTEXT) no dia 1 é mostrada na Figura 4. Ratos expostos ao odor de gato foram devolvidos à câmara de teste 24 h após o primeiro encontro com o odor do predador. No dia 1, os animais exibiram níveis mais altos de congelamento (teste de Wilcoxon Signed-ranks, Z = -2,366, p = 0,018) e avaliação de risco (teste de Wilcoxon Signed-ranks, Z = -2,201, p = 0,028) em resposta ao contexto de teste do que no dia 0. Além disso, não houve diferenças nos níveis de congelamento (teste dos postos sinalizados de Wilcoxon, Z = -0,841, p = 0,400) ou avaliação de risco (teste dos postos sinalizados de Wilcoxon, Z = -0,943, p = 0,345) entre o CONTEXTO e o RETESTE. Os ratos apresentaram os mesmos níveis de congelamento (teste dos postos sinalizados de Wilcoxon, Z = -0,105, p = 0,917) e avaliação de risco (teste dos postos sinalizados de Wilcoxon, Z = -0,980, p = 0,327) durante o RETESTE e o TESTE. Esses resultados demonstraram que uma única exposição de 10 minutos ao odor de pele / pele do gato resultou em uma resposta de ameaça aprendida ao contexto em que os animais foram confrontados com o odor do predador.
A Figura 5 e a Figura 6 mostram dois conjuntos de experimentos usando o protocolo apresentado neste artigo. Testamos se o córtex interoceptivo primário (pIC), uma região do cérebro envolvida no processamento de emoções 8,30,31,32, é necessário para a expressão de comportamentos defensivos. A ativação neuronal induzida pelo odor do gato foi avaliada no pIC pela contagem de células c-Fos-ir em grupos de animais separados: condições sem odor e odor do gato. Esses ratos foram eutanasiados 90 min após a conclusão do TESTE. Um aumento significativo foi observado no número de neurônios c-Fos-ir no pIC no grupo odor de gato (teste de Mann-Whitney, U = 3,000, p = 0,016) em comparação com o grupo controle (Figura 5).
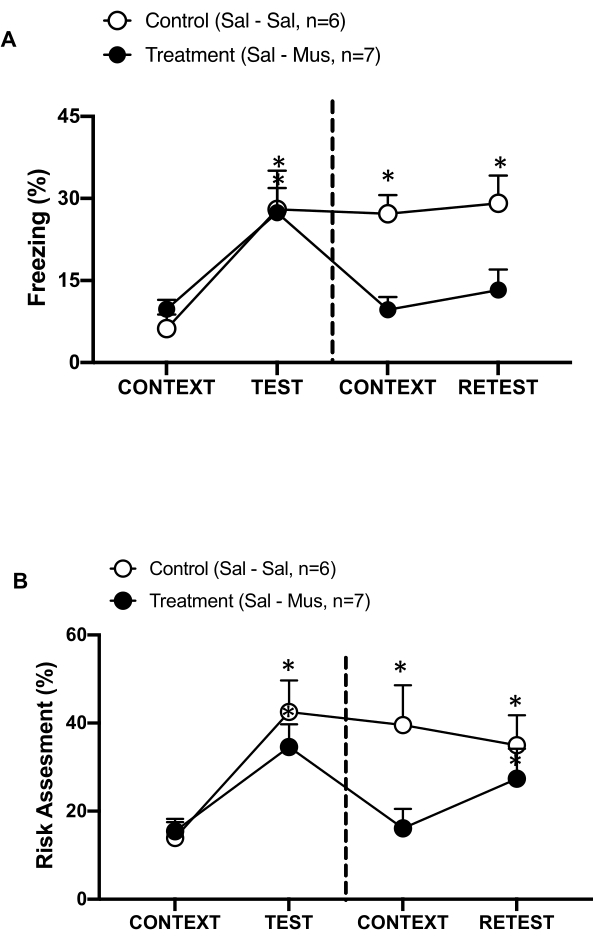
Figura 6: A inativação do córtex interoceptivo primário pelo muscimol prejudica a memória contextual da ameaça. (A, B) O grupo de tratamento foi injetado com solução salina no dia 0 e muscimol no dia 1 no pIC (grupo de tratamento). Ratos controle foram injetados com solução salina no pIC em ambos os dias. No dia 1, os animais foram devolvidos à câmara de teste familiar e expostos ao CONTEXT por 10 min e reexpostos ao odor do gato (RETEST) por um período adicional de 10 min. Os círculos mostram a porcentagem de tempo gasto no congelamento (círculos pretos) e o comportamento de avaliação de risco (círculos abertos). A linha tracejada separa o teste de medo inato (Dia 0, à esquerda) do teste de medo contextual (Dia 1, à direita). Os dados são expressos como média + EPM. *p < 0,05. Este número foi modificado de 8. Abreviaturas: pIC = córtex interoceptivo primário; Sal-Sal = soro fisiológico injetado no dia 0 e no dia 1; Sal-Mus = solução salina injetada no dia 0 e muscimol no dia 1. Clique aqui para ver uma versão maior desta figura.
Também medimos o efeito da inativação do pIC pelo muscimol na memória contextual de ameaças (Figura 6). O grupo de tratamento (ratos sal-mus) recebeu uma injeção salina no pIC no dia 0 e o agonista GABA-A muscimol no dia 1. Este grupo de animais não apresentou diferenças nos níveis de congelamento (Figura 6A, teste de Wilcoxon Signed-ranks, Z = -0,140, p = 0,889) ou avaliação de risco (Figura 6B, teste de Wilcoxon Signed-ranks, Z = -0,700, p = 0,484) no dia 1 em resposta ao contexto familiar em comparação com o dia 0, indicando um comprometimento na memória contextual de ameaças. Curiosamente, o congelamento (Figura 6A, teste de Wilcoxon Signed-ranks, Z = -2,100, p = 0,036), mas não a avaliação de risco (Figura 6B, teste de Wilcoxon Signed-ranks, Z = -0,980, p = 0,327), foi significativamente reduzido durante o RETEST em comparação com o TEST. Esta última descoberta indica que silenciar o pIC no dia 1 prejudicou seletivamente a resposta de medo, mas não de ansiedade, ao cheiro do predador. Tomados em conjunto, esses resultados apóiam que o protocolo experimental descrito acima é adequado para o estudo de respostas defensivas inatas e aprendidas a ameaças predatórias.
Discussão
O protocolo descrito aqui oferece uma abordagem inovadora para avaliar comportamentos defensivos evocados por estímulos aversivos inatos e aprendidos. Uma câmara de teste sem uma área de esconderijo seguro (Figura 1) e uma coleira impregnada com odor de pele/pele de uma gata doméstica ovariectomizada foram usadas para provocar um estado de ameaça forte e sustentado em ratos que pode ser útil para investigar circuitos neurais subjacentes a reações defensivas adaptativas e desadaptativas.
É bem sabido que a exibição de reações defensivas específicas depende das características do estímulo de ameaça e da situação/ambiente em que o animal se encontra21,33. Evitação, avaliação de risco e congelamento fazem parte de um vasto repertório de reações defensivas animais que podem ser evocadas por estímulos ameaçadores 9,19. No entanto, a seleção da reação defensiva predominante depende das condições ambientais, como a distância da ameaça33 ou a presença de um local seguro dentro da câmara de teste21,33. Por exemplo, quando os ratos são colocados na arena com uma caixa de esconderijo, na presença de odor de gato, eles exibem comportamentos defensivos, como posturas de alongamento/atenção, caixa de cabeça para fora e evitação 6,24,25. Em contraste, o comportamento de congelamento, a varredura vigilante e as posturas de alongamento/atenção são fortemente eliciados em situações em que a fuga não é possível e a distância até a ameaça não é excessivamente curta33,34.
Estudos têm mostrado que a exposição a um estressor incontrolável produz uma variedade de consequências comportamentais que são diferentes daquelas que ocorrem quando o estressor é controlável 35,36,37,38. Por exemplo, o choque de cauda inevitável, mas não evitável, leva a grandes aumentos de serotonina no núcleo dorsal da rafe35 e comportamentos semelhantes à ansiedade medidos 24 h após a experiência aversiva36. Além disso, estressores incontroláveis aumentam o condicionamento do medo em animais36,37 e humanos38. Nossa justificativa inicial para desenvolver o protocolo era expor os ratos a uma situação em que eles não podem controlar o estímulo aversivo e, portanto, exibir respostas de ameaça fortes e sustentadas e desenvolver um aprendizado contextual aprimorado após uma única e curta exposição ao odor do gato.
No desenho experimental aqui descrito, a ausência de uma caixa de ocultação evocou um estado defensivo forte e sustentado que alternou entre comportamentos de congelamento (ou seja, imobilidade completa, exceto respiração28) e avaliação de risco (ou seja, varredura vigilante e posturas de alongamento/atenção29), que geralmente são considerados como manifestações comportamentais de estados de medo e ansiedade em roedores, respectivamente (Figura 3). Notavelmente, o mesmo padrão de reações defensivas ocorreu 24 horas depois, quando os ratos foram reexpostos ao contexto de teste, indicando que uma única exposição de 10 minutos ao odor de pele / pele do gato é suficiente para induzir um aprendizado de ameaça contextual duradouro, conforme relatado anteriormente 7,10,11,14,15,34,39 (Figura 4).
Uma coleira de gato com forro interno de feltro foi usada para coletar e capturar odores/aromas de forma eficiente e, assim, obter uma amostra confiável do estímulo de ameaça para evocar uma forte resposta defensiva. Os pesquisadores usaram estímulos aversivos, como fezes de gato, urina ou trimetiltiazolina (TMT, um componente das fezes de raposa) em trabalhos semelhantes. No entanto, esses estímulos parecem ser menos preditivos da presença imediata de um predador porque são menos capazes de induzir a aprendizagem contextual40,41. De acordo com achados anteriores 2,4,8,9,10,11,20,34,39, o odor de gato é um estímulo aversivo inato confiável que pode induzir reações defensivas sustentadas e memória de ameaça contextual em ratos. Ao longo dos anos, esse tipo de modelo animal comportamental etológico tem capturado cada vez mais o interesse dos pesquisadores em estudar o estresse e os distúrbios relacionados ao estresse 13,14,15,16,17,23,42 como aqueles associados a memórias de medo desadaptativas, como TEPT.
Este protocolo destina-se a ser usado em conjunto com uma variedade de técnicas experimentais, incluindo, por exemplo, abordagens de biologia molecular e celular e eletrofisiologia em animais acordados e comportados, que oferecem a oportunidade de responder a perguntas abertas e melhorar nossa compreensão das respostas adaptativas e desadaptativas a ameaças. Neste estudo, testamos a ideia de que o pIC, uma região do cérebro envolvida no processamento de emoções, é necessário para a expressão de comportamentos defensivos. Experimentos comportamentais foram acoplados à imuno-histoquímica c-Fos para mapear padrões de atividade neuronal no pIC em resposta ao odor de gato e infusões intracerebrais do agonista do receptor GABA-A, muscimol, para silenciar reversivelmente o pIC e determinar seu envolvimento em reações de ameaça inatas e aprendidas ao odor do predador. Esses achados revelaram que o odor do gato provocou um aumento na atividade neuronal no pIC (Figura 5) e que o silenciamento do pIC levou a um grave déficit de memória de ameaça contextual (Figura 6).
Embora o protocolo descrito aqui seja tecnicamente simples de implementar e executar, algumas complicações podem surgir. Por exemplo, a contaminação cruzada por odor de gato pode ocorrer se a coleira não usada entrar em contato com a coleira de gato usada. Assim, os colares devem ser mantidos separadamente durante todos os procedimentos, e as luvas devem ser trocadas após a colocação do colar usado na câmara de teste. Se o experimentador quiser conduzir condições de odor e sem odor usando a mesma câmara de teste, os experimentos devem ser realizados em dias diferentes. Duas câmaras de teste idênticas podem ser usadas para esses experimentos34, e os ratos devem ser mantidos em salas separadas para evitar a comunicação social43. O estresse provocado pela exposição a novos estímulos em ambientes desconhecidos também pode ser um problema. Portanto, os animais devem ter pelo menos três dias de habituação ao ambiente de teste e procedimentos para reduzir o estresse e a defensividade comumente exibidos por ratos em situações novas. Além disso, o tempo necessário para o período de habituação deve ser maior do que o período de teste. Por exemplo, se o teste demorar 10 min, 20 ou 30 min devem ser atribuídos para o período de habituação.
Finalmente, os comportamentos defensivos devem ser avaliados preferencialmente durante a fase escura do ciclo, quando os ratos estão ativos. Os ratos devem ser mantidos sob um ciclo reverso claro/escuro para permitir que os procedimentos experimentais sejam realizados enquanto o rato e o experimentador estão em suas fases ativas34. A mudança no ciclo claro/escuro não leva mais de 10 dias para ser resolvida e, com base na experiência, a maioria dos ratos nessa condição responde adequadamente ao odor do gato. No entanto, existem alguns estudos que mostram que os ratos Sprague-Dawley são menos vulneráveis ao condicionamento de ameaças e ansiedade de longa duração do que os ratos Wistar44. Assim, é possível que o uso de ratos Wistar em vez de ratos da linhagem Sprague-Dawley possa produzir resultados mais robustos.
Em conclusão, o odor do gato é um estímulo ameaçador etologicamente relevante que provoca respostas neuronais, endócrinas e comportamentais confiáveis em ratos. O encontro com o odor do gato em uma câmara inescapável leva a uma resposta robusta e prolongada de medo/ansiedade em ratos, o que resulta em um aprendizado rápido e durável de ameaças contextuais. O protocolo descrito acima pode ser uma ferramenta útil para estudar o medo e os mecanismos de codificação de memória de ameaças adaptativas e mal-adaptativas.
Divulgações
Os autores deste manuscrito não têm interesses financeiros concorrentes ou outros conflitos de interesse a divulgar.
Agradecimentos
Os autores agradecem a Marcela Gonzalez por ajudar nos procedimentos laboratoriais, Mabel Matamala por contribuir com o design do protocolo e Miguel Rojas por ajudar na ilustração.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
Referências
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682(2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283(2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. , Elsevier Academic Press. Amsterdam. 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, Chapter 9, Unit 9 45(2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16(2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , Chapter 8, Unit 8.19 (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91(2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , Academic Press. San Diego. (1997).
- Swanson, L. W. Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , Elsevier. (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377(1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292(2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132(2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041(2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados