Method Article
Неизбежный протокол воздействия кошачьего запаха для изучения врожденного и контекстуального обусловливания угроз у крыс
В этой статье
Резюме
Воздействие запаха кошачьей кожи/шерсти является надежным методом исследования нейронных цепей и механизмов защитных реакций у грызунов и может дать представление о механизмах, которые опосредуют страх у людей. В данной статье мы описываем протокол исследования роли интероцептивной коры головного мозга в реагировании на угрозы у крыс.
Аннотация
Животные реагируют на угрожающие ситуации, проявляя ряд защитных форм поведения, включая избегание, замирание и оценку риска. Животная модель с этологическим подходом предлагает более глубокое понимание биологических механизмов, лежащих в основе реакций на угрозы. В этой статье описывается методология измерения защитного поведения по отношению к врожденным и приобретенным аверсивным стимулам у крыс. Животные по отдельности подвергались воздействию запаха хищника в неизбежной камере, чтобы вызвать измеримое, устойчивое, защитное состояние. План эксперимента включал помещение крысы в знакомую камеру на 10 минут с последующим воздействием кошачьего запаха в течение еще 10 минут в том же контексте. На следующий день крыс повторно подвергали воздействию в течение 10 минут ту же контекстную камеру, где происходило воздействие кошачьего запаха. Сеансы записывались на видео, и в оба дня оценивалось защитное поведение.
Поведенческий тест сочетался с обратимой функциональной инактивацией и методами иммуногистохимии c-Fos для определения роли интероцептивной коры в ответах на угрозы. Крысы, подвергшиеся воздействию кошачьего запаха в первый день и повторно подвергшиеся воздействию контекстной камеры на второй день, демонстрировали более высокий уровень защитного поведения, и этот кошачий запах вызвал значительное увеличение нейронной активности интероцептивной коры. Более того, инактивация мусцимолом интероцептивной коры снижала экспрессию защитного поведения в ответ на кошачий запах и ухудшала память на контекстуальные угрозы. Эти результаты показывают, что этот поведенческий анализ является полезным инструментом для изучения нейронных механизмов защитного поведения и может дать представление о механизмах, которые опосредуют страх у людей и связанные с ним расстройства.
Введение
Защитное поведение возникает в ответ на раздражители, которые сигнализируют о потенциальной угрозе выживанию животного. Такое поведение в значительной степени консервативно у млекопитающих и быстро связано со стимулами или обстоятельствами, связанными с угрозой 1,2,3. В природе угрожающими раздражителями для большинства животных являются хищники; Таким образом, обнаружение сигналов хищника, таких как сигналы запаха, особенно полезно для предотвращения хищников. Поведенческие реакции на сигналы хищника были широко исследованы у грызунов.
Например, раздражители, такие как естественная кошачья шерсть или запах кожи, активируют обонятельную и вомероназальную системы, вызывая высокий уровень защитногоповедения. Эти стимулы сопровождаются изменениями нейронной и эндокринной активности 5,6,7,8 и являются сильными, безусловными, аверсивными стимулами для обусловливания контекстуальной угрозы у крыс 7,8,9,10,11. Исследования показали, что по крайней мере через 24 часа после воздействия естественных сигналов хищника крысы демонстрируют устойчивые и длительные условные тревожныесостояния. Этот феномен представляет особый интерес для разработки более реалистичных моделей посттравматического стрессового расстройства (ПТСР)14,15,16,17, генерализованного тревожного расстройства (ГТР)5 и панического расстройства (БП)18,19.
В лабораторных условиях поведение страха измеряется как бегство, избегание (например, отступление, укрытие) или замирание. Кроме того, тревога может быть измерена в виде поз растяжения и бдительного сканирования, направленного на мониторинг хищнического стимула — набора реакций, широко известных как поведение по оценке риска 6,9,20. Исследования показали, что поведение замирания является преобладающей защитной стратегией у крыс перед лицом неизбежной угрозы, в то время как оценка риска наблюдается, когда угроза неоднозначна или не локализована. Хотя известно, что врожденный или приобретенный стимул может вызывать защитное поведение, существует нехватка лабораторных поведенческих парадигм, которые надежно фиксируют защитные реакции в более этологическом контексте. Чтобы восполнить этот пробел, мы разработали протокол с этологическим подходом, который позволяет измерять устойчивое врожденное и контекстуальное угрожающее поведение наряду с реакцией мозга на естественные стимулы угрозы.
Стрессовые переживания, такие как воздействие неизбежного запаха хищника, вызывают устойчивые изменения в поведенческих и физиологических реакциях у крыс 14,22,23. Эти изменения отражают профиль симптомов, наблюдаемый при страхе и тревожных расстройствах, таких как ПТСР. В текущей модели испытательная камера используется без безопасного укрытия, чтобы подвергнуть крыс неизбежному событию угрозы и, таким образом, усилить защитные реакции. Крысы демонстрировали устойчивое поведение при замораживании и оценке риска в ответ как на кошачий запах, так и на контекст тестирования. Эти результаты подтверждают использование данного протокола в качестве надежного и валидного метода для изучения биологических механизмов, лежащих в основе защитного поведения, а также для разработки и совершенствования новых стратегий лечения расстройств страха у людей.
протокол
Следующая процедура проводилась в соответствии с рекомендациями Институциональных руководящих принципов Руководства по уходу и использованию лабораторных животных Национальными институтами здравоохранения (США) (Публикация NIH No 80-23, пересмотренная в 1996 году). Институциональный комитет по биобезопасности и этике при Папском католическом университете Чили одобрил все процедуры. Все экспериментальные сеансы проводились во время активной фазы крысы (темная фаза).
1. Подготовка испытательного помещения и испытательной камеры
ПРИМЕЧАНИЕ: Обзор аппарата показан на рисунке 1. Испытательная камера была разработана и модифицирована в соответствии с предыдущими исследованиями24,25.
- Используйте прозрачную прямоугольную испытательную камеру из полиметилметакрилата со следующими размерами: 60 см (длина) х 40 см (ширина) х 40 см (высота). Боковые и задние стенки испытательной камеры накройте любой черной бумагой. Убедитесь, что передняя часть испытательной камеры прозрачна, чтобы записывать поведение животных.
- Закрепите стальной кронштейн на полу в правом нижнем углу испытательной камеры и используйте его для крепления ошейников для проведения испытаний.
- Очистите испытательную камеру 5% (v/v) этанолом до и после испытаний, чтобы удалить любые запаховые признаки, оставленные испытуемыми крысами, и избежать реакции отвращения крыс. Подождите 5 минут между каждым сеансом, чтобы этанол полностью испарился.
- Проводите сеанс тестирования в тихом помещении, слабо освещенном красной лампочкой мощностью 80 Вт, расположенной на высоте 20 см над испытательной камерой. Используйте видеокамеру, расположенную перед камерой, чтобы зафиксировать поведение животных.
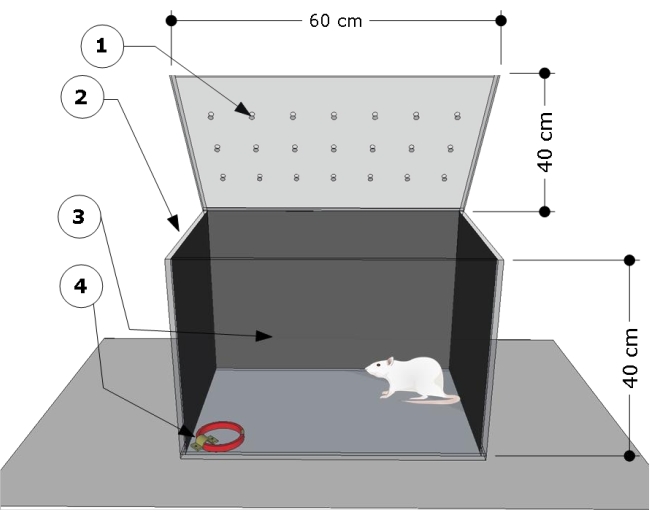
Рисунок 1: Схематический обзор испытательной камеры. Аппарат состоит из испытательного отсека с: (1) вентиляционными отверстиями, (2) боковыми и (3) затемненными задними стенками, а также стальным кронштейном, запертым на левом угловом полу (4) для крепления кошачьего ошейника (размеры: ширина 15 мм, толщина 5 мм, длина 300 мм). Размеры камеры указаны на карикатуре (60 Д x 40 Ш x 40 В см). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Подготовка кошачьего запаха
- Приобретите кошачий ошейник с войлочной подкладкой для внутренней морды, чтобы лучше улавливать запах кошки. Обеспечьте наличие нескольких ошейников для использования в качестве контрольного ошейника (без запаха) или тестового ошейника (запах кошки).
ПРИМЕЧАНИЕ: Важным моментом является то, что ошейник для кошки должен иметь внутреннюю подкладку для сбора и улавливания запахов. - Наденьте ошейник на домашнюю овариэктомированную кошку и дайте кошке носить ошейник в течение недели до тестирования. Старайтесь держать кошку в помещении во время ношения испытательного ошейника.
ПРИМЕЧАНИЕ: Используйте одну и ту же кошку на протяжении всего исследования. - Храните изношенный ошейник для кошки в герметичном пластиковом контейнере и храните его при температуре 4 °C. Каждые три дня заменяйте изношенный кошачий ошейник на ошейник, содержащий свежий кошачий запах.
3. Подготовка крыс к экспериментальной процедуре
- Используйте взрослых самцов крыс Спрэг-Доули, которые весят 270-290 г. Поместите их в индивидуальные клетки с едой и водой, доступными в неограниченном количестве.
- [Необязательный] Подготовка крыс к хирургическому вмешательству (по желанию)
- Проводите операцию в стерильных условиях. Очистите и продезинфицируйте рабочую зону раствором 70% этанола и простерилизуйте все хирургические материалы и инструменты.
- Обезболите крысу внутрибрюшинной смесью кетамина (100 мг/кг) и ксилазина (20 мг/кг). Подождите, пока не будет достигнута надлежащая плоскость анестезии, когда крыса не реагирует на стимул щипка пальца ноги или стимуляцию роговицы. Для поддержания обезболивающего состояния на протяжении всей операции вводите дополнительную дозу анестетического коктейля каждые 45 минут.
- Аккуратно выбрейте голову крысы от уха до межглаз и продезинфицируйте операционную область стерильной спиртовой салфеткой с последующим нанесением раствора повидон-йода. Нанесите лубрикантную глазную мазь, чтобы избежать пересыхания роговицы во время хирургического вмешательства.
- Поместите крысу в стереотаксический аппарат и удерживайте голову, правильно расположив ушные планки в ушных каналах. Затем аккуратно вставьте резцы крысы в планку резцов и закрепите носовой зажим.
- Поместите стерильную направляющую канюлю из нержавеющей стали 26 G в стереотаксический держатель. Возьмите скальпель и сделайте разрез по средней линии вдоль кожи головы. Поместите 2 или более зажимов вокруг разреза (2-3 см).
- Полностью очистите череп от тканей до тех пор, пока не станут видны черепные швы брегмы и лямбда.
- Проверьте симметричное положение головы путем выравнивания дорсовентральной и переднезадней оси черепа с помощью резцов и ушных планок соответственно. Определите координаты направляющей канюли для интересующей области мозга. Брегму и лямбду удерживайте в одной горизонтальной плоскости с помощью резцов.
- Рассчитайте координаты места имплантации направляющей канюли в зону интереса по стереотаксическим координатам Paxinos и Watson26 или атласу Свенсона27.
ПРИМЕЧАНИЕ: Для первичной интероцептивной островковой коры использовали следующие стереотаксические координаты: Брегма -0,51 мм, средняя линия 5,0 мм, глубина от поверхности черепа 4,5 мм, под углом 10° медиально от вертикали. - Проверьте координаты имплантации направляющей канюли, опустив ее вниз до касания черепа, а затем просверлите отверстие в черепной коробке на верифицированном участке. Просверлите 3 дополнительных отверстия вокруг целевой области, чтобы вставить 3 винта в череп.
- Вставьте канюлю в интересующую область мозга и с помощью винтов и стоматологического акрила закрепите канюлю на черепе. Налейте стоматологический акрил на сухой череп и убедитесь, что он покрывает винты для фиксации канюли на месте. Дайте акриловому зубу застыть, а затем осторожно снимите стереотаксический рычаг, оставив направляющую канюлю на месте.
ПРИМЕЧАНИЕ: Эта процедура обездвиживает имплантированную канюлю и позволяет экспериментаторам выполнять множественные микроинъекции в интересующую область. - Вставьте стилет из нержавеющей стали в направляющую канюлю, чтобы избежать засорения и загрязнения.
- В конце операции введите однократную дозу антибиотика (энрофлоксацин 5%; 19 мг/кг в/) и противовоспалительного (кетофен 0,2 мг/кг в/). Повторяйте этот шаг в течение трех дней подряд после операции.
- Дайте крысам полностью восстановиться хотя бы за неделю до начала экспериментов.
- Держите крыс в обратном цикле свет/темнота в течение 12/12 часов (свет включается в 7:00 вечера) в течение как минимум десяти дней до начала экспериментов (рис. 2).
Примечание: Если экспериментатору необходимо выполнить какую-либо хирургическую процедуру, это необходимо сделать до того, как цикл «темнота-свет» будет обращен вспять. Это позволяет снизить стресс после операции. - Обрабатывайте всех крыс в течение 20 мин/день в течение 2-3 дней. Берите по одной крысе за раз, надежно держите животное за туловище (не за хвост) и гладьте его в течение этого времени. Если животные проявляют признаки стресса, прикасайтесь к ним в течение длительного времени.
ПРИМЕЧАНИЕ: Этот шаг имеет решающее значение для минимизации нагрузки при обработке, которая может повлиять на следующие шаги. - Предварительное воздействие на животных в испытательной камере (камере кошачьего запаха с неношеным кошачьим ошейником) в течение 30 минут в день в течение трех дней перед экспериментами, чтобы позволить животным акклиматизироваться к условиям испытаний.
ПРИМЕЧАНИЕ: Экспериментатору не рекомендуется пользоваться ароматизированными духами или лосьонами. - Поместив животное в камеру, подождите примерно 10-15 минут, введите руку в испытательную камеру и замените кошачий ошейник на другой кошачий ошейник с теми же характеристиками.
ПРИМЕЧАНИЕ: На этом этапе крайне важно как можно точнее смоделировать каждый этап поведенческих процедур для минимизации стресса, который может повлиять на поведенческие показатели крысы в последние 10 минут теста. - Очищайте испытательную камеру 5% (v/v) этанолом между сеансами.
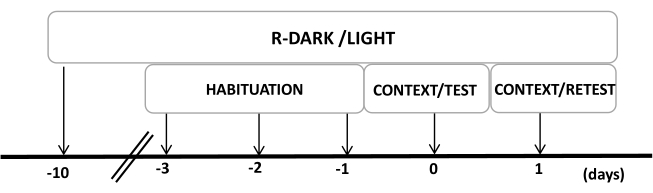
Рисунок 2: График разработки экспериментального плана. Крысы подвергались воздействию обратного цикла темноты-света в течение 10 дней, а затем приучались к испытательной камере, содержащей контрольный (неношеный) кошачий ошейник, в течение 30 минут в течение последних трех дней. На 0-й день крысы сначала подвергались воздействию знакомой тестовой камеры (КОНТЕКСТ) в течение 10 минут, а затем ошейника с кошачьим запахом или без него в течение дополнительного периода в 10 минут (ТЕСТ) в том же контексте. В день 1 крысы, подвергшиеся воздействию кошачьего запаха (TEST) в день 0, были возвращены в ту же испытательную камеру на 10 минут (CONTEXT) и повторно подвергнуты воздействию кошачьего запаха (RETEST) в течение дополнительного периода в 10 минут. Эта цифра была изменена с 8. Сокращение: R-Dark/light = обратный цикл темный-светлый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Процедуры тестирования на кошачий запах
- В день 0 экспериментального протокола оцените реакцию на угрозу кошачьего запаха.
- При необходимости вводите корковые инъекции перед поведенческими пробами по методу, описанному ниже. Если вы выполняете только поведенческий протокол, пропустите этот шаг и перейдите к шагу 4.3.
- После удаления окклюдера вставьте стерильную канюлю для инъекций 33 G в сочетании со шприцем Hamilton объемом 1 мкл в направляющую канюлю.
- Наполните шприц Гамильтона стерильным физиологическим раствором (для контрольных крыс) или агонистом рецепторов ГАМК-А, мусцимолом (для лечения крыс) и введите 0,5 мкл/полушарие в течение 2 минут. Подождите 2 минуты, чтобы дать возможность диффузии препарата, медленно извлеките канюлю для инъекции и сразу же вставьте окклюдеры.
ПРИМЕЧАНИЕ: Выполняйте этот шаг на спокойном, бодрствующем животном и вводите препараты медленно, чтобы свести к минимуму дрожание канюли для инъекций и последующую диффузию в соседние области мозга. - После того, как корковая инъекция/полушарие будет завершена, подождите 30 минут и перейдите к следующему шагу.
- Поместите животных в испытательную камеру на 20 минут. В течение первых 10 минут подвергните животных воздействию неношеного знакомого ошейника. Введите ошейник, пропитанный кошачьим запахом (ТЕСТ) или неношеный фамильярный ошейник (КОНТЕКСТ) в течение следующих 10 минут (Рисунок 3).
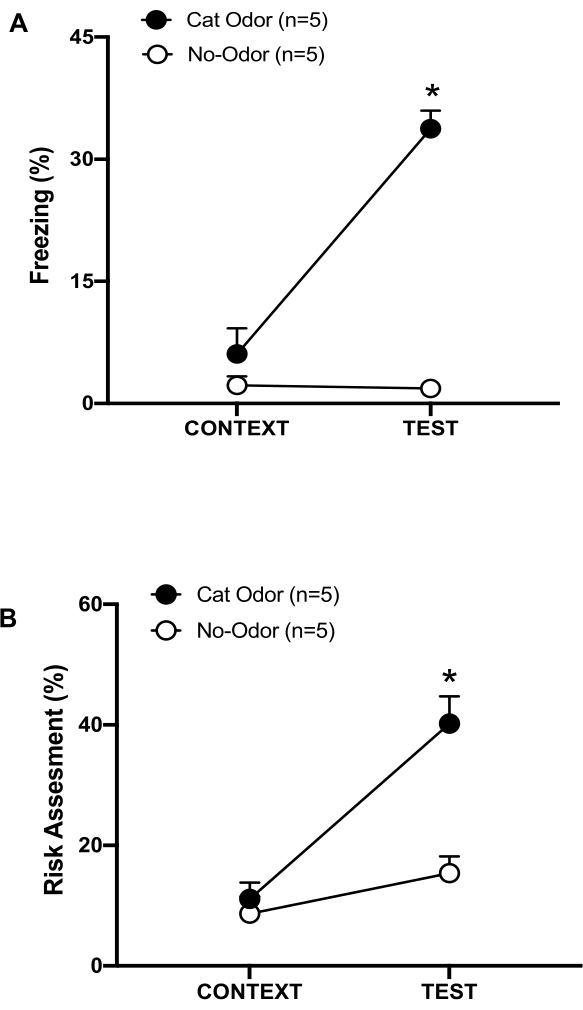
Рисунок 3: Встреча с кошачьим запахом усиливает врожденное защитное поведение. (A, B) Крысы сначала подвергались воздействию знакомой тестовой камеры (CONTEXT) в течение 10 минут, а затем ошейника с кошачьим запахом (группа кошачьего запаха, черные круги) или без кошачьего запаха (группа без запаха, открытые круги) в течение дополнительного периода времени в 10 минут (TEST) в том же контексте. Кружки показывают процент времени, затраченного наивными крысами на замораживание (В) и оценку риска (С). Данные выражаются в средних +SEM. *p < 0,05. Эта цифра была изменена с 8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Поместите видеокамеру перед испытательной камерой и запишите поведение животного для последующей поведенческой оценки экспериментатором, слепым к условиям эксперимента.
- В конце сеанса кошачьего запаха верните животных в их домашние клетки и поместите их обратно в помещение для животных до следующего сеанса.
- Очищайте испытательную камеру 5% (v/v) этанолом между сеансами.
- Через двадцать четыре часа после сеанса кошачьего запаха (день 1) оцените защитные реакции на контекст тестирования.
- При необходимости повторите шаг 4.2 перед воздействием контекста.
- Верните крыс в ту же испытательную камеру с неношеным знакомым ошейником и оцените защитное поведение для измерения контекстуальной памяти об угрозах в течение 10 минут (рис. 4).
- Поместите видеокамеру перед испытательной камерой и запишите поведение животного для последующей поведенческой оценки экспериментатором, слепым к условиям эксперимента.
- В течение следующих 10 минут замените ненадетый знакомый ошейник, снова подвергните животное ошейнику с кошачьим запахом и измерьте защитное поведение.
- После второго воздействия кошачьего запаха верните животное в домашнюю клетку и очистите испытательную камеру 5% (v/v) этанолом. Поместите крысу обратно в помещение для животных.
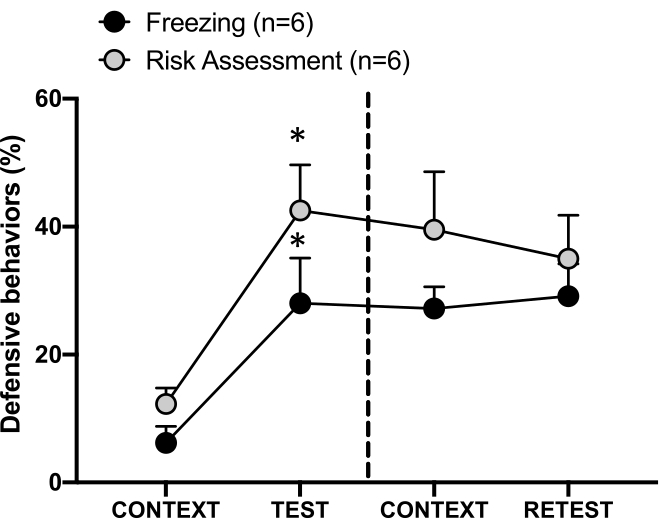
Рисунок 4: Встреча с кошачьим запахом вызывает контекстуальное обучение угрозам. Кружки показывают процент времени, проведенного в заморожении (черные круги) и поведение при оценке рисков (серые круги). Пунктирная линия отделяет тест на врожденный страх (День 0, слева) от теста на контекстуальный страх (День 1, справа). Данные выражаются в средних + SEM. *p < 0,05. Эта цифра была изменена с 8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Иммуногистохимические процедуры
- Обезболивают животное внутрибрюшинной смесью кетамина (0,45 мг/кг) и ксилазина (0,05 мг/кг) через 90 мин после завершения экспериментов. Затем усыпьте крысу путем транскардиальной перфузии с 4% параформальдегидом.
Примечание: Если необходимо оценить первое воздействие кошачьего запаха, условную реакцию на контекст или повторное воздействие кошачьего запаха, выполняйте этот шаг после каждой из этих экспериментальных ситуаций. Надевайте перчатки и лабораторный халат и осторожно обращайтесь с параформальдегидом под вытяжным шкафом для химикатов. - После перфузии зафиксировать мозг в том же фиксирующем растворе на 2 ч, а затем перевести его на 30% сахарозу с 0,02% азидом натрия в фосфатно-солевом буфере (PBS) до тех пор, пока мозг не опустится на дно. Храните мозг при температуре 4 °C.
- Заморозьте мозг с помощью сухого льда и разрежьте его на последовательные корональные срезы толщиной 50 мкм на скользящем микротоме. Соберите три набора срезов мозга в области интереса, оставив один для проверки расположения канюли и два набора для иммуногистохимической процедуры.
- Свободно плавающие участки мозга инкубировать в 0,3% H2O2 в PBS в течение 30 мин, промыть в PBS и перенести эти участки в блокирующий раствор (0,4% Triton X-100, 0,02% азид натрия, 3% нормальная козья сыворотка в PBS) на 1 ч.
- Перенесите срезы в первичный раствор для инкубации антител, содержащий антитела c-Fos, разведенные в соотношении 1:20 000 в блокирующем растворе, и оставьте их на ночь при комнатной температуре.
- Промойте срезы в PBS в течение 1 ч, а затем инкубируйте их во вторичном растворе антител, разведенном 1:1000 в 0,4% Triton X-100 и 1,5% нормальной козьей сыворотке в PBS.
- Промойте срезы в течение 40 мин и инкубируйте их в течение 1 ч в системе пероксидазы на основе авидина/биотина (см. Таблицу материалов), разведенной в соотношении 1:500 в PBS.
- Промыть и инкубировать срезы в 0,05% растворе 3-3'-диаминобензидина гидрохлорида (DAB), содержащем 0,003%H2O2и 0,05% хлорида никеля, до получения темно-синего продукта реакции.
6. Подсчет ячеек
- Исследуйте срезы под камерой lucida с использованием объектива малой мощности (10x) для локализации окрашивания c-Fos punctiform в ядрах нейронов (рис. 5).
- Используйте счетную сетку, связанную с размером области интереса. Для pIC, например, от Брегмы 0,95 до -0,26, используйте счетную сетку 0,25 мм х 1 мм; от Брегмы от -0,51 до -2,45 мм используйте счетную сетку 0,5 мм х 1 мм.
- Количественно определите количество иммунореактивных (Fos-ir) клеток c-Fos на секцию с помощью цифрового ручного счетчика.
- Подсчитайте все интересующие вас участки короны дважды и убедитесь, что один и тот же наблюдатель, слепой к условиям эксперимента, выполняет подсчет.
- Сделайте фотографию с помощью микроскопа в сочетании с цифровой камерой.
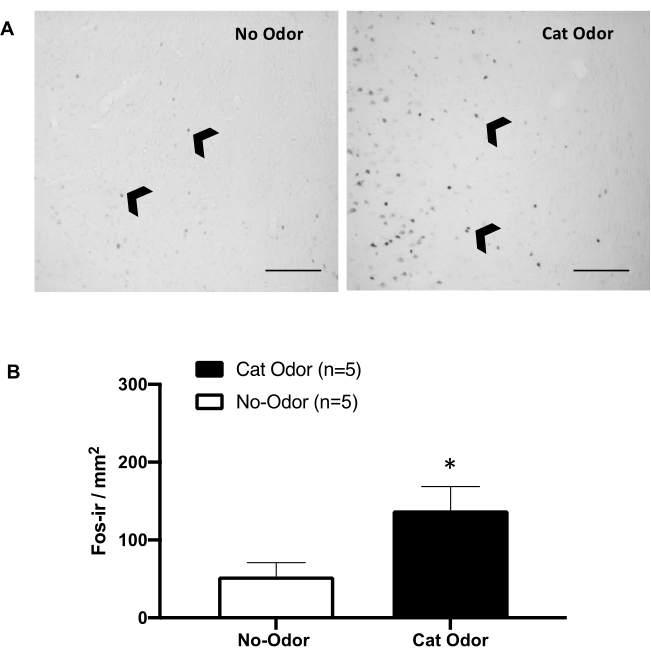
Рисунок 5: Кошачий запах вызывает активацию нейронов в первичной интероцептивной коре. (A) Репрезентативная микрофотография pIC, показывающая почти полное отсутствие c-Fos-ir клеток (черные стрелки) у крыс, подвергшихся воздействию неношеного кошачьего ошейника (без запаха, слева) по сравнению с заметно увеличенным количеством c-Fos-ir клеток у крыс, подвергшихся воздействию кошачьего запаха (справа). (B) Количественная оценка c-Fos-ir клеток в pIC в обоих экспериментальных условиях. Данные выражаются в средних + SEM. *p < 0,05. Масштабные линейки = 200 мкм. Эта цифра была изменена с 8. Сокращения: pIC = первичная интероцептивная кора; c-fos-ir = c-Fos-иммунореактивный. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
7. Анализ данных
- Оценивайте защитное поведение на основе записанных на видео экспериментов и анализируйте их с помощью статистического программного обеспечения.
- Оценивайте замирание по времени замирания, выраженному в процентах от времени, затраченного на замораживание в течение 10 минут. Рассчитайте процент замерзания с помощью уравнения (1).
Замораживание = (секунды, затраченные на замораживание/600 с) × 100 (1)
Примечание: Замораживание определялось как полное отсутствие движения, за исключением дыхания, в течение как минимум 1 с28 секунд. - Оценивайте оценку риска по времени сеансов бдительного сканирования и выражайте ее в процентах от времени, затраченного на оценку риска в течение 10 минут. Рассчитайте процент оценки риска с помощью уравнения (2).
% Оценка риска = (секунды, затраченные на оценку риска/600 с) × 100 (2)
ПРИМЕЧАНИЕ: Поведение при оценке риска определялось как бдительное сканирование (обсерватория, движения головой из стороны в сторону, без передвижения) в течение как минимум 1 с29. - Оцените эти поведенческие параметры вручную и убедитесь, что они подсчитываются экспериментатором, не обращающим внимания на условия эксперимента (т.е. запах и лекарственные условия). В зависимости от нормальности наборов данных используйте параметрические или непараметрические тесты для сравнения двух или более групп.
ПРИМЕЧАНИЕ: В данном исследовании все статистические тесты проводились с использованием программного обеспечения SPSS.- Используйте H-критерий Краскела-Уоллиса с U-критерием Манна-Уитни для попарного сравнения между группами.
- Проанализируйте внутригрупповые сравнения с течением времени с помощью теста Фридмана, за которым следует тест Вилкоксона со знаком ранга для попарных сравнений.
ПРИМЕЧАНИЕ: На всех рисунках уровни значимости были установлены на уровне p < 0,05 (*) и p < 0,01 (**).
- Для анализа экспрессии c-Fos в определенных областях мозга подсчитайте количество c-Fos-положительных клеток на участок, рассчитав плотность c-Fos-ir клеток намм2, и сравните среднее число между контрольными (без запаха) и стимулированными (кошачий запах) условиями.
- В зависимости от нормальности данных используйте непарный t-критерий Стьюдента или U-критерий Манна-Уитни.
ПРИМЕЧАНИЕ: В данном исследовании использовался U-критерий Манна-Уитни; Различия считались достоверными, если p < 0,05 (*).
- В зависимости от нормальности данных используйте непарный t-критерий Стьюдента или U-критерий Манна-Уитни.
Результаты
В этом протоколе проценты замерзания и оценки риска измерялись как индикаторы страха и тревожных состояний у крыс соответственно. График разработки эксперимента показан на рисунке 2. Результаты работы животных, подвергшихся воздействию кошачьего запаха в день 0, представлены на рисунке 3. Крысы показали значительно более высокие уровни замораживания (рис. 2A, группа кошачьего запаха, тест Вилкоксона со знаками ранга, Z = -2,201, p = 0,028) и оценки риска (рисунок 2B, группа кошачьего запаха, тест Вилкоксона со знаками ранга Z = -2,336 p = 0,018) в ответ на кошачий запах (ТЕСТ), чем на знакомый контекст (КОНТЕКСТ). Низкие уровни замораживания (рисунок 2A, группа без запаха, тест Вилкоксона со знаками, Z = -0,184, p = 0,854) и оценки риска (рисунок 2B, группа без запаха, тест Вилкоксона со знаками ранга, Z = -1,753, p = 0,08) наблюдались у крыс, подвергшихся воздействию неношеного ошейника во время второй части теста.
Дополнительный анализ показал, что уровни замораживания (рис. 2А, критерий Манна-Уитни, U = 0,000, p = 0,004) и оценки риска (рис. 2В, критерий Манна-Уитни, U = 4,000, p = 0,025) были выше в группе кошачьего запаха, чем в группе без запаха во время второй части теста. Не было существенных различий в замораживании (рис. 2А, критерий Манна-Уитни, U = 11,000, p = 0,256) и оценке риска (рис. 2В, критерий Манна-Уитни, U = 15,00, p = 0,627) между двумя группами в течение первых 10 минут воздействия знакомого контекста (КОНТЕКСТ). Эти результаты демонстрируют, что протокол подходит для тестирования защитного поведения в ответ на запах кошачьей шерсти/кожи.
Условная реакция на угрозу в контексте тестирования (CONTEXT) в первый день показана на рисунке 4. Крысы, подвергшиеся воздействию кошачьего запаха, были возвращены в испытательную камеру через 24 ч после первой встречи с запахом хищника. В 1-й день животные демонстрировали более высокие уровни замораживания (критерий Вилкоксона, Z = -2,366, p = 0,018) и оценки риска (критерий Вилкоксона, Z = -2,201, p = 0,028) в ответ на контекст тестирования, чем в 0-й день. Кроме того, не было выявлено различий между уровнями замораживания (критерий Вилкоксона, Z = -0,841, p = 0,400) или оценки риска (тест Вилкоксона, Z = -0,943, p = 0,345). Крысы показали одинаковые уровни замораживания (тест Вилкоксона со знаками ранга, Z = -0,105, p = 0,917) и оценку риска (тест Вилкоксона со знаками ранга, Z = -0,980, p = 0,327) во время РЕТЕСТА и ТЕСТА. Эти результаты показали, что однократное 10-минутное воздействие запаха шерсти/кожи кошки привело к выученной реакции на угрозу в контексте, в котором животные столкнулись с запахом хищника.
На рисунках 5 и 6 показаны две серии экспериментов с использованием протокола, представленного в этой статье. Мы проверили, необходима ли первичная интероцептивная кора (pIC), область мозга, участвующая в обработке эмоций 8,30,31,32, для выражения защитного поведения. Индуцированная кошачьим запахом активация нейронов оценивалась в pIC путем подсчета клеток c-Fos-ir в отдельных группах животных: без запаха и в условиях кошачьего запаха. Эти крысы были усыплены через 90 минут после завершения теста. Наблюдалось значительное увеличение числа нейронов c-Fos-ir в pIC в группе кошачьего запаха (критерий Манна-Уитни, U = 3.000, p = 0.016) по сравнению с контрольной группой (рис. 5).
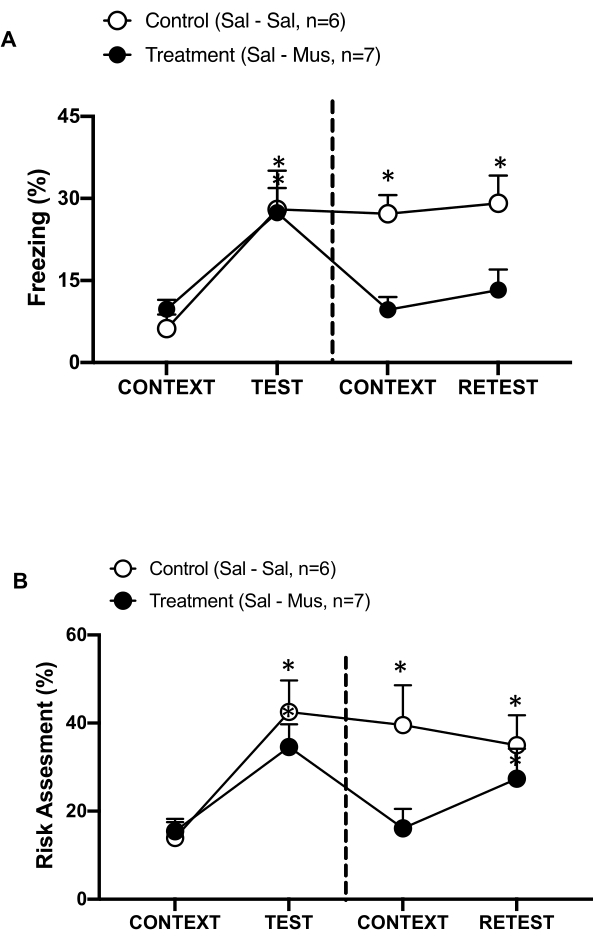
Рисунок 6: Мусцимоловая инактивация первичной интероцептивной коры головного мозга ухудшает контекстуальную память об угрозах. (А, Б) Группе лечения вводили физиологический раствор в 0-й день и мусцимол в 1-й день в группе pIC (Treatment). Контрольным крысам вводили физиологический раствор в pIC в оба дня. В 1-й день животных возвращали в знакомую испытательную камеру и подвергали воздействию КОНТЕКСТА в течение 10 минут, а затем повторно подвергали воздействию кошачьего запаха (РЕТЕСТ) в течение дополнительного периода в 10 минут. Кружки показывают процент времени, проведенного в заморожении (черные круги) и поведение при оценке риска (открытые круги). Пунктирная линия отделяет тест на врожденный страх (День 0, слева) от теста на контекстуальный страх (День 1, справа). Данные выражаются в средних + SEM. *p < 0,05. Эта цифра была изменена с 8. Сокращения: pIC = первичная интероцептивная кора; Sal-Sal = физиологический раствор, вводимый в день 0 и день 1; Sal-Mus = физиологический раствор, вводимый в 0-й день, и мусцимол в 1-й день. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Мы также измерили влияние инактивации мусцимола pIC на память о контекстуальных угрозах (рис. 6). Группа лечения (крысы sal-mus) получала инъекцию физиологического раствора в pIC на 0-й день и агонист ГАМК-А мусцимол на 1-й день. Эта группа животных не показала каких-либо различий в уровнях замораживания (рис. 6A, тест Вилкоксона со знаками ранга, Z = -0,140, p = 0,889) или оценке риска (рисунок 6B, тест Вилкоксона со знаками ранга, Z = -0,700, p = 0,484) в первый день в ответ на знакомый контекст по сравнению с днем 0, что указывает на ухудшение контекстуальной памяти об угрозах. Интересно, что замораживание (рис. 6A, критерий знаковых рангов Вилкоксона, Z = -2,100, p = 0,036), но не оценка риска (рис. 6B, критерий знаковых рангов Вилкоксона, Z = -0,980, p = 0,327), было значительно снижено во время RETEST по сравнению с TEST. Этот последний вывод указывает на то, что подавление pIC в первый день избирательно ослабляло реакцию страха, но не тревоги на запах хищника. В совокупности эти результаты подтверждают, что описанный выше экспериментальный протокол подходит для изучения врожденных и приобретенных защитных реакций на хищнические угрозы.
Обсуждение
Описанный здесь протокол предлагает инновационный подход к оценке защитного поведения, вызванного врожденными и приобретенными аверсивными стимулами. Испытательная камера без безопасного укрытия (рис. 1) и ошейник, пропитанный запахом кожи/шерсти овариэктомированной самки домашней кошки, были использованы для того, чтобы вызвать сильное и устойчивое состояние угрозы у крыс, что может быть полезно для исследования нейронных цепей, лежащих в основе адаптивных и дезадаптивных защитных реакций.
Хорошо известно, что проявление специфических защитных реакций зависит от особенностей как угрожающего стимула, так и ситуации/среды, в которой животное встречается21,33. Избегание, оценка риска и замирание являются частью обширного репертуара защитных реакций животных, которые могут быть вызваны угрожающими стимулами 9,19. Однако выбор преобладающей защитной реакции зависит от условий окружающей среды, таких как расстояние от угрозы33 или наличие безопасного места внутри испытательной камеры21,33. Например, когда крыс помещают на арену с укрытием, в присутствии кошачьего запаха, они демонстрируют защитное поведение, такое как позы растяжения/внимания, вытягивание головы из укрытия и избегание 6,24,25. Напротив, поведение при замирании, бдительное сканирование и позы растяжки/помощи сильно проявляются в ситуациях, когда побег невозможен, а расстояние до угрозы неслишком короткое.
Исследования показали, что воздействие неконтролируемого стрессора приводит к различным поведенческим последствиям, которые отличаются от тех, которые происходят, когда стрессор находится под контролем 35,36,37,38. Например, неизбежный, но не убежать хвостовой шок приводит к значительному увеличению серотонина в дорсальном ядре рафе35и тревожному поведению, измеряемому через 24 ч после аверсивного переживания. Более того, неконтролируемые стрессоры усиливают условные рефлексы страха у животных36,37 и у людей38. Первоначальная цель разработки протокола заключалась в том, чтобы поставить крыс в ситуацию, в которой они не могут контролировать аверсивный стимул и, следовательно, демонстрируют сильные и устойчивые реакции на угрозу и развивают улучшенное контекстуальное обучение после однократного и короткого воздействия кошачьего запаха.
В описанном здесь экспериментальном дизайне отсутствие укрытия вызывало сильное и устойчивое защитное состояние, которое чередовалось между замиранием (т.е. полной неподвижностью, за исключением дыхания28) и оценкой риска (т.е. бдительным сканированием и растяжкой/постановкой поз29) поведением, которое обычно рассматривается как поведенческие проявления страха и тревожных состояний у грызунов, соответственно (рисунок 3). Примечательно, что та же модель защитных реакций наблюдалась через 24 часа, когда крысы были повторно подвергнуты воздействию тестового контекста, что указывает на то, что однократного 10-минутного воздействия запаха кошачьей шерсти/кожи достаточно, чтобы вызвать долгосрочное контекстуальное обучение угрозе, как сообщалось ранее 7,10,11,14,15,34,39 (рис. 4).
Кошачий ошейник с внутренней войлочной подкладкой использовался для эффективного сбора и улавливания запахов/запахов и, таким образом, получения надежного образца стимула угрозы, вызывающего сильную защитную реакцию. В аналогичной работе исследователи использовали аверсивные стимулы, такие как кошачьи фекалии, моча или триметилтиазолин (ТМТ, компонент лисьих фекалий). Тем не менее, эти стимулы, по-видимому, менее предсказательны в отношении непосредственного присутствия хищника, потому что они менее способны вызывать контекстуальное обучение40,41. Согласно предыдущим результатам 2,4,8,9,10,11,20,34,39, кошачий запах является надежным врожденным аверсивным стимулом, который может вызывать устойчивые защитные реакции и контекстуальную память об угрозе у крыс. На протяжении многих лет этот вид этологической поведенческой модели животных все больше привлекал интерес исследователей к изучению стресса и связанных со стрессом расстройств 13,14,15,16,17,23,42, подобных тем, которые связаны с дезадаптивными воспоминаниями о страхе, такими как ПТСР.
Этот протокол предназначен для использования в сочетании с различными экспериментальными методами, включая, например, подходы молекулярной и клеточной биологии и электрофизиологию у бодрствующих и ведущих себя животных, которые дают возможность ответить на открытые вопросы и улучшить наше понимание адаптивных и дезадаптивных реакций на угрозы. В этом исследовании мы проверили идею о том, что pIC, область мозга, участвующая в обработке эмоций, необходима для выражения защитного поведения. Поведенческие эксперименты были объединены с иммуногистохимией c-Fos для картирования паттернов нейрональной активности в pIC в ответ на кошачий запах и внутримозговые инфузии агониста рецепторов ГАМК-А, мусцила, чтобы обратимо заглушить pIC и определить его участие во врожденных и приобретенных реакциях угрозы на запах хищника. Эти результаты показали, что кошачий запах вызывает увеличение активности нейронов в pIC (рис. 5), и что подавление pIC приводит к серьезному дефициту контекстуальной памяти об угрозах (рис. 6).
Несмотря на то, что описанный здесь протокол технически прост в реализации и исполнении, могут возникнуть некоторые сложности. Например, перекрестное загрязнение кошачьим запахом может произойти, если неношеный ошейник соприкасается с изношенным кошачьим ошейником. Таким образом, ошейники должны храниться отдельно во время всех процедур, а перчатки должны быть заменены после помещения надетого ошейника в испытательную камеру. Если экспериментатор хочет провести условия с запахом и отсутствием запаха, используя одну и ту же испытательную камеру, эксперименты должны проводиться в разные дни. Дляэтих экспериментов можно использовать две идентичные испытательные камеры, и крысы должны содержаться в отдельных комнатах, чтобы избежатьсоциальной коммуникации. Стресс, вызванный воздействием новых стимулов в незнакомой среде, также может быть проблемой. Следовательно, животные должны иметь по крайней мере трехдневное привыкание к тестовой среде и процедурам, чтобы снизить стресс и защитную реакцию, обычно проявляемые крысами в новых ситуациях. Кроме того, время, необходимое для периода привыкания, должно быть больше, чем тестовый период. Например, если тест занимает 10 минут, то на период привыкания следует выделить 20 или 30 минут.
Наконец, защитное поведение предпочтительно оценивать в темную фазу цикла, когда крысы активны. Крысы должны содержаться в обратном цикле свет/темнота, чтобы можно было выполнять экспериментальные процедуры, пока и крыса, и экспериментатор находятся в своих активныхфазах. Изменение цикла света/темноты занимает не более 10 дней, и, исходя из опыта, большинство крыс в этом состоянии адекватно реагируют на запах кошки. Тем не менее, есть несколько исследований, которые показывают, что крысы Спрэг-Доули менее уязвимы к длительной угрозе и беспокойству, чем крысы Вистар44. Таким образом, возможно, что использование крыс типа Wistar вместо крыс линии Спрага-Доули может дать более надежные результаты.
В заключение следует отметить, что кошачий запах является этологически значимым угрожающим стимулом, который вызывает надежные нейронные, эндокринные и поведенческие реакции у крыс. Встреча с кошачьим запахом в неизбежной камере приводит к устойчивой и длительной реакции страха/тревоги у крыс, что приводит к быстрому и длительному обучению контекстуальным угрозам. Описанный выше протокол может быть полезным инструментом для изучения механизмов кодирования памяти страха и адаптивных и дезадаптивных угроз.
Раскрытие информации
Авторы данной рукописи не имеют конкурирующих финансовых интересов или других конфликтов интересов, которые можно было бы раскрыть.
Благодарности
Авторы выражают благодарность Марселе Гонсалес за помощь в проведении лабораторных процедур, Мейбл Матамала за вклад в разработку протокола и Мигелю Рохасу за помощь в иллюстрировании.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
Ссылки
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682(2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283(2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. , Elsevier Academic Press. Amsterdam. 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, Chapter 9, Unit 9 45(2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16(2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , Chapter 8, Unit 8.19 (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91(2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , Academic Press. San Diego. (1997).
- Swanson, L. W. Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , Elsevier. (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377(1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292(2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132(2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041(2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены