Method Article
Un protocole incontournable d’exposition aux odeurs de chat pour l’étude du conditionnement des menaces innées et contextuelles chez les rats
Dans cet article
Résumé
L’exposition aux odeurs de peau et de fourrure de chat fournit une méthode fiable pour étudier les circuits neuronaux et les mécanismes des réponses défensives chez les rongeurs et peut donner un aperçu des mécanismes qui médient la peur chez les humains. Ici, nous décrivons un protocole pour étudier le rôle du cortex intéroceptif dans les réponses aux menaces chez les rats.
Résumé
Les animaux réagissent aux situations menaçantes en adoptant un certain nombre de comportements défensifs, notamment l’évitement, le gel et l’évaluation des risques. Un modèle animal avec une approche éthologique offre un aperçu plus approfondi des mécanismes biologiques sous-jacents aux réponses aux menaces. Cet article décrit une méthodologie pour mesurer les comportements défensifs envers les stimuli aversifs innés et appris chez les rats. Les animaux ont été exposés individuellement à l’odeur d’un prédateur dans une chambre inéluctable pour provoquer un état défensif mesurable et durable. La conception expérimentale consistait à placer un rat dans une chambre familière pendant 10 minutes, suivi d’une exposition à l’odeur du chat pendant 10 minutes supplémentaires dans le même contexte. Le lendemain, les rats ont été réexposés pendant 10 minutes dans la même chambre de contexte où l’exposition à l’odeur de chat s’est produite. Les séances ont été enregistrées sur vidéo et les comportements défensifs ont été évalués les deux jours.
Le test comportemental a été couplé à des techniques d’inactivation fonctionnelle réversible et d’immunohistochimie c-Fos pour déterminer le rôle du cortex intéroceptif dans les réponses à la menace. Les rats exposés à l’odeur du chat le premier jour et réexposés à la chambre contextuelle le deuxième jour ont montré des niveaux plus élevés de comportements défensifs, et cette odeur de chat a provoqué une augmentation robuste de l’activité neuronale du cortex intéroceptif. De plus, l’inactivation du cortex intéroceptif par le muscimol a réduit l’expression des comportements défensifs en réponse à l’odeur du chat et a altéré la mémoire contextuelle de la menace. Ces résultats montrent que ce test comportemental est un outil utile pour étudier les mécanismes neuronaux des comportements défensifs et peut donner un aperçu des mécanismes qui médient la peur chez l’homme et ses troubles associés.
Introduction
Les comportements défensifs se produisent en réponse à des stimuli qui signalent une menace potentielle pour la survie d’un animal. Ces comportements sont hautement conservés chez les mammifères et rapidement associés à des stimuli ou à des circonstances liés à la menace1, 2, 3. Dans la nature, les stimuli menaçants pour la plupart des animaux sont les prédateurs ; Par conséquent, la détection des indices de prédateurs, tels que les indices olfactifs, est particulièrement avantageuse pour éviter la prédation. Les réponses comportementales aux signaux de prédateur ont été largement étudiées chez les rongeurs.
Par exemple, des stimuli, tels que la fourrure naturelle du chat ou les odeurs de peau, activent le système olfactif et voméronasal, induisant des niveaux élevés de comportements défensifs4. Ces stimuli sont accompagnés de changements dans l’activité neuronale et endocrinienne 5,6,7,8, et ce sont des stimuli forts, inconditionnés et aversifs pour le conditionnement de la menace contextuelle chez les rats 7,8,9,10,11. Des études ont montré qu’au moins 24 heures après l’exposition à des signaux naturels de prédateurs, les rats présentent des états d’anxiété conditionnés robustes et durables 7,12,13. Ce phénomène est particulièrement intéressant pour l’élaboration de modèles plus réalistes du trouble de stress post-traumatique (TSPT)14,15,16,17, du trouble d’anxiété généralisée (TAG)5 et du trouble panique (MP)18,19.
En laboratoire, le comportement de peur est mesuré comme la fuite, l’évitement (par exemple, la retraite, la clandestinité) ou la congélation. De plus, l’anxiété peut être mesurée par des postures d’étirement et un balayage vigilant visant à surveiller un stimulus prédateur - un ensemble de réponses généralement connues sous le nom de comportements d’évaluation du risque 6,9,20. Des études ont montré que le comportement de congélation est la stratégie défensive prédominante chez les rats face à une menace inéluctable, tandis que l’évaluation des risques est observée lorsque la menace est ambiguë ou non localisée 12,21,32. Bien que l’on sache qu’un stimulus inné ou appris peut susciter des comportements défensifs, il existe un manque de paradigmes comportementaux de laboratoire qui capturent de manière fiable les réponses défensives dans un contexte plus éthologique. Pour combler cette lacune, nous avons conçu un protocole avec une approche éthologique qui permet de mesurer les comportements de menace innés et contextuels soutenus ainsi que les réponses cérébrales aux stimuli de menace naturalistes.
Les expériences stressantes, telles que l’exposition à une odeur de prédateur inéluctable, provoquent des altérations durables de la réponse comportementale et physiologique chez les rats 14,22,23. Ces altérations reflètent le profil symptomatique observé dans les troubles liés à la peur et à l’anxiété tels que le SSPT. Dans le modèle actuel, une chambre d’essai est utilisée sans cachette sûre pour exposer les rats à un événement de menace inévitable et ainsi améliorer les réponses défensives. Les rats ont montré des comportements robustes de congélation et d’évaluation des risques en réponse à la fois à l’odeur du chat et au contexte de test. Ces résultats soutiennent l’utilisation de ce protocole comme une méthode fiable et valide pour explorer les mécanismes biologiques sous-jacents aux comportements défensifs et développer et affiner de nouvelles stratégies pour le traitement des troubles de la peur chez l’homme.
Protocole
La procédure suivante a été menée conformément aux recommandations des directives institutionnelles du National Institutes of Health (États-Unis) Guide for the Care and Use of Laboratory Animals (NIH Publication No. 80-23, révisée en 1996). Le Comité institutionnel de biosécurité et d’éthique de la Pontificia Universidad Católica de Chile a approuvé toutes les procédures. Toutes les séances expérimentales ont été menées pendant la phase active du rat (phase sombre).
1. Préparation de la salle d’essai et de la chambre d’essai
REMARQUE : La vue d’ensemble de l’appareil est illustrée à la figure 1. La chambre d’essai a été développée et modifiée selon les études précédentes24,25.
- Utilisez une chambre d’essai rectangulaire transparente en polyméthacrylate de méthyle aux dimensions suivantes : 60 cm (longueur) x 40 cm (largeur) x 40 cm (hauteur). Couvrez les parois latérale et arrière de la chambre d’essai avec du papier noir. Assurez-vous que l’avant de la chambre d’essai est transparent pour enregistrer les comportements des animaux.
- Fixez un support en acier au sol dans le coin inférieur droit de la chambre d’essai et utilisez-le pour fixer les colliers de chat pour les procédures de test.
- Nettoyez la chambre d’essai avec de l’éthanol à 5 % (v/v) avant et après les tests pour éliminer tout indice d’odeur laissé par les rats sujets et éviter la réponse d’aversion du rat. Comptez 5 min entre chaque séance pour que l’éthanol s’évapore complètement.
- Effectuez la séance d’essai dans une pièce calme faiblement éclairée par une ampoule rouge de 80 W située à 20 cm au-dessus de la chambre d’essai. Utilisez une caméra vidéo située devant la chambre pour enregistrer le comportement des animaux.
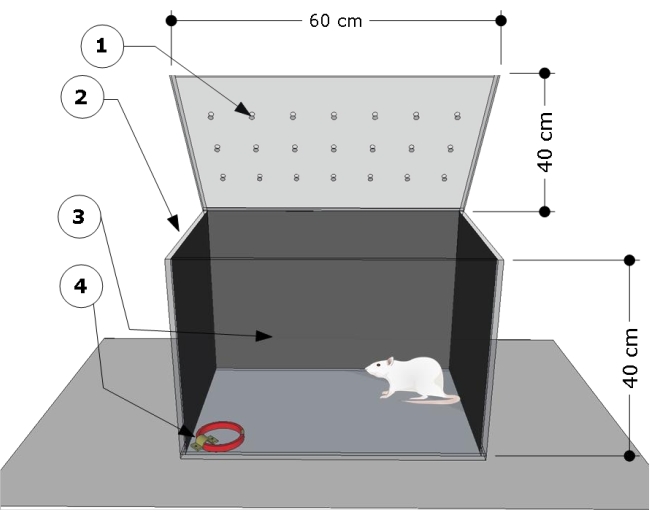
Figure 1 : Vue d’ensemble schématique de la chambre d’essai. L’appareil se compose d’un compartiment d’essai avec : (1) des trous de ventilation, (2) des parois latérales et (3) des parois arrière obscurcies, et un support en acier verrouillé au niveau du sol du coin gauche (4) pour fixer le collier pour chat (dimensions : largeur 15 mm, épaisseur 5 mm, longueur 300 mm). Les dimensions de la chambre sont indiquées sur le carton (60 L x 40 l x 40 H cm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation de l’odeur de chat
- Procurez-vous un collier pour chat avec une face intérieure doublée de feutre pour mieux piéger l’odeur du chat. S’assurer de la disponibilité de plusieurs colliers à utiliser comme collier de contrôle (pas d’odeur) ou collier de test (odeur de chat).
REMARQUE : Le point crucial est que le collier pour chat doit avoir une doublure interne pour collecter et piéger les odeurs. - Mettez un collier sur une chatte domestique ovariectomisée et laissez-la porter le collier pendant une semaine avant de faire le test. Essayez de garder la chatte à l’intérieur pendant qu’elle porte le collier de test.
REMARQUE : Utilisez le même chat tout au long de l’étude. - Conservez le collier pour chat usé dans un récipient en plastique hermétique et rangez-le à 4 °C. Remplacez le collier pour chat usé par un collier contenant une odeur de chat frais tous les trois jours.
3. Préparation des rats pour la procédure expérimentale
- Utilisez des rats Sprague-Dawley mâles adultes qui pèsent de 270 à 290 g. Hébergez-les dans des cages individuelles avec de la nourriture et de l’eau disponibles à volonté.
- [Facultatif] Préparation des rats pour l’intervention chirurgicale (facultatif)
- Effectuez la chirurgie dans des conditions stériles. Nettoyez et désinfectez la zone de travail avec une solution d’éthanol à 70 % et stérilisez tout le matériel et les instruments chirurgicaux.
- Anesthésier le rat avec un mélange intrapéritonéal de kétamine (100 mg/kg) et de xylazine (20 mg/kg). Attendez que le plan d’anesthésie approprié soit atteint lorsque le rat ne répond pas à un stimulus de pincement de l’orteil ou à une stimulation cornéenne. Pour maintenir l’état anesthésique tout au long de la chirurgie, administrez une dose supplémentaire du cocktail anesthésique toutes les 45 minutes.
- Rasez doucement la tête du rat de l’arrière de l’oreille à l’entre-yeux, et désinfectez la zone chirurgicale avec un tampon de préparation d’alcool stérile suivi d’une solution de povidone iodée. Appliquez une pommade oculaire lubrifiante pour éviter le dessèchement de la cornée pendant l’intervention chirurgicale.
- Placez le rat dans un appareil stéréotaxique et tenez la tête en positionnant correctement les barres d’oreille dans les conduits auditifs. Ensuite, insérez doucement les incisives du rat dans la barre d’incisive et fixez le collier de nez.
- Placez une canule guide stérile en acier inoxydable de 26 G dans le support stéréotaxique. Prenez un scalpel et faites une incision médiane le long du cuir chevelu. Placez 2 pinces ou plus autour de l’incision (2-3 cm).
- Nettoyez complètement le crâne de tissu jusqu’à ce que les sutures crâniennes bregma et lambda soient visibles.
- Vérifiez le positionnement symétrique de la tête par l’alignement de l’axe dorso-ventral et antéropostérieur du crâne à l’aide des incisives et des barres auriculaires, respectivement. Identifier les coordonnées de la canule guide pour la région cérébrale d’intérêt. Gardez le bregma et le lambda dans le même plan horizontal à l’aide de la barre incisive.
- Calculez les coordonnées du site d’implantation de la canule guide dans la zone d’intérêt en suivant les coordonnées stéréotaxiques de Paxinos et Watson26 ou de Swanson atlas27.
REMARQUE : Pour le cortex insulaire intéroceptif primaire, les coordonnées stéréotaxiques suivantes ont été utilisées : Bregma -0,51 mm, ligne médiane 5,0 mm, profondeur à partir de la surface crânienne 4,5 mm, inclinée de 10° médialement par rapport à la verticale. - Vérifiez les coordonnées d’implantation de la canule guide en l’abaissant jusqu’à ce qu’elle touche le crâne, puis percez un trou à travers le crâne sur le site vérifié. Percez 3 trous supplémentaires autour de la zone cible pour placer 3 vis dans le crâne.
- Insérez la canule dans la zone cérébrale d’intérêt et utilisez des vis et de l’acrylique dentaire pour ancrer la canule au crâne. Versez de l’acrylique dentaire sur le crâne sec et assurez-vous qu’il recouvre les vis pour fixer la canule en place. Laissez durcir la denture en acrylique, puis retirez soigneusement le bras stéréotaxique, en laissant la canule de guidage en place.
REMARQUE : Cette procédure immobilise la canule implantée et permet aux expérimentateurs d’effectuer plusieurs micro-injections dans la zone d’intérêt. - Insérez un stylet en acier inoxydable dans la canule de guidage pour éviter toute obstruction et contamination.
- À la fin de l’opération, administrer une dose unique d’antibiotique (enrofloxacine 5 % ; 19 mg/kg i.p) et d’anti-inflammatoire (kétagène 0,2 mg/kg i.p.). Répétez cette étape pendant trois jours consécutifs après la chirurgie.
- Laissez les rats se rétablir complètement pendant au moins une semaine avant de commencer les expériences.
- Maintenez les rats sous un cycle lumière/obscurité inversé de 12/12 h (lumières allumées à 19h00) pendant au moins dix jours avant le début des expériences (Figure 2).
REMARQUE : Si l’expérimentateur doit effectuer une intervention chirurgicale, il serait nécessaire de le faire avant d’inverser le cycle obscurité-lumière. Cela permet de réduire le stress après la chirurgie. - Manipulez tous les rats pendant 20 min/jour pendant 2-3 jours. Prenez un rat à la fois, tenez l’animal en toute sécurité par le torse (pas par la queue) et caressez-le pendant ce temps. Si les animaux montrent des signes de stress, manipulez-les pendant de longues périodes.
REMARQUE : Cette étape est essentielle pour minimiser le stress de manipulation qui peut affecter les étapes suivantes. - Préexposez les animaux dans la chambre d’essai (chambre d’odeur de chat avec un collier pour chat non porté) pendant 30 min/jour pendant trois jours avant les expériences pour permettre aux animaux de s’acclimater au contexte d’essai.
REMARQUE : Il est suggéré à l’expérimentateur de ne pas porter de parfums ou de lotions parfumés. - Après avoir placé l’animal dans la chambre, attendez environ 10 à 15 minutes, introduisez un bras dans la chambre de test et remplacez le collier pour chat par un autre collier pour chat avec les mêmes caractéristiques.
REMARQUE : Cette étape est essentielle pour simuler, aussi fidèlement que possible, chaque étape des procédures comportementales afin de minimiser le stress, ce qui peut affecter les performances comportementales du rat dans les 10 dernières minutes du test. - Nettoyez la chambre d’essai avec de l’éthanol à 5 % (v/v) entre les sessions.
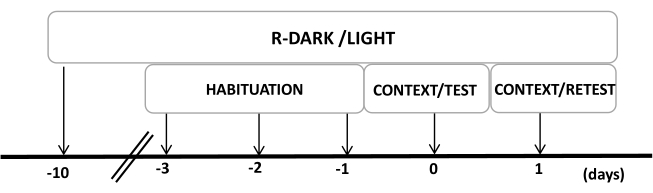
Figure 2 : Chronologie de la conception expérimentale. Les rats ont été exposés à un cycle sombre-lumière inversé pendant 10 jours, puis se sont habitués à la chambre d’essai contenant un collier de chat témoin (non porté) pendant 30 minutes pendant les trois derniers jours. Le jour 0, les rats ont d’abord été exposés à une chambre d’essai familière (CONTEXT) pendant 10 min, puis exposés à un collier avec ou sans odeur de chat pendant une période supplémentaire de 10 min (TEST) dans le même contexte. Le jour 1, les rats exposés à l’odeur de chat (TEST) le jour 0 ont été renvoyés dans la même chambre de test pendant 10 minutes (CONTEXT) et réexposés à l’odeur de chat (RETEST) pendant une période supplémentaire de 10 minutes. Cette figure a été modifiée au lieu de 8. Abréviation : R-Dark/light = cycle sombre-lumière inversé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Procédures de test d’odeur de chat
- Au jour 0 du protocole expérimental, évaluez les réponses de menace à l’odeur du chat.
- Si nécessaire, administrez des injections corticales avant les tests comportementaux en suivant la méthode décrite ci-dessous. Si vous exécutez uniquement un protocole comportemental, ignorez cette étape et passez à l’étape 4.3.
- Insérez une canule d’injection stérile de 33 G couplée à une seringue Hamilton de 1 μL dans la canule guide après avoir retiré l’occlusion.
- Remplissez la seringue Hamilton avec une solution saline stérile (rats témoins) ou l’agoniste des récepteurs GABA-A, le muscimol (rats traités), et injectez 0,5 μL/hémisphère pendant 2 minutes. Attendez 2 minutes pour permettre la diffusion du médicament, retirez lentement la canule d’injection et insérez immédiatement les occluseurs.
REMARQUE : Effectuez cette étape chez un animal calme et éveillé et injectez les médicaments lentement pour minimiser la gigue de la canule d’injection et la diffusion conséquente dans les zones cérébrales adjacentes. - Une fois l’injection/l’hémisphère cortical terminé, attendez 30 min et passez à l’étape suivante.
- Placez les animaux dans la chambre d’essai pendant 20 min. Pendant les 10 premières minutes, exposez les animaux à un collier familier non porté. Introduisez le collier imprégné d’odeur de chat (TEST) ou un collier familier non porté (CONTEXT) au cours des 10 prochaines minutes (Figure 3).
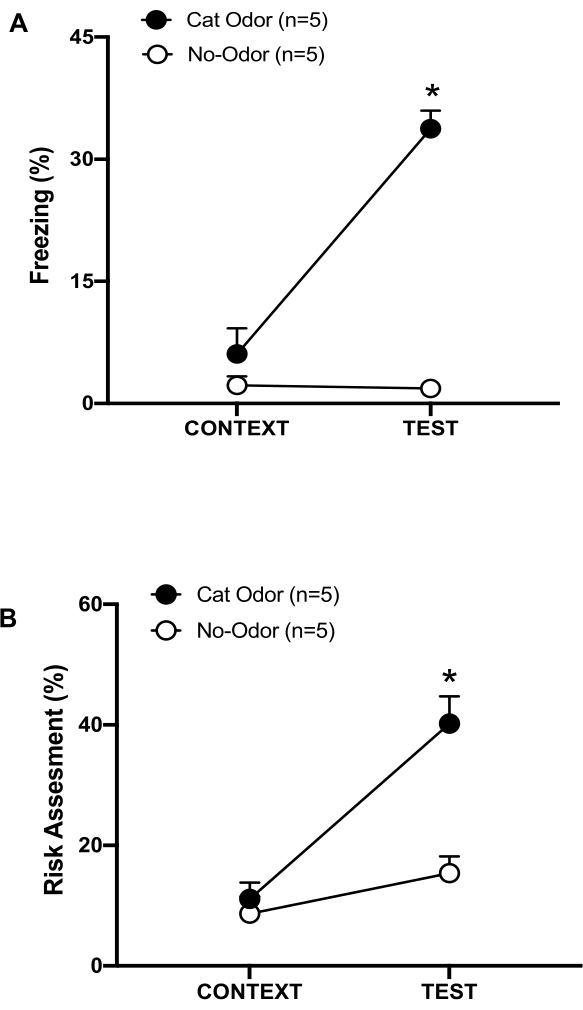
Figure 3 : La rencontre avec l’odeur du chat augmente les comportements défensifs innés. (A, B) Les rats ont d’abord été exposés à la chambre d’essai familière (CONTEXT) pendant 10 min, puis exposés à un collier avec une odeur de chat (groupe d’odeur de chat, cercles noirs) ou sans odeur de chat (groupe sans odeur, cercles ouverts) pendant une période supplémentaire de 10 min (TEST) dans le même contexte. Les cercles montrent le pourcentage de temps passé en congélation (B) et en évaluation des risques (C) affiché par les rats naïfs. Les données sont exprimées en moyennes + SEM. *p < 0,05. Cette figure a été modifiée au lieu de 8. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Placez une caméra vidéo devant la chambre d’essai et enregistrez le comportement de l’animal pour une évaluation comportementale ultérieure par un expérimentateur aveugle aux conditions expérimentales.
- À la fin de la séance d’odeur de chat, retournez les animaux dans leurs cages d’origine et remettez-les dans l’animalerie jusqu’à la prochaine séance.
- Nettoyez la chambre d’essai avec de l’éthanol à 5 % (v/v) entre les sessions.
- Vingt-quatre heures après la séance d’odeur de chat (jour 1), évaluez les réponses défensives au contexte de test.
- Si nécessaire, répétez l’étape 4.2 avant l’exposition au contexte.
- Renvoyez les rats dans la même chambre d’essai que le collier familier non porté, et notez les comportements défensifs pour mesurer la mémoire contextuelle de la menace pendant 10 minutes (Figure 4).
- Placez une caméra vidéo devant la chambre d’essai et enregistrez le comportement de l’animal pour une évaluation comportementale ultérieure par un expérimentateur aveugle aux conditions expérimentales.
- Au cours des 10 prochaines minutes, remplacez le collier familier non porté, réexposez l’animal à un collier à odeur de chat et mesurez les comportements défensifs.
- Après la deuxième exposition à l’odeur du chat, retournez l’animal dans sa cage d’origine et nettoyez la chambre d’essai avec de l’éthanol à 5 % (v/v). Remettez le rat dans l’animalerie.
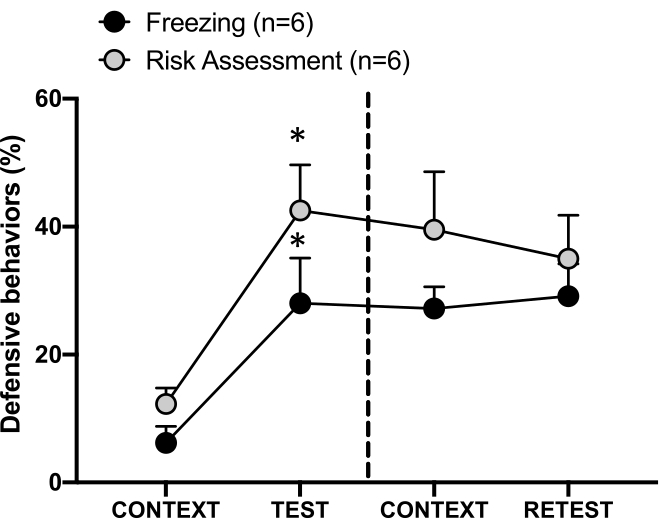
Figure 4 : La rencontre avec l’odeur du chat induit un apprentissage contextuel des menaces. Les cercles indiquent le pourcentage de temps passé en position figée (cercles noirs) et le comportement d’évaluation des risques (cercles gris). La ligne pointillée sépare le test de peur innée (jour 0, à gauche) du test de peur contextuelle (jour 1, à droite). Les données sont exprimées en moyennes + MEB. *p < 0,05. Cette figure a été modifiée au lieu de 8. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Procédures immunohistochimiques
- Anesthésier l’animal avec un mélange intrapéritonéal de kétamine (0,45 mg/kg) et de xylazine (0,05 mg/kg) 90 min après la fin des expériences. Ensuite, euthanasiez le rat par perfusion transcardique avec 4 % de paraformaldéhyde.
REMARQUE : S’il est nécessaire d’évaluer la première exposition à l’odeur de chat, la réponse conditionnée au contexte ou la réexposition à l’odeur de chat, effectuez cette étape après chacune de ces situations expérimentales. Portez des gants et une blouse de laboratoire et manipulez le paraformaldéhyde avec précaution sous une hotte chimique. - Après la perfusion, fixez le cerveau dans la même solution fixatrice pendant 2 heures, puis transférez-le dans du saccharose à 30 % avec de l’azoture de sodium à 0,02 % dans une solution saline tamponnée au phosphate (PBS) jusqu’à ce que le cerveau coule au fond. Stockez le cerveau à 4 °C.
- Congelez le cerveau à l’aide de glace sèche et coupez-le en sections coronales en série de 50 m d’épaisseur sur un microtome coulissant. Prélever trois séries de sections cérébrales de la zone d’intérêt, en laissant une pour la vérification du placement de la canule et deux séries pour la procédure immunohistochimique.
- Incuber les sections de cerveau flottantes dans 0,3 % de H2O2 dans du PBS pendant 30 min, laver dans du PBS et transférer ces sections dans la solution de blocage (0,4 % de Triton X-100, 0,02 % d’azoture de sodium, 3 % de sérum de chèvre normal dans du PBS) pendant 1 h.
- Transférez les sections dans la solution primaire d’incubation d’anticorps contenant l’anticorps c-Fos dilué 1:20 000 dans une solution bloquante et laissez-les passer la nuit à température ambiante.
- Rincer les sections dans du PBS pendant 1 h, puis les incuber dans la solution d’anticorps secondaires diluée à 1:1 000 dans du Triton X-100 à 0,4 % et du sérum de chèvre normal à 1,5 % dans du PBS.
- Rincer les sections pendant 40 min et les incuber pendant 1 h dans le système de peroxydase à base d’avidine/biotine (voir le tableau des matériaux), dilué à 1:500 dans du PBS.
- Rincez et incubez les sections dans une solution à 0,05 % de chlorhydrate de diaminobenzidine 3-3' (DAB) contenant 0,003 % de chlorure de H, 2O2 et 0,05 % de chlorure de nickel pour obtenir un produit de réaction bleu foncé.
6. Comptage cellulaire
- Examiner des sections sous une camera lucida à l’aide d’un objectif de faible puissance (10x) pour localiser la coloration punctiforme de c-Fos dans les noyaux des neurones (Figure 5).
- Utilisez une grille de comptage liée à la taille de la zone d’intérêt. Pour le pIC, par exemple, de Bregma 0,95 à -0,26, utilisez une grille de comptage de 0,25 mm x 1 mm ; de Bregma -0,51 à -2,45 mm, utilisez une grille de comptage de 0,5 mm x 1 mm.
- Quantifiez le nombre de cellules immunoréactives c-Fos (Fos-ir) par section à l’aide d’un compteur manuel de chiffres.
- Comptez deux fois toutes les coupes coronales d’intérêt et assurez-vous que le même observateur, aveugle aux conditions expérimentales, effectue le comptage.
- Prenez une photo à l’aide d’un microscope couplé à un appareil photo numérique.
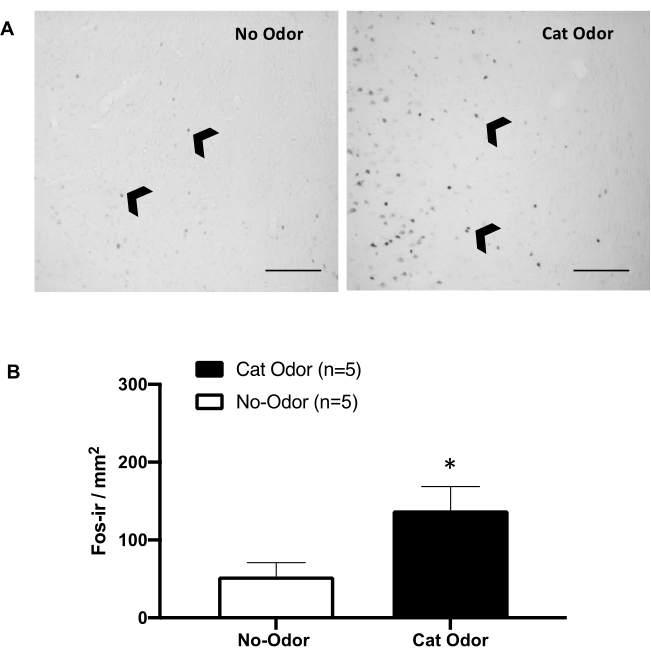
Figure 5 : L’odeur du chat provoque une activation neuronale dans le cortex intéroceptif primaire. (A) Photomicrographie représentative du pIC montrant une quasi-absence de cellules c-Fos-ir (pointes de flèches noires) chez les rats exposés à un collier de chat non porté (pas d’odeur, à gauche) par rapport à un nombre remarquablement accru de cellules c-Fos-ir chez les rats exposés à l’odeur du chat (à droite). (B) Quantification des cellules c-Fos-ir dans le pIC dans les deux conditions expérimentales. Les données sont exprimées en moyennes + MEB. *p < 0,05. Barres d’échelle = 200 μm. Cette figure a été modifiée au lieu de 8. Abréviations : pIC = cortex intéroceptif primaire ; c-Fos-ir = c-Fos-immunoréactif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Analyse des données
- Évaluez les comportements défensifs à partir des expériences enregistrées sur vidéo et analysez-les à l’aide d’un logiciel statistique.
- Évaluez la congélation en chronométrant les épisodes, exprimé en pourcentage du temps passé à congeler pendant 10 min. Calculez le pourcentage de congélation à l’aide de l’équation (1).
Congélation = (secondes de congélation/600 s) × 100 (1)
REMARQUE : Le gel a été défini comme l’absence totale de mouvement, à l’exception de la respiration, pendant au moins 1 s28. - Évaluez l’évaluation des risques en chronométrant les périodes de balayage vigilant et exprimez-la en pourcentage du temps consacré à l’évaluation des risques pendant 10 minutes. Calculer le pourcentage d’évaluation des risques à l’aide de l’équation (2).
% d’évaluation des risques = (secondes consacrées à l’évaluation des risques/600 s) × 100 (2)
REMARQUE : Le comportement d’évaluation des risques a été défini comme un balayage vigilant (observatoire, mouvements latéraux de la tête, sans déplacement) pendant au moins 1 s29. - Notez ces paramètres comportementaux manuellement et assurez-vous qu’ils sont comptés par un expérimentateur aveugle aux conditions expérimentales (c’est-à-dire les conditions d’odeur et de médicament). En fonction de la normalité des ensembles de données, utilisez des tests paramétriques ou non paramétriques pour comparer deux groupes ou plus.
REMARQUE : Dans cette étude, tous les tests statistiques ont été effectués à l’aide du logiciel SPSS.- Utilisez le test H de Kruskal-Wallis avec le test U de Mann-Whitney pour des comparaisons par paires entre les groupes.
- Analysez les comparaisons intragroupes au fil du temps avec le test de Friedman suivi du test de Wilcoxon pour les comparaisons par paires.
REMARQUE : Dans toutes les figures, les niveaux de signification ont été fixés à p < 0,05 (*) et p < 0,01 (**).
- Pour l’analyse de l’expression de c-Fos dans des zones cérébrales spécifiques, comptez le nombre de cellules c-Fos-positives par section en calculant la densité de cellules c-Fos-ir par mm2, et comparez le nombre moyen entre les conditions de contrôle (pas d’odeur) et stimulées (odeur de chat).
- Selon la normalité des données, utilisez le test t de Student non apparié ou le test U de Mann-Whitney.
REMARQUE : Dans cette étude, le test U de Mann-Whitney a été utilisé ; Les différences étaient considérées comme significatives si p < 0,05 (*).
- Selon la normalité des données, utilisez le test t de Student non apparié ou le test U de Mann-Whitney.
Résultats
Dans ce protocole, les pourcentages de congélation et d’évaluation des risques ont été mesurés comme indicateurs de la peur et des états anxiogènes chez les rats, respectivement. La chronologie de la conception expérimentale est illustrée à la figure 2. Les résultats des animaux exposés à l’odeur de chat le jour 0 sont présentés à la figure 3. Les rats ont montré des niveaux significativement plus élevés de congélation (figure 2A, groupe Cat Odor, test Wilcoxon Signed-ranks, Z = -2,201, p = 0,028) et d’évaluation des risques (figure 2B, groupe Cat Odor, test Wilcoxon Signed-ranks Z = -2,336, p = 0,018) en réponse à l’odeur de chat (TEST) qu’au contexte familier (CONTEXT). De faibles niveaux de congélation (figure 2A, groupe inodore, test Wilcoxon Signed-ranks, Z = -0,184, p = 0,854) et d’évaluation des risques (figure 2B, groupe inodore, test Wilcoxon Signed-ranks, Z = -1,753, p = 0,08) ont été observés chez les rats exposés à un collier non porté pendant la deuxième partie de l’essai.
Une analyse supplémentaire a révélé que les niveaux de congélation (figure 2A, test de Mann-Whitney, U = 0,000, p = 0,004) et d’évaluation des risques (figure 2B, test de Mann-Whitney, U = 4 000, p = 0,025) étaient plus élevés dans le groupe Cat Odor que dans le groupe sans odeur au cours de la deuxième partie du test. Il n’y avait pas de différences significatives entre les deux groupes en ce qui concerne la congélation (figure 2A, test de Mann-Whitney, U = 11 000, p = 0,256) et l’évaluation des risques (figure 2B, test de Mann-Whitney, U = 15,00, p = 0,627) au cours des 10 premières minutes d’exposition à un contexte familier (CONTEXT). Ces résultats démontrent que le protocole est adapté pour tester les comportements défensifs en réponse à l’odeur de fourrure/peau de chat.
La figure 4 montre la réponse conditionnée de la menace au contexte de test (CONTEXT) le jour 1. Les rats exposés à l’odeur du chat ont été renvoyés dans la chambre d’essai 24 heures après la première rencontre avec l’odeur du prédateur. Le jour 1, les animaux présentaient des taux de congélation (test de Wilcoxon Signed-rangs, Z = -2,366, p = 0,018) et d’évaluation des risques (test de Wilcoxon Signed-rangs, Z = -2,201, p = 0,028) plus élevés en réponse au contexte de test qu’au jour 0. De plus, il n’y avait pas de différences dans les niveaux de congélation (test de Wilcoxon Signed-ranks, Z = -0,841, p = 0,400) ou d’évaluation du risque (test de Wilcoxon Signed-ranks, Z = -0,943, p = 0,345) entre CONTEXT et RETEST. Les rats ont montré les mêmes niveaux de congélation (test de Wilcoxon Signed-ranks, Z = -0,105, p = 0,917) et d’évaluation des risques (test de Wilcoxon Signed-ranks, Z = -0,980, p = 0,327) pendant le RETEST et le TEST. Ces résultats ont démontré qu’une seule exposition de 10 minutes à l’odeur de fourrure et de peau de chat entraînait une réponse apprise à la menace dans le contexte dans lequel les animaux étaient confrontés à l’odeur d’un prédateur.
Les figures 5 et 6 montrent deux séries d’expériences utilisant le protocole présenté dans cet article. Nous avons testé si le cortex intéroceptif primaire (pIC), une région du cerveau impliquée dans le traitement des émotions 8,30,31,32, est nécessaire à l’expression des comportements défensifs. L’activation neuronale induite par l’odeur de chat a été évaluée dans le pIC en comptant les cellules c-Fos-ir dans des groupes d’animaux séparés : conditions sans odeur et odeur de chat. Ces rats ont été euthanasiés 90 minutes après la fin du TEST. Une augmentation significative a été observée du nombre de neurones c-Fos-ir dans le pIC dans le groupe odeur de chat (test de Mann-Whitney, U = 3,000, p = 0,016) par rapport au groupe témoin (Figure 5).
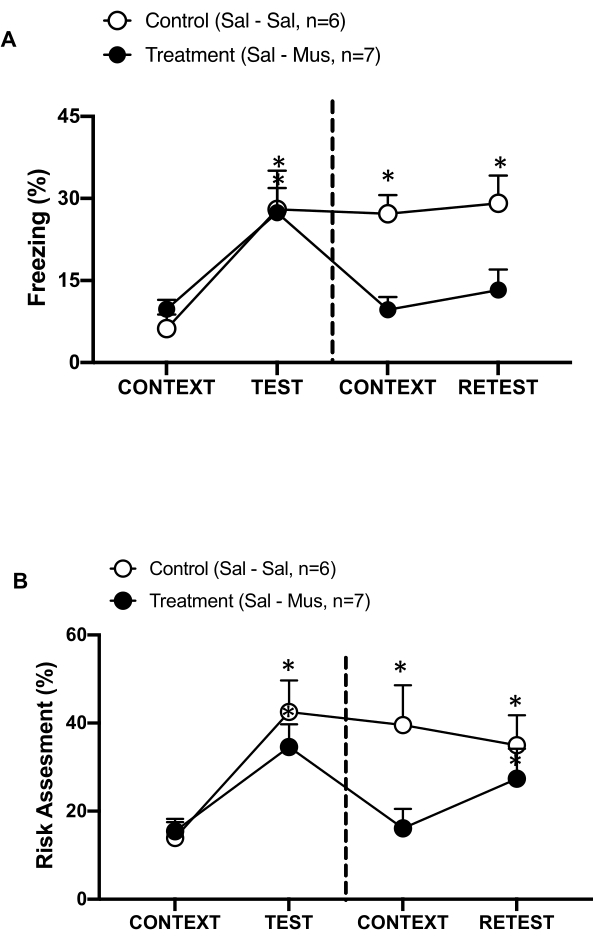
Figure 6 : L’inactivation muscimol du cortex intéroceptif primaire altère la mémoire contextuelle de la menace. (A, B) Le groupe de traitement a reçu une injection de solution saline le jour 0 et de muscimol le jour 1 dans le groupe pIC (groupe de traitement). Des rats témoins ont reçu une injection de solution saline dans le pIC les deux jours. Le jour 1, les animaux ont été renvoyés dans la chambre d’essai familière et exposés au CONTEXTE pendant 10 minutes et réexposés à l’odeur du chat (RETEST) pendant une période supplémentaire de 10 minutes. Les cercles indiquent le pourcentage de temps passé en position figée (cercles noirs) et le comportement d’évaluation des risques (cercles ouverts). La ligne pointillée sépare le test de peur innée (jour 0, à gauche) du test de peur contextuelle (jour 1, à droite). Les données sont exprimées en moyennes + MEB. *p < 0,05. Cette figure a été modifiée au lieu de 8. Abréviations : pIC = cortex intéroceptif primaire ; Sal-Sal = solution saline injectée le jour 0 et le jour 1 ; Sal-Mus = solution saline injectée le jour 0 et muscimol le jour 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Nous avons également mesuré l’effet de l’inactivation du muscimol du pIC sur la mémoire contextuelle de la menace (Figure 6). Le groupe de traitement (rats sal-mus) a reçu une injection de solution saline dans le pIC le jour 0 et du muscimol agoniste du GABA-A le jour 1. Ce groupe d’animaux n’a montré aucune différence dans les taux de congélation (figure 6A, test de Wilcoxon Signed-ranks, Z = -0,140, p = 0,889) ou d’évaluation du risque (figure 6B, test de Wilcoxon Signed-ranks, Z = -0,700, p = 0,484) le jour 1 en réponse au contexte familier par rapport au jour 0, ce qui indique une altération de la mémoire contextuelle de la menace. Il est intéressant de noter que la congélation (figure 6A, test de Wilcoxon Signed-ranks, Z = -2,100, p = 0,036), mais pas l’évaluation des risques (figure 6B, test de Wilcoxon Signed-ranks, Z = -0,980, p = 0,327), a été significativement réduite pendant RETEST par rapport à TEST. Cette dernière constatation indique que le fait de faire taire le pIC le jour 1 a altéré de manière sélective la réponse de peur, mais pas d’anxiété, à l’odeur du prédateur. Pris ensemble, ces résultats soutiennent que le protocole expérimental décrit ci-dessus convient à l’étude des réponses défensives innées et apprises aux menaces prédatrices.
Discussion
Le protocole décrit ici propose une approche innovante pour évaluer les comportements défensifs évoqués par des stimuli aversifs innés et appris. Une chambre d’essai sans cachette (figure 1) et un collier imprégné d’une odeur de peau et de fourrure provenant d’une chatte domestique ovariectomisée ont été utilisés pour susciter chez les rats un état de menace fort et soutenu qui pourrait être utile pour étudier les circuits neuronaux sous-jacents aux réactions défensives adaptatives et inadaptées.
Il est bien connu que l’apparition de réactions défensives spécifiques dépend à la fois des caractéristiques du stimulus de menace et de la situation/de l’environnement dans lequel l’animal est rencontré21,33. L’évitement, l’évaluation des risques et la congélation font partie d’un vaste répertoire de réactions défensives animales qui peuvent être évoquées par des stimuli menaçants 9,19. Cependant, le choix de la réaction défensive prédominante dépend des conditions environnementales telles que la distance par rapport à la menace33 ou la présence d’un endroit sûr à l’intérieur de la chambre d’essai21,33. Par exemple, lorsque les rats sont placés dans l’arène avec une cachette, en présence d’une odeur de chat, ils affichent des comportements défensifs tels que des postures d’étirement/assistance, la tête hors de la boîte et l’évitement 6,24,25. En revanche, le comportement de figément, le balayage vigilant et les postures d’étirement/assistance sont fortement provoqués dans les situations où il n’est pas possible de s’échapper et où la distance par rapport à la menace n’est pas trop courte33,34.
Des études ont montré que l’exposition à un facteur de stress incontrôlable produit une variété de conséquences comportementales qui sont différentes de celles qui se produisent lorsque le facteur de stress est contrôlable 35,36,37,38. Par exemple, un choc caudal, inévitable, mais non évitable, entraîne de fortes augmentations de la sérotonine dans le noyau du raphé dorsal35 et des comportements anxieux mesurés 24 h après l’expérience aversive36. De plus, les facteurs de stress incontrôlables améliorent le conditionnement de la peur chez les animaux36,37 et les humains38. Notre raison initiale pour développer le protocole était d’exposer les rats à une situation où ils ne peuvent pas contrôler le stimulus aversif, et donc présentent des réponses de menace fortes et soutenues et développent un apprentissage contextuel amélioré après une seule et courte exposition à l’odeur de chat.
Dans la conception expérimentale décrite ici, l’absence de cachette évoquait un état défensif fort et soutenu qui alternait entre le gel (c’est-à-dire l’immobilité complète sauf la respiration28) et l’évaluation du risque (c’est-à-dire le balayage vigilant et les postures d’étirement/assistance29), qui sont généralement considérés comme des manifestations comportementales de la peur et des états anxiogènes chez les rongeurs, respectivement (Figure 3). Notamment, le même schéma de réactions défensives s’est produit 24 heures plus tard lorsque les rats ont été réexposés au contexte de test, indiquant qu’une seule exposition de 10 minutes à l’odeur de la fourrure et de la peau de chat est suffisante pour induire un apprentissage contextuel durable de la menace, comme indiqué précédemment 7,10,11,14,15,34,39 (Figure 4).
Un collier pour chat avec une doublure interne en feutre a été utilisé pour collecter et piéger efficacement les odeurs/odeurs et ainsi obtenir un échantillon fiable du stimulus de menace afin d’évoquer une forte réponse défensive. Les chercheurs ont utilisé des stimuli aversifs tels que des excréments de chat, de l’urine ou de la triméthylthiazoline (TMT, un composant des excréments de renard) dans des travaux similaires. Néanmoins, ces stimuli semblent être moins prédictifs de la présence immédiate d’un prédateur car ils sont moins capables d’induire un apprentissage contextuel40,41. Selon les résultats précédents 2,4,8,9,10,11,20,34,39, l’odeur de chat est un stimulus aversif inné fiable qui peut induire des réactions défensives soutenues et une mémoire de menace contextuelle chez les rats. Au fil des ans, ce type de modèle animal comportemental éthologique a suscité de plus en plus l’intérêt des chercheurs pour l’étude du stress et des troubles liés au stress 13,14,15,16,17,23,42 comme ceux associés à des souvenirs de peur inadaptés tels que le SSPT.
Ce protocole est destiné à être utilisé conjointement avec une variété de techniques expérimentales, y compris, par exemple, les approches de biologie moléculaire et cellulaire et l’électrophysiologie chez les animaux éveillés et en comportement, qui offrent la possibilité de répondre à des questions ouvertes et d’améliorer notre compréhension des réponses adaptatives et inadaptées aux menaces. Dans cette étude, nous avons testé l’idée que le pIC, une région du cerveau impliquée dans le traitement des émotions, est nécessaire à l’expression des comportements défensifs. Des expériences comportementales ont été couplées à l’immunohistochimie c-Fos pour cartographier les modèles d’activité neuronale dans le pIC en réponse à l’odeur du chat et aux perfusions intracérébrales de l’agoniste du récepteur GABA-A, le muscimol, afin de réduire au silence de manière réversible le pIC et de déterminer son implication dans les réactions de menace innées et apprises à l’odeur du prédateur. Ces résultats ont révélé que l’odeur du chat provoquait une augmentation de l’activité neuronale dans le pIC (Figure 5), et que le fait de réduire au silence le pIC entraînait un grave déficit de mémoire contextuelle de la menace (Figure 6).
Bien que le protocole décrit ici soit techniquement simple à mettre en œuvre et à exécuter, quelques complications peuvent survenir. Par exemple, une contamination croisée par les odeurs de chat peut se produire si le collier non porté entre en contact avec le collier pour chat usé. Ainsi, les colliers doivent être conservés séparément pendant toutes les procédures, et les gants doivent être changés après la mise en place du collier usé dans la chambre d’essai. Si l’expérimentateur souhaite effectuer des conditions d’odeur et d’absence d’odeur en utilisant la même chambre d’essai, les expériences doivent être effectuées à des jours différents. Deux chambres d’essai identiques pourraient être utilisées pour ces expériences34, et les rats devraient être maintenus dans des pièces séparées pour éviter la communication sociale43. Le stress provoqué par l’exposition à de nouveaux stimuli dans des environnements inconnus peut également être un problème. Par conséquent, les animaux doivent avoir au moins trois jours d’accoutumance à l’environnement d’essai et aux procédures pour réduire le stress et la défensive couramment affichés par les rats dans des situations nouvelles. De plus, le temps nécessaire à la période d’habituation doit être plus long que la période d’essai. Par exemple, si le test dure 10 minutes, il faut attribuer 20 ou 30 minutes à la période d’habituation.
Enfin, les comportements défensifs doivent être évalués de préférence pendant la phase sombre du cycle, lorsque les rats sont actifs. Les rats doivent être maintenus sous un cycle lumière/obscurité inversé pour permettre aux procédures expérimentales d’être effectuées pendant que le rat et l’expérimentateur sont dans leurs phases actives34. Le changement dans le cycle lumière/obscurité ne prend pas plus de 10 jours pour être réglé et, d’après l’expérience, la plupart des rats dans cette condition réagissent de manière adéquate à l’odeur du chat. Cependant, quelques études montrent que les rats Sprague-Dawley sont moins vulnérables au conditionnement des menaces et à l’anxiété de longue durée que les rats Wistar44. Ainsi, il est possible que l’utilisation de rats Wistar au lieu de rats de souche Sprague-Dawley puisse donner des résultats plus robustes.
En conclusion, l’odeur du chat est un stimulus menaçant éthologiquement pertinent qui suscite des réponses neuronales, endocriniennes et comportementales fiables chez les rats. La rencontre avec l’odeur du chat dans une chambre inéluctable conduit à une réponse de peur/anxiété robuste et prolongée chez les rats, ce qui se traduit par un apprentissage rapide et durable des menaces contextuelles. Le protocole décrit ci-dessus pourrait être un outil utile pour étudier la peur et les mécanismes de codage de la mémoire des menaces adaptatives et inadaptées.
Déclarations de divulgation
Les auteurs de ce manuscrit n’ont aucun intérêt financier concurrent ou autre conflit d’intérêts à divulguer.
Remerciements
Les auteurs remercient Marcela Gonzalez pour son aide aux procédures de laboratoire, Mabel Matamala pour sa contribution à la conception du protocole et Miguel Rojas pour son aide à l’illustration.
matériels
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
Références
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682 (2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283 (2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J., Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. , 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, 45 (2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16 (2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91 (2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1997).
- Swanson, L. W. . Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377 (1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292 (2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132 (2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041 (2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon