Method Article
Un protocollo inevitabile di esposizione all'odore del gatto per studiare il condizionamento innato e contestuale della minaccia nei ratti
In questo articolo
Riepilogo
L'esposizione all'odore della pelle/pelo del gatto fornisce un metodo affidabile per studiare i circuiti neurali e i meccanismi delle risposte difensive nei roditori e può offrire informazioni sui meccanismi che mediano la paura negli esseri umani. Qui, descriviamo un protocollo per studiare il ruolo della corteccia interocettiva nelle risposte alle minacce nei ratti.
Abstract
Gli animali rispondono a situazioni minacciose esibendo una serie di comportamenti difensivi, tra cui l'evitamento, il congelamento e la valutazione del rischio. Un modello animale con un approccio etologico offre una visione più approfondita dei meccanismi biologici alla base delle risposte alle minacce. Questo articolo descrive una metodologia per misurare i comportamenti difensivi nei confronti di stimoli avversi sia innati che appresi nei ratti. Gli animali sono stati esposti individualmente all'odore dei predatori in una camera ineluttabile per suscitare uno stato difensivo misurabile, prolungato. Il disegno sperimentale prevedeva il posizionamento di un ratto in una camera familiare per 10 minuti, seguito dall'esposizione all'odore di gatto per altri 10 minuti nello stesso contesto. Il giorno successivo, i ratti sono stati riesposti per 10 minuti nella stessa camera di contesto in cui si è verificata l'esposizione all'odore di gatto. Le sessioni sono state videoregistrate e in entrambi i giorni sono stati valutati i comportamenti difensivi.
Il test comportamentale è stato abbinato a tecniche di inattivazione funzionale reversibile e immunoistochimica c-Fos per determinare il ruolo della corteccia interocettiva nelle risposte alle minacce. I ratti esposti all'odore di gatto il primo giorno e riesposti alla camera di contesto il secondo giorno hanno mostrato livelli più elevati di comportamenti difensivi e quell'odore di gatto ha suscitato un robusto aumento dell'attività neurale della corteccia interocettiva. Inoltre, l'inattivazione del muscimolo della corteccia interocettiva ha ridotto l'espressione dei comportamenti difensivi in risposta all'odore del gatto e ha alterato la memoria della minaccia contestuale. Questi risultati mostrano che questo test comportamentale è uno strumento utile per studiare i meccanismi neurali dei comportamenti difensivi e può offrire informazioni sui meccanismi che mediano la paura negli esseri umani e sui disturbi correlati.
Introduzione
I comportamenti difensivi si verificano in risposta a stimoli che segnalano una potenziale minaccia alla sopravvivenza di un animale. Questi comportamenti sono altamente conservati in tutti i mammiferi e rapidamente associati a stimoli o circostanze legate alla minaccia 1,2,3. In natura, gli stimoli minacciosi per la maggior parte degli animali sono i predatori; Pertanto, il rilevamento di segnali predatori, come i segnali olfattivi, è particolarmente vantaggioso per evitare la predazione. Le risposte comportamentali ai segnali predatori sono state ampiamente studiate nei roditori.
Ad esempio, gli stimoli, come il pelo naturale del gatto o gli odori della pelle, attivano l'olfatto e il sistema vomeronasale, inducendo alti livelli di comportamenti difensivi4. Questi stimoli sono accompagnati da cambiamenti nell'attività neuronale ed endocrina 5,6,7,8 e sono stimoli forti, incondizionati e avversivi per il condizionamento contestuale della minaccia nei ratti 7,8,9,10,11. Gli studi hanno dimostrato che almeno 24 ore dopo l'esposizione ai segnali naturali dei predatori, i ratti mostrano stati ansiosi condizionati robusti e duraturi 7,12,13. Questo fenomeno è di particolare interesse per lo sviluppo di modelli più realistici di disturbo da stress post-traumatico (PTSD)14,15,16,17, disturbo d'ansia generalizzato (GAD)5 e disturbo di panico (PD)18,19.
In laboratorio, il comportamento della paura è misurato come la fuga, l'evitamento (ad esempio, la ritirata, il nascondersi) o il congelamento. Inoltre, l'ansia può essere misurata come posture di allungamento e scansione vigile diretta al monitoraggio di uno stimolo predatorio, un insieme di risposte ampiamente note come comportamenti di valutazione del rischio 6,9,20. Gli studi hanno dimostrato che il comportamento di congelamento è la strategia difensiva predominante nei ratti di fronte a una minaccia ineluttabile, mentre la valutazione del rischio si osserva quando la minaccia è ambigua o non localizzata 12,21,32. Sebbene sia noto che uno stimolo innato o appreso può suscitare comportamenti difensivi, mancano paradigmi comportamentali di laboratorio che catturino in modo affidabile le risposte difensive in un contesto più etologico. Per colmare questa lacuna, abbiamo progettato un protocollo con un approccio etologico che consente la misurazione di comportamenti di minaccia innati e contestuali sostenuti insieme alle risposte cerebrali a stimoli di minaccia naturalistici.
Esperienze stressanti, come l'esposizione a un inevitabile odore di predatore, causano alterazioni permanenti nella risposta comportamentale e fisiologica nei ratti 14,22,23. Queste alterazioni riflettono il profilo dei sintomi osservati nei disturbi legati alla paura e all'ansia come il PTSD. Nel modello attuale, una camera di prova viene utilizzata senza un'area di nascondiglio sicura per esporre i ratti a un evento di minaccia inevitabile e quindi migliorare le risposte difensive. I ratti hanno mostrato robusti comportamenti di congelamento e valutazione del rischio in risposta sia all'odore del gatto che al contesto del test. Questi risultati supportano l'uso di questo protocollo come metodo affidabile e valido per esplorare i meccanismi biologici alla base dei comportamenti difensivi e sviluppare e perfezionare nuove strategie per il trattamento dei disturbi della paura nell'uomo.
Protocollo
La seguente procedura è stata condotta secondo le raccomandazioni delle linee guida istituzionali della Guida del National Institutes of Health (USA) per la cura e l'uso degli animali da laboratorio (NIH Publication No. 80-23, rivista nel 1996). Il Comitato Etico e di Biosicurezza Istituzionale della Pontificia Universidad Católica de Chile ha approvato tutte le procedure. Tutte le sessioni sperimentali sono state condotte durante la fase attiva del ratto (fase oscura).
1. Preparazione della sala prove e della camera di prova
NOTA: La panoramica dell'apparecchio è mostrata nella Figura 1. La camera di prova è stata sviluppata e modificata in base a studi precedenti24,25.
- Utilizzare una camera di prova rettangolare trasparente in polietilene (metacrilato di metile) con le seguenti dimensioni: 60 cm (lunghezza) x 40 cm (larghezza) x 40 cm (altezza). Coprire le pareti laterali e posteriori della camera di prova con carta nera. Assicurarsi che la parte anteriore della camera di prova sia trasparente per registrare i comportamenti degli animali.
- Fissare una staffa d'acciaio al pavimento nell'angolo in basso a destra della camera di prova e utilizzarla per fissare i collari per gatti per le procedure di test.
- Pulire la camera di prova con etanolo al 5% (v/v) prima e dopo i test per rimuovere eventuali indizi olfattivi lasciati dai ratti soggetti ed evitare la risposta di avversione del ratto. Attendere 5 minuti tra una sessione e l'altra affinché l'etanolo evapori completamente.
- Esegui la sessione di test in una stanza silenziosa scarsamente illuminata da una lampadina rossa da 80 W situata a 20 cm sopra la camera di prova. Usa una videocamera situata davanti alla camera per registrare il comportamento degli animali.
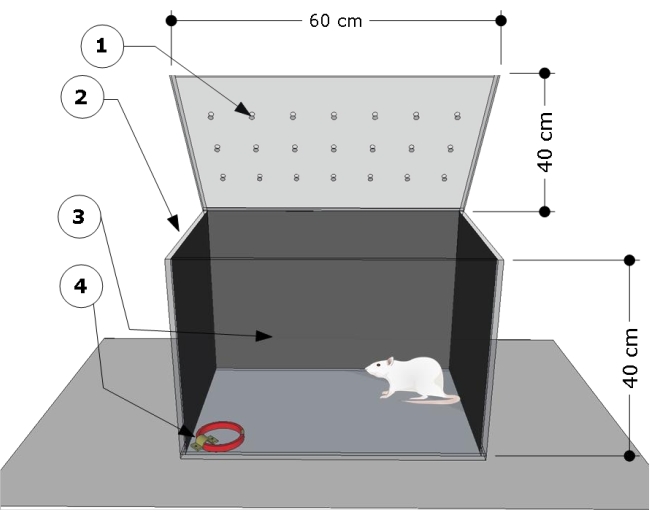
Figura 1: Panoramica schematica della camera di prova. L'apparecchiatura è costituita da un vano di prova con: (1) fori di ventilazione, (2) pareti laterali e (3) posteriori oscurate e una staffa in acciaio bloccata sul pavimento dell'angolo sinistro (4) per fissare il collare per gatti (dimensioni: larghezza 15 mm, spessore 5 mm, lunghezza 300 mm). Le dimensioni della camera sono indicate sul cartone (60 L x 40 P x 40 H cm). Clicca qui per visualizzare una versione più grande di questa figura.
2. Preparazione dell'odore di gatto
- Procurati un collare per gatti con una faccia interna foderata in feltro per intrappolare meglio l'odore del gatto. Garantire la disponibilità di diversi collari da utilizzare come collare di controllo (nessun odore) o collare di prova (odore di gatto).
NOTA: Il punto cruciale è che il collare per gatti deve avere una fodera interna per la raccolta e l'intrappolamento degli odori. - Metti un collare su una gatta domestica ovariectomizzata e lascia che la gatta indossi il collare per una settimana prima del test. Cerca di tenere la gatta in casa mentre indossi il collare di prova.
NOTA: Utilizzare lo stesso gatto per tutto lo studio. - Conservare il collare per gatti indossato in un contenitore di plastica ermetico e conservarlo a 4 °C. Sostituisci il collare per gatti usurato con un collare contenente un fresco odore di gatto ogni tre giorni.
3. Preparazione dei ratti per la procedura sperimentale
- Utilizzare ratti maschi adulti di Sprague-Dawley che pesano 270-290 g. Alloggiali in gabbie individuali con cibo e acqua disponibili ad libitum.
- [Facoltativo] Preparazione dei ratti per la procedura chirurgica (opzionale)
- Eseguire l'intervento chirurgico in condizioni sterili. Pulire e disinfettare l'area di lavoro con una soluzione di etanolo al 70% e sterilizzare tutti i materiali e gli strumenti chirurgici.
- Anestetizzare il ratto con una miscela intraperitoneale di ketamina (100 mg/kg) e xilazina (20 mg/kg). Attendere fino a quando non viene raggiunto il piano di anestesia corretto quando il ratto non risponde a uno stimolo di pizzicamento delle dita dei piedi o alla stimolazione corneale. Per mantenere la condizione anestetica durante l'intervento, somministrare una dose aggiuntiva del cocktail anestetico ogni 45 minuti.
- Radere delicatamente la testa del ratto da dietro l'orecchio fino a tra gli occhi e disinfettare l'area chirurgica con un tampone sterile per la preparazione di alcol seguito da una soluzione di iodio povidone. Applicare un unguento lubrificante per gli occhi per evitare l'essiccazione della cornea durante la procedura chirurgica.
- Metti il ratto in un apparato stereotassico e tieni la testa posizionando correttamente le barre auricolari nei canali uditivi. Quindi, inserire delicatamente gli incisivi del ratto nella barra degli incisivi e fissare il morsetto per il naso.
- Inserire una cannula guida sterile in acciaio inox da 26 G nel supporto stereotassico. Prendi un bisturi e fai un'incisione sulla linea mediana lungo il cuoio capelluto. Posizionare 2 o più morsetti attorno all'incisione (2-3 cm).
- Liberare completamente il cranio dal tessuto fino a quando non sono visibili le suture craniche bregma e lambda.
- Verificare il posizionamento simmetrico della testa mediante l'allineamento dell'asse dorso-ventrale e anteroposteriore del cranio utilizzando rispettivamente le barre incisive e auricolari. Identificare le coordinate della cannula guida per la regione cerebrale di interesse. Mantenere la bregma e la lambda sullo stesso piano orizzontale utilizzando la barra incisiva.
- Calcolare le coordinate del sito di impianto della cannula guida nell'area di interesse seguendo le coordinate stereotassiche di Paxinos e Watson26 o Swanson atlas27.
NOTA: Per la corteccia insulare interocettiva primaria sono state utilizzate le seguenti coordinate stereotassiche: Bregma -0,51 mm, linea mediana 5,0 mm, profondità dalla superficie cranica 4,5 mm, angolata 10° medialmente dalla verticale. - Controlla le coordinate dell'impianto della cannula guida abbassandola fino a toccare il cranio, quindi pratica un foro attraverso il cranio sul sito verificato. Pratica 3 fori aggiuntivi attorno all'area bersaglio per posizionare 3 viti nel cranio.
- Inserire la cannula nell'area cerebrale di interesse e utilizzare viti e acrilico dentale per ancorare la cannula al cranio. Versare l'acrilico dentale sul cranio asciutto e assicurarsi che copra le viti per fissare la cannula in posizione. Lasciare indurire il dentale in acrilico, quindi rimuovere con cautela il braccio stereotassico, lasciando la cannula guida in posizione.
NOTA: Questa procedura immobilizza la cannula impiantata e consente agli sperimentatori di eseguire più microiniezioni nell'area di interesse. - Inserire uno stiletto in acciaio inossidabile nella cannula guida per evitare ostruzioni e contaminazioni.
- Al termine dell'intervento, somministrare una singola dose di antibiotico (enrofloxacina 5%; 19 mg/kg i.p.) e antinfiammatorio (ketofene 0,2 mg/kg i.p.). Ripetere questo passaggio per tre giorni consecutivi dopo l'intervento.
- Lasciare che i ratti si riprendano completamente per almeno una settimana prima di iniziare gli esperimenti.
- Tenere i ratti sotto un ciclo di luce/buio inverso di 12/12 ore (luci accese alle 19:00) per almeno dieci giorni prima dell'inizio degli esperimenti (Figura 2).
NOTA: Se lo sperimentatore deve eseguire qualsiasi procedura chirurgica, sarebbe necessario eseguirla prima di invertire il ciclo buio-luce. Ciò consente la riduzione dello stress dopo l'intervento chirurgico. - Maneggiare tutti i ratti per 20 minuti al giorno per 2-3 giorni. Prendi un topo alla volta, tieni saldamente l'animale per il busto (non per la coda) e accarezzalo durante questo periodo. Se gli animali mostrano segni di stress, maneggiarli per periodi prolungati.
NOTA: Questo passaggio è fondamentale per ridurre al minimo lo stress di manipolazione che può influire sui passaggi successivi. - Preesporre gli animali alla camera di prova (camera degli odori di gatto con un collare per gatti non indossato) per 30 minuti al giorno per tre giorni prima degli esperimenti per consentire agli animali di acclimatarsi al contesto di test.
NOTA: Si suggerisce che lo sperimentatore non indossi profumi o lozioni profumate. - Dopo aver posizionato l'animale nella camera, attendere circa 10-15 minuti, introdurre un braccio nella camera di prova e sostituire il collare per gatti con un altro collare per gatti con le stesse caratteristiche.
NOTA: Questo passaggio è fondamentale per simulare, il più fedelmente possibile, ogni fase delle procedure comportamentali per ridurre al minimo lo stress, che può influenzare le prestazioni comportamentali del ratto negli ultimi 10 minuti del test. - Pulire la camera di prova con etanolo al 5% (v/v) tra una sessione e l'altra.
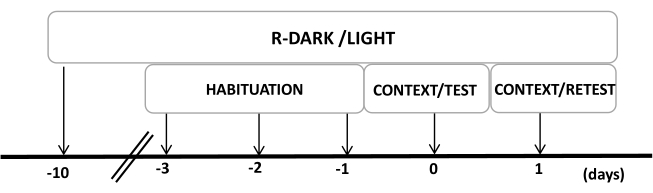
Figura 2: Cronologia del disegno sperimentale. I ratti sono stati esposti a un ciclo buio-luce invertito per 10 giorni e poi abituati alla camera di prova contenente un collare di controllo (non indossato) per 30 minuti negli ultimi tre giorni. Il giorno 0, i ratti sono stati prima esposti a una camera di prova familiare (CONTEXT) per 10 minuti e poi esposti a un collare con o senza odore di gatto per un ulteriore periodo di 10 minuti (TEST) nello stesso contesto. Il giorno 1, i ratti esposti all'odore di gatto (TEST) il giorno 0 sono stati riportati nella stessa camera di prova per 10 minuti (CONTESTO) e riesposti all'odore di gatto (RETEST) per un ulteriore periodo di 10 minuti. Questa cifra è stata modificata da 8. Abbreviazione: R-Dark/light = ciclo buio-luce inverso. Clicca qui per visualizzare una versione più grande di questa figura.
4. Procedure di test dell'odore di gatto
- Il giorno 0 del protocollo sperimentale, valutare le risposte di minaccia all'odore del gatto.
- Se necessario, somministrare iniezioni corticali prima dei test comportamentali seguendo il metodo descritto di seguito. Se si esegue solo un protocollo comportamentale, saltare questo passaggio e procedere al passaggio 4.3.
- Inserire una cannula sterile per iniezione da 33 G accoppiata a una siringa Hamilton da 1 μL nella cannula guida dopo aver rimosso l'occlusore.
- Riempire la siringa di Hamilton con soluzione fisiologica sterile (ratti di controllo) o con l'agonista del recettore GABA-A, il muscimolo (ratti in trattamento) e iniettare 0,5 μL/emisfero in 2 minuti. Attendere 2 minuti per consentire la diffusione del farmaco, rimuovere lentamente la cannula di iniezione e inserire immediatamente gli occlusori.
NOTA: Eseguire questo passaggio in un animale tranquillo e sveglio e iniettare i farmaci lentamente per ridurre al minimo il jitter della cannula di iniezione e la conseguente diffusione alle aree cerebrali adiacenti. - Una volta completata l'iniezione corticale/emisfero, attendere 30 minuti e procedere al passaggio successivo.
- Mettere gli animali nella camera di prova per 20 minuti. Durante i primi 10 minuti, esponi gli animali a un collare familiare mai indossato. Introdurre il collare impregnato di odore di gatto (TEST) o un collare familiare non indossato (CONTESTO) entro i successivi 10 minuti (Figura 3).
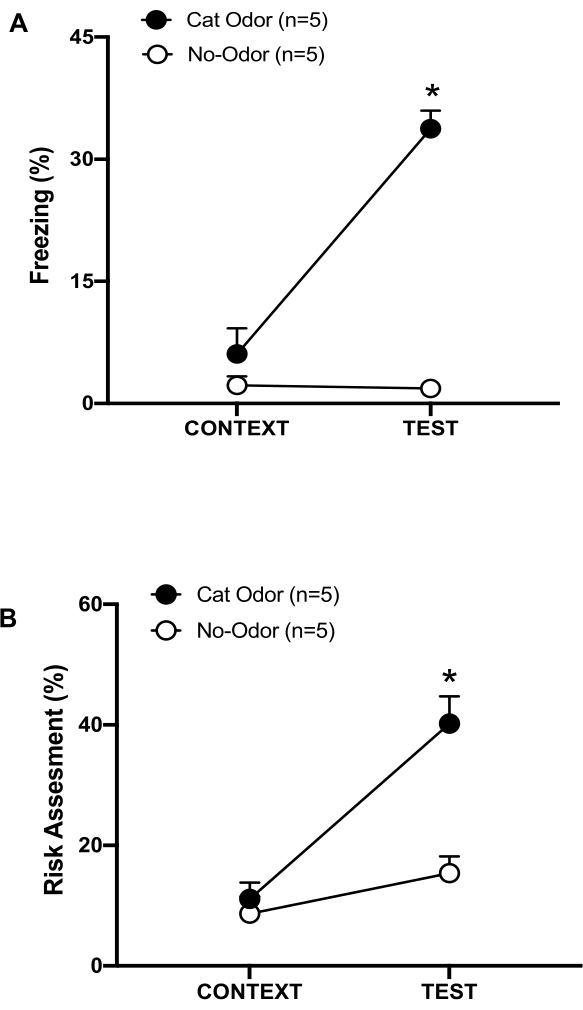
Figura 3: L'incontro con l'odore del gatto aumenta i comportamenti difensivi innati. (A, B) I ratti sono stati prima esposti alla familiare camera di prova (CONTESTO) per 10 minuti e poi esposti a un collare con odore di gatto (gruppo odoroso di gatto, cerchi neri) o senza odore di gatto (gruppo senza odore, cerchi aperti) per un ulteriore periodo di 10 minuti (TEST) nello stesso contesto. I cerchi mostrano la percentuale di tempo trascorso nel congelamento (B) e nella valutazione del rischio (C) mostrata dai ratti naïve. I dati sono espressi come medie +SEM. *p < 0,05. Questa cifra è stata modificata da 8. Clicca qui per visualizzare una versione più grande di questa figura.
- Posiziona una videocamera davanti alla camera di prova e registra il comportamento dell'animale per un successivo punteggio comportamentale da parte di uno sperimentatore cieco alle condizioni sperimentali.
- Al termine della sessione sull'odore del gatto, riporta gli animali nelle gabbie di casa e rimettili nella struttura per animali fino alla sessione successiva.
- Pulire la camera di prova con etanolo al 5% (v/v) tra una sessione e l'altra.
- Ventiquattro ore dopo la sessione sull'odore di gatto (Giorno 1), valutare le risposte difensive al contesto del test.
- Se necessario, ripetere il passaggio 4.2 prima dell'esposizione al contesto.
- Riporta i ratti nella stessa camera di prova con il collare familiare non indossato e assegna un punteggio per i comportamenti difensivi per misurare la memoria contestuale della minaccia durante 10 minuti (Figura 4).
- Posiziona una videocamera davanti alla camera di prova e registra il comportamento dell'animale per un successivo punteggio comportamentale da parte di uno sperimentatore cieco alle condizioni sperimentali.
- Durante i successivi 10 minuti, sostituisci il collare familiare non indossato, esponi nuovamente l'animale a un collare con odore di gatto e misura i comportamenti difensivi.
- Dopo la seconda esposizione all'odore di gatto, riportare l'animale nella sua gabbia di casa e pulire la camera di prova con etanolo al 5% (v/v). Rimetti il topo nella struttura per animali.
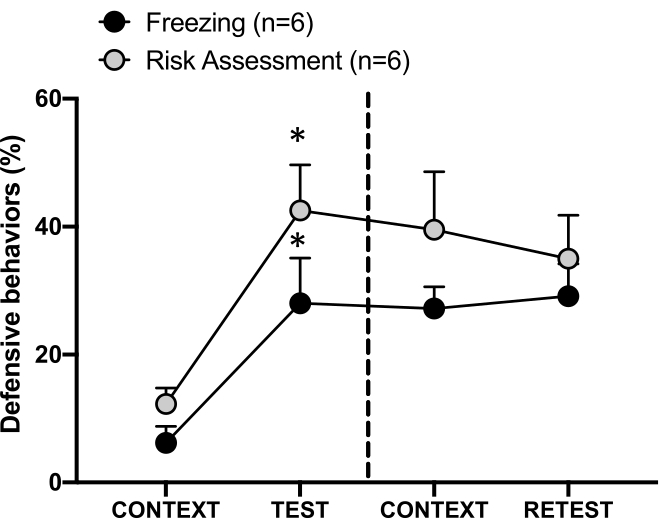
Figura 4: L'incontro con l'odore del gatto induce l'apprendimento contestuale della minaccia. I cerchi mostrano la percentuale di tempo trascorso nel congelamento (cerchi neri) e il comportamento di valutazione del rischio (cerchi grigi). La linea tratteggiata separa il test della paura innata (Giorno 0, a sinistra) dal test della paura contestuale (Giorno 1, a destra). I dati sono espressi come medie + SEM. *p < 0,05. Questa cifra è stata modificata da 8. Clicca qui per visualizzare una versione più grande di questa figura.
5. Procedure immunoistochimiche
- Anestetizzare l'animale con una miscela intraperitoneale di ketamina (0,45 mg/kg) e xilazina (0,05 mg/kg) 90 minuti dopo aver completato gli esperimenti. Quindi, sopprimere il ratto mediante perfusione transcardica con paraformaldeide al 4%.
NOTA: Se è necessario valutare la prima esposizione all'odore del gatto, la risposta condizionata al contesto o la riesposizione all'odore del gatto, eseguire questo passaggio dopo ciascuna di queste situazioni sperimentali. Indossare guanti e camice da laboratorio e maneggiare con cura la paraformaldeide sotto una cappa chimica. - Dopo la perfusione, fissare il cervello nella stessa soluzione fissativa per 2 ore e poi trasferirlo al saccarosio al 30% con sodio azide allo 0,02% in soluzione salina tamponata con fosfato (PBS) fino a quando il cervello non affonda sul fondo. Conservare il cervello a 4 °C.
- Congelare il cervello con ghiaccio secco e tagliarlo in sezioni coronali seriali spesse 50 μm su un microtomo scorrevole. Raccogliere tre serie di sezioni cerebrali dell'area di interesse, lasciandone una per la verifica del posizionamento della cannula e due serie per la procedura immunoistochimica.
- Incubare le sezioni cerebrali libere in 0,3% H2O2 in PBS per 30 minuti, lavare in PBS e trasferire queste sezioni nella soluzione bloccante (Triton X-100 0,4%, azoturo di sodio 0,02%, siero di capra normale al 3% in PBS) per 1 ora.
- Trasferire le sezioni nella soluzione di incubazione dell'anticorpo primario contenente l'anticorpo c-Fos diluito 1:20.000 in soluzione bloccante e lasciarle per una notte a temperatura ambiente.
- Sciacquare le sezioni in PBS per 1 ora e poi incubarle nella soluzione di anticorpi secondari diluita 1:1.000 in Triton X-100 allo 0,4% e siero di capra normale all'1,5% in PBS.
- Sciacquare le sezioni per 40 minuti e incubarle per 1 ora nel sistema perossidasi a base di avidina/biotina (vedi Tabella dei Materiali), diluito 1:500 in PBS.
- Sciacquare e incubare le sezioni in una soluzione allo 0,05% di 3-3′ diaminobenzidina cloridrato (DAB) contenente lo 0,003% di H2O2 e lo 0,05% di cloruro di nichel per ottenere un prodotto di reazione blu scuro.
6. Conteggio delle cellule
- Esaminare le sezioni sotto una camera lucida utilizzando un obiettivo a bassa potenza (10x) per localizzare la colorazione puntiforme c-Fos nei nuclei dei neuroni (Figura 5).
- Utilizzare una griglia di conteggio correlata alle dimensioni dell'area di interesse. Per il pIC, ad esempio, da Bregma 0,95 a -0,26, utilizzare una griglia di conteggio da 0,25 mm x 1 mm; da Bregma -0,51 a -2,45 mm, utilizzare una griglia di conteggio da 0,5 mm x 1 mm.
- Quantificare il numero di cellule immunoreattive c-Fos (Fos-ir) per sezione utilizzando un contatore manuale numerico.
- Contare due volte tutte le sezioni coronali di interesse e assicurarsi che lo stesso osservatore, cieco alle condizioni sperimentali, esegua il conteggio.
- Scatta una fotografia usando un microscopio accoppiato con una fotocamera digitale.
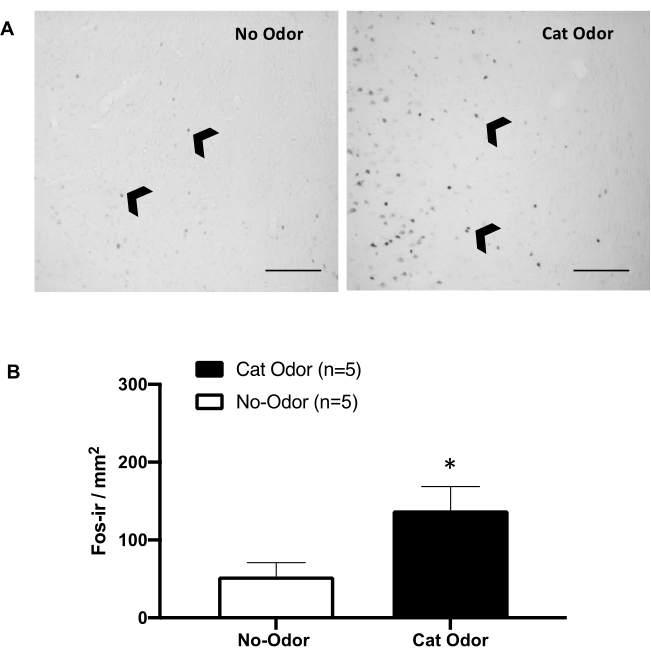
Figura 5: L'odore di gatto suscita l'attivazione neuronale nella corteccia interocettiva primaria. (A) Micrografia fotografica rappresentativa del pIC che mostra una quasi assenza di cellule c-Fos-ir (punte di freccia nere) nei ratti esposti a un collare di gatto non indossato (nessun odore, a sinistra) rispetto a un numero notevolmente aumentato di cellule c-Fos-ir nei ratti esposti all'odore di gatto (a destra). (B) Quantificazione di cellule c-Fos-ir nel pIC in entrambe le condizioni sperimentali. I dati sono espressi come medie + SEM. *p < 0,05. Barre di scala = 200 μm. Questa cifra è stata modificata da 8. Abbreviazioni: pIC = corteccia interocettiva primaria; c-fos-ir = c-Fos-immunoreattivo. Clicca qui per visualizzare una versione più grande di questa figura.
7. Analisi dei dati
- Assegna un punteggio ai comportamenti difensivi dagli esperimenti videoregistrati e analizzali utilizzando un software statistico.
- Valutare il congelamento cronometrando gli attacchi, espressi come percentuale del tempo trascorso a congelare durante 10 minuti. Calcolare la percentuale di congelamento utilizzando l'Eq (1).
Congelamento = (secondi trascorsi a congelare/600 s) × 100 (1)
NOTA: Il congelamento è stato definito come la completa mancanza di movimento ad eccezione della respirazione per almeno 1 s28. - Assegna un punteggio alla valutazione del rischio cronometrando i periodi di scansione vigile ed esprimilo come percentuale del tempo trascorso nella valutazione del rischio durante 10 minuti. Calcolare la percentuale di valutazione del rischio utilizzando l'Eq (2).
% Valutazione del rischio = (secondi spesi nella valutazione del rischio/600 s) × 100 (2)
NOTA: Il comportamento di valutazione del rischio è stato definito come scansione vigile (osservatorio, movimenti laterali della testa, senza locomozione) per almeno 1 s29. - Assegna un punteggio manuale a questi parametri comportamentali e assicurati che vengano conteggiati da uno sperimentatore all'oscuro delle condizioni sperimentali (ad esempio, odore e condizioni del farmaco). A seconda della normalità dei set di dati, utilizzare test parametrici o non parametrici per confrontare due o più gruppi.
NOTA: In questo studio, tutti i test statistici sono stati eseguiti utilizzando il software SPSS.- Utilizzare il test H di Kruskal-Wallis con il test U di Mann-Whitney per confronti a coppie tra gruppi.
- Analizza i confronti intragruppo nel tempo con il test di Friedman seguito dal test di Wilcoxon con rango firmato per confronti a coppie.
NOTA: In tutte le cifre, i livelli di significatività sono stati fissati a p < 0,05 (*) e p < 0,01 (**).
- Per l'analisi dell'espressione di c-Fos in specifiche aree cerebrali, contare il numero di cellule c-Fos-positive per sezione calcolando la densità delle cellule c-Fos-ir per mm2 e confrontare il numero medio tra le condizioni di controllo (nessun odore) e stimolate (odore di gatto).
- A seconda della normalità dei dati, utilizzare il test t dello studente non accoppiato o il test U di Mann-Whitney.
NOTA: In questo studio è stato utilizzato il test U di Mann-Whitney; Le differenze sono state considerate significative se P < 0,05 (*).
- A seconda della normalità dei dati, utilizzare il test t dello studente non accoppiato o il test U di Mann-Whitney.
Risultati
In questo protocollo, le percentuali di congelamento e di valutazione del rischio sono state misurate rispettivamente come indicatori di stati di paura e ansia nei ratti. La cronologia del disegno sperimentale è mostrata nella Figura 2. I risultati degli animali esposti all'odore di gatto il giorno 0 sono presentati nella Figura 3. I ratti hanno mostrato livelli significativamente più elevati di congelamento (Figura 2A, Gruppo di odore di gatto, test di Wilcoxon Signed-ranks, Z = -2,201, p = 0,028) e di valutazione del rischio (Figura 2B, Gruppo di odore di gatto, test di Wilcoxon Signed-ranks Z = -2,336 p = 0,018) in risposta all'odore di gatto (TEST) rispetto al contesto familiare (CONTEXT). Bassi livelli di congelamento (Figura 2A, gruppo senza odore, test Wilcoxon Signed-ranks, Z = -0,184, p = 0,854) e valutazione del rischio (Figura 2B, gruppo senza odore, test Wilcoxon Signed-ranks, Z = -1,753, p = 0,08) sono stati osservati nei ratti esposti a un collare non indossato durante la seconda parte del test.
Ulteriori analisi hanno rivelato che i livelli di congelamento (Figura 2A, test di Mann-Whitney, U = 0,000, p = 0,004) e di valutazione del rischio (Figura 2B, test di Mann-Whitney, U = 4,000, p = 0,025) erano più alti nel gruppo Cat Odor rispetto al gruppo senza odore durante la seconda parte del test. Non ci sono state differenze significative nel congelamento (Figura 2A, test di Mann-Whitney, U = 11.000, p = 0,256) e nella valutazione del rischio (Figura 2B, test di Mann-Whitney, U = 15,00, p = 0,627) tra i due gruppi durante i primi 10 minuti di esposizione a un contesto familiare (CONTEXT). Questi risultati dimostrano che il protocollo è adatto per testare comportamenti difensivi in risposta all'odore di pelo/pelle di gatto.
La risposta condizionata alla minaccia al contesto di test (CONTEXT) il giorno 1 è illustrata nella Figura 4. I ratti esposti all'odore di gatto sono stati riportati nella camera di prova 24 ore dopo il primo incontro con l'odore del predatore. Il giorno 1, gli animali hanno mostrato livelli di congelamento (test Wilcoxon Signed-ranks, Z = -2,366, p = 0,018) e di valutazione del rischio (test Wilcoxon Signed-ranks, Z = -2,201, p = 0,028) in risposta al contesto del test rispetto al giorno 0. Inoltre, non ci sono state differenze nei livelli di congelamento (Wilcoxon Signed-ranks test, Z = -0,841, p = 0,400) o di valutazione del rischio (Wilcoxon Signed-ranks test, Z = -0,943, p = 0,345) tra CONTEXT e RETEST. I ratti hanno mostrato gli stessi livelli di congelamento (test Wilcoxon Signed-ranks, Z = -0,105, p = 0,917) e valutazione del rischio (Wilcoxon Signed-ranks test, Z = -0,980, p = 0,327) durante RETEST e TEST. Questi risultati hanno dimostrato che una singola esposizione di 10 minuti all'odore di pelo/pelle di gatto ha portato a una risposta di minaccia appresa al contesto in cui gli animali si sono confrontati con l'odore del predatore.
La Figura 5 e la Figura 6 mostrano due serie di esperimenti che utilizzano il protocollo presentato in questo articolo. Abbiamo testato se la corteccia interocettiva primaria (pIC), una regione del cervello coinvolta nell'elaborazione delle emozioni 8,30,31,32, è necessaria per l'espressione dei comportamenti difensivi. L'attivazione neuronale indotta dall'odore del gatto è stata valutata nel pIC contando le cellule c-Fos-ir in gruppi di animali separati: condizioni di assenza di odore e odore di gatto. Questi ratti sono stati soppressi 90 minuti dopo il completamento del TEST. Un aumento significativo è stato osservato nel numero di neuroni c-Fos-ir nel pIC nel gruppo dell'odore del gatto (test di Mann-Whitney, U = 3.000, p = 0.016) rispetto al gruppo di controllo (Figura 5).
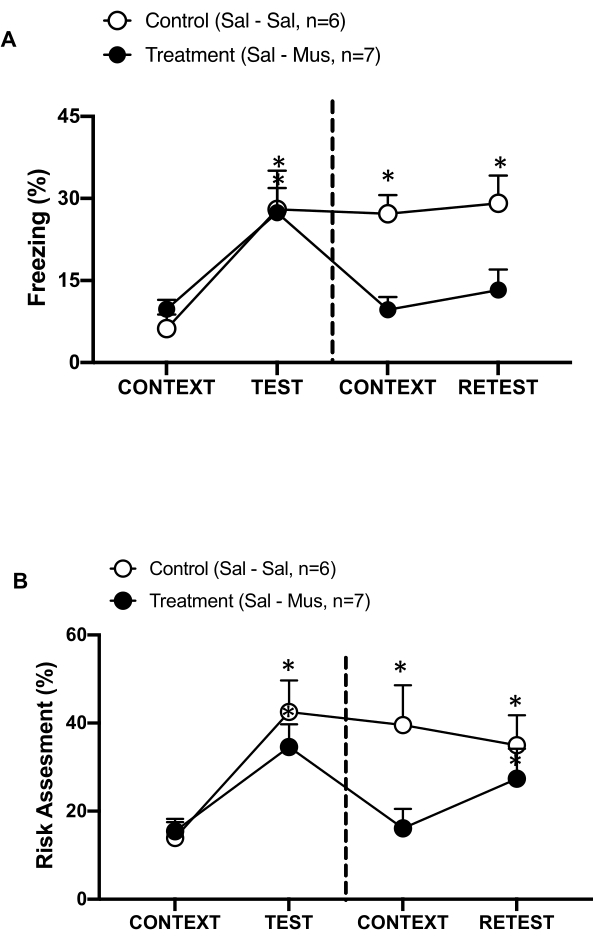
Figura 6: L'inattivazione del moscimolo della corteccia interocettiva primaria compromette la memoria contestuale della minaccia. (A, B) Al gruppo di trattamento è stata iniettata soluzione fisiologica il giorno 0 e muscimolo il giorno 1 nel pIC (Gruppo di trattamento). Ai ratti di controllo è stata iniettata soluzione salina nel pIC in entrambi i giorni. Il giorno 1, gli animali sono stati riportati nella familiare camera di prova ed esposti al CONTESTO per 10 minuti e riesposti all'odore di gatto (RETEST) per un ulteriore periodo di 10 minuti. I cerchi mostrano la percentuale di tempo trascorso nel congelamento (cerchi neri) e il comportamento di valutazione del rischio (cerchi aperti). La linea tratteggiata separa il test della paura innata (Giorno 0, a sinistra) dal test della paura contestuale (Giorno 1, a destra). I dati sono espressi come medie + SEM. *p < 0,05. Questa cifra è stata modificata da 8. Abbreviazioni: pIC = corteccia interocettiva primaria; Sal-Sal = soluzione salina iniettata il giorno 0 e il giorno 1; Sal-Mus = soluzione salina iniettata il giorno 0 e muscimolo il giorno 1. Clicca qui per visualizzare una versione più grande di questa figura.
Abbiamo anche misurato l'effetto dell'inattivazione del muscimolo del pIC sulla memoria contestuale della minaccia (Figura 6). Il gruppo di trattamento (ratti sal-mus) ha ricevuto un'iniezione di soluzione salina nel pIC il giorno 0 e il muscimolo agonista GABA-A il giorno 1. Questo gruppo di animali non ha mostrato alcuna differenza nei livelli di congelamento (Figura 6A, Wilcoxon Signed-ranks test, Z = -0,140, p = 0,889) o di valutazione del rischio (Figura 6B, Wilcoxon Signed-ranks test, Z = -0,700, p = 0,484) il giorno 1 in risposta al contesto familiare rispetto al giorno 0, indicando una compromissione della memoria contestuale della minaccia. È interessante notare che il congelamento (Figura 6A, Wilcoxon Signed-ranks test, Z = -2,100, p = 0,036), ma non la valutazione del rischio (Figura 6B, Wilcoxon Signed-ranks test, Z = -0,980, p = 0,327), è stato significativamente ridotto durante il RETEST rispetto al TEST. Quest'ultima scoperta indica che il silenziamento del pIC il giorno 1 ha compromesso selettivamente la risposta di paura, ma non di ansia, all'odore del predatore. Nel loro insieme, questi risultati supportano che il protocollo sperimentale sopra descritto è adatto per lo studio delle risposte difensive innate e apprese alle minacce predatorie.
Discussione
Il protocollo qui descritto offre un approccio innovativo per valutare i comportamenti difensivi evocati da stimoli avversivi innati e appresi. Una camera di prova senza un'area di nascondiglio sicura (Figura 1) e un collare impregnato di odore di pelle/pelo di una femmina di gatto domestico ovariectomizzato sono stati utilizzati per suscitare uno stato di minaccia forte e prolungato nei ratti che può essere utile per studiare i circuiti neurali alla base delle reazioni difensive adattative e disadattive.
È noto che l'esibizione di specifiche reazioni difensive dipende dalle caratteristiche sia dello stimolo di minaccia che della situazione/ambiente in cui l'animale si incontra21,33. L'evitamento, la valutazione del rischio e il congelamento fanno parte di un vasto repertorio di reazioni difensive degli animali che possono essere evocate da stimoli minacciosi 9,19. Tuttavia, la selezione della reazione difensiva predominante dipende dalle condizioni ambientali come la distanza dalla minaccia33 o la presenza di un luogo sicuro all'interno della camera di prova21,33. Ad esempio, quando i ratti vengono collocati nell'arena con un nascondiglio, in presenza di odore di gatto, mostrano comportamenti difensivi come posture di allungamento/attenzione, scatola con la testa fuori dalla pelle e evitamento 6,24,25. Al contrario, il comportamento di congelamento, la scansione vigile e le posture di allungamento/attenzione sono fortemente stimolati in situazioni in cui la fuga non è possibile e la distanza dalla minaccia non è eccessivamente breve33,34.
Gli studi hanno dimostrato che l'esposizione a un fattore di stress incontrollabile produce una varietà di conseguenze comportamentali diverse da quelle che si verificano quando il fattore di stress è controllabile 35,36,37,38. Ad esempio, lo shock della coda inevitabile, ma non evitabile, porta a un grande aumento della serotonina nel nucleo del rafe dorsale35 e comportamenti ansiosi misurati 24 ore dopo l'esperienza avversiva36. Inoltre, i fattori di stress incontrollabili aumentano il condizionamento della paura negli animali36,37 e negli esseri umani38. La nostra logica iniziale per lo sviluppo del protocollo era quella di esporre i ratti a una situazione in cui non possono controllare lo stimolo avversivo, e quindi mostrare risposte di minaccia forti e sostenute e sviluppare un apprendimento contestuale migliorato dopo una singola e breve esposizione all'odore di gatto.
Nel disegno sperimentale qui descritto, l'assenza di un nascondiglio ha evocato uno stato difensivo forte e prolungato che alternava comportamenti di congelamento (cioè completa immobilità tranne la respirazione28) e di valutazione del rischio (cioè scansione vigile e posture di allungamento/attenzione29), che sono solitamente considerati come manifestazioni comportamentali di stati di paura e ansia nei roditori, rispettivamente (Figura 3). In particolare, lo stesso modello di reazioni difensive si è verificato 24 ore dopo, quando i ratti sono stati riesposti al contesto di test, indicando che una singola esposizione di 10 minuti all'odore di pelo di gatto/pelle è sufficiente per indurre un apprendimento contestuale della minaccia di lunga durata, come precedentemente riportato 7,10,11,14,15,34,39 (Figura 4).
Un collare per gatti con una fodera interna in feltro è stato utilizzato per raccogliere e intrappolare odori/profumi in modo efficiente e ottenere così un campione affidabile dello stimolo di minaccia per evocare una forte risposta difensiva. I ricercatori hanno utilizzato stimoli avversi come le feci di gatto, l'urina o la trimetiltiazolina (TMT, un componente delle feci di volpe) in lavori simili. Tuttavia, questi stimoli sembrano essere meno predittivi della presenza immediata di un predatore perché sono meno in grado di indurre l'apprendimento contestuale 40,41. Secondo i risultati precedenti 2,4,8,9,10,11,20,34,39, l'odore del gatto è uno stimolo avversivo innato affidabile che può indurre reazioni difensive sostenute e memoria della minaccia contestuale nei ratti. Nel corso degli anni, questo tipo di modello animale comportamentale etologico ha catturato sempre più l'interesse dei ricercatori per studiare lo stress e i disturbi correlati allo stress 13,14,15,16,17,23,42 come quelli associati a ricordi di paura disadattivi come il PTSD.
Questo protocollo è destinato ad essere utilizzato in combinazione con una varietà di tecniche sperimentali, tra cui, ad esempio, approcci di biologia molecolare e cellulare e l'elettrofisiologia in animali svegli e comportabili, che offrono l'opportunità di rispondere a domande aperte e migliorare la nostra comprensione delle risposte adattive e disadattive alle minacce. In questo studio, abbiamo testato l'idea che il pIC, una regione del cervello coinvolta nell'elaborazione delle emozioni, sia necessario per l'espressione dei comportamenti difensivi. Gli esperimenti comportamentali sono stati accoppiati con l'immunoistochimica c-Fos per mappare i modelli di attività neuronale nel pIC in risposta all'odore del gatto e le infusioni intracerebrali dell'agonista del recettore GABA-A, il muscimolo, per silenziare reversibilmente il pIC e determinare il suo coinvolgimento nelle reazioni di minaccia innate e apprese all'odore del predatore. Questi risultati hanno rivelato che l'odore del gatto ha suscitato un aumento dell'attività neuronale nel pIC (Figura 5) e che il silenziamento del pIC ha portato a un grave deficit di memoria della minaccia contestuale (Figura 6).
Sebbene il protocollo qui descritto sia tecnicamente semplice da implementare ed eseguire, possono sorgere alcune complicazioni. Ad esempio, può verificarsi una contaminazione incrociata dell'odore del gatto se il collare non indossato entra in contatto con il collare del gatto indossato. Pertanto, i collari devono essere tenuti separati durante tutte le procedure e i guanti devono essere cambiati dopo aver posizionato il collare indossato nella camera di prova. Se lo sperimentatore desidera condurre condizioni di odore e non odore utilizzando la stessa camera di prova, gli esperimenti devono essere eseguiti in giorni diversi. Per questi esperimenti potrebbero essere utilizzate due camere di prova identiche34 e i ratti dovrebbero essere tenuti in stanze separate per evitare la comunicazione sociale43. Anche lo stress suscitato dall'esposizione a nuovi stimoli in ambienti non familiari può essere un problema. Pertanto, gli animali devono avere almeno tre giorni di abitudine all'ambiente di prova e alle procedure per ridurre lo stress e la difensiva comunemente mostrati dai ratti in situazioni nuove. Inoltre, il tempo necessario per il periodo di assuefazione dovrebbe essere più lungo del periodo di prova. Ad esempio, se il test dura 10 minuti, 20 o 30 minuti dovrebbero essere assegnati per il periodo di assuefazione.
Infine, i comportamenti difensivi dovrebbero essere valutati preferibilmente durante la fase oscura del ciclo, quando i ratti sono attivi. I ratti devono essere mantenuti sotto un ciclo inverso luce/buio per consentire l'esecuzione delle procedure sperimentali mentre sia il ratto che lo sperimentatore sono nelle loro fasi attive34. Il cambiamento nel ciclo luce/buio non richiede più di 10 giorni per essere risolto e, in base all'esperienza, la maggior parte dei ratti in questa condizione risponde adeguatamente all'odore del gatto. Tuttavia, ci sono alcuni studi che dimostrano che i ratti Sprague-Dawley sono meno vulnerabili al condizionamento della minaccia e all'ansia di lunga durata rispetto ai ratti Wistar44. Pertanto, è possibile che l'uso di ratti Wistar invece di ratti del ceppo Sprague-Dawley possa produrre risultati più robusti.
In conclusione, l'odore di gatto è uno stimolo minaccioso etologicamente rilevante che suscita risposte neuronali, endocrine e comportamentali affidabili nei ratti. L'incontro con l'odore del gatto in una camera ineluttabile porta a una risposta di paura/ansia robusta e prolungata nei ratti, che si traduce in un apprendimento contestuale della minaccia rapido e duraturo. Il protocollo sopra descritto potrebbe essere uno strumento utile per studiare la paura e i meccanismi di codifica adattiva e disadattiva della memoria delle minacce.
Divulgazioni
Gli autori di questo manoscritto non hanno interessi finanziari concorrenti o altri conflitti di interesse da rivelare.
Riconoscimenti
Gli autori ringraziano Marcela Gonzalez per l'aiuto con le procedure di laboratorio, Mabel Matamala per aver contribuito alla progettazione del protocollo e Miguel Rojas per l'aiuto con l'illustrazione.
Materiali
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
Riferimenti
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682 (2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283 (2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J., Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. , 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, 45 (2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16 (2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91 (2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1997).
- Swanson, L. W. . Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377 (1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292 (2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132 (2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041 (2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon