Method Article
Sıçanlarda Doğuştan Gelen ve Bağlamsal Tehdit Koşullandırmasını İncelemek için Kaçınılmaz Bir Kedi Kokusuna Maruz Kalma Protokolü
Bu Makalede
Özet
Kedi derisi/kürk kokusuna maruz kalma, kemirgenlerde nöral devreleri ve savunma tepkilerinin mekanizmalarını araştırmak için güvenilir bir yöntem sağlar ve insanlarda korkuya aracılık eden mekanizmalar hakkında fikir verebilir. Burada, sıçanlarda tehdit tepkilerinde interoseptif korteksin rolünü araştırmak için bir protokol açıklıyoruz.
Özet
Hayvanlar, kaçınma, dondurma ve risk değerlendirmesi dahil olmak üzere bir dizi savunma davranışı sergileyerek tehdit edici durumlara tepki verir. Etolojik bir yaklaşıma sahip bir hayvan modeli, tehdit tepkilerinin altında yatan biyolojik mekanizmalar hakkında daha derin bir anlayış sunar. Bu makale, sıçanlarda hem doğuştan gelen hem de öğrenilmiş caydırıcı uyaranlara karşı savunma davranışlarını ölçmek için bir metodolojiyi açıklamaktadır. Hayvanlar, ölçülebilir, sürekli, savunma durumunu ortaya çıkarmak için kaçınılmaz bir odada bireysel olarak avcı kokusuna maruz bırakıldı. Deneysel tasarım, bir fareyi 10 dakika boyunca tanıdık bir odaya yerleştirmeyi ve ardından aynı bağlamda 10 dakika daha kedi kokusuna maruz bırakmayı içeriyordu. Ertesi gün, sıçanlar 10 dakika boyunca kedi kokusuna maruz kalmanın meydana geldiği aynı bağlam odasına tekrar maruz bırakıldı. Oturumlar videoya kaydedildi ve her iki günde de savunma davranışları değerlendirildi.
Davranışsal test, tehdit yanıtlarında interoseptif korteksin rolünü belirlemek için geri dönüşümlü fonksiyonel inaktivasyon ve c-Fos immünohistokimya teknikleri ile birleştirildi. İlk gün kedi kokusuna maruz kalan ve ikinci gün bağlam odasına tekrar maruz kalan sıçanlar, daha yüksek düzeyde savunma davranışları sergiledi ve bu kedi kokusu, interoseptif korteksin nöral aktivitesinde güçlü bir artış ortaya çıkardı. Ayrıca, interoseptif korteksin muscimol inaktivasyonu, kedi kokusuna yanıt olarak savunma davranışlarının ifadesini azalttı ve bağlamsal tehdit hafızasını bozdu. Bu sonuçlar, bu davranışsal tahlilin, savunma davranışlarının sinirsel mekanizmalarını incelemek için yararlı bir araç olduğunu ve insanlarda ve bununla ilgili bozukluklarda korkuya aracılık eden mekanizmalar hakkında fikir verebileceğini göstermektedir.
Giriş
Savunma davranışları, bir hayvanın hayatta kalması için potansiyel bir tehdide işaret eden uyaranlara yanıt olarak ortaya çıkar. Bu davranışlar memeliler arasında yüksek oranda korunur ve tehdit 1,2,3 ile ilgili uyaranlar veya durumlarla hızla ilişkilidir. Doğada, çoğu hayvan için tehdit edici uyaranlar yırtıcı hayvanlardır; Bu nedenle, koku ipuçları gibi yırtıcı ipuçlarının tespiti, avlanmayı önlemek için özellikle avantajlıdır. Yırtıcı hayvan ipuçlarına verilen davranışsal tepkiler kemirgenlerde geniş çapta araştırılmıştır.
Örneğin, doğal kedi kürkü veya deri kokuları gibi uyaranlar, koku alma ve vomeronazal sistemi harekete geçirerek yüksek düzeyde savunma davranışlarına neden olur4. Bu uyaranlara nöronal ve endokrin aktivitedekideğişiklikler eşlik eder 5,6,7,8 ve sıçanlarda bağlamsal tehdit koşullandırması için güçlü, koşulsuz, caydırıcı uyaranlardır 7,8,9,10,11. Araştırmalar, doğal yırtıcı ipuçlarına maruz kaldıktan en az 24 saat sonra, sıçanların sağlam ve uzun süreli koşullu anksiyete benzeri durumlar sergilediğini göstermiştir 7,12,13. Bu fenomen, travma sonrası stres bozukluğu (TSSB)14,15,16,17, yaygın anksiyete bozukluğu (YAB)5 ve panik bozukluğu (PD)18,19'un daha gerçekçi modellerini geliştirmek için özellikle ilgi çekicidir.
Laboratuvar ortamlarında, korku davranışı uçuş, kaçınma (örneğin, geri çekilme, saklanma) veya donma olarak ölçülür. Ek olarak, kaygı, yırtıcı bir uyaranın izlenmesine yönelik gergin duruşlar ve uyanık tarama olarak ölçülebilir - genel olarak risk değerlendirme davranışları olarak bilinen bir dizi yanıt 6,9,20. Çalışmalar, donma davranışının sıçanlarda kaçınılmaz bir tehdide karşı baskın savunma stratejisi olduğunu, oysa risk değerlendirmesinin tehdit belirsiz veya lokalize olmadığında gözlendiğini göstermiştir 12,21,32. Doğuştan gelen veya öğrenilmiş bir uyaranın savunma davranışlarını ortaya çıkarabileceği bilinmesine rağmen, daha etolojik bir bağlamda savunma tepkilerini güvenilir bir şekilde yakalayan laboratuvar davranış paradigmalarının eksikliği vardır. Bu boşluğu doldurmak için, doğal tehdit uyaranlarına beyin tepkilerinin yanı sıra sürekli doğuştan gelen ve bağlamsal tehdit davranışlarının ölçülmesine izin veren etolojik bir yaklaşıma sahip bir protokol tasarladık.
Kaçınılmaz bir avcı kokusuna maruz kalma gibi stresli deneyimler, sıçanlarda davranışsal ve fizyolojik tepkide kalıcı değişikliklere neden olur 14,22,23. Bu değişiklikler, TSSB gibi korku ve kaygı ile ilgili bozukluklarda gözlenen semptom profilini yansıtır. Mevcut modelde, fareleri kaçınılmaz bir tehdit olayına maruz bırakmak ve böylece savunma tepkilerini geliştirmek için güvenli bir saklanma alanı olmayan bir test odası kullanılmaktadır. Sıçanlar, hem kedi kokusuna hem de test bağlamına yanıt olarak sağlam dondurma ve risk değerlendirme davranışları sergiledi. Bu bulgular, bu protokolün, savunma davranışlarının altında yatan biyolojik mekanizmaları keşfetmek ve insanlarda korku bozukluklarının tedavisi için yeni stratejiler geliştirmek ve iyileştirmek için güvenilir ve geçerli bir yöntem olarak kullanılmasını desteklemektedir.
Protokol
Aşağıdaki prosedür, Ulusal Sağlık Enstitüleri (ABD) Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzu (NIH Yayın No. 80-23, 1996'da revize edilmiştir) tarafından hazırlanan Kurumsal kılavuzların tavsiyelerine göre gerçekleştirilmiştir. Pontificia Universidad Católica de Chile'deki Kurumsal Biyo-Güvenlik ve Etik Komitesi tüm prosedürleri onayladı. Tüm deney oturumları, sıçanın aktif fazı (karanlık faz) sırasında gerçekleştirildi.
1. Sınav odasının ve sınav odasının hazırlanması
NOT: Cihazın üzerindeview Şekil 1'de gösterilmiştir. Test odası, önceki çalışmalara göre geliştirilmiş ve modifiye edilmiştir 24,25.
- Aşağıdaki boyutlara sahip şeffaf dikdörtgen bir poli (metil metakrilat) test odası kullanın: 60 cm (uzunluk) x 40 cm (genişlik) x 40 cm (yükseklik). Test odasının yan ve arka duvarlarını herhangi bir siyah kağıtla örtün. Hayvanların davranışlarını kaydetmek için test odasının ön tarafının şeffaf olduğundan emin olun.
- Test odasının sağ alt köşesindeki zemine çelik bir braket sabitleyin ve test prosedürleri için kedi tasmalarını takmak için kullanın.
- Denek sıçanların bıraktığı koku ipuçlarını gidermek ve sıçanın kaçınma tepkisini önlemek için testlerden önce ve sonra test odasını %5 (h/h) etanol ile temizleyin. Etanolün tamamen buharlaşması için her seans arasında 5 dakika bekleyin.
- Test oturumunu, test odasının 20 cm yukarısında bulunan 80 W kırmızı ampulle loş bir şekilde aydınlatılan sessiz bir odada gerçekleştirin. Hayvanların davranışlarını kaydetmek için odanın önünde bulunan bir video kamera kullanın.
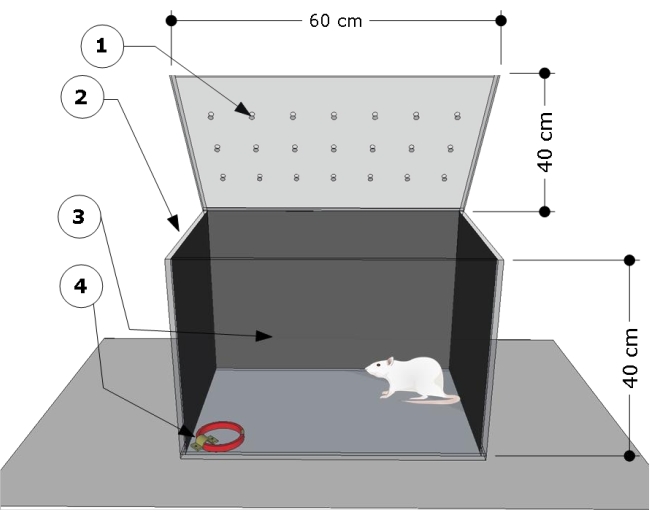
Şekil 1: Test odasının şematik genel görünümü. Cihaz, aşağıdakilere sahip bir test bölmesinden oluşur: (1) havalandırma delikleri, (2) yan ve (3) arka duvarlar karartılmış ve kedi tasmasını takmak için sol köşe zemininde kilitli çelik bir braket (4) (boyutlar: genişlik 15 mm, kalınlık 5 mm, uzunluk 300 mm). Hazne boyutları karikatürde belirtilmiştir (60 U x 40 G x 40 Y cm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. Kedi kokusu hazırlama
- Kedi kokusunu daha iyi hapsetmek için keçe astarlı iç yüze sahip bir kedi tasması edinin. Kontrol tasması (koku yok) veya test tasması (kedi kokusu) olarak kullanım için birkaç tasmanın mevcut olduğundan emin olun.
NOT: Önemli olan nokta, kedi tasmasının kokuları toplamak ve hapsetmek için bir iç astara sahip olması gerektiğidir. - Evcil yumurtalıklı bir dişi kediye bir tasma takın ve testten önce kedinin tasmayı bir hafta boyunca takmasına izin verin. Test tasmasını takarken dişi kediyi içeride tutmaya çalışın.
NOT: Çalışma boyunca aynı kediyi kullanın. - Yıpranmış kedi tasmasını hava geçirmez plastik bir kapta saklayın ve 4 °C'de saklayın. Yıpranmış kedi tasmasını her üç günde bir taze kedi kokusu içeren bir tasma ile değiştirin.
3. Deney prosedürü için sıçanların hazırlanması
- 270-290 g ağırlığındaki yetişkin erkek Sprague-Dawley sıçanlarını kullanın. Onları, ad libitum olarak mevcut olan yemek ve su ile ayrı kafeslere koyun.
- [İsteğe bağlı] Sıçanların cerrahi prosedür için hazırlanması (isteğe bağlı)
- Ameliyatı steril koşullar altında gerçekleştirin. Çalışma alanını %70 etanol çözeltisi ile temizleyin ve dezenfekte edin ve tüm cerrahi malzemeleri ve aletleri sterilize edin.
- Sıçanı intraperitoneal ketamin (100 mg / kg) ve ksilazin (20 mg / kg) karışımı ile uyuşturun. Sıçan bir ayak parmağı sıkışma uyaranına veya kornea stimülasyonuna yanıt vermediğinde uygun anestezi düzlemi elde edilene kadar bekleyin. Ameliyat boyunca anestezi durumunu korumak için, her 45 dakikada bir ek bir doz anestezik kokteyl uygulayın.
- Sıçanın kafasını kulağın arkasından gözlerin arasına kadar nazikçe tıraş edin ve cerrahi alanı steril bir alkol hazırlama pedi ve ardından bir povidon-iyot çözeltisi ile dezenfekte edin. Cerrahi işlem sırasında kornea kurumasını önlemek için kayganlaştırıcı göz merhemi sürün.
- Fareyi stereotaksik bir cihaza yerleştirin ve kulak çubuklarını kulak kanallarına uygun şekilde yerleştirerek başını tutun. Ardından, farenin kesici dişlerini kesici kola nazikçe yerleştirin ve burun kelepçesini sabitleyin.
- Stereotaksik tutucuya steril bir 26 G paslanmaz çelik kılavuz kanül yerleştirin. Bir neşter alın ve kafa derisi boyunca orta hat kesisi yapın. Kesiğin etrafına 2 veya daha fazla kelepçe yerleştirin (2-3 cm).
- Hem bregma hem de lambda kraniyal dikişler görünene kadar kafatasını dokudan tamamen temizleyin.
- Sırasıyla kesici ve kulak çubuklarını kullanarak kafatasının dorsoventral ve anteroposterior ekseninin hizalanmasıyla başın simetrik konumunu doğrulayın. İlgilenilen beyin bölgesi için kılavuz kanülün koordinatlarını belirleyin. Kesici çubuğu kullanarak bregma ve lambda'yı aynı yatay düzlemde tutun.
- Paxinos ve Watson26 veya Swanson atlas27'nin stereotaksik koordinatlarını takip ederek kılavuz kanül implantasyon bölgesinin koordinatlarını ilgili alana hesaplayın.
NOT: Primer interoseptif insular korteks için aşağıdaki stereotaksik koordinatlar kullanıldı: Bregma -0.51 mm, orta hat 5.0 mm, kraniyal yüzeyden derinlik 4.5 mm, dikeyden medial 10° açılı. - Kılavuz kanül implantasyon koordinatlarını kafatasına değene kadar aşağı indirerek kontrol edin ve ardından doğrulanmış bölgedeki kafatasından bir delik açın. Kafatasına 3 vida yerleştirmek için hedef alanın etrafına 3 ek delik açın.
- Kanülü beynin ilgilendiği alana yerleştirin ve kanülü kafatasına sabitlemek için vidalar ve diş akrilik kullanın. Kuru kafatasının üzerine diş akriliği dökün ve kanülü yerine sabitlemek için vidaları kapattığından emin olun. Akrilik dişin sertleşmesine izin verin ve ardından kılavuz kanülü yerinde bırakarak stereotaksik kolu dikkatlice çıkarın.
NOT: Bu prosedür, implante edilen kanülü hareketsiz hale getirir ve deneycilerin ilgilenilen alanda birden fazla mikroenjeksiyon yapmasına izin verir. - Tıkanıklığı ve kontaminasyonu önlemek için kılavuz kanüle paslanmaz çelik bir stile yerleştirin.
- Ameliyatın sonunda tek doz antibiyotik (enrofloksasin %5; 19 mg/kg i.p) ve antiinflamatuar (ketofen 0.2 mg/kg i.p.) uygulayın. Ameliyattan sonra bu adımı art arda üç gün boyunca tekrarlayın.
- Deneylere başlamadan önce farelerin en az bir hafta tamamen iyileşmesine izin verin.
- Deneylerin başlamasından en az on gün önce fareleri ters 12/12 saatlik bir aydınlık / karanlık döngüsü altında tutun (ışıklar 7: 00'de yanar) (Şekil 2).
NOT: Deneycinin herhangi bir cerrahi prosedür gerçekleştirmesi gerekiyorsa, bunu karanlık ışık döngüsünü tersine çevirmeden önce yapması gerekecektir. Bu, ameliyat sonrası stresin azalmasını sağlar. - Tüm fareleri 2-3 gün boyunca günde 20 dakika boyunca idare edin. Her seferinde bir sıçan alın, hayvanı gövdesinden (kuyruğundan değil) güvenli bir şekilde tutun ve bu süre zarfında onları evcilleştirin. Hayvanlar stres belirtileri gösteriyorsa, onları uzun süre idare edin.
NOT: Bu adım, aşağıdaki adımları etkileyebilecek taşıma stresini en aza indirmek için kritik öneme sahiptir. - Hayvanların test bağlamına alışmasını sağlamak için deneylerden önce üç gün boyunca 30 dakika / gün boyunca hayvanları test odasına (giyilmemiş kedi tasması olan kedi koku odası) önceden maruz bırakın.
NOT: Deneyi yapan kişinin kokulu parfüm veya losyon kullanmaması önerilir. - Hayvanı hazneye yerleştirdikten sonra yaklaşık 10-15 dakika bekleyin, test haznesine bir kol sokun, ve kedi tasmasını aynı özelliklere sahip başka bir kedi tasması ile değiştirin.
NOT: Bu adım, testin son 10 dakikasında farenin davranışsal performansını etkileyebilecek stresi en aza indirmek için davranışsal prosedürlerin her adımını mümkün olduğunca yakından simüle etmek için kritik öneme sahiptir. - Test odasını seanslar arasında %5 (h/h) etanol ile temizleyin.
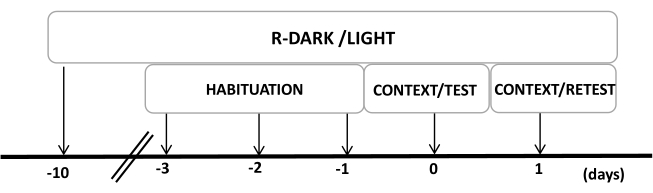
Şekil 2: Deney tasarımının zaman çizelgesi. Sıçanlar, 10 gün boyunca ters karanlık ışık döngüsüne maruz bırakıldı ve daha sonra son üç gün boyunca 30 dakika boyunca bir kontrol (giyilmemiş) kedi tasması içeren test odasına alıştırıldı. 0. günde, sıçanlar önce 10 dakika boyunca tanıdık bir test odasına (CONTEXT) maruz bırakıldı ve daha sonra aynı bağlamda 10 dakikalık ek bir süre (TEST) boyunca kedi kokusu olan veya olmayan bir tasmaya maruz bırakıldı. 1. günde, 0. günde kedi kokusuna (TEST) maruz kalan sıçanlar, 10 dakika boyunca aynı test odasına geri gönderildi (BAĞLAM) ve 10 dakika daha kedi kokusuna (RETEST) yeniden maruz bırakıldı. Bu rakam 8'den değiştirildi. Kısaltma: R-Dark/aydınlık = ters karanlık-ışık döngüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Kedi kokusu test prosedürleri
- Deneysel protokolün 0. gününde, kedi kokusuna yönelik tehdit tepkilerini değerlendirin.
- Gerekirse, aşağıda açıklanan yöntemi izleyerek davranış testlerinden önce kortikal enjeksiyonlar uygulayın. Yalnızca davranışsal bir protokol gerçekleştiriyorsanız, bu adımı atlayın ve adım 4.3'e geçin.
- Tıkayıcıyı çıkardıktan sonra kılavuz kanüle 1 μL Hamilton şırıngaya bağlı steril bir 33 G enjeksiyon kanülü yerleştirin.
- Hamilton şırıngasını steril salin (kontrol sıçanları) veya GABA-A reseptör agonisti, muscimol (tedavi sıçanları) ile doldurun ve 2 dakika boyunca 0,5 μL / hemisfer enjekte edin. İlacın difüzyonuna izin vermek için 2 dakika bekleyin, enjeksiyon kanülünü yavaşça çıkarın ve tıkayıcıları hemen yerleştirin.
NOT: Bu adımı sessiz, uyanık bir hayvanda gerçekleştirin ve enjeksiyon kanülünün titremesini ve bunun sonucunda bitişik beyin bölgelerine difüzyonu en aza indirmek için ilaçları yavaşça enjekte edin. - Kortikal enjeksiyon / hemisfer tamamlandıktan sonra 30 dakika bekleyin ve bir sonraki adıma geçin.
- Hayvanları 20 dakika boyunca test odasına koyun. İlk 10 dakika boyunca, hayvanları giyilmemiş tanıdık bir tasmaya maruz bırakın. Kedi kokusu emdirilmiş tasmayı (TEST) veya giyilmemiş tanıdık bir tasmayı (CONTEXT) sonraki 10 dakikaya kadar tanıtın (Şekil 3).
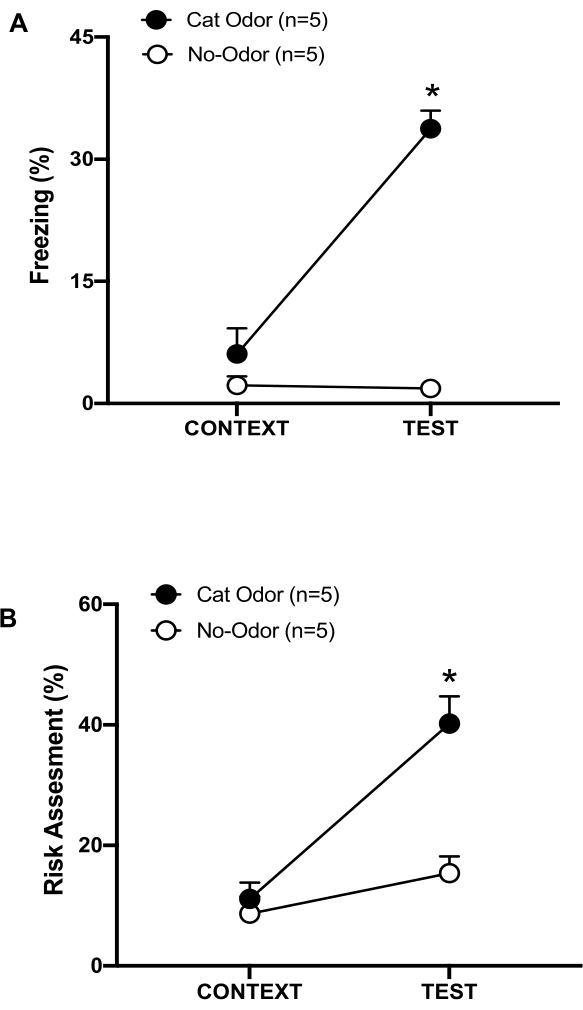
Şekil 3: Kedi kokusu karşılaşması doğuştan gelen savunma davranışlarını artırır. (A, B) Sıçanlar önce 10 dakika boyunca tanıdık test odasına (CONTEXT) maruz bırakıldı ve daha sonra aynı bağlamda 10 dakikalık ek bir süre boyunca kedi kokulu (kedi kokusu grubu, siyah halkalar) veya kedi kokusu olmayan (kokusuz grup, açık daireler) bir tasmaya maruz bırakıldı (TEST). Daireler, saf fareler tarafından gösterilen donma (B) ve risk değerlendirmesinde (C) harcanan zamanın yüzdesini göstermektedir. Veriler ortalama +SEM olarak ifade edilir. *p < 0.05. Bu rakam 8'den değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Test odasının önüne bir video kamera yerleştirin ve deney koşullarına kör olan bir deneyci tarafından daha sonra davranışsal puanlama için hayvanın davranışını kaydedin.
- Kedi kokusu seansının sonunda, hayvanları ev kafeslerine geri koyun ve bir sonraki seansa kadar hayvan tesisine geri koyun.
- Test odasını seanslar arasında %5 (h/h) etanol ile temizleyin.
- Kedi kokusu seansından yirmi dört saat sonra (1. gün), test bağlamına yönelik savunma tepkilerini değerlendirin.
- Gerekirse, bağlam pozlamasından önce adım 4.2'yi tekrarlayın.
- Fareleri, giyilmemiş tanıdık tasma ile aynı test odasına geri koyun ve 10 dakika boyunca bağlamsal tehdit belleğini ölçmek için savunma davranışları için puan verin (Şekil 4).
- Test odasının önüne bir video kamera yerleştirin ve deney koşullarına kör olan bir deneyci tarafından daha sonra davranışsal puanlama için hayvanın davranışını kaydedin.
- Önümüzdeki 10 dakika boyunca, giyilmemiş tanıdık tasmayı değiştirin, hayvanı kedi kokulu bir tasmaya tekrar maruz bırakın ve savunma davranışlarını ölçün.
- Kedi kokusuna ikinci kez maruz kaldıktan sonra, hayvanı ev kafesine geri koyun ve test odasını %5 (h/h) etanol ile temizleyin. Fareyi hayvan tesisine geri koyun.
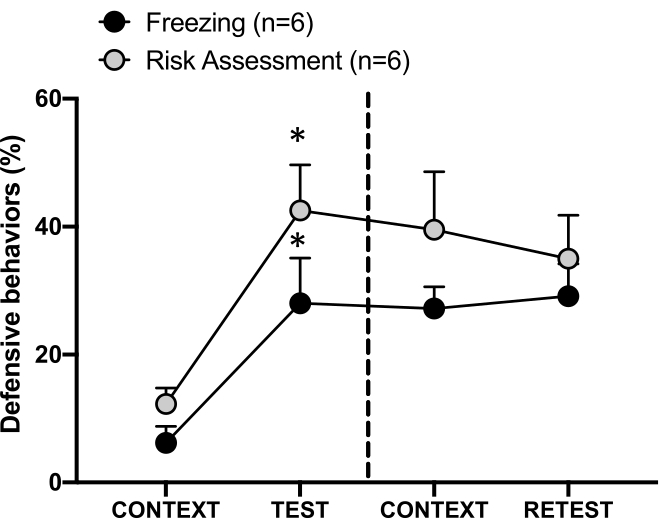
Şekil 4: Kedi kokusu karşılaşması bağlamsal tehdit öğrenmesine neden olur. Daireler, donmada geçirilen sürenin yüzdesini (siyah daireler) ve risk değerlendirme davranışını (gri daireler) gösterir. Kesikli çizgi, doğuştan gelen korku testini (Gün 0, sol) bağlamsal korku testinden (Gün 1, sağ) ayırır. Veriler ortalama + SEM olarak ifade edilir. *p < 0.05. Bu rakam 8'den değiştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. İmmünohistokimyasal işlemler
- Deneyleri tamamladıktan 90 dakika sonra hayvanı intraperitoneal ketamin (0.45 mg / kg) ve ksilazin (0.05 mg / kg) karışımı ile uyuşturun. Daha sonra,% 4 paraformaldehit ile transkardiyal perfüzyon ile sıçanı ötenazi yapın.
NOT: İlk kedi kokusuna maruz kalmayı, bağlama koşullu tepkiyi veya kedi kokusuna yeniden maruz kalmayı değerlendirmek gerekirse, bu deneysel durumların her birinden sonra bu adımı gerçekleştirin. Eldiven ve laboratuvar önlüğü giyin ve paraformaldehiti kimyasal bir davlumbaz altında dikkatli bir şekilde kullanın. - Perfüzyondan sonra, beyni 2 saat boyunca aynı fiksatif solüsyonda sabitleyin ve daha sonra beyin dibe çökene kadar fosfat tamponlu salin (PBS) içinde% 0.02 sodyum azid ile% 30 sükroza aktarın. Beyni 4 °C'de saklayın.
- Beyni kuru buz kullanarak dondurun ve kayan bir mikrotom üzerinde 50 μm kalınlığında seri koronal bölümler halinde kesin. İlgilenilen alanın üç set beyin bölümünü toplayın, biri kanül yerleşiminin doğrulanması için ve ikisi immünohistokimyasal prosedür için bırakın.
- Serbest yüzen beyin bölümlerini PBS'de% 0.3 H2O2 içinde 30 dakika inkübe edin, PBS'de yıkayın ve bu bölümleri 1 saat boyunca bloke edici (% 0.4 Triton X-100,% 0.02 sodyum azid,% 3 normal keçi serumu) çözeltisine aktarın.
- Bölümleri, bloke edici çözeltide 1:20.000 oranında seyreltilmiş c-Fos antikoru içeren birincil antikor inkübasyon çözeltisine aktarın ve gece boyunca oda sıcaklığında bırakın.
- PBS'deki bölümleri 1 saat durulayın ve daha sonra PBS'de% 0.4 Triton X-100 ve% 1.5 normal keçi serumunda 1: 1.000 oranında seyreltilmiş ikincil antikor çözeltisinde inkübe edin.
- Bölümleri 40 dakika durulayın ve avidin/biotin bazlı peroksidaz sisteminde 1 saat inkübe edin (PBS'de 1:500 oranında seyreltilmiş Malzeme Tablosuna bakınız).
- Koyu mavi bir reaksiyon ürünü elde etmek için bölümleri %0.05H2O2ve %0.05 nikel klorür içeren %0.05'lik bir 3-3" diaminobenzidin hidroklorür (DAB) çözeltisinde durulayın ve inkübe edin.
6. Hücre sayımı
- Nöronların çekirdeğindeki c-Fos punktiform boyamayı lokalize etmek için düşük güç (10x) objektif kullanarak bir kamera lucida altındaki bölümleri inceleyin (Şekil 5).
- İlgilenilen alanın boyutuyla ilgili bir sayma ızgarası kullanın. pIC için, örneğin, Bregma 0,95 ila -0,26 arasında, 0,25 mm x 1 mm'lik bir sayma ızgarası kullanın; Bregma -0,51 ila -2,45 mm arasında, 0,5 mm x 1 mm sayma ızgarası kullanın.
- Basamaklı bir manuel sayaç kullanarak bölüm başına c-Fos immünoreaktif (Fos-ir) hücrelerin sayısını ölçün.
- İlgilenilen tüm koronal bölümleri iki kez sayın ve deney koşullarına kör olan aynı gözlemcinin sayımı gerçekleştirdiğinden emin olun.
- Dijital kamera ile birleştirilmiş bir mikroskop kullanarak fotoğraf çekin.
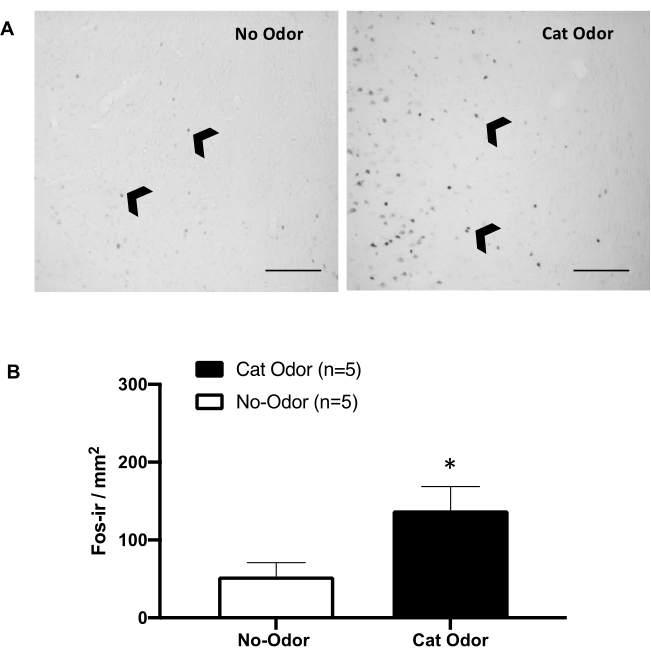
Şekil 5: Kedi kokusu primer interoseptif kortekste nöronal aktivasyonu ortaya çıkarır. (A) Kedi kokusuna maruz kalan sıçanlarda (sağda) önemli ölçüde artan c-Fos-ir hücresi sayısı ile karşılaştırıldığında, giyilmemiş bir kedi tasmasına maruz kalan sıçanlarda (koku yok, solda) c-Fos-ir hücrelerinin (siyah ok uçları) neredeyse yokluğunu gösteren pIC'nin temsili fotomikrografı. (B) Her iki deney koşulunda pIC'deki c-Fos-ir hücrelerinin miktarının belirlenmesi. Veriler ortalama + SEM olarak ifade edilir. *p < 0.05. Ölçek çubukları = 200 μm. Bu rakam 8'den değiştirildi. Kısaltmalar: pIC = birincil interoseptif korteks; c-fos-ir = c-Fos-immünoreaktif. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
7. Veri analizi
- Video ile kaydedilen deneylerden savunma davranışlarını puanlayın ve bunları istatistiksel yazılım kullanarak analiz edin.
- Donmayı, 10 dakika boyunca donma için harcanan sürenin yüzdesi olarak ifade edilen zamanlama nöbetleri ile değerlendirin. Eşitlik (1) kullanarak donma yüzdesini hesaplayın.
Donma = (dondurmak için harcanan saniye/600 sn) × 100 (1)
NOT: Donma, en az 1 s28 boyunca solunum dışında tamamen hareket eksikliği olarak tanımlandı. - Dikkatli tarama nöbetlerini zamanlayarak risk değerlendirmesini puanlayın ve bunu 10 dakika boyunca risk değerlendirmesinde harcanan sürenin yüzdesi olarak ifade edin. Eşitlik (2) kullanarak risk değerlendirmesinin yüzdesini hesaplayın.
% Risk değerlendirmesi = (risk değerlendirmesinde harcanan saniye/600 sn) × 100 (2)
NOT: Risk değerlendirme davranışı, en az 1 s29 boyunca uyanık tarama (gözlemevi, yan yana baş hareketleri, hareket etmeden) olarak tanımlanmıştır. - Bu davranışsal parametreleri manuel olarak puanlayın ve deney koşullarına (yani koku ve ilaç koşulları) kör olan bir deneyci tarafından sayıldığından emin olun. Veri kümelerinin normalliğine bağlı olarak, iki veya daha fazla grubu karşılaştırmak için parametrik veya parametrik olmayan testler kullanın.
NOT: Bu çalışmada tüm istatistiksel testler SPSS paket programı kullanılarak yapılmıştır.- Gruplar arasında ikili karşılaştırmalar için Kruskal-Wallis H-testini ve Mann-Whitney U-testini kullanın.
- İkili karşılaştırmalar için Friedman testi ve ardından Wilcoxon işaretli sıra testi ile zaman içindeki grup içi karşılaştırmaları analiz edin.
NOT: Tüm şekillerde anlamlılık düzeyleri p < 0.05 (*) ve p < 0.01 (**) olarak ayarlanmıştır.
- Belirli beyin bölgelerinde c-Fos ekspresyonunun analizi için, mm2 başına c-Fos-ir hücrelerinin yoğunluğunu hesaplayarak bölüm başına c-Fos-pozitif hücre sayısını sayın ve kontrol (koku yok) ve uyarılmış (kedi kokusu) koşullar arasındaki ortalama sayıyı karşılaştırın.
- Verilerin normalliğine bağlı olarak, eşleştirilmemiş öğrenci t-testini veya Mann-Whitney U-testini kullanın.
NOT: Bu çalışmada Mann-Whitney U testi kullanılmış; P < 0.05 (*) ise farklılıklar anlamlı kabul edildi.
- Verilerin normalliğine bağlı olarak, eşleştirilmemiş öğrenci t-testini veya Mann-Whitney U-testini kullanın.
Sonuçlar
Bu protokolde, donma ve risk değerlendirme yüzdeleri sıçanlarda sırasıyla korku ve kaygı benzeri durumların göstergesi olarak ölçüldü. Deneysel tasarımın zaman çizelgesi Şekil 2'de gösterilmiştir. 0. günde kedi kokusuna maruz kalan hayvanlardan elde edilen sonuçlar Şekil 3'te sunulmuştur. Sıçanlar, kedi kokusuna (TEST) yanıt olarak tanıdık bağlama (BAĞLAM) göre anlamlı derecede daha yüksek donma seviyeleri (Şekil 2A, Kedi Kokusu grubu, Wilcoxon İşaretli sıralar testi, Z = -2.201, p = 0.028) ve risk değerlendirmesi (Şekil 2B, Kedi Kokusu grubu, Wilcoxon İşaretli sıralar testi Z = -2.336 p = 0.018) göstermiştir. Testin ikinci bölümünde giyilmemiş bir tasmaya maruz kalan sıçanlarda düşük donma seviyeleri (Şekil 2A, koku içermeyen grup, Wilcoxon İşaretli sıralar testi, Z = -0.184, p = 0.854) ve risk değerlendirmesi (Şekil 2B, koku almayan grup, Wilcoxon İşaretli sıralar testi, Z = -1.753, p = 0.08) gözlenmiştir.
Ek analizler, testin ikinci bölümünde donma (Şekil 2A, Mann-Whitney testi, U = 0.000, p = 0.004) ve risk değerlendirme (Şekil 2B, Mann-Whitney testi, U = 4.000, p = 0.025) seviyelerinin Kedi Kokusu grubunda kokusuz gruba göre daha yüksek olduğunu ortaya koydu. Tanıdık bir bağlama (CONTEXT) maruz kalmanın ilk 10 dakikasında iki grup arasında dondurma (Şekil 2A, Mann-Whitney testi, U = 11.000, p = 0.256) ve risk değerlendirmesi (Şekil 2B, Mann-Whitney testi, U = 15.00, p = 0.627) açısından anlamlı bir fark yoktu. Bu sonuçlar, protokolün kedi kürkü/deri kokusuna yanıt olarak savunma davranışlarını test etmek için uygun olduğunu göstermektedir.
1. gündeki test bağlamına (CONTEXT) koşullu tehdit yanıtı Şekil 4'te gösterilmiştir. Kedi kokusuna maruz kalan sıçanlar, ilk avcının koku karşılaşmasından 24 saat sonra test odasına geri gönderildi. 1. günde, hayvanlar test bağlamına yanıt olarak daha yüksek donma (Wilcoxon İşaretli sıralar testi, Z = -2.366, p = 0.018) ve risk değerlendirmesi (Wilcoxon İşaretli sıralar testi, Z = -2.201, p = 0.028) seviyeleri sergiledi. Ayrıca CONTEXT ve RETEST arasında dondurma (Wilcoxon İşaretli Sıralar testi, Z = -0.841, p = 0.400) veya risk değerlendirmesi (Wilcoxon İşaretli Sıralar testi, Z = -0.943, p = 0.345) düzeylerinde fark bulunmamıştır. Sıçanlar, RETEST ve TEST sırasında aynı donma seviyelerini (Wilcoxon İşaretli sıralar testi, Z = -0.105, p = 0.917) ve risk değerlendirmesini (Wilcoxon İşaretli sıralar testi, Z = -0.980, p = 0.327) gösterdi. Bu sonuçlar, tek bir 10 dakikalık kedi kürkü / deri kokusu maruziyetinin, hayvanların avcı kokusuyla karşı karşıya kaldığı bağlama öğrenilmiş bir tehdit tepkisi ile sonuçlandığını göstermiştir.
Şekil 5 ve Şekil 6, bu makalede sunulan protokolü kullanan iki deney setini göstermektedir. 8,30,31,32 duygu işlemede yer alan bir beyin bölgesi olan birincil interoseptif korteksin (pIC) savunma davranışlarının ifadesi için gerekli olup olmadığını test ettik. Kedi kokusunun neden olduğu nöronal aktivasyon, pIC'de ayrılmış hayvan gruplarındaki c-Fos-ir hücreleri sayılarak değerlendirildi: koku ve kedi kokusu koşulları. Bu sıçanlar, testin tamamlanmasından 90 dakika sonra ötenazi yapıldı. Kedi kokusu grubunda pIC'deki c-Fos-ir nöronlarının sayısında kontrol grubuna göre anlamlı bir artış gözlenmiştir (Mann-Whitney testi, U=3.000, p=0.016).
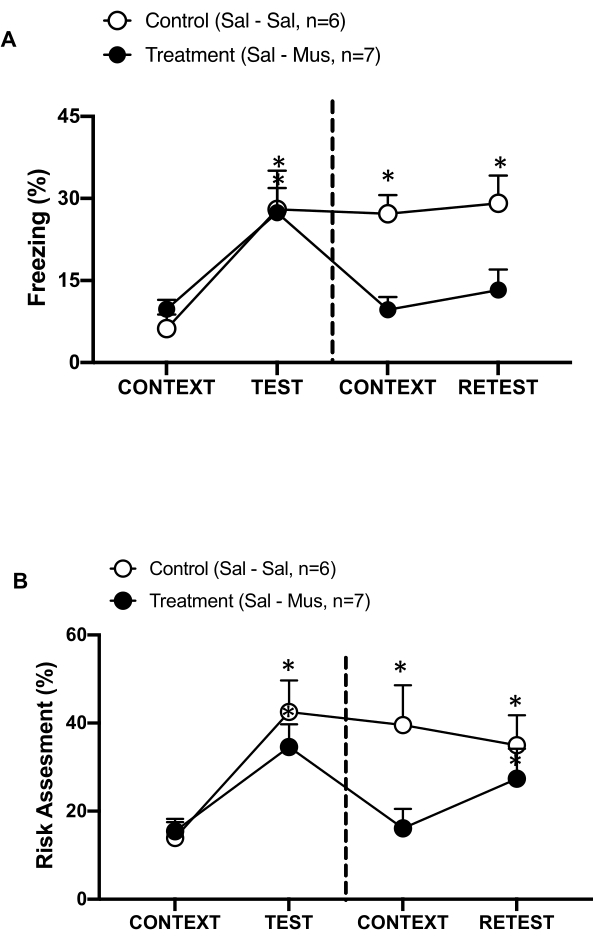
Şekil 6: Primer interoseptif korteksin muscimol inaktivasyonu bağlamsal tehdit hafızasını bozar. (A, B) Tedavi grubuna pIC'de (Tedavi grubu) 0. günde salin, 1. günde muscimol enjekte edildi. Kontrol sıçanlarına her iki günde de pIC'de salin enjekte edildi. 1. günde, hayvanlar tanıdık test odasına geri gönderildi ve 10 dakika boyunca CONTEXT'e maruz bırakıldı ve 10 dakikalık ek bir süre boyunca kedi kokusuna (RETEST) yeniden maruz bırakıldı. Daireler, donmada geçirilen sürenin yüzdesini (siyah daireler) ve risk değerlendirme davranışını (açık daireler) gösterir. Kesikli çizgi, doğuştan gelen korku testini (Gün 0, sol) bağlamsal korku testinden (Gün 1, sağ) ayırır. Veriler ortalama + SEM olarak ifade edilir. *p < 0.05. Bu rakam 8'den değiştirildi. Kısaltmalar: pIC = birincil interoseptif korteks; Sal-Sal = 0. gün ve 1. günde enjekte edilen salin; Sal-Mus = 0. günde enjekte edilen salin ve 1. günde muscimol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ayrıca, pIC'nin muscimol inaktivasyonunun bağlamsal tehdit belleği üzerindeki etkisini de ölçtük (Şekil 6). Tedavi grubuna (sal-mus sıçanları) 0. günde pIC'de salin enjeksiyonu ve 1. günde GABA-A agonisti muscimol enjeksiyonu yapıldı. Bu hayvan grubu, 0. güne kıyasla tanıdık bağlama yanıt olarak 1. günde donma (Şekil 6A, Wilcoxon İşaretli sıralar testi, Z = -0.140, p = 0.889) veya risk değerlendirmesinde (Şekil 6B, Wilcoxon İşaretli sıralar testi, Z = -0.700, p = 0.484) herhangi bir fark göstermedi, bu da bağlamsal tehdit belleğinde bir bozulma olduğunu gösteriyor. İlginç bir şekilde, donma (Şekil 6A, Wilcoxon İşaretli sıralar testi, Z = -2.100, p = 0.036), ancak risk değerlendirmesi değil (Şekil 6B, Wilcoxon İşaretli sıralar testi, Z = -0.980, p = 0.327), TEST'e kıyasla RETEST sırasında önemli ölçüde azaldı. Bu son bulgu, pIC'nin 1. günde susturulmasının, yırtıcı hayvan kokusuna verilen tepkiyi seçici olarak bozduğunu, ancak kaygıyı bozmadığını göstermektedir. Birlikte ele alındığında, bu sonuçlar yukarıda açıklanan deneysel protokolün, yırtıcı tehditlere karşı doğuştan gelen ve öğrenilmiş savunma tepkilerinin incelenmesi için uygun olduğunu desteklemektedir.
Tartışmalar
Burada açıklanan protokol, doğuştan gelen ve öğrenilmiş caydırıcı uyaranların uyandırdığı savunma davranışlarını değerlendirmek için yenilikçi bir yaklaşım sunar. Güvenli bir saklanma alanı olmayan bir test odası (Şekil 1) ve yumurtalıklı bir dişi evcil kediden deri/kürk kokusu ile emprenye edilmiş bir tasma, sıçanlarda adaptif ve maladaptif savunma reaksiyonlarının altında yatan nöral devreleri araştırmak için yararlı olabilecek güçlü ve sürekli bir tehdit durumu ortaya çıkarmak için kullanıldı.
Spesifik savunma reaksiyonlarının gösterilmesinin hem tehdit uyaranının özelliklerine hem de hayvanla karşılaşılan durumun/ortamın özelliklerine bağlı olduğu iyi bilinmektedir21,33. Kaçınma, risk değerlendirmesi ve donma, tehdit edici uyaranlarla uyandırılabilecek geniş bir hayvan savunma reaksiyonları repertuarının bir parçasıdır 9,19. Bununla birlikte, baskın savunma reaksiyonunun seçimi, tehdittenuzaklık 33 veya test odası21,33 içinde güvenli bir yerin varlığı gibi çevresel koşullara bağlıdır. Örneğin, sıçanlar bir saklanma kutusu ile arenaya yerleştirildiğinde, kedi kokusu varlığında, germe/katılma duruşları, saklanma kutusundan çıkma ve kaçınma gibi savunma davranışları sergilerler 6,24,25. Buna karşılık, donma davranışı, tetikte tarama ve germe/katılma duruşları, kaçışın mümkün olmadığı durumlarda güçlü bir şekilde ortaya çıkar ve tehdide olan mesafenin aşırı kısa olmadığı durumlarda33,34.
Araştırmalar, kontrol edilemeyen bir stres etkenine maruz kalmanın, stres etkeni kontrol edilebilir olduğunda ortaya çıkanlardan farklı çeşitli davranışsal sonuçlar ürettiğini göstermiştir 35,36,37,38. Örneğin, kaçınılmaz, ancak kaçış olmayan kuyruk şoku, dorsal raphe çekirdeğinde serotoninde büyük artışlarayol açar 35 ve caydırıcı deneyimden 24 saat sonra ölçülen kaygı benzeri davranışlar36. Ayrıca, kontrol edilemeyen stresörler hayvanlarda36,37 ve insanlarda38 korku koşullanmasını artırır. Protokolü geliştirmek için ilk mantığımız, fareleri caydırıcı uyaranı kontrol edemeyecekleri bir duruma maruz bırakmak ve bu nedenle güçlü ve sürekli tehdit tepkileri sergilemek ve tek ve kısa bir kedi kokusuna maruz kaldıktan sonra gelişmiş bağlamsal öğrenme geliştirmekti.
Burada açıklanan deneysel tasarımda, bir saklanma kutusunun olmaması, genellikle kemirgenlerde korku ve kaygı benzeri durumların davranışsal tezahürleri olarak kabul edilen donma (yani, nefes alma dışında tamamen hareketsizlik28) ve risk değerlendirmesi (yani, uyanık tarama ve germe/katılma duruşları29) davranışları arasında değişen güçlü ve sürekli bir savunma durumunu uyandırmıştır (Şekil 3). Özellikle, aynı savunma reaksiyonları paterni 24 saat sonra, sıçanlar test bağlamına yeniden maruz kaldıklarında meydana geldi, bu da daha önce bildirildiği gibi 7,10,11,14,15,34,39 (Şekil 4).
Kokuları/kokuları verimli bir şekilde toplamak ve hapsetmek ve böylece güçlü bir savunma tepkisi uyandırmak için tehdit uyaranının güvenilir bir örneğini elde etmek için iç keçe astarlı bir kedi tasması kullanıldı. Araştırmacılar benzer çalışmalarda kedi dışkısı, idrar veya trimetiltiyazolin (TMT, tilki dışkısının bir bileşeni) gibi caydırıcı uyaranlar kullandılar. Bununla birlikte, bu uyaranlar, bağlamsal öğrenmeyi teşvik etme konusunda daha az yetenekli oldukları için bir avcının hemen varlığını daha az öngörüyor gibi görünmektedir40,41. Önceki bulgular 2,4,8,9,10,11,20,34,39'a göre, kedi kokusu, sıçanlarda sürekli savunma reaksiyonlarını ve bağlamsal tehdit hafızasını indükleyebilen güvenilir bir doğuştan gelen caydırıcı uyarandır. Yıllar geçtikçe, bu tür bir etolojik davranışsal hayvan modeli, araştırmacıların stres ve stresle ilgili bozuklukları 13,14,15,16,17,23,42 TSSB gibi uyumsuz korku anılarıyla ilişkili olanlar gibi incelemeye olan ilgisini giderek daha fazla çekmiştir.
Bu protokolün, örneğin moleküler ve hücre biyolojisi yaklaşımları ve uyanık ve davranan hayvanlarda elektrofizyoloji dahil olmak üzere çeşitli deneysel tekniklerle birlikte kullanılması amaçlanmıştır, bu da açık soruları yanıtlama ve uyarlanabilir ve uyumsuz tehdit tepkileri hakkındaki anlayışımızı geliştirme fırsatı sunar. Bu çalışmada, duygu işlemede yer alan bir beyin bölgesi olan pIC'nin savunma davranışlarının ifadesi için gerekli olduğu fikrini test ettik. Davranışsal deneyler, kedi kokusuna ve GABA-A reseptör agonisti muscimol'ün intraserebral infüzyonlarına yanıt olarak pIC'deki nöronal aktivite modellerini haritalamak için c-Fos immünohistokimyası ile birleştirildi, pIC'yi geri dönüşümlü olarak susturmak ve avcı kokusuna karşı doğuştan gelen ve öğrenilmiş tehdit reaksiyonlarına katılımını belirlemek için. Bu bulgular, kedi kokusunun pIC'de nöronal aktivitede bir artışa neden olduğunu (Şekil 5) ve pIC'nin susturulmasının ciddi bir bağlamsal tehdit belleği eksikliğine yol açtığını ortaya koymuştur (Şekil 6).
Burada açıklanan protokolün uygulanması ve gerçekleştirilmesi teknik olarak basit olsa da, birkaç komplikasyon ortaya çıkabilir. Örneğin, giyilmemiş tasma ile yıpranmış kedi tasması temas ederse kedi kokusu çapraz kontaminasyonu meydana gelebilir. Bu nedenle, tüm prosedürler sırasında tasmalar ayrı tutulmalı ve yıpranmış yaka test odasına yerleştirildikten sonra eldivenler değiştirilmelidir. Deneyci, aynı test odasını kullanarak koku ve koku olmaması koşullarını gerçekleştirmek isterse, deneylerin farklı günlerde yapılması gerekir. Bu deneyler için iki özdeş test odası kullanılabilir34 ve sosyal iletişimi önlemek için fareler ayrı odalarda tutulmalıdır43. Alışılmadık ortamlarda yeni uyaranlara maruz kalmanın ortaya çıkardığı stres de bir sorun olabilir. Bu nedenle, hayvanların, yeni durumlarda sıçanlar tarafından yaygın olarak sergilenen stres ve savunmacılığı azaltmak için test ortamına ve prosedürlerine en az üç günlük alışma süresi olmalıdır. Ayrıca alışma süresi için gereken sürenin test süresinden daha uzun olması gerekmektedir. Örneğin, test 10 dakika sürüyorsa, alışma süresi için 20 veya 30 dakika atanmalıdır.
Son olarak, savunma davranışları tercihen sıçanların aktif olduğu döngünün karanlık fazında değerlendirilmelidir. Sıçanlar, hem sıçan hem de deneyci aktif fazlarındayken deney prosedürlerinin gerçekleştirilmesine izin vermek için ters ışık/karanlık döngüsü altında tutulmalıdır34. Aydınlık / karanlık döngüsündeki değişimin çözülmesi 10 günden fazla sürmez ve deneyime dayanarak, bu koşul altındaki çoğu sıçan kedi kokusuna yeterince yanıt verir. Bununla birlikte, Sprague-Dawley sıçanlarının, Wistar sıçanlarına göre uzun süreli tehdit koşullandırma ve kaygıya karşı daha az savunmasız olduğunu gösteren birkaç çalışma vardır44. Bu nedenle, Sprague-Dawley suşu sıçanları yerine Wistar sıçanlarının kullanılmasının daha sağlam sonuçlar vermesi mümkündür.
Sonuç olarak, kedi kokusu, sıçanlarda güvenilir nöronal, endokrin ve davranışsal tepkiler ortaya çıkaran etolojik olarak ilgili tehdit edici bir uyarandır. Kaçınılmaz bir odada kedi kokusu ile karşılaşma, sıçanlarda sağlam ve uzun süreli bir korku/endişe tepkisine yol açar, bu da hızlı ve kalıcı bağlamsal tehdit öğrenimi ile sonuçlanır. Yukarıda açıklanan protokol, korku ve uyarlanabilir ve uyumsuz tehdit belleği kodlama mekanizmalarını incelemek için yararlı bir araç olabilir.
Açıklamalar
Bu makalenin yazarlarının ifşa etmesi gereken hiçbir rakip mali çıkar veya başka çıkar çatışması yoktur.
Teşekkürler
Yazarlar, laboratuvar prosedürlerine yardımcı olduğu için Marcela Gonzalez'e, protokol tasarımına katkıda bulunduğu için Mabel Matamala'ya ve illüstrasyona yardımcı olduğu için Miguel Rojas'a minnetle teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
Referanslar
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682 (2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283 (2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J., Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. , 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, 45 (2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16 (2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91 (2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1997).
- Swanson, L. W. . Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377 (1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292 (2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132 (2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041 (2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır