Method Article
Ein unentrinnbares Protokoll zur Exposition gegenüber Katzengerüchen zur Untersuchung der angeborenen und kontextuellen Bedrohungskonditionierung bei Ratten
In diesem Artikel
Zusammenfassung
Die Exposition gegenüber Katzenhaut-/Fellgeruch bietet eine zuverlässige Methode zur Untersuchung neuronaler Schaltkreise und Mechanismen von Abwehrreaktionen bei Nagetieren und kann Einblicke in Mechanismen geben, die Angst beim Menschen vermitteln. Hier beschreiben wir ein Protokoll zur Untersuchung der Rolle des interozeptiven Kortex bei Bedrohungsreaktionen bei Ratten.
Zusammenfassung
Tiere reagieren auf bedrohliche Situationen mit einer Reihe von Abwehrverhaltensweisen, darunter Vermeidung, Erstarren und Risikobewertung. Ein Tiermodell mit einem ethologischen Ansatz bietet einen tieferen Einblick in die biologischen Mechanismen, die den Bedrohungsreaktionen zugrunde liegen. In dieser Arbeit wird eine Methodik zur Messung von Abwehrverhalten gegenüber angeborenen und erlernten aversiven Reizen bei Ratten beschrieben. Die Tiere wurden einzeln in einer unentrinnbaren Kammer dem Geruch von Raubtieren ausgesetzt, um einen messbaren, anhaltenden Abwehrzustand hervorzurufen. Das Versuchsdesign beinhaltete, eine Ratte für 10 Minuten in eine vertraute Kammer zu setzen, gefolgt von einer weiteren 10-minütigen Exposition gegenüber Katzengeruch im gleichen Kontext. Am nächsten Tag wurden die Ratten erneut für 10 Minuten in dieselbe Kontextkammer gebracht, in der die Katzengeruchsexposition auftrat. Die Sitzungen wurden auf Video aufgezeichnet und das Abwehrverhalten an beiden Tagen bewertet.
Der Verhaltenstest wurde mit reversibler funktioneller Inaktivierung und c-Fos-Immunhistochemie gekoppelt, um die Rolle des interozeptiven Kortex bei der Bedrohungsreaktion zu bestimmen. Ratten, die am ersten Tag Katzengeruch ausgesetzt waren und am zweiten Tag erneut der Kontextkammer ausgesetzt wurden, zeigten ein höheres Maß an Abwehrverhalten, und dieser Katzengeruch führte zu einem robusten Anstieg der neuronalen Aktivität des interozeptiven Kortex. Darüber hinaus reduzierte die Muscimol-Inaktivierung des interozeptiven Kortex die Ausprägung von Abwehrverhaltensweisen als Reaktion auf Katzengeruch und beeinträchtigte das kontextuelle Bedrohungsgedächtnis. Diese Ergebnisse zeigen, dass dieser Verhaltensassay ein nützliches Werkzeug für die Untersuchung neuronaler Mechanismen von Abwehrverhalten ist und Einblicke in die Mechanismen geben kann, die Angst beim Menschen und den damit verbundenen Störungen vermitteln.
Einleitung
Defensive Verhaltensweisen treten als Reaktion auf Reize auf, die eine potenzielle Bedrohung für das Überleben eines Tieres signalisieren. Diese Verhaltensweisen sind bei Säugetieren stark konserviert und schnell mit Reizen oder Umständen im Zusammenhang mit der Bedrohung verbunden 1,2,3. In der Natur sind die bedrohlichen Reize für die meisten Tiere Raubtiere; Daher ist die Erkennung von Räuberhinweisen, wie z. B. Geruchshinweisen, besonders vorteilhaft, um Raubtiere zu vermeiden. Verhaltensreaktionen auf Raubtierreize wurden bei Nagetieren umfassend untersucht.
Zum Beispiel aktivieren Reize wie natürliches Katzenfell oder Hautgerüche das Geruchs- und das Vomeronasalsystem und induzieren ein hohes Maß an Abwehrverhalten4. Diese Stimuli werden von Veränderungen der neuronalen und endokrinen Aktivitätbegleitet 5,6,7,8 und sind starke, unbedingte, aversive Stimuli für die kontextuelle Bedrohungskonditionierung bei Ratten 7,8,9,10,11. Studien haben gezeigt, dass Ratten mindestens 24 Stunden nach der Exposition gegenüber natürlichen Raubtierreizen robuste und lang anhaltende konditionierte angstähnliche Zustände zeigen 7,12,13. Dieses Phänomen ist von besonderem Interesse für die Entwicklung realistischerer Modelle der posttraumatischen Belastungsstörung (PTBS)14,15,16,17, der generalisierten Angststörung (GAD)5 und der Panikstörung (PD)18,19.
Im Labor wird Angstverhalten als Flucht, Vermeidung (z. B. Rückzug, Verstecken) oder Erstarren gemessen. Darüber hinaus kann Angst als Dehnungshaltungen und wachsames Scannen gemessen werden, das auf die Überwachung eines räuberischen Stimulus gerichtet ist - eine Reihe von Reaktionen, die allgemein als Risikobewertungsverhalten bekannt sind 6,9,20. Studien haben gezeigt, dass das Erstarrungsverhalten bei Ratten die vorherrschende Verteidigungsstrategie gegen eine unausweichliche Bedrohung ist, während eine Risikobewertung beobachtet wird, wenn die Bedrohung mehrdeutig oder nicht lokalisiert ist 12,21,32. Obwohl bekannt ist, dass ein angeborener oder erlernter Reiz defensive Verhaltensweisen hervorrufen kann, gibt es einen Mangel an Laborverhaltensparadigmen, die defensive Reaktionen in einem eher ethologischen Kontext zuverlässig erfassen. Um diese Lücke zu schließen, haben wir ein Protokoll mit einem ethologischen Ansatz entwickelt, das die Messung von anhaltendem angeborenem und kontextuellem Bedrohungsverhalten zusammen mit den Reaktionen des Gehirns auf naturalistische Bedrohungsreize ermöglicht.
Stressige Erfahrungen, wie z. B. die Exposition gegenüber einem unausweichlichen Raubtiergeruch, führen bei Ratten zu dauerhaften Veränderungen des Verhaltens und der physiologischen Reaktion 14,22,23. Diese Veränderungen spiegeln das Symptomprofil wider, das bei Angst- und Angststörungen wie PTBS beobachtet wird. Im aktuellen Modell wird eine Testkammer ohne sicheres Versteck verwendet, um Ratten einem unausweichlichen Bedrohungsereignis auszusetzen und so die Abwehrreaktionen zu verbessern. Die Ratten zeigten ein robustes Einfrier- und Risikobewertungsverhalten als Reaktion sowohl auf den Katzengeruch als auch auf den Testkontext. Diese Ergebnisse unterstützen die Verwendung dieses Protokolls als zuverlässige und valide Methode zur Erforschung biologischer Mechanismen, die defensiven Verhaltensweisen zugrunde liegen, und zur Entwicklung und Verfeinerung neuer Strategien zur Behandlung von Angststörungen beim Menschen.
Protokoll
Das folgende Verfahren wurde gemäß den Empfehlungen der institutionellen Richtlinien des National Institutes of Health (USA) Guide for the Care and Use of Laboratory Animals (NIH Publication No. 80-23, revised 1996) durchgeführt. Die Institutionelle Kommission für biologische Sicherheit und Ethik der Pontificia Universidad Católica de Chile hat alle Verfahren genehmigt. Alle experimentellen Sitzungen wurden während der aktiven Phase der Ratte (dunkle Phase) durchgeführt.
1. Vorbereitung des Prüfraums und der Prüfkammer
HINWEIS: Die Übersicht über das Gerät ist in Abbildung 1 dargestellt. Die Prüfkammer wurde nach früheren Studien entwickelt und modifiziert24,25.
- Verwenden Sie eine transparente rechteckige Prüfkammer aus Poly (Methylmethacrylat) mit folgenden Abmessungen: 60 cm (Länge) x 40 cm (Breite) x 40 cm (Höhe). Decken Sie die Seiten- und Rückwände der Prüfkammer mit schwarzem Papier ab. Stellen Sie sicher, dass die Vorderseite der Prüfkammer transparent ist, um das Verhalten der Tiere aufzuzeichnen.
- Befestigen Sie eine Stahlhalterung am Boden in der unteren rechten Ecke der Prüfkammer und befestigen Sie damit die Katzenhalsbänder für die Testverfahren.
- Reinigen Sie die Prüfkammer vor und nach den Tests mit 5 % (v/v) Ethanol, um alle Geruchsspuren zu entfernen, die von den Versuchsratten hinterlassen wurden, und um die Abneigungsreaktion der Ratte zu vermeiden. Lassen Sie zwischen den einzelnen Sitzungen 5 Minuten warten, bis das Ethanol vollständig verdampft ist.
- Führen Sie die Testsitzung in einem ruhigen Raum durch, der von einer roten 80-W-Glühbirne 20 cm über der Testkammer schwach beleuchtet wird. Verwenden Sie eine Videokamera, die sich vor der Kammer befindet, um das Verhalten der Tiere aufzuzeichnen.
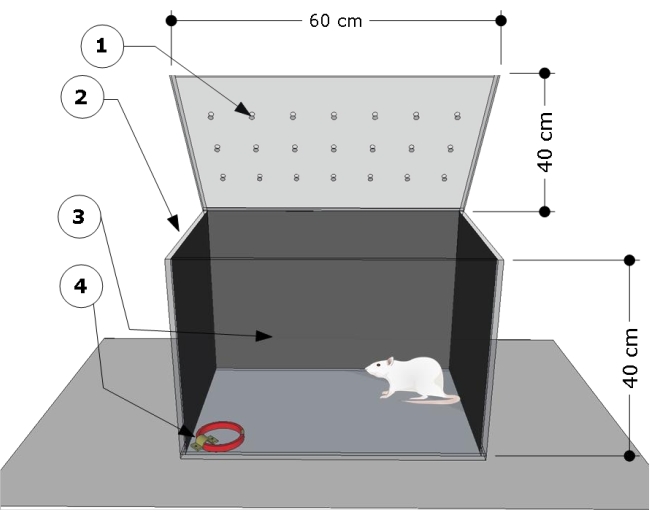
Abbildung 1: Schematische Übersicht der Prüfkammer. Das Gerät besteht aus einem Prüffach mit: (1) Belüftungslöchern, (2) Seiten- und (3) Rückwänden abgedunkelt, und einem Stahlbügel, der am linken Eckboden (4) verriegelt ist, um das Katzenhalsband zu befestigen (Maße: Breite 15 mm, Dicke 5 mm, Länge 300 mm). Die Kammerabmessungen sind auf dem Cartoon angegeben (60 L x 40 B x 40 H cm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Vorbereitung auf Katzengeruch
- Besorgen Sie sich ein Katzenhalsband mit einer mit Filz gefütterten Innenseite, um den Katzengeruch besser einzufangen. Stellen Sie sicher, dass mehrere Halsbänder für den Einsatz als Kontrollhalsband (kein Geruch) oder als Prüfhalsband (Katzengeruch) zur Verfügung stehen.
HINWEIS: Der entscheidende Punkt ist, dass das Katzenhalsband ein Innenfutter zum Sammeln und Einfangen von Gerüchen haben muss. - Legen Sie einer eierektomierten Hauskatze ein Halsband an und lassen Sie die Katze das Halsband eine Woche lang tragen, bevor sie den Test durchführt. Versuchen Sie, die weibliche Katze im Haus zu halten, während Sie das Testhalsband tragen.
HINWEIS: Verwenden Sie während der gesamten Studie dieselbe Katze. - Bewahren Sie das getragene Katzenhalsband in einem luftdichten Plastikbehälter auf und lagern Sie es bei 4 °C. Ersetzen Sie das abgenutzte Katzenhalsband durch ein Halsband, das alle drei Tage einen frischen Katzengeruch enthält.
3. Vorbereitung der Ratten auf das experimentelle Verfahren
- Verwenden Sie erwachsene männliche Sprague-Dawley-Ratten mit einem Gewicht von 270-290 g. Halten Sie sie in Einzelkäfigen, in denen Futter und Wasser nach Belieben zur Verfügung stehen.
- [Fakultativ] Vorbereitung von Ratten auf chirurgische Eingriffe (optional)
- Führen Sie die Operation unter sterilen Bedingungen durch. Reinigen und desinfizieren Sie den Arbeitsbereich mit einer Lösung aus 70%igem Ethanol und sterilisieren Sie alle chirurgischen Materialien und Instrumente.
- Betäuben Sie die Ratte mit einer intraperitonealen Mischung aus Ketamin (100 mg/kg) und Xylazin (20 mg/kg). Warten Sie, bis die richtige Anästhesieebene erreicht ist, wenn die Ratte nicht auf einen Zehenkneifreiz oder eine Hornhautstimulation reagiert. Um den Narkosezustand während der gesamten Operation aufrechtzuerhalten, verabreichen Sie alle 45 Minuten eine zusätzliche Dosis des Anästhesiecocktails.
- Rasieren Sie den Kopf der Ratte vorsichtig von hinter dem Ohr bis zwischen den Augen und desinfizieren Sie den Operationsbereich mit einem sterilen Alkoholpräparationspad, gefolgt von einer Povidon-Jod-Lösung. Tragen Sie eine Gleitmittel-Augensalbe auf, um ein Austrocknen der Hornhaut während des chirurgischen Eingriffs zu vermeiden.
- Setzen Sie die Ratte in ein stereotaktisches Gerät und halten Sie den Kopf, indem Sie die Ohrstangen richtig in den Gehörgängen positionieren. Führen Sie dann die Schneidezähne der Ratte vorsichtig in die Schneidestange ein und befestigen Sie die Nasenklemme.
- Setzen Sie eine sterile Führungskanüle aus Edelstahl 26 G in die stereotaktische Halterung ein. Nehmen Sie ein Skalpell und machen Sie einen Schnitt in der Mittellinie entlang der Kopfhaut. Platzieren Sie 2 oder mehr Klammern um den Schnitt (2-3 cm).
- Befreien Sie den Schädel vollständig von Gewebe, bis sowohl die Bregma- als auch die Lambda-Schädelnähte sichtbar sind.
- Überprüfen Sie die symmetrische Positionierung des Kopfes durch die Ausrichtung der dorsoventralen und anteroposterioren Achse des Schädels mit dem Schneidezahn bzw. der Ohrstange. Identifizieren Sie die Koordinaten der Führungskanüle für die interessierende Hirnregion. Halten Sie das Bregma und das Lambda mit dem Schneidezahn in derselben horizontalen Ebene.
- Berechnen Sie die Koordinaten der Implantationsstelle der Führungskanüle in den interessierenden Bereich nach den stereotaktischen Koordinaten von Paxinos und Watson26 oder Swanson Atlas27.
HINWEIS: Für den primären interozeptiven Inselkortex wurden die folgenden stereotaktischen Koordinaten verwendet: Bregma -0,51 mm, Mittellinie 5,0 mm, Tiefe von der Schädeloberfläche 4,5 mm, medial um 10° von der Vertikalen abgewinkelt. - Überprüfen Sie die Koordinaten der Implantation der Führungskanüle, indem Sie sie nach unten bringen, bis sie den Schädel berühren, und bohren Sie dann an der überprüften Stelle ein Loch durch den Schädel. Bohren Sie 3 zusätzliche Löcher um den Zielbereich, um 3 Schrauben in den Schädel zu setzen.
- Führen Sie die Kanüle in den interessierenden Hirnbereich ein und verankern Sie die Kanüle mit Schrauben und Zahnacryl am Schädel. Gießen Sie Zahnacryl auf den trockenen Schädel und stellen Sie sicher, dass es die Schrauben bedeckt, um die Kanüle zu fixieren. Lassen Sie das Zahnmetall aus Kunststoff aushärten und entfernen Sie dann vorsichtig den stereotaktischen Arm, wobei Sie die Führungskanüle an Ort und Stelle belassen.
HINWEIS: Dieses Verfahren immobilisiert die implantierte Kanüle und ermöglicht es den Experimentatoren, mehrere Mikroinjektionen im interessierenden Bereich durchzuführen. - Setzen Sie ein Mandrin aus Edelstahl in die Führungskanüle ein, um Verstopfungen und Verunreinigungen zu vermeiden.
- Am Ende der Operation ist eine Einzeldosis des Antibiotikums (Enrofloxacin 5%; 19 mg/kg i.p.) und des entzündungshemmenden (Ketophen 0,2 mg/kg i.p.) zu verabreichen. Wiederholen Sie diesen Schritt an drei aufeinanderfolgenden Tagen nach der Operation.
- Lassen Sie die Ratten mindestens eine Woche lang vollständig genesen, bevor Sie mit den Experimenten beginnen.
- Halten Sie die Ratten mindestens zehn Tage vor Beginn der Experimente unter einem umgekehrten Hell-Dunkel-Zyklus von 12/12 h (Licht an um 19:00 Uhr) (Abbildung 2).
HINWEIS: Wenn der Experimentator einen chirurgischen Eingriff durchführen muss, muss er dies vor der Umkehrung des Dunkellichtzyklus durchführen. Dies ermöglicht es, den Stress nach der Operation zu reduzieren. - Behandeln Sie alle Ratten für 20 min/Tag für 2-3 Tage. Nehmen Sie eine Ratte nach der anderen, halten Sie das Tier sicher am Oberkörper (nicht am Schwanz) und streicheln Sie es während dieser Zeit. Wenn Tiere Anzeichen von Stress zeigen, fassen Sie sie über einen längeren Zeitraum an.
HINWEIS: Dieser Schritt ist wichtig, um den Handhabungsaufwand zu minimieren, der sich auf die folgenden Schritte auswirken kann. - Die Tiere vor den Versuchen drei Tage lang 30 min/Tag lang der Versuchskammer (Katzengeruchskammer mit ungetragenem Katzenhalsband) aussetzen, damit sich die Tiere an den Testkontext gewöhnen können.
HINWEIS: Es wird empfohlen, dass der Versuchsleiter keine parfümierten Parfüms oder Lotionen tragen sollte. - Nachdem Sie das Tier in die Kammer gelegt haben, warten Sie ca. 10-15 Minuten, führen Sie einen Arm in die Testkammer ein und tauschen Sie das Katzenhalsband gegen ein anderes Katzenhalsband mit den gleichen Merkmalen aus.
HINWEIS: Dieser Schritt ist entscheidend, um jeden Schritt der Verhaltensverfahren so genau wie möglich zu simulieren, um Stress zu minimieren, der die Verhaltensleistung der Ratte in den letzten 10 Minuten des Tests beeinträchtigen kann. - Reinigen Sie die Prüfkammer zwischen den Sitzungen mit 5 % (v/v) Ethanol.
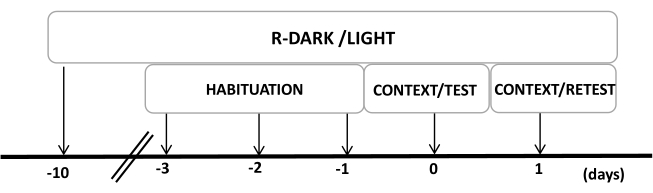
Abbildung 2: Zeitleiste des Versuchsdesigns. Die Ratten wurden 10 Tage lang einem umgekehrten Dunkel-Licht-Zyklus ausgesetzt und gewöhnten sich dann in den letzten drei Tagen 30 Minuten lang an die Testkammer mit einem (ungetragenen) Kontrollhalsband für Katzen. An Tag 0 wurden die Ratten zunächst 10 Minuten lang einer vertrauten Testkammer (CONTEXT) ausgesetzt und dann für einen weiteren Zeitraum von 10 min (TEST) im selben Kontext einem Halsband mit oder ohne Katzengeruch (TEST) ausgesetzt. An Tag 1 wurden Ratten, die an Tag 0 Katzengeruch (TEST) ausgesetzt waren, für 10 Minuten in dieselbe Testkammer zurückgebracht (CONTEXT) und für einen weiteren Zeitraum von 10 Minuten erneut Katzengeruch ausgesetzt (RETEST). Diese Zahl wurde von 8 geändert. Abkürzung: R-Dark/light = umgekehrter Dunkel-Hell-Zyklus. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Verfahren zur Untersuchung von Katzengeruch
- Bewerten Sie an Tag 0 des Versuchsprotokolls die Bedrohungsreaktionen auf den Katzengeruch.
- Falls erforderlich, verabreichen Sie vor den Verhaltenstests kortikale Injektionen nach der unten beschriebenen Methode. Wenn Sie nur ein Verhaltensprotokoll ausführen, überspringen Sie diesen Schritt und fahren Sie mit Schritt 4.3 fort.
- Führen Sie eine sterile 33-G-Injektionskanüle, die mit einer 1-μl-Hamilton-Spritze gekoppelt ist, in die Führungskanüle ein, nachdem Sie den Okkluder entfernt haben.
- Füllen Sie die Hamilton-Spritze mit steriler Kochsalzlösung (Kontrollratten) oder dem GABA-A-Rezeptoragonisten, Muscimol (Behandlungsratten) und injizieren Sie 0,5 μl/Hemisphäre über 2 Minuten. Warten Sie 2 Minuten, um die Diffusion des Arzneimittels zu ermöglichen, entfernen Sie langsam die Injektionskanüle und setzen Sie sofort die Okkluder ein.
HINWEIS: Führen Sie diesen Schritt an einem ruhigen, wachen Tier durch und injizieren Sie die Arzneimittel langsam, um das Zittern der Injektionskanüle und die daraus resultierende Diffusion in benachbarte Gehirnbereiche zu minimieren. - Sobald die kortikale Injektion/Hemisphäre abgeschlossen ist, warten Sie 30 Minuten und fahren Sie mit dem nächsten Schritt fort.
- Setzen Sie die Tiere für 20 Minuten in die Versuchskammer. Setzen Sie die Tiere während der ersten 10 Minuten einem ungetragenen, vertrauten Halsband aus. Führen Sie das mit Katzengeruch imprägnierte Halsband (TEST) oder ein ungetragenes vertrautes Halsband (CONTEXT) bis zu den nächsten 10 Minuten ein (Abbildung 3).
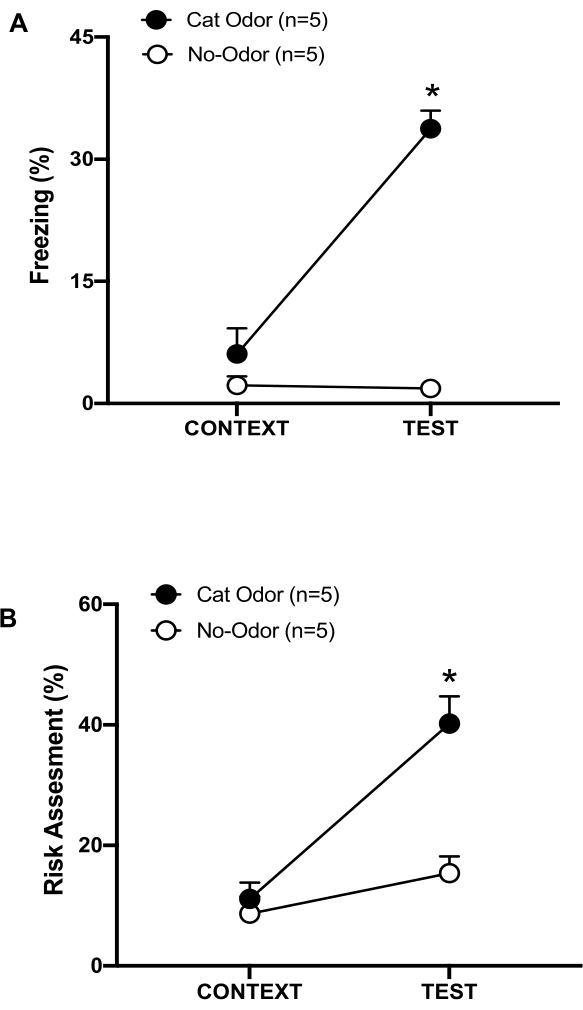
Abbildung 3: Die Begegnung mit Katzengerüchen erhöht das angeborene Abwehrverhalten. (A, B) Ratten wurden zunächst für 10 min der bekannten Testkammer (CONTEXT) ausgesetzt und dann für einen weiteren Zeitraum von 10 min im gleichen Kontext einem Halsband mit Katzengeruch (Katzengeruchsgruppe, schwarze Kreise) oder ohne Katzengeruch (No-Odor-Gruppe, offene Kreise) ausgesetzt. Die Kreise zeigen den Prozentsatz der Zeit, die naive Ratten mit dem Einfrieren (B) und der Risikobewertung (C) verbracht haben. Die Daten werden als Mittelwert +SEM ausgedrückt. *p < 0,05. Diese Zahl wurde von 8 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Platzieren Sie eine Videokamera vor der Versuchskammer und zeichnen Sie das Verhalten des Tieres auf, um es später von einem Experimentator in Kenntnis der Versuchsbedingungen bewerten zu können.
- Bringen Sie die Tiere am Ende der Katzengeruchssitzung in ihre Heimatkäfige zurück und setzen Sie sie bis zur nächsten Sitzung wieder in die Tieranlage.
- Reinigen Sie die Prüfkammer zwischen den Sitzungen mit 5 % (v/v) Ethanol.
- Vierundzwanzig Stunden nach der Katzengeruchssitzung (Tag 1) bewerten Sie die Abwehrreaktionen auf den Testkontext.
- Wiederholen Sie bei Bedarf Schritt 4.2 vor der Kontextbelichtung.
- Bringen Sie die Ratten in dieselbe Testkammer mit dem ungetragenen vertrauten Halsband zurück und bewerten Sie das Abwehrverhalten, um das kontextuelle Bedrohungsgedächtnis während 10 Minuten zu messen (Abbildung 4).
- Platzieren Sie eine Videokamera vor der Versuchskammer und zeichnen Sie das Verhalten des Tieres auf, um es später von einem Experimentator in Kenntnis der Versuchsbedingungen bewerten zu können.
- Ersetzen Sie in den nächsten 10 Minuten das ungetragene vertraute Halsband, setzen Sie das Tier erneut einem Halsband mit Katzengeruch aus und messen Sie das Abwehrverhalten.
- Nach dem zweiten Kontakt mit Katzengeruch bringen Sie das Tier in seinen Käfig zurück und reinigen Sie die Prüfkammer mit 5 % (v/v) Ethanol. Setze die Ratte zurück in die Tieranlage.
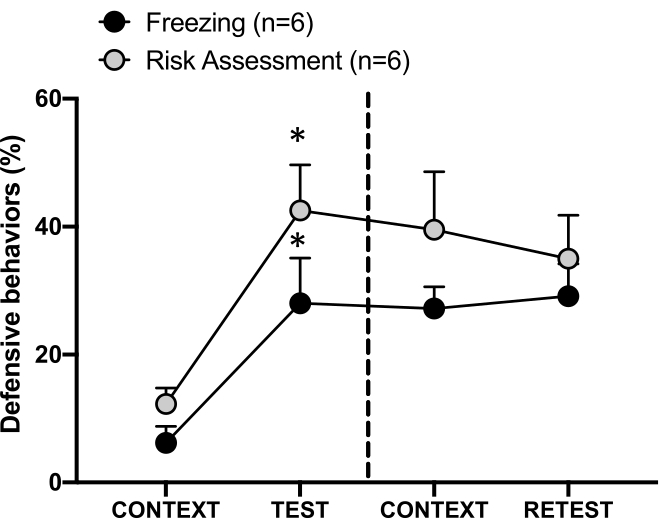
Abbildung 4: Die Begegnung mit Katzengerüchen induziert kontextuelles Bedrohungslernen. Die Kreise zeigen den Prozentsatz der Zeit, die mit dem Einfrieren verbracht wurde (schwarze Kreise) und das Verhalten bei der Risikobewertung (graue Kreise). Die gestrichelte Linie trennt den Test der angeborenen Angst (Tag 0, links) vom kontextuellen Angsttest (Tag 1, rechts). Die Daten werden als Mittelwert + SEM ausgedrückt. *p < 0,05. Diese Zahl wurde von 8 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Immunhistochemische Verfahren
- Betäuben Sie das Tier 90 Minuten nach Abschluss der Versuche mit einer intraperitonealen Mischung aus Ketamin (0,45 mg/kg) und Xylazin (0,05 mg/kg). Dann euthanasieren Sie die Ratte durch transkardiale Perfusion mit 4% Paraformaldehyd.
HINWEIS: Wenn es notwendig ist, die erste Exposition gegenüber Katzengeruch, die konditionierte Reaktion auf den Kontext oder die erneute Exposition gegenüber Katzengeruch zu bewerten, führen Sie diesen Schritt nach jeder dieser Versuchssituationen durch. Tragen Sie Handschuhe und einen Laborkittel und gehen Sie vorsichtig mit Paraformaldehyd unter einem chemischen Abzug um. - Fixieren Sie das Gehirn nach der Perfusion 2 h lang in der gleichen Fixierlösung und übertragen Sie es dann auf 30% Saccharose mit 0,02% Natriumazid in phosphatgepufferter Kochsalzlösung (PBS), bis das Gehirn zu Boden sinkt. Lagern Sie das Gehirn bei 4 °C.
- Frieren Sie das Gehirn mit Trockeneis ein und schneiden Sie es auf einem gleitenden Mikrotom in 50 μm dicke serielle koronale Schnitte. Sammeln Sie drei Sätze von Hirnschnitten des interessierenden Bereichs, wobei einer für die Überprüfung der Kanülenplatzierung und zwei Sätze für das immunhistochemische Verfahren übrig bleiben.
- Inkubieren Sie die frei schwebenden Gehirnabschnitte 30 Minuten lang in 0,3 % H2O2 in PBS, waschen Sie sie in PBS und übertragen Sie diese Abschnitte für 1 h in die Blocklösung (0,4 % Triton X-100, 0,02 % Natriumazid, 3 % normales Ziegenserum in PBS).
- Die Abschnitte werden in die primäre Antikörper-Inkubationslösung mit c-Fos-Antikörpern überführt, die 1:20.000 in einer Blockierungslösung verdünnt sind, und über Nacht bei Raumtemperatur belassen.
- Spülen Sie die Abschnitte 1 h lang in PBS und inkubieren Sie sie dann in der sekundären Antikörperlösung, die 1:1.000 in 0,4 % Triton X-100 und 1,5 % normalem Ziegenserum in PBS verdünnt ist.
- Spülen Sie die Schnitte 40 Minuten lang und inkubieren Sie sie 1 Stunde lang im Avidin/Biotin-basierten Peroxidasesystem (siehe Materialtabelle), verdünnt 1:500 in PBS.
- Spülen und inkubieren Sie die Schnitte in einer 0,05%igen Lösung von 3-3'-Diaminobenzidinhydrochlorid (DAB), die 0,003 %H2O2 und 0,05 % Nickelchlorid enthält, um ein dunkelblaues Reaktionsprodukt zu erhalten.
6. Zellzählung
- Untersuchen Sie Schnitte unter einer Camera Lucida mit einem Objektiv mit geringer Vergrößerung (10x), um die punktuelle c-Fos-Färbung in den Zellkernen von Neuronen zu lokalisieren (Abbildung 5).
- Verwenden Sie ein Zählraster, das sich auf die Größe des Interessenbereichs bezieht. Verwenden Sie für den pIC, z. B. von Bregma 0,95 bis -0,26, ein Zählgitter von 0,25 mm x 1 mm. von Bregma -0,51 bis -2,45 mm verwenden Sie ein Zählgitter von 0,5 mm x 1 mm.
- Quantifizieren Sie die Anzahl der immunreaktiven (Fos-ir) c-Fos-Zellen pro Schnitt mit Hilfe eines manuellen Ziffernzählers.
- Zählen Sie alle koronalen Abschnitte von Interesse zweimal und stellen Sie sicher, dass derselbe Beobachter, der für die experimentellen Bedingungen blind ist, die Zählung durchführt.
- Machen Sie ein Foto mit einem Mikroskop, das mit einer Digitalkamera gekoppelt ist.
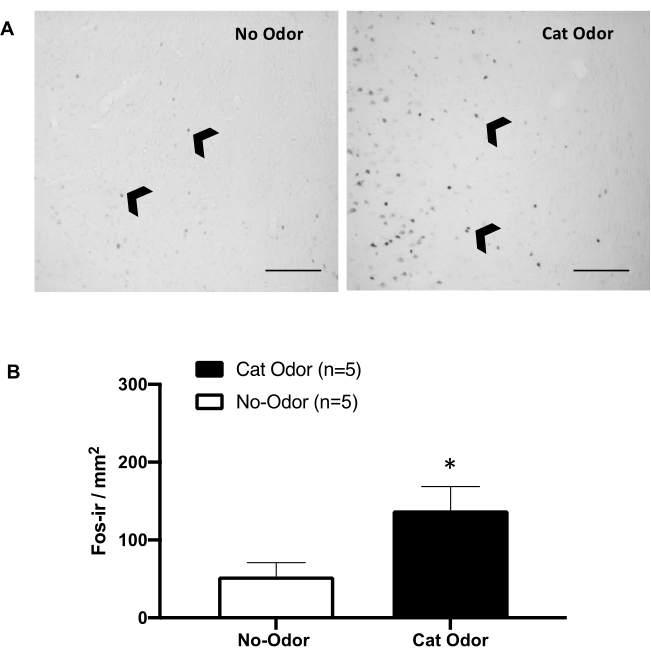
Abbildung 5: Katzengeruch löst eine neuronale Aktivierung im primären interozeptiven Kortex aus. (A) Repräsentative Mikrofotoaufnahme des pIC, die ein nahezu fehlendes Vorhandensein von c-Fos-ir-Zellen (schwarze Pfeilspitzen) bei Ratten zeigt, die einem ungetragenen Katzenhalsband ausgesetzt waren (kein Geruch, links), verglichen mit einer bemerkenswert erhöhten Anzahl von c-Fos-ir-Zellen bei Ratten, die Katzengeruch ausgesetzt waren (rechts). (B) Quantifizierung von c-Fos-ir-Zellen im pIC unter beiden Versuchsbedingungen. Die Daten werden als Mittelwert + SEM ausgedrückt. *p < 0,05. Maßstabsleisten = 200 μm. Diese Zahl wurde von 8 geändert. Abkürzungen: pIC = primärer interozeptiver Kortex; c-fos-ir = c-Fos-immunreaktiv. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Datenanalyse
- Bewerten Sie defensive Verhaltensweisen aus den videoaufgezeichneten Experimenten und analysieren Sie sie mit Hilfe von Statistiksoftware.
- Bewerten Sie das Einfrieren durch die Zeitmessung der Kämpfe, ausgedrückt als Prozentsatz der Zeit, die Sie während 10 Minuten mit dem Einfrieren verbracht haben. Berechnen Sie den prozentualen Anteil des Einfrierens mit Gl (1).
Einfrieren = (Sekunden des Einfrierens/600 s) × 100 (1)
HINWEIS: Das Einfrieren wurde definiert als das völlige Fehlen von Bewegung mit Ausnahme der Atmung für mindestens 1 s28. - Bewerten Sie die Risikobewertung, indem Sie wachsame Scanvorgänge zeitlich planen und als Prozentsatz der Zeit ausdrücken, die während 10 Minuten für die Risikobewertung aufgewendet wurde. Berechnen Sie den Prozentsatz der Risikobewertung mit Gl (2).
% Risikobewertung = (Sekunden in der Risikobewertung/600 s) × 100 (2)
HINWEIS: Das Verhalten zur Risikobewertung wurde definiert als wachsames Scannen (Observatorium, Kopfbewegungen von Seite zu Seite, ohne Fortbewegung) für mindestens 1 s29. - Bewerten Sie diese Verhaltensparameter manuell und stellen Sie sicher, dass sie von einem Experimentator gezählt werden, der für die Versuchsbedingungen (d. h. Geruchs- und Drogenbedingungen) verblindet ist. Verwenden Sie je nach Normalität der Datensätze parametrische oder nichtparametrische Tests, um zwei oder mehr Gruppen zu vergleichen.
HINWEIS: In dieser Studie wurden alle statistischen Tests mit SPSS-Software durchgeführt.- Verwenden Sie den Kruskal-Wallis-H-Test mit dem Mann-Whitney-U-Test für paarweise Vergleiche zwischen Gruppen.
- Analysieren Sie gruppeninterne Vergleiche im Zeitverlauf mit dem Friedman-Test, gefolgt vom Wilcoxon-Vorzeichen-Rang-Test für paarweise Vergleiche.
HINWEIS: In allen Abbildungen wurden die Signifikanzniveaus auf p < 0,05 (*) und p < 0,01 (**) festgelegt.
- Für die Analyse der c-Fos-Expression in bestimmten Hirnbereichen zählen Sie die Anzahl der c-Fos-positiven Zellen pro Schnitt, indem Sie die Dichte der c-Fos-ir-Zellen pro mm2 berechnen und vergleichen Sie die mittlere Anzahl zwischen kontrollierten (kein Geruch) und stimulierten (Katzengeruch) Bedingungen.
- Verwenden Sie je nach Normalität der Daten den t-Test des ungepaarten Schülers oder den Mann-Whitney-U-Test.
HINWEIS: In dieser Studie wurde der Mann-Whitney-U-Test verwendet; Unterschiede wurden als signifikant angesehen, wenn p < 0,05 (*).
- Verwenden Sie je nach Normalität der Daten den t-Test des ungepaarten Schülers oder den Mann-Whitney-U-Test.
Ergebnisse
In diesem Protokoll wurden die Prozentsätze des Einfrierens und der Risikobewertung als Indikatoren für Angst bzw. angstähnliche Zustände bei Ratten gemessen. Der Zeitplan des Versuchsdesigns ist in Abbildung 2 dargestellt. Die Ergebnisse der Tiere, die an Tag 0 Katzengeruch ausgesetzt waren, sind in Abbildung 3 dargestellt. Ratten zeigten signifikant höhere Gefrierwerte (Abbildung 2A, Katzengeruchsgruppe, Wilcoxon Signed-Ranks Test, Z = -2,201, p = 0,028) und Risikobewertung (Abbildung 2B, Katzengeruchsgruppe, Wilcoxon Signed-Ranks Test Z = -2,336 p = 0,018) als Reaktion auf Katzengeruch (TEST) als auf den vertrauten Kontext (CONTEXT). Niedrige Gefriergrade (Abbildung 2A, No-Odor-Gruppe, Wilcoxon-Signed-Ranks-Test, Z = -0,184, p = 0,854) und Risikobewertung (Abbildung 2B, No-Odor-Gruppe, Wilcoxon-Signed-Ranks-Test, Z = -1,753, p = 0,08) wurden bei Ratten beobachtet, die während des zweiten Teils des Tests einem ungetragenen Halsband ausgesetzt waren.
Zusätzliche Analysen ergaben, dass die Gefriergrade (Abbildung 2A, Mann-Whitney-Test, U = 0,000, p = 0,004) und die Risikobewertung (Abbildung 2B, Mann-Whitney-Test, U = 4,000, p = 0,025) während des zweiten Teils des Tests in der Katzengeruchsgruppe höher waren als in der geruchsneutralen Gruppe. Es gab keine signifikanten Unterschiede beim Einfrieren (Abbildung 2A, Mann-Whitney-Test, U = 11.000, p = 0,256) und der Risikobewertung (Abbildung 2B, Mann-Whitney-Test, U = 15.00, p = 0.627) zwischen den beiden Gruppen während der ersten 10 Minuten der Exposition gegenüber einem vertrauten Kontext (CONTEXT). Diese Ergebnisse zeigen, dass das Protokoll geeignet ist, um Abwehrverhaltensweisen als Reaktion auf Katzenfell-/Hautgeruch zu testen.
Die konditionierte Bedrohungsreaktion auf den Testkontext (CONTEXT) an Tag 1 ist in Abbildung 4 dargestellt. Ratten, die Katzengeruch ausgesetzt waren, wurden 24 Stunden nach der ersten Geruchsbegegnung des Raubtiers wieder in die Testkammer zurückgebracht. An Tag 1 wiesen die Tiere je nach Testkontext höhere Gefrier- (Wilcoxon-Vorzeichen-Rang-Test, Z = -2,366, p = 0,018) und Risikobewertungswerte (Wilcoxon-Vorzeichen-Rang-Test, Z = -2,201, p = 0,028) auf als an Tag 0. Darüber hinaus gab es keine Unterschiede im Einfrieren (Wilcoxon Signed-Ranks Test, Z = - 0,841, p = 0,400) oder in der Risikobewertung (Wilcoxon Signed-Ranks Test, Z = -0,943, p = 0,345) zwischen CONTEXT und RETEST. Die Ratten zeigten während des RETEST und des TEST die gleichen Gefrierwerte (Wilcoxon Signed-Ranks Test, Z = -0,105, p = 0,917) und Risikobewertung (Wilcoxon Signed-Ranks Test, Z = -0,980, p = 0,327). Diese Ergebnisse zeigten, dass eine einzige 10-minütige Exposition gegenüber Katzenfell/Hautgeruch zu einer erlernten Bedrohungsreaktion auf den Kontext führte, in dem die Tiere mit Raubtiergeruch konfrontiert wurden.
Abbildung 5 und Abbildung 6 zeigen zwei Versuchsreihen unter Verwendung des in diesem Artikel vorgestellten Protokolls. Wir haben getestet, ob der primäre interozeptive Kortex (pIC), eine Gehirnregion, die an der Emotionsverarbeitung beteiligt ist 8,30,31,32, für die Expression von Abwehrverhalten notwendig ist. Die durch Katzengeruch induzierte neuronale Aktivierung wurde im pIC durch Zählung von c-Fos-ir-Zellen in getrennten Tiergruppen bewertet: geruchslose und katzengeruchsbedingte Bedingungen. Diese Ratten wurden 90 Minuten nach Abschluss des TESTS eingeschläfert. Ein signifikanter Anstieg der Anzahl von c-Fos-ir-Neuronen im pIC wurde in der Katzengeruchsgruppe (Mann-Whitney-Test, U = 3.000, p = 0,016) im Vergleich zur Kontrollgruppe beobachtet (Abbildung 5).
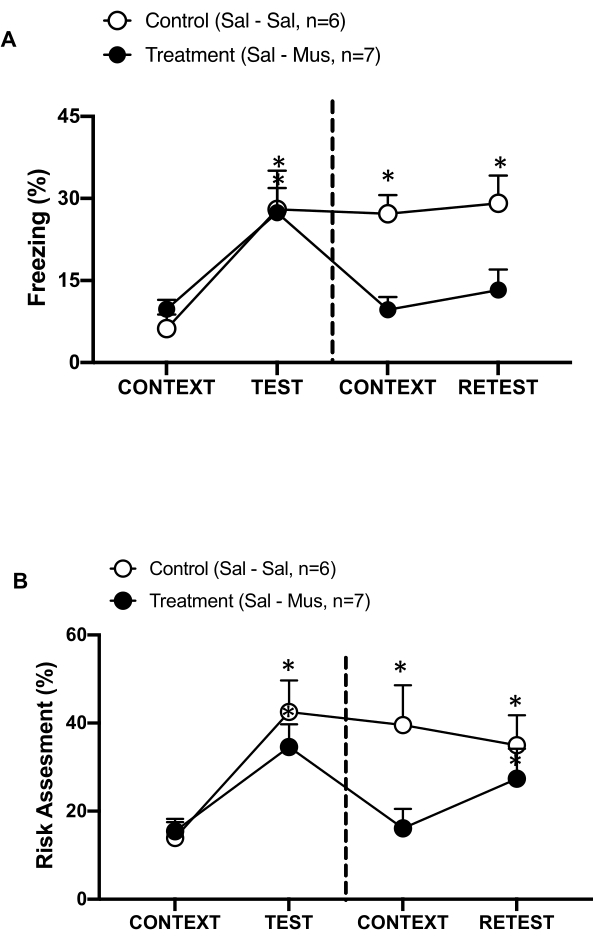
Abbildung 6: Die Muscimol-Inaktivierung des primären interozeptiven Kortex beeinträchtigt das kontextuelle Bedrohungsgedächtnis .(A, B) In der Behandlungsgruppe wurde an Tag 0 Kochsalzlösung und an Tag 1 im pIC Muscimol injiziert (Behandlungsgruppe). Kontrollratten wurde an beiden Tagen Kochsalzlösung in den pIC injiziert. An Tag 1 wurden die Tiere in die vertraute Testkammer zurückgebracht und für 10 Minuten dem CONTEXT und für einen weiteren Zeitraum von 10 Minuten dem Katzengeruch (RETEST) ausgesetzt. Die Kreise zeigen den Prozentsatz der Zeit, die im Einfrieren verbracht wurde (schwarze Kreise) und das Verhalten bei der Risikobewertung (offene Kreise). Die gestrichelte Linie trennt den Test der angeborenen Angst (Tag 0, links) vom kontextuellen Angsttest (Tag 1, rechts). Die Daten werden als Mittelwert + SEM ausgedrückt. *p < 0,05. Diese Zahl wurde von 8 geändert. Abkürzungen: pIC = primärer interozeptiver Kortex; Sal-Sal = Kochsalzlösung, die an Tag 0 und Tag 1 injiziert wird; Sal-Mus = Kochsalzlösung, die am Tag 0 und Muscimol am Tag 1 injiziert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wir haben auch den Effekt der Muscimol-Inaktivierung des pIC auf das kontextuelle Bedrohungsgedächtnis gemessen (Abbildung 6). Die Behandlungsgruppe (Sal-Mus-Ratten) erhielt an Tag 0 eine Kochsalzinjektion in das pIC und an Tag 1 den GABA-A-Agonisten Muscimol. Diese Gruppe von Tieren zeigte an Tag 1 im Vergleich zu Tag 0 keine Unterschiede in Bezug auf das Einfrieren (Abbildung 6A, Wilcoxon Signed-Ranks Test, Z = -0,140, p = 0,889) oder die Risikobewertung (Abbildung 6B, Wilcoxon Signed-Ranks Test, Z = -0,700, p = 0,484), was auf eine Beeinträchtigung des kontextuellen Bedrohungsgedächtnisses hinweist. Interessanterweise war das Einfrieren (Abbildung 6A, Wilcoxon-Vorzeichen-Rang-Test, Z = -2,100, p = 0,036), nicht aber die Risikobewertung (Abbildung 6B, Wilcoxon-Vorzeichen-Rang-Test, Z = -0,980, p = 0,327), während des RE-Tests im Vergleich zu TEST signifikant reduziert. Dieser letzte Befund deutet darauf hin, dass das Stummschalten des pIC an Tag 1 selektiv die Angst-, aber nicht die Angstreaktion auf den Raubtiergeruch beeinträchtigte. Zusammengenommen unterstützen diese Ergebnisse, dass das oben beschriebene experimentelle Protokoll für die Untersuchung von angeborenen und erlernten Abwehrreaktionen auf räuberische Bedrohungen geeignet ist.
Diskussion
Das hier beschriebene Protokoll bietet einen innovativen Ansatz zur Bewertung von Abwehrverhaltensweisen, die durch angeborene und erlernte aversive Reize hervorgerufen werden. Eine Testkammer ohne sicheres Versteck (Abbildung 1) und ein Halsband, das mit Haut-/Fellgeruch einer ovariektomierten weiblichen Hauskatze imprägniert war, wurden verwendet, um bei Ratten einen starken und anhaltenden Bedrohungszustand hervorzurufen, der nützlich sein könnte, um neuronale Schaltkreise zu untersuchen, die adaptiven und maladaptiven Abwehrreaktionen zugrunde liegen.
Es ist allgemein bekannt, dass das Zeigen spezifischer Abwehrreaktionen sowohl von den Merkmalen des Bedrohungsreizes als auch von der Situation/Umgebung abhängt, in der das Tier angetroffen wird21,33. Vermeidung, Risikobewertung und Einfrieren sind Teil eines riesigen Repertoires an tierischen Abwehrreaktionen, die durch bedrohliche Reize hervorgerufen werden können 9,19. Die Auswahl der vorherrschenden Abwehrreaktion hängt jedoch von den Umgebungsbedingungen ab, wie z. B. der Entfernung von der Bedrohung33 oder dem Vorhandensein eines sicheren Ortes innerhalb der Prüfkammer21, 33. Wenn Ratten beispielsweise in Gegenwart von Katzengeruch mit einem Versteck in die Arena gesetzt werden, zeigen sie defensive Verhaltensweisen wie Dehnungs-/Anwesenheitshaltungen, Kopf-aus-dem-Versteck-Box und Vermeidung 6,24,25. Im Gegensatz dazu werden Erstarrungsverhalten, wachsames Scannen und Stretch/Attend-Haltungen stark in Situationen hervorgerufen, in denen ein Entkommen nicht möglich ist und die Distanz zur Bedrohung nicht zu kurz ist33,34.
Studien haben gezeigt, dass die Exposition gegenüber einem unkontrollierbaren Stressor eine Vielzahl von Verhaltensfolgen hervorruft, die sich von denen unterscheiden, die auftreten, wenn der Stressor kontrollierbar ist 35,36,37,38. Zum Beispiel führt ein unausweichlicher, aber nicht entweichbarer Schwanzschock zu einem starken Anstieg des Serotonins im dorsalen Raphe-Kern35 und angstähnlichen Verhaltensweisen, die 24 Stunden nach der aversiven Erfahrung gemessen werden36. Darüber hinaus verstärken unkontrollierbare Stressoren die Angstkonditionierung bei Tieren36,37 und Menschen38. Unsere ursprüngliche Begründung für die Entwicklung des Protokolls bestand darin, Ratten einer Situation auszusetzen, in der sie den aversiven Reiz nicht kontrollieren können und daher starke und anhaltende Bedrohungsreaktionen zeigen und nach einer einzigen und kurzen Exposition gegenüber Katzengerüchen ein verbessertes kontextuelles Lernen entwickeln.
In dem hier beschriebenen Versuchsdesign evozierte das Fehlen eines Verstecks einen starken und anhaltenden Abwehrzustand, der zwischen Erstarren (d. h. völlige Unbeweglichkeit außer Atmung28) und Risikobewertung (d. h. wachsames Scannen und Dehnen/Betreuen29) wechselte, Verhaltensweisen, die bei Nagetieren normalerweise als Verhaltensmanifestationen von Angst bzw. angstähnlichen Zuständen angesehen werden (Abbildung 3). Bemerkenswert ist, dass das gleiche Muster von Abwehrreaktionen 24 Stunden später auftrat, als die Ratten erneut dem Testkontext ausgesetzt wurden, was darauf hindeutet, dass eine einzige 10-minütige Exposition gegenüber Katzenfell/Hautgeruch ausreicht, um ein lang anhaltendes kontextuelles Bedrohungslernen zu induzieren, wie zuvor berichtet 7,10,11,14,15,34,39 (Abbildung 4).
Ein Katzenhalsband mit einem internen Filzfutter wurde verwendet, um Gerüche/Düfte effizient zu sammeln und einzufangen und so eine zuverlässige Probe des Bedrohungsreizes zu erhalten, um eine starke Abwehrreaktion hervorzurufen. Forscher haben in ähnlichen Arbeiten aversive Reize wie Katzenkot, Urin oder Trimethylthiazolin (TMT, ein Bestandteil des Fuchskots) verwendet. Nichtsdestotrotz scheinen diese Reize weniger prädiktiv für die unmittelbare Anwesenheit eines Raubtiers zu sein, da sie weniger in der Lage sind, kontextuelles Lernen zu induzieren40,41. Nach früheren Befunden 2,4,8,9,10,11,20,34,39 ist Katzengeruch ein zuverlässiger angeborener aversiver Reiz, der bei Ratten anhaltende Abwehrreaktionen und ein kontextuelles Bedrohungsgedächtnis hervorrufen kann. Im Laufe der Jahre hat diese Art von ethologischem Verhaltenstiermodell zunehmend das Interesse von Forschern geweckt, Stress und stressbedingte Störungen zu untersuchen 13,14,15,16,17,23,42 wie solche, die mit maladaptiven Angsterinnerungen wie PTBS verbunden sind.
Dieses Protokoll soll in Verbindung mit einer Vielzahl von experimentellen Techniken verwendet werden, darunter beispielsweise molekular- und zellbiologische Ansätze und Elektrophysiologie bei wachen und sich verhaltenden Tieren, die die Möglichkeit bieten, offene Fragen zu beantworten und unser Verständnis von adaptiven und maladaptiven Bedrohungsreaktionen zu verbessern. In dieser Studie haben wir die Idee getestet, dass der pIC, eine Gehirnregion, die an der Emotionsverarbeitung beteiligt ist, für den Ausdruck von Abwehrverhalten notwendig ist. Verhaltensexperimente wurden mit c-Fos-Immunhistochemie gekoppelt, um Muster der neuronalen Aktivität im pIC als Reaktion auf Katzengeruch und intrazerebrale Infusionen des GABA-A-Rezeptoragonisten Muscimol zu kartieren, um den pIC reversibel zum Schweigen zu bringen und seine Beteiligung an angeborenen und erlernten Bedrohungsreaktionen auf Raubtiergeruch zu bestimmen. Diese Ergebnisse zeigten, dass Katzengeruch eine Zunahme der neuronalen Aktivität im pIC auslöste (Abbildung 5) und dass das Stummschalten des pIC zu einem starken Defizit des kontextuellen Bedrohungsgedächtnisses führte (Abbildung 6).
Obwohl das hier beschriebene Protokoll technisch einfach zu implementieren und durchzuführen ist, können einige Komplikationen auftreten. Zum Beispiel kann es zu einer Kreuzkontamination durch Katzengeruch kommen, wenn das ungetragene Halsband mit dem abgenutzten Katzenhalsband in Kontakt kommt. Daher müssen die Halsbänder bei allen Eingriffen getrennt aufbewahrt werden, und die Handschuhe sollten gewechselt werden, nachdem der getragene Kragen in die Prüfkammer gelegt wurde. Wenn der Versuchsleiter Geruchs- und Nichtgeruchsbedingungen in derselben Prüfkammer durchführen möchte, müssen die Versuche an verschiedenen Tagen durchgeführt werden. Für diese Experimente konnten zwei identische Versuchskammern verwendet werden34, und die Ratten sollten in getrennten Räumen gehalten werden, um soziale Kommunikation zu vermeiden43. Der Stress, der durch die Exposition gegenüber neuartigen Reizen in ungewohnten Umgebungen ausgelöst wird, kann ebenfalls ein Problem darstellen. Daher müssen sich die Tiere mindestens drei Tage lang an die Versuchsumgebung und die Verfahren gewöhnt haben, um den Stress und die Abwehrhaltung zu reduzieren, die Ratten in neuen Situationen üblicherweise an den Tag legen. Außerdem sollte die benötigte Zeit für die Gewöhnungszeit länger sein als die Testphase. Wenn der Test beispielsweise 10 Minuten dauert, sollten 20 oder 30 Minuten für die Gewöhnungszeit eingeplant werden.
Schließlich sollten defensive Verhaltensweisen vorzugsweise während der dunklen Phase des Zyklus bewertet werden, wenn Ratten aktiv sind. Die Ratten müssen in einem umgekehrten Hell-Dunkel-Zyklus gehalten werden, damit die Versuchsverfahren durchgeführt werden können, während sich sowohl die Ratte als auch der Versuchsleiter in ihrer aktiven Phasebefinden 34. Es dauert nicht länger als 10 Tage, bis sich die Änderung des Hell-Dunkel-Zyklus eingestellt hat, und erfahrungsgemäß reagieren die meisten Ratten unter dieser Bedingung angemessen auf den Katzengeruch. Es gibt jedoch einige Studien, die zeigen, dass die Sprague-Dawley-Ratten weniger anfällig für lang anhaltende Bedrohungskonditionierungen und Angstzustände sind als Wistar-Ratten44. Daher ist es möglich, dass die Verwendung von Wistar-Ratten anstelle von Ratten des Sprague-Dawley-Stammes zu robusteren Ergebnissen führen könnte.
Zusammenfassend lässt sich sagen, dass Katzengeruch ein ethologisch relevanter Bedrohungsreiz ist, der bei Ratten zuverlässige neuronale, endokrine und Verhaltensreaktionen hervorruft. Die Begegnung mit Katzengeruch in einer unentrinnbaren Kammer führt bei Ratten zu einer robusten und anhaltenden Angst-/Angstreaktion, was zu einem schnellen und dauerhaften kontextuellen Bedrohungslernen führt. Das oben beschriebene Protokoll könnte ein nützliches Werkzeug sein, um Angst und adaptive und maladaptive Mechanismen zur Kodierung des Bedrohungsgedächtnisses zu untersuchen.
Offenlegungen
Die Autoren dieses Manuskripts haben keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren danken Marcela Gonzalez für die Hilfe bei den Laborverfahren, Mabel Matamala für ihren Beitrag zum Protokolldesign und Miguel Rojas für die Hilfe bei der Illustration.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
Referenzen
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682(2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283(2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. , Elsevier Academic Press. Amsterdam. 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, Chapter 9, Unit 9 45(2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16(2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , Chapter 8, Unit 8.19 (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91(2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , Academic Press. San Diego. (1997).
- Swanson, L. W. Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , Elsevier. (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377(1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292(2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132(2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041(2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten