Method Article
一种不可避免的猫气味暴露方案,用于研究大鼠先天性和情境威胁条件反射
摘要
猫的皮肤/毛皮气味暴露为研究啮齿动物的神经回路和防御反应机制提供了一种可靠的方法,并可能为介导人类恐惧的机制提供见解。在这里,我们描述了一种用于研究内感受皮层在大鼠威胁反应中的作用的方案。
摘要
动物通过表现出许多防御行为来应对威胁情况,包括回避、冻结和风险评估。具有行为学方法的动物模型可以更深入地了解威胁反应背后的生物学机制。本文描述了一种测量大鼠对先天性和习得性厌恶刺激的防御行为的方法。动物在一个不可避免的房间里单独暴露在捕食者的气味中,以引发一种可测量的、持续的、防御性的状态。实验设计包括将大鼠放在熟悉的房间里 10 分钟,然后在相同的环境中再暴露于猫的气味中 10 分钟。第二天,将大鼠重新暴露在发生猫气味暴露的同一环境室中 10 分钟。会议被录像,并在这两天评估了防御行为。
行为测试与可逆功能失活和 c-Fos 免疫组化技术相结合,以确定内感受皮层在威胁反应中的作用。第一天暴露于猫气味并在第二天再次暴露于上下文室的大鼠表现出更高水平的防御行为,并且猫气味引起了内感受皮层神经活动的强烈增加。此外,内感受皮层的麝香酚失活降低了对猫气味和情境威胁记忆受损的防御行为的表达。这些结果表明,这种行为分析是研究防御行为的神经机制的有用工具,并可能为介导人类恐惧及其相关疾病的机制提供见解。
引言
防御行为是对预示着对动物生存构成潜在威胁的刺激的反应。这些行为在哺乳动物中高度保守,并迅速与与威胁相关的刺激或环境相关联 1,2,3。在自然界中,对大多数动物的威胁性刺激是捕食者;因此,检测捕食者线索,例如气味线索,对于避免捕食特别有利。对捕食者线索的行为反应已在啮齿动物中得到广泛研究。
例如,天然猫毛或皮肤气味等刺激会激活嗅觉和犁鼻系统,从而引起高水平的防御行为4。这些刺激伴随着神经元和内分泌活动的变化 5,6,7,8,它们是大鼠情境威胁条件反射的强烈、无条件、厌恶的刺激 7,8,9,10,11。研究表明,在暴露于自然捕食者线索后至少 24 小时,大鼠表现出强烈且持久的条件性焦虑样状态 7,12,13。这种现象对于开发更现实的创伤后应激障碍 (PTSD) 14,15,16,17、广泛性焦虑症 (GAD)5 和恐慌症 (PD)18,19 模型特别感兴趣。
在实验室环境中,恐惧行为被衡量为逃跑、逃避(例如,撤退、躲藏)或冻结。此外,焦虑可以通过伸展姿势和警惕的扫描来衡量,旨在监控掠夺性刺激——一组被广泛称为风险评估行为的反应 6,9,20。研究表明,冻结行为是大鼠对不可避免的威胁的主要防御策略,而当威胁模棱两可或非局部时,会观察到风险评估 12,21,32。尽管众所周知,先天或习得的刺激可以引发防御行为,但缺乏实验室行为范式,可以在更道德的行为学背景下可靠地捕捉防御反应。为了填补这一空白,我们设计了一个采用行为学方法的协议,该协议允许测量持续的先天和情境威胁行为以及大脑对自然威胁刺激的反应。
压力经历,例如暴露于不可避免的捕食者气味,会导致大鼠的行为和生理反应发生持久的变化 14,22,23。这些改变反映了在恐惧和焦虑相关疾病(如 PTSD)中观察到的症状特征。在目前的模型中,使用没有安全藏身区域的测试室,使大鼠暴露于不可避免的威胁事件中,从而增强防御反应。大鼠对猫气味和测试环境都表现出强烈的冻结和风险评估行为。这些发现支持使用该方案作为一种可靠且有效的方法来探索防御行为背后的生物学机制,并开发和完善治疗人类恐惧障碍的新策略。
研究方案
以下程序是根据美国国立卫生研究院(美国)实验动物护理和使用指南(NIH 出版物第 80-23 号,1996 年修订)的机构指南的建议进行的。智利天主教大学机构生物安全和伦理委员会批准了所有程序。所有实验均在大鼠的活动期(暗期)进行。
1. 测试室和测试室的准备
注意: 设备概述如图 1 所示。测试室是根据以前的研究开发和修改的 24,25。
- 使用透明矩形聚甲基丙烯酸甲酯测试室,尺寸如下:60 cm(长)x 40 cm(宽)x 40 cm(高)。用任何黑纸覆盖测试室的侧壁和后壁。确保测试室的正面是透明的,以记录动物的行为。
- 将钢支架固定在测试室右下角的地板上,并用它来连接猫项圈以进行测试程序。
- 测试前后用 5% (v/v) 乙醇清洁测试室,以去除实验大鼠留下的任何气味线索,避免大鼠的厌恶反应。每次疗程之间等待 5 分钟,让乙醇完全蒸发。
- 在位于测试室上方 20 cm 处的 80 W 红灯昏暗的安静房间里进行测试。使用位于房间前面的摄像机记录动物的行为。
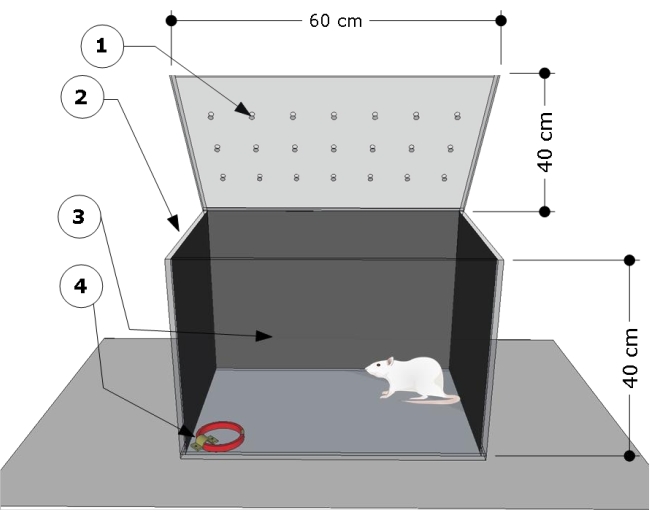
图 1:测试室的示意图。 该设备由一个测试室组成,其中有:(1) 通风孔,(2) 侧面和 (3) 深色后壁,以及一个锁定在左角地板 (4) 的钢支架,用于连接猫项圈(尺寸:宽 15 毫米,厚 5 毫米,长 300 毫米)。卡通上标明了腔室尺寸(60 L x 40 W x 40 H cm)。 请单击此处查看此图的较大版本。
2. 猫咪气味的准备
- 获得内表面有毛毡衬里的猫项圈,以更好地捕获猫的气味。确保有几个项圈可用作控制项圈(无气味)或测试项圈(猫臭)。
注意:关键是猫项圈必须有内衬,用于收集和捕获异味。 - 给家养的卵巢切除母猫戴上项圈,让猫在测试前戴上项圈一周。尽量让母猫戴上测试项圈留在室内。
注意:在整个研究过程中使用同一只猫。 - 将磨损的猫项圈保存在密封塑料容器中,并将其存放在 4 °C 下。 每三天用带有新鲜猫气味的项圈更换磨损的猫项圈。
3. 为实验程序准备大鼠
- 使用体重为 270-290 克的成年雄性 Sprague-Dawley 大鼠。将它们安置在单独的笼子里, 随意提供食物和水。
- [可选]为大鼠准备外科手术(可选)
- 在无菌条件下进行手术。用 70% 乙醇溶液清洁和消毒工作区域,并对所有手术材料和器械进行消毒。
- 用氯胺酮 (100 mg/kg) 和甲苯噻嗪 (20 mg/kg) 的腹膜内混合物麻醉大鼠。等到达到适当的麻醉平面时,当大鼠对脚趾捏刺激或角膜刺激没有反应时。为了在整个手术过程中保持麻醉状态,每 45 分钟服用额外剂量的麻醉鸡尾酒。
- 从耳后到眼睛之间轻轻剃掉大鼠的头部,然后用无菌酒精制备垫对手术区域进行消毒,然后用聚维酮碘溶液消毒。涂抹润滑眼膏以避免手术过程中角膜干燥。
- 将大鼠置于立体定位装置中,并通过将耳杆正确放置在耳道中来固定头部。然后,轻轻地将大鼠的门牙插入门牙杆并固定鼻夹。
- 将无菌的 26 G 不锈钢导向套管放入立体定位支架中。拿一把手术刀,沿着头皮做一个中线切口。在切口周围放置 2 个或更多夹子 (2-3 cm)。
- 完全清除颅骨上的组织,直到可以看到前囟和 lambda 颅缝线。
- 分别使用门牙和耳杆对准颅骨的背腹轴和前后轴,验证头部的对称位置。确定感兴趣大脑区域的导向套管的坐标。使用门牙棒将前囟和 lambda 保持在同一水平面上。
- 根据 Paxinos 和 Watson26 或 Swanson atlas27 的立体定位坐标,计算引导套管植入部位到感兴趣区域的坐标。
注意:对于初级内感受岛叶皮层,使用以下立体定位坐标:前囟 -0.51 毫米,中线 5.0 毫米,距颅面深度 4.5 毫米,与垂直方向内侧成 10° 角。 - 检查导套管植入坐标,将其放下直至接触颅骨,然后在验证部位的颅骨上钻一个孔。在目标区域周围再钻 3 个孔,将 3 个螺钉放入颅骨中。
- 将套管插入感兴趣的大脑区域,并使用螺钉和牙科丙烯酸将套管固定在颅骨上。将牙科丙烯酸倒在干燥的头骨上,并确保它覆盖螺钉以将套管固定到位。让丙烯酸牙科硬化,然后小心地取下立体定位臂,将引导套管留在原位。
注意:该程序固定植入的套管,并允许实验者在感兴趣区域进行多次显微注射。 - 将不锈钢管心针插入导向套管,以避免阻塞和污染。
- 手术结束时,给予单剂量抗生素(恩诺沙星 5%;腹腔注射 19 mg/kg)和抗炎药(酮啡 0.2 mg/kg ip)。手术后连续三天重复此步骤。
- 在开始实验之前,让大鼠完全恢复至少一周。
- 在实验开始前至少10天,将大鼠保持在反向的12/12小时光照/黑暗循环下(晚上7:00开灯)(图2)。
注意:如果实验者需要进行任何外科手术,则必须在反转暗光循环之前进行。这样可以减轻手术后的压力。 - 处理所有大鼠 20 分钟/天,持续 2-3 天。一次只抓一只老鼠,牢牢抓住动物的躯干(而不是尾巴),并在此期间抚摸它们。如果动物表现出压力迹象,请长时间处理它们。
注意: 此步骤对于最大限度地减少可能影响以下步骤的处理压力至关重要。 - 在实验前三天,将动物预先暴露在测试室(带有未佩戴的猫项圈的猫气味室)中 30 分钟/天,以使动物适应测试环境。
注意:建议实验者不要使用有香味的香水或乳液。 - 将动物放入腔室后,等待大约 10-15 分钟,将一只手臂引入测试室,然后将猫项圈换成另一个具有相同功能的猫项圈。
注意:此步骤对于尽可能接近地模拟行为程序的每个步骤以尽量减少压力至关重要,这可能会影响大鼠在测试的最后 10 分钟内的行为表现。 - 在两次会议之间用 5% (v/v) 乙醇清洁测试室。
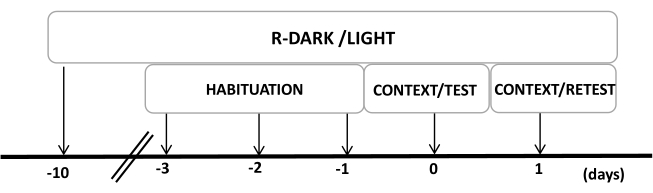
图 2:实验设计的时间表。 大鼠暴露于反向暗光循环 10 天,然后在最后三天习惯于包含对照(未佩戴)猫项圈的测试室 30 分钟。第 0 天,大鼠首先暴露于熟悉的测试室 (CONTEXT) 中 10 分钟,然后在相同环境中暴露于有或没有猫气味的项圈中额外暴露 10 分钟 (TEST)。第 1 天,将第 0 天暴露于猫气味 (TEST) 的大鼠放回同一检测室 10 分钟 (CONTEXT),并重新暴露于猫气味 (RETEST) 10 分钟。此数字已从 8 修改。缩写:R-Dark/light = 反向暗光循环。 请单击此处查看此图的较大版本。
4. 猫咪气味测试程序
- 在实验方案的第 0 天,评估对猫气味的威胁反应。
- 如有必要,请按照下述方法在行为测试前进行皮质注射。如果仅执行行为协议,请跳过此步骤并继续执行步骤 4.3。
- 移除封堵器后,将与 1 μL Hamilton 注射器耦合的无菌 33 G 注射套管插入导向套管。
- 用无菌盐水(对照大鼠)或 GABA-A 受体激动剂 muscimol(治疗大鼠)填充 Hamilton 注射器,并在 2 分钟内注射 0.5 μL/半球。等待 2 分钟让药物扩散,慢慢取出注射套管,并立即插入封堵剂。
注意:在安静、清醒的动物中执行此步骤,并缓慢注射药物,以尽量减少注射套管的抖动和随之而来的扩散到邻近的大脑区域。 - 皮质注射/半球完成后,等待 30 分钟,然后进行下一步。
- 将动物放入测试室 20 分钟。在前 10 分钟内,将动物暴露在未佩戴的熟悉项圈中。在接下来的 10 分钟内引入浸渍了猫气味的项圈 (TEST) 或未磨损的熟悉项圈 (CONTEXT)(图 3)。
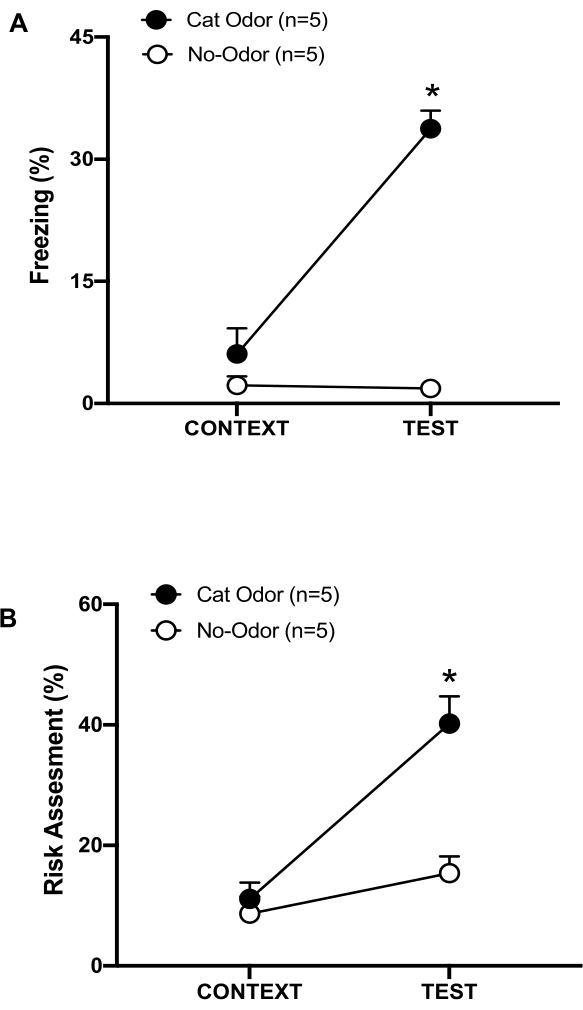
图 3:猫气味遭遇会增加先天防御行为。 (A、B) 首先将大鼠暴露于熟悉的测试室(CONTEXT)中 10 分钟,然后在相同环境中暴露于有猫气味(猫气味组,黑圈)或无猫气味(无气味组,空心圆圈)的项圈中额外 10 分钟 (TEST)。圆圈显示幼稚大鼠显示的冷冻 (B) 和风险评估 (C) 所花费的时间百分比。数据表示为平均值 +SEM。*p < 0.05。此数字已从 8 修改。 请单击此处查看此图的较大版本。
- 在测试室前放置一个摄像机并记录动物的行为,以便对实验条件不知情的实验者稍后进行行为评分。
- 在猫气味疗程结束时,将动物放回它们的家笼子里,并将它们放回动物设施中,直到下一次疗程。
- 在两次会议之间用 5% (v/v) 乙醇清洁测试室。
- 猫咪气味会议后 24 小时(第 1 天),评估对测试环境的防御反应。
- 如果需要,请在上下文暴露之前重复步骤 4.2。
- 将大鼠放回同一个测试室,戴上未佩戴的熟悉项圈,并对防御行为进行评分,以测量 10 分钟内的上下文威胁记忆(图 4)。
- 在测试室前放置一个摄像机并记录动物的行为,以便对实验条件不知情的实验者稍后进行行为评分。
- 在接下来的 10 分钟内,更换未佩戴的熟悉项圈,将动物重新暴露在有猫气味的项圈中,并测量防御行为。
- 第二次接触猫气味后,将动物放回笼子,并用 5% (v/v) 乙醇清洁检测室。将大鼠放回动物设施中。
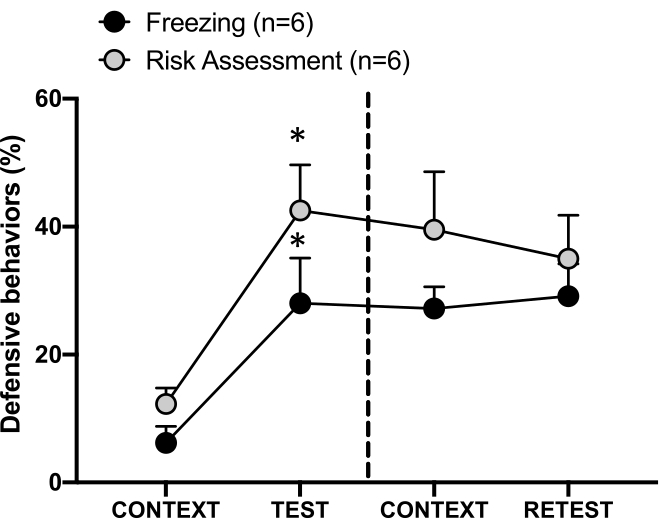
图 4:猫的气味遭遇会诱发情境威胁学习。 圆圈显示冻结时间(黑色圆圈)和风险评估行为(灰色圆圈)所花费的时间百分比。虚线将先天恐惧测试(第 0 天,左)与情境恐惧测试(第 1 天,右)分开。数据表示为均值 + SEM。*p < 0.05。此数字已从 8 修改。 请单击此处查看此图的较大版本。
5. 免疫组织化学程序
- 完成实验后 90 分钟,用氯胺酮 (0.45 mg/kg) 和甲苯噻嗪 (0.05 mg/kg) 的腹膜内混合物麻醉动物。然后,通过经心灌注 4% 多聚甲醛对大鼠实施安乐死。
注意:如果有必要评估第一次猫气味暴露、对环境的条件反应或再次暴露于猫气味,请在这些实验情况中的每一个之后执行此步骤。戴上手套和实验服,并在化学通风橱下小心处理多聚甲醛。 - 灌注后,将大脑固定在相同的固定液中 2 小时,然后将其转移到 30% 蔗糖和 0.02% 叠氮化钠的磷酸盐缓冲盐水 (PBS) 中,直到大脑沉入底部。将大脑储存在 4 °C。
- 使用干冰冷冻大脑,并在滑动切片机上将其切成 50 μm 厚的连续冠状切片。收集感兴趣区域的三组脑切片,留下一组用于验证套管放置,两组用于免疫组织化学程序。
- 将自由漂浮的脑切片在 0.3% H2O2 的 PBS 中孵育 30 分钟,在 PBS 中洗涤,并将这些切片转移到封闭(0.4% Triton X-100、0.02% 叠氮化钠、3% 正常山羊血清的 PBS 溶液中)溶液中 1 小时。
- 将切片转移至含有在封闭溶液中以 1:20,000 稀释的 c-Fos 抗体的一抗孵育溶液中,并在室温下放置过夜。
- 在 PBS 中冲洗切片 1 小时,然后在 0.4% Triton X-100 和 1.5% 正常山羊血清的 PBS 中以 1:1,000 稀释的二抗溶液中孵育。
- 冲洗切片 40 分钟,并在基于亲和素/生物素的过氧化物酶系统中孵育 1 小时(参见 材料表),在 PBS 中以 1:500 稀释。
- 在含有 0.003% H2O2 和 0.05% 氯化镍的 3-3' 盐酸二氨基联苯胺 (DAB) 的 0.05% 溶液中冲洗和孵育切片,以获得深蓝色反应产物。
6. 细胞计数
- 使用低倍 (10x) 物镜检查相机 lucida 下的切片,以定位神经元核中的 c-Fos 点状染色(图 5)。
- 使用与感兴趣区域的大小相关的计数网格。对于 pIC,例如,从 Pregma 0.95 到 -0.26,使用 0.25 mm x 1 mm 计数网格;从 Pregma -0.51 到 -2.45 mm,使用 0.5 mm x 1 mm 的计数网格。
- 使用数字手动计数器量化每个切片的 c-Fos 免疫反应性 (Fos-ir) 细胞的数量。
- 对所有感兴趣的冠状切片进行两次计数,并确保对实验条件视而不见的同一观察者进行计数。
- 使用显微镜和数码相机拍摄照片。
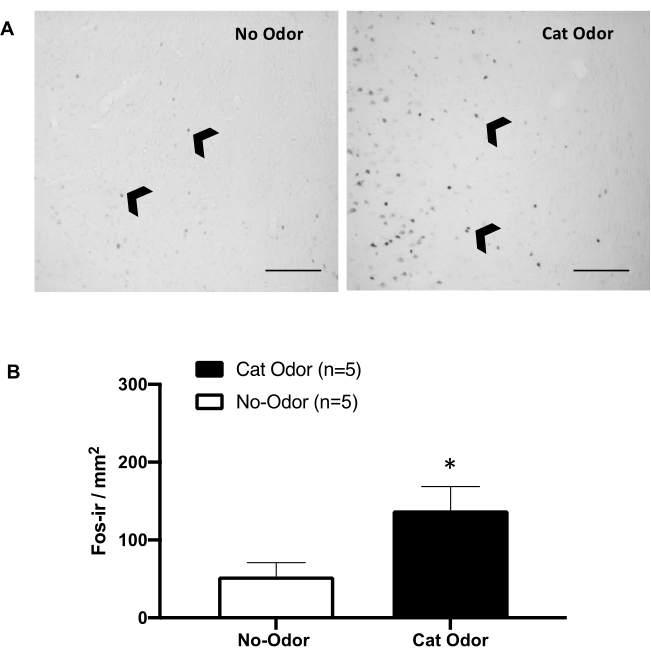
图 5:猫气味在初级内感受皮层中引起神经元激活。 (A) pIC 的代表性显微照片显示,暴露于未佩戴的猫项圈(无气味,左)的大鼠中几乎不存在 c-Fos-ir 细胞(黑色箭头),而暴露于猫气味的大鼠中 c-Fos-ir 细胞的数量显着增加(右)。(B) 在两种实验条件下 pIC 中 c-Fos-ir 细胞的定量。数据表示为均值 + SEM。*p < 0.05。比例尺 = 200 μm。此数字已从 8 修改。缩写: pIC = 初级内感受皮层;c-fos-ir = c-Fos-免疫反应性。 请单击此处查看此图的较大版本。
7. 数据分析
- 对视频录制的实验中的防御行为进行评分,并使用统计软件对其进行分析。
- 通过计时比赛评估冻结,表示为 10 分钟内冻结时间的百分比。使用 Eq (1) 计算冻结百分比。
冻结 =(冻结秒数/600 秒)× 100 (1)
注意:冻结被定义为至少 1 秒28 除呼吸外完全没有运动。 - 通过计时警惕扫描回合对风险评估进行评分,并将其表示为 10 分钟内风险评估时间的百分比。使用方程 (2) 计算风险评估的百分比。
% 风险评估 =(风险评估所用秒数/600 秒)× 100 (2)
注意:风险评估行为被定义为至少 1 秒29 的警惕扫描(天文台,左右头部运动,无移动)。 - 手动对这些行为参数进行评分,并确保它们由对实验条件(即气味和药物条件)不知情的实验者计数。根据数据集的正态性,使用参数或非参数检验来比较两个或多个组。
注:在本研究中,所有统计检验均使用 SPSS 软件进行。- 将 Kruskal-Wallis H 检验与 Mann-Whitney U 检验用于组间成对比较。
- 使用 Friedman 检验和 Wilcoxon 符号秩检验分析一段时间内的组内比较,以进行成对比较。
注:在所有图中,显著性水平均设置为 p < 0.05 (*) 和 p < 0.01 (**)。
- 为了分析特定大脑区域中的 c-Fos 表达,通过计算每 mm2 的 c-Fos-ir 细胞密度来计算每个切片的 c-Fos 阳性细胞的数量,并比较对照(无气味)和刺激(猫气味)条件之间的平均值。
- 根据数据的正态性,使用未配对的学生 t 检验或 Mann-Whitney U 检验。
注:在本研究中,使用了 Mann-Whitney U 检验;如果 P < 0.05 (*),则认为差异显著。
- 根据数据的正态性,使用未配对的学生 t 检验或 Mann-Whitney U 检验。
结果
在该协议中,冻结和风险评估百分比分别作为大鼠恐惧和焦虑样状态的指标进行测量。实验设计的时间表如图 2 所示。第 0 天暴露于猫气味的动物的结果如图 3 所示。大鼠对猫气味 (TEST) 的反应 (TEST) 比熟悉的环境 (CONTEXT) 响应,大鼠表现出显着更高的冻结水平 (图 2A,猫气味 组,Wilcoxon 符号秩测试 Z = -2.336 p = 0.018)。在测试的第二部分,暴露于未磨损项圈的大鼠中观察到低水平冻结(图 2A,无气味组,Wilcoxon 符号秩检验,Z = -0.184,p = 0.854)和风险评估(图 2B,无气味组,Wilcoxon 符号秩检验,Z = -1.753,p = 0.08)。
其他分析显示,在测试的第二部分,猫气味组的冻结水平(图 2A,Mann-Whitney 检验, U = 0.000,p = 0.004)和风险评估(图 2B,Mann-Whitney 检验, U = 4.000,p = 0.025)高于无气味组。在暴露于熟悉环境 (CONTEXT) 的前 10 分钟内,两组之间的冻结(图 2A,Mann-Whitney 检验, U = 11.000,p = 0.256)和风险评估(图 2B,Mann-Whitney 检验, U = 15.00,p = 0.627)没有显着差异。这些结果表明,该协议适用于测试对猫毛皮/皮肤气味的防御行为。
图 4 显示了第 1 天对测试环境 (CONTEXT) 的条件威胁反应。暴露于猫气味的大鼠在第一次遇到捕食者的气味后 24 小时被送回测试室。在第 1 天,动物表现出更高的冻结 (Wilcoxon Signed-ranks 检验,Z = -2.366,p = 0.018) 和风险评估 (Wilcoxon Signed-ranks 检验,Z = -2.201,p = 0.028) 水平响应测试环境比第 0 天。此外,CONTEXT 和 RETEST 之间的冻结 (Wilcoxon Signed-ranks 检验,Z = -0.841,p = 0.400) 或风险评估 (Wilcoxon Signed-ranks 检验,Z = -0.943,p = 0.345) 水平没有差异。大鼠在复测和测试期间表现出相同的冻结水平 (Wilcoxon Signed-ranks 检验,Z = -0.105,p = 0.917) 和风险评估 (Wilcoxon Signed-rank 检验,Z = -0.980,p = 0.327)。这些结果表明,单次 10 分钟的猫毛/皮肤气味暴露会导致对动物面对捕食者气味的环境的习得性威胁反应。
图 5 和图 6 显示了使用本文中介绍的协议的两组实验。我们测试了初级内感受皮层 (pIC),一个参与情绪处理 8,30,31,32 的大脑区域,对于防御行为的表达是否是必需的。通过在分离的动物组中计数 c-Fos-ir 细胞来评估猫气味诱导的神经元激活:无气味和猫气味条件。这些大鼠在 TEST 完成后 90 分钟被安乐死。与对照组相比,猫气味组 (Mann-Whitney 检验,U = 3.000,p = 0.016) 中 pIC 中 c-Fos-ir 神经元的数量显着增加(图 5)。
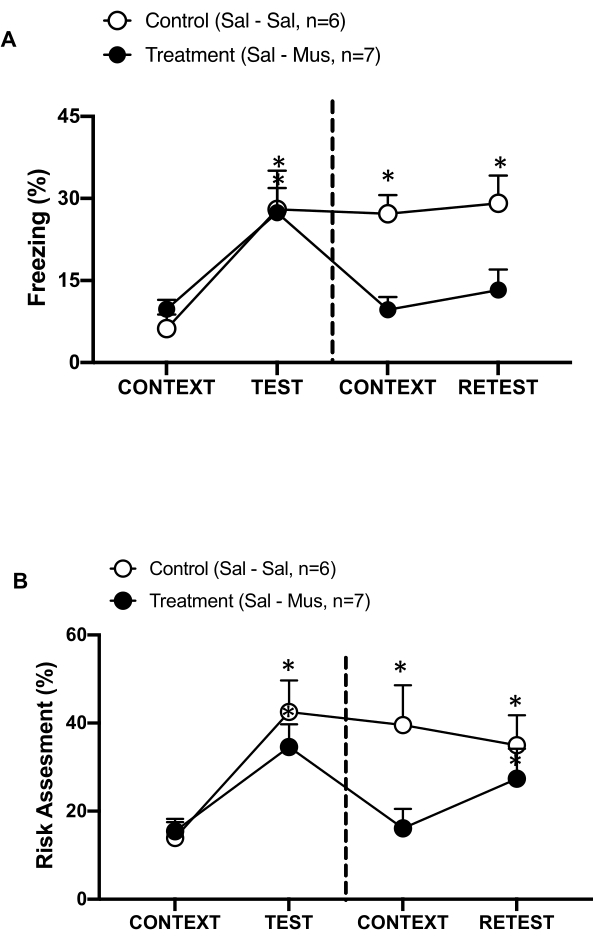
图 6:初级内感受皮层的 Muscimol 失活会损害情境威胁记忆。 (一、二)治疗组 pIC 第 0 天注射生理盐水,第 1 天注射麝香酚 (治疗组)。对照大鼠在两天的 pIC 中注射生理盐水。第 1 天,将动物放回熟悉的测试室,暴露于 CONTEXT 中 10 分钟,然后再次暴露于猫气味 (RETEST) 中 10 分钟。圆圈显示冻结 (黑色圆圈) 和风险评估行为 (空心圆圈) 所花费的时间百分比。虚线将先天恐惧测试(第 0 天,左)与情境恐惧测试(第 1 天,右)分开。数据表示为均值 + SEM。*p < 0.05。此数字已从 8 修改。缩写: pIC = 初级内感受皮层;Sal-Sal = 第 0 天和第 1 天注射生理盐水;Sal-Mus = 第 0 天注射生理盐水和第 1 天注射麝香酚。 请单击此处查看此图的较大版本。
我们还测量了 pIC 的 muscimol 失活对情境威胁记忆的影响(图 6)。治疗组 (sal-mus 大鼠) 第 0 天在 pIC 中接受生理盐水注射,第 1 天接受 GABA-A 激动剂麝香酚注射。与第 0 天相比,这组动物在第 1 天的冻结(图 6A,Wilcoxon 符号秩检验,Z = -0.140,p = 0.889)或风险评估(图 6B,Wilcoxon 符号秩检验,Z = -0.700,p = 0.484)水平上没有表现出任何差异,表明上下文威胁记忆受损。有趣的是,与 TEST 相比,在重测期间,冻结(图 6A,Wilcoxon 符号秩检验,Z = -2.100,p = 0.036),但风险评估(图 6B,Wilcoxon 符号秩检验,Z = -0.980,p = 0.327)显着减少。最后的发现表明,在第 1 天沉默 pIC 选择性地损害了对捕食者气味的恐惧反应,而不是焦虑反应。综上所述,这些结果支持上述实验方案适用于研究对捕食性威胁的先天和习得防御反应。
讨论
这里描述的协议提供了一种创新方法来评估由先天和习得厌恶刺激引起的防御行为。使用没有安全藏身区的测试室(图 1)和浸渍了卵巢切除的雌性家猫的皮肤/皮毛气味的项圈在大鼠中引发强烈而持续的威胁状态,这可能有助于研究适应性和适应不良防御反应的神经回路。
众所周知,特定防御反应的表现取决于威胁刺激的特征和遇到动物的情况/环境21,33。回避、风险评估和冻结是动物防御反应的一部分,这些反应可以由威胁性刺激诱发 9,19。然而,主要防御反应的选择取决于环境条件,例如与威胁的距离33 或测试室内是否存在安全场所21,33。例如,当老鼠被放置在带有藏身箱的竞技场中时,在猫气味存在的情况下,它们会表现出防御行为,例如伸展/参加姿势、头从藏身箱中出来和回避 6,24,25。相比之下,在无法逃脱的情况下,冻结行为、警惕扫描和伸展/参加姿势会强烈诱发,并且与威胁的距离不会太短33,34。
研究表明,暴露于无法控制的压力源会产生各种行为后果,这些后果与压力源可控时发生的后果不同 35,36,37,38。例如,不可避免但不可避免的尾部休克导致中缝背核 5-羟色胺大幅增加35 和厌恶经历后 24 小时测量的焦虑样行为36。此外,无法控制的压力源会增强动物36,37 和人类38 的恐惧条件反射。我们开发该协议的最初基本原理是将大鼠暴露在它们无法控制厌恶刺激的情况下,因此表现出强烈而持续的威胁反应,并在单次短暂的猫气味暴露后发展增强的情境学习。
在此处描述的实验设计中,没有藏身箱引起了一种强烈而持续的防御状态,这种状态在冻结(即除呼吸外完全不动28)和风险评估(即警惕扫描和伸展/注意姿势29)行为之间交替出现,这通常分别被认为是啮齿动物恐惧和焦虑样状态的行为表现(图 3).值得注意的是,当大鼠重新暴露于测试环境中时,24 小时后发生了相同的防御反应模式,这表明单次 10 分钟的猫毛/皮肤气味暴露就足以诱导持久的上下文威胁学习,如之前报道的那样 7,10,11,14,15,34,39 (图 4)。
带有内部毛毡衬里的猫项圈用于有效地收集和捕获气味/气味,从而获得可靠的威胁刺激样本,以引起强烈的防御反应。研究人员在类似的工作中使用了厌恶刺激,例如猫粪、尿液或三甲基噻唑啉(TMT,狐狸粪便的一种成分)。然而,这些刺激似乎不太能预测捕食者的直接存在,因为它们诱导情境学习的能力较弱40,41。根据之前的发现 2,4,8,9,10,11,20,34,39,猫气味是一种可靠的先天厌恶刺激,可以诱导大鼠持续的防御反应和情境威胁记忆。多年来,这种行为学行为动物模型越来越引起研究人员的兴趣,以研究压力和与压力相关的疾病 13,14,15,16,17,23,42,例如与适应不良恐惧记忆(如 PTSD)相关的疾病。
该协议旨在与各种实验技术结合使用,包括例如,清醒和行为动物的分子和细胞生物学方法以及电生理学,这为回答开放性问题和提高我们对适应性和适应不良威胁反应的理解提供了机会。在这项研究中,我们测试了 pIC(一个参与情绪处理的大脑区域)对于防御行为的表达是必需的想法。行为实验与 c-Fos 免疫组织化学相结合,以绘制 pIC 中神经元活动模式响应猫气味和 GABA-A 受体激动剂麝香酚的脑内输注,以可逆地使 pIC 沉默并确定其参与先天和习得的威胁反应捕食者气味。这些发现表明,猫的气味引起了 pIC 中神经元活动的增加(图 5),而沉默 pIC 会导致情境威胁记忆的严重缺陷(图 6)。
尽管此处描述的协议在技术上易于实现和执行,但可能会出现一些复杂性。例如,如果未磨损的项圈与磨损的猫项圈接触,可能会发生猫气味交叉污染。因此,在所有程序中都必须单独保存项圈,并且在将磨损的项圈放入测试室后应更换手套。如果实验者想使用相同的测试室进行有气味和无气味的条件,则必须在不同的日期进行实验。可以使用两个相同的测试室进行这些实验34,并且应将大鼠饲养在不同的房间内,以避免社交交流43。在不熟悉的环境中暴露于新刺激所引起的压力也可能是一个问题。因此,动物必须至少三天适应测试环境和程序,以减少老鼠在新情况下通常表现出的压力和防御性。此外,适应期所需的时间应长于测试期。例如,如果测试需要 10 分钟,则应为适应期分配 20 或 30 分钟。
最后,防御行为最好在周期的黑暗阶段进行评估,此时老鼠很活跃。大鼠必须保持在反向光照/黑暗循环下,以便在大鼠和实验者都处于活跃期时进行实验程序34。明/暗周期的变化需要不超过 10 天的时间才能解决,根据经验,在这种情况下,大多数大鼠对猫的气味反应充分。然而,有一些研究表明,与 Wistar 大鼠44 相比,Sprague-Dawley 大鼠更不容易受到长期威胁条件反射和焦虑的影响。因此,使用 Wistar 大鼠而不是 Sprague-Dawley 品系大鼠可能会产生更稳健的结果。
总之,猫气味是一种与行为学相关的威胁刺激,可在大鼠中引起可靠的神经元、内分泌和行为反应。在不可避免的房间里遇到猫的气味会导致大鼠产生强烈而持久的恐惧/焦虑反应,从而导致快速而持久的情境威胁学习。上述协议可能是研究恐惧以及适应性和适应不良威胁记忆编码机制的有用工具。
披露声明
本手稿的作者没有需要披露的竞争性经济利益或其他利益冲突。
致谢
作者非常感谢 Marcela Gonzalez 在实验室程序方面的帮助,Mabel Matamala 对方案设计的贡献,以及 Miguel Rojas 在插图方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
参考文献
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682(2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283(2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. , Elsevier Academic Press. Amsterdam. 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, Chapter 9, Unit 9 45(2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16(2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , Chapter 8, Unit 8.19 (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91(2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. The rat brain in stereotaxic coordinates. , Academic Press. San Diego. (1997).
- Swanson, L. W. Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , Elsevier. (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377(1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292(2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132(2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041(2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。