Method Article
쥐의 선천적 및 상황별 위협 조건화를 연구하기 위한 피할 수 없는 고양이 냄새 노출 프로토콜
요약
고양이 피부/털 냄새 노출은 설치류의 신경 회로와 방어 반응 메커니즘을 조사할 수 있는 신뢰할 수 있는 방법을 제공하며 인간의 두려움을 매개하는 메커니즘에 대한 통찰력을 제공할 수 있습니다. 여기에서는 쥐의 위협 반응에서 내부수용성 피질(interoceptive cortex)의 역할을 조사하기 위한 프로토콜에 대해 설명합니다.
초록
동물은 회피, 얼어붙기, 위험 평가를 포함한 여러 가지 방어 행동을 보임으로써 위협 상황에 대응합니다. 윤리학적 접근 방식을 사용하는 동물 모델은 위협 반응의 기저에 있는 생물학적 메커니즘에 대한 더 깊은 통찰력을 제공합니다. 이 논문은 쥐의 선천적 및 학습된 혐오 자극에 대한 방어 행동을 측정하는 방법론을 설명합니다. 동물들은 측정 가능하고 지속적이며 방어적인 상태를 이끌어내기 위해 피할 수 없는 방에서 포식자의 냄새에 개별적으로 노출되었습니다. 실험 설계는 쥐를 익숙한 방에 10분 동안 두었다가 같은 맥락에서 10분 동안 고양이 냄새에 다시 노출시키는 것이었습니다. 다음 날, 쥐는 고양이 냄새 노출이 발생한 동일한 컨텍스트 챔버에 10분 동안 다시 노출되었습니다. 세션은 비디오로 녹화되었으며 이틀 동안 방어 행동을 평가했습니다.
행동 검사는 가역적 기능 비활성화 및 c-Fos 면역조직화학 기술과 결합되어 위협 반응에서 내부수용성 피질의 역할을 결정했습니다. 첫날에 고양이 냄새에 노출되었다가 둘째 날에 컨텍스트 챔버에 다시 노출된 쥐는 더 높은 수준의 방어 행동을 보였으며, 고양이 냄새는 내부수용성 피질의 신경 활동을 강력하게 증가시켰습니다. 더욱이, 내부수용성 피질의 무시몰 비활성화는 고양이 냄새에 대한 반응으로 방어 행동의 표현을 감소시키고 맥락적 위협 기억을 손상시켰다. 이러한 결과는 이 행동 분석이 방어 행동의 신경 메커니즘을 연구하는 데 유용한 도구이며 인간의 두려움 및 관련 장애를 중재하는 메커니즘에 대한 통찰력을 제공할 수 있음을 보여줍니다.
서문
방어 행동은 동물의 생존에 대한 잠재적인 위협을 알리는 자극에 대한 반응으로 발생합니다. 이러한 행동은 포유류 전반에 걸쳐 고도로 보존되어 있으며 위협 1,2,3과 관련된 자극 또는 상황과 빠르게 연관됩니다. 자연에서 대부분의 동물을 위협하는 자극은 포식자입니다. 그러므로, 냄새 신호와 같은 포식자 신호의 감지는 포식을 피하는 데 특히 유리합니다. 포식자 신호에 대한 행동 반응은 설치류에서 널리 조사되었습니다.
예를 들어, 천연 고양이 털이나 피부 냄새와 같은 자극은 후각과 체구를 활성화하여 높은 수준의 방어 행동을 유도합니다4. 이러한 자극은 뉴런 및 내분비 활동의 변화를 동반하며, 5,6,7,8, 쥐의 상황별 위협 조건화를 위한 강력하고 무조건적이며 혐오적인 자극입니다 7,8,9,10,11. 연구에 따르면 자연 포식자 신호에 노출 된 후 최소 24 시간이 지나면 쥐는 강력하고 오래 지속되는 조건화 불안과 같은 상태를 나타냅니다7 , 12 , 13 . 이 현상은 외상 후 스트레스 장애(PTSD)14,15,16,17, 범불안장애(GAD)5 및 공황장애(PD)18,19의 보다 현실적인 모델을 개발하는 데 특히 관심이 있습니다.
실험실 환경에서 공포 행동은 도주, 회피(예: 후퇴, 숨음) 또는 얼어붙음으로 측정됩니다. 또한, 불안은 스트레칭 자세와 약탈적 자극을 모니터링하기 위한 주의 깊은 스캔으로 측정할 수 있으며, 이는 위험 평가 행동으로 널리 알려진 일련의 반응입니다 6,9,20. 연구에 따르면 쥐의 경우 피할 수 없는 위협에 대한 동결 행동이 지배적인 방어 전략인 반면, 위험 평가는 위협이 모호하거나 국지화되지 않은 경우 관찰됩니다 12,21,32. 타고난 자극이나 학습된 자극이 방어 행동을 이끌어낼 수 있다는 것은 알려져 있지만, 보다 윤리학적 맥락에서 방어 반응을 안정적으로 포착하는 실험실 행동 패러다임이 부족합니다. 이 간극을 메우기 위해 우리는 자연주의적 위협 자극에 대한 뇌 반응과 함께 지속적인 선천적 및 맥락적 위협 행동을 측정할 수 있는 윤리학적 접근 방식을 갖춘 프로토콜을 설계했습니다.
피할 수 없는 포식자 냄새에 노출되는 것과 같은 스트레스가 많은 경험은 쥐의 행동 및 생리적 반응에 지속적인 변화를 일으킵니다 14,22,23. 이러한 변화는 PTSD와 같은 두려움 및 불안 관련 장애에서 관찰되는 증상 프로필을 반영합니다. 현재 모델에서는 안전한 은신처 없이 테스트 챔버를 사용하여 쥐를 피할 수 없는 위협 이벤트에 노출시켜 방어 대응을 강화합니다. 쥐는 고양이 냄새와 테스트 맥락 모두에 반응하여 강력한 동결 및 위험 평가 행동을 보였습니다. 이러한 발견은 방어 행동의 기저에 있는 생물학적 메커니즘을 탐구하고 인간의 공포 장애 치료를 위한 새로운 전략을 개발 및 개선하기 위한 신뢰할 수 있고 유효한 방법으로 이 프로토콜의 사용을 뒷받침합니다.
프로토콜
다음 절차는 미국 국립보건원(National Institutes of Health, USA) Guide for the Care and Use of Laboratory Animals(NIH 간행물 번호 80-23, 1996년 개정)의 기관 지침의 권장 사항에 따라 수행되었습니다. 칠레 가톨릭 교황청(Pontificia Universidad Católica de Chile)의 기관 생물 안전 및 윤리 위원회(Institutional Bio-Safety and Ethical Committee)는 모든 절차를 승인했습니다. 모든 실험 세션은 쥐의 활성 단계(암흑기) 동안 수행되었습니다.
1. 시험실 및 테스트 챔버의 준비
알림: 이상view 장치의 그림은 그림 1에 나와 있습니다. 테스트 챔버는 이전 연구24,25에 따라 개발 및 수정되었습니다.
- 60cm(길이) x 40cm(너비) x 40cm(높이) 크기의 투명 직사각형 폴리(메틸 메타크릴레이트) 테스트 챔버를 사용합니다. 테스트 챔버의 측면과 후면 벽을 검은 종이로 덮습니다. 동물의 행동을 기록하기 위해 실험실의 전면이 투명한지 확인하십시오.
- 테스트 챔버의 오른쪽 하단 모서리에 있는 바닥에 강철 브래킷을 고정하고 이를 사용하여 테스트 절차를 위한 고양이 목걸이를 부착합니다.
- 실험 전후에 5%(v/v) 에탄올로 실험실을 청소하여 대상 쥐가 남긴 냄새 단서를 제거하고 쥐의 혐오 반응을 피하십시오. 에탄올이 완전히 증발할 때까지 각 세션 사이에 5분을 허용합니다.
- 시험실에서 20cm 위에 위치한 80W 빨간색 전구로 희미하게 조명이 켜진 조용한 방에서 테스트 세션을 수행합니다. 방 앞에 있는 비디오 카메라를 사용하여 동물의 행동을 기록하십시오.
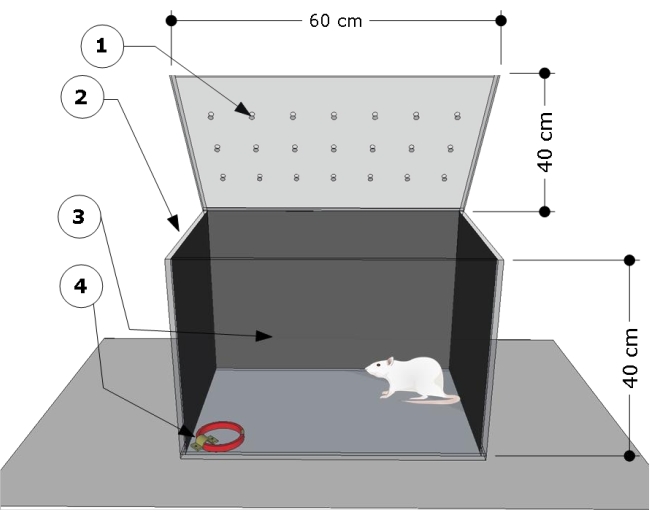
그림 1: 테스트 챔버의 개략도. 이 장치는 (1) 통풍구, (2) 측면 및 (3) 뒷벽이 어둡고 고양이 목걸이를 부착하기 위해 왼쪽 모서리 바닥 (4)에 잠긴 강철 브래킷으로 구성된 테스트 구획으로 구성됩니다 (크기 : 너비 15mm, 두께 5mm, 길이 300mm). 챔버 치수는 만화에 표시되어 있습니다(60 L x 40 W x 40 H cm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 고양이 냄새 대책
- 고양이 냄새를 더 잘 가두기 위해 펠트 안감이 있는 안쪽 얼굴이 있는 고양이 목걸이를 구하십시오. 대조군 칼라(냄새 없음) 또는 테스트 칼라(고양이 냄새)로 사용할 수 있는 여러 칼라의 가용성을 확인하십시오.
참고: 중요한 점은 고양이 목걸이에 냄새를 수집하고 가두기 위한 내부 안감이 있어야 한다는 것입니다. - 국내 난소 절제술을 받은 암컷 고양이에게 목걸이를 착용하고 고양이가 테스트하기 전에 일주일 동안 목걸이를 착용하도록 합니다. 테스트용 목걸이를 착용한 상태에서 암컷 고양이를 실내에 두십시오.
참고: 연구 내내 같은 고양이를 사용하십시오. - 마모된 고양이 목걸이는 밀폐 플라스틱 용기에 보관하고 4°C에서 보관하십시오. 낡은 고양이 목걸이는 3일에 한 번씩 신선한 고양이 냄새가 나는 목걸이로 교체하십시오.
3. 실험 절차를 위한 쥐 준비
- 무게가 270-290g인 성인 수컷 Sprague-Dawley 쥐를 사용하십시오. 차우와 물을 자유롭게 사용할 수 있는 개별 케이지에 보관하십시오.
- [선택 사항] 수술 절차를 위한 쥐 준비(선택 사항)
- 멸균 상태에서 수술을 수행합니다. 70% 에탄올 용액으로 작업 영역을 청소 및 소독하고 모든 수술 재료와 기구를 살균합니다.
- 케타민(100mg/kg)과 자일라진(20mg/kg)의 복강 내 혼합물로 쥐를 마취합니다. 쥐가 발가락 꼬집음 자극이나 각막 자극에 반응하지 않을 때 적절한 마취 평면이 달성될 때까지 기다립니다. 수술 내내 마취 상태를 유지하려면 45분마다 마취 칵테일을 추가로 투여하십시오.
- 쥐의 머리를 귀 뒤에서 눈 사이까지 부드럽게 면도하고 멸균 알코올 준비 패드로 수술 부위를 소독한 다음 포비돈 요오드 용액을 사용합니다. 수술 중 각막이 건조해지는 것을 방지하기 위해 윤활제 안연고를 바르십시오.
- 쥐를 입체 장치에 넣고 이어바를 외이도에 적절하게 배치하여 머리를 잡습니다. 그런 다음 쥐의 앞니를 앞니 막대에 부드럽게 삽입하고 코 클램프를 고정합니다.
- 멸균 26G 스테인리스 스틸 가이드 캐뉼러를 입체택시 홀더에 놓습니다. 메스를 들고 두피를 따라 정중선을 절개합니다. 절개 부위 (2-3cm) 주위에 2 개 이상의 클램프를 놓습니다.
- 브레그마와 람다 두개골 봉합사가 모두 보일 때까지 두개골 조직을 완전히 제거합니다.
- 앞니와 이어바를 각각 사용하여 두개골의 배복부와 전후 축의 정렬을 통해 머리의 대칭 위치를 확인합니다. 관심 있는 뇌 영역에 대한 가이드 캐뉼라의 좌표를 식별합니다. 앞니 막대를 사용하여 bregma와 lambda를 동일한 수평면에 유지합니다.
- Paxinos 및 Watson26 또는 Swanson atlas27의 입체 좌표에 따라 관심 영역으로 안내 캐뉼라 이식 부위의 좌표를 계산합니다.
참고: 1차 내부수용성 섬피질의 경우, 다음과 같은 입체성 좌표가 사용되었습니다: 브레그마 -0.51mm, 정중선 5.0mm, 두개골 표면으로부터의 깊이 4.5mm, 수직에서 내측으로 10° 각도. - 가이드 캐뉼라 이식 좌표를 두개골에 닿을 때까지 아래로 내려 확인한 다음 검증된 부위의 두개골을 통해 구멍을 뚫습니다. 대상 부위 주위에 3개의 추가 구멍을 뚫어 두개골에 나사 3개를 삽입합니다.
- 캐뉼라를 관심 있는 뇌 영역에 삽입하고 나사와 치과용 아크릴을 사용하여 캐뉼라를 두개골에 고정합니다. 마른 두개골에 치과용 아크릴을 붓고 캐뉼라를 제자리에 고정하기 위해 나사를 덮고 있는지 확인합니다. 아크릴 치과가 굳어지도록 한 다음 가이드 캐뉼러를 제자리에 두고 정위 암을 조심스럽게 제거합니다.
참고: 이 절차는 이식된 캐뉼라를 고정시키고 실험자가 관심 영역에서 여러 미세 주입을 수행할 수 있도록 합니다. - 스테인리스 스틸 탐침을 가이드 캐뉼러에 삽입하여 막힘과 오염을 방지하십시오.
- 수술 종료 시 항생제(엔로플록사신 5%; 19mg/kg i.p)와 항염증제(케토펜 0.2mg/kg i.p.)를 1회 투여합니다. 수술 후 3일 연속으로 이 단계를 반복합니다.
- 실험을 시작하기 전에 적어도 일주일 동안 쥐가 완전히 회복되도록 합니다.
- 실험이 시작되기 최소 10일 전에 쥐를 역으로 12/12시간의 라이트/다크 사이클(오후 7:00에 불을 켜짐)으로 유지합니다(그림 2).
참고: 실험자가 수술 절차를 수행해야 하는 경우 암흑광 주기를 역전시키기 전에 수행해야 합니다. 이를 통해 수술 후 스트레스를 줄일 수 있습니다. - 모든 쥐를 20-3일 동안 하루 20분 동안 처리하십시오. 한 번에 한 마리의 쥐를 데려다가 꼬리가 아닌 몸통을 단단히 잡고 이 시간 동안 쓰다듬습니다. 동물이 스트레스 징후를 보이면 장기간 다루십시오.
참고: 이 단계는 다음 단계에 영향을 줄 수 있는 취급 스트레스를 최소화하는 데 중요합니다. - 동물이 실험 환경에 적응할 수 있도록 실험 전 3일 동안 하루 30분 동안 동물을 실험실(착용하지 않은 고양이 목걸이가 있는 고양이 냄새 방)에 사전 노출시킵니다.
참고: 실험자는 향이 나는 향수나 로션을 착용해서는 안 됩니다. - 동물을 챔버에 넣은 후 약 10-15분 동안 기다렸다가 팔을 실험실에 넣고 고양이 목걸이를 동일한 기능을 가진 다른 고양이 목걸이로 교체합니다.
참고: 이 단계는 테스트의 마지막 10분 동안 쥐의 행동 수행에 영향을 미칠 수 있는 스트레스를 최소화하기 위해 행동 절차의 각 단계를 가능한 한 가깝게 시뮬레이션하는 것이 중요합니다. - 세션 사이에 5%(v/v) 에탄올로 테스트 챔버를 청소합니다.
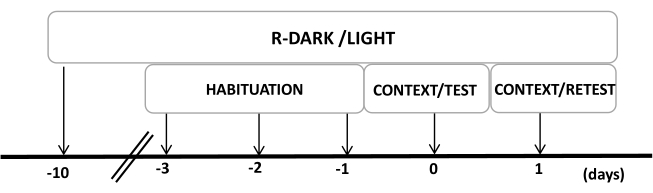
그림 2: 실험 설계의 타임라인. 쥐는 10일 동안 반전된 암흑광 주기에 노출된 다음 마지막 3일 동안 30분 동안 대조군(착용하지 않은) 고양이 목걸이가 있는 실험실에 익숙해졌습니다. 0일차에 쥐는 먼저 10분 동안 친숙한 테스트 챔버(CONTEXT)에 노출된 다음 동일한 맥락에서 10분(TEST)의 추가 기간 동안 고양이 냄새가 있거나 없는 목걸이에 노출되었습니다. 1일차에 0일차에 고양이 냄새(TEST)에 노출된 쥐를 10분 동안 동일한 실험실로 되돌려 보내고(CONTEXT) 추가로 10분 동안 고양이 냄새에 다시 노출(RETEST)했습니다. 이 수치는 8에서 수정되었습니다. 약어 : R-Dark/light = 역 dark-light cycle. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 고양이 냄새 테스트 절차
- 실험 프로토콜의 0일차에 고양이 냄새에 대한 위협 반응을 평가합니다.
- 필요한 경우, 아래에 설명된 방법에 따라 행동 테스트를 하기 전에 피질 주사를 투여합니다. 동작 프로토콜만 수행하는 경우 이 단계를 건너뛰고 4.3단계로 진행합니다.
- 폐색기를 제거한 후 1 μL Hamilton 주사기에 연결된 멸균 33 G 주입 캐뉼라를 가이드 캐뉼라에 삽입합니다.
- Hamilton 주사기에 멸균 식염수(대조군 쥐) 또는 GABA-A 수용체 작용제인 muscimol(치료 쥐)을 채우고 2분에 걸쳐 0.5μL/반구를 주입합니다. 약물이 확산될 때까지 2분 동안 기다렸다가 주입 캐뉼라를 천천히 제거한 다음 즉시 폐색을 삽입합니다.
참고: 조용하고 깨어 있는 동물에서 이 단계를 수행하고 약물을 천천히 주입하여 주입 캐뉼라의 지터와 그에 따른 인접 뇌 영역으로의 확산을 최소화합니다. - 피질 주사/반구가 완료되면 30분 동안 기다렸다가 다음 단계로 진행합니다.
- 동물들을 실험실에 20분 동안 눕힙니다. 처음 10분 동안은 동물들을 닳지 않은 익숙한 목걸이에 노출시킵니다. 다음 10분까지 고양이 냄새가 스며든 목걸이(TEST) 또는 착용하지 않은 친숙한 목걸이(CONTEXT)를 소개합니다(그림 3).
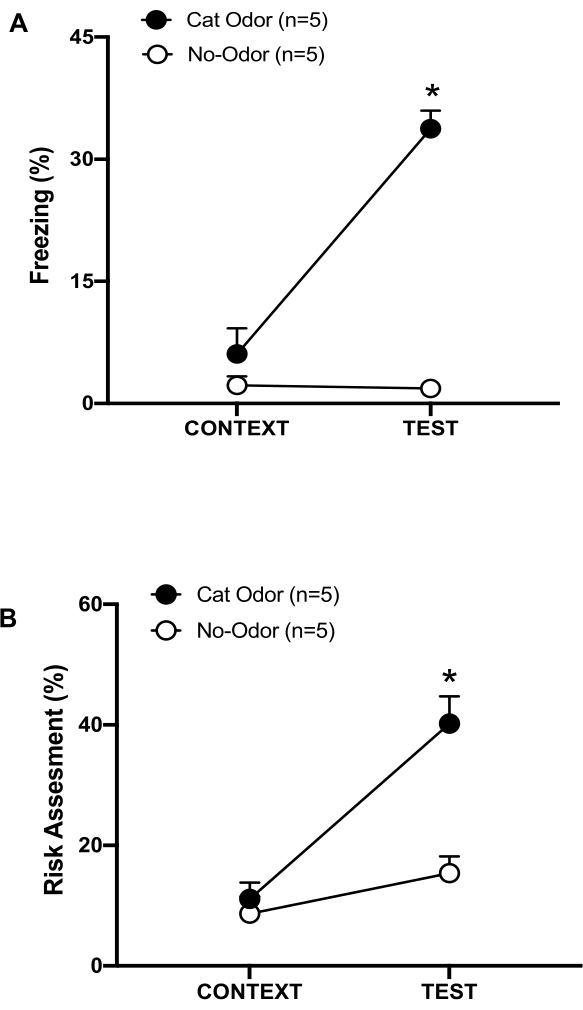
그림 3: 고양이 냄새를 맡은 쥐는 타고난 방어 행동을 증가시킵니다. (A, B) 쥐를 먼저 익숙한 실험실(CONTEXT)에 10분 동안 노출시킨 다음 동일한 맥락에서 고양이 냄새가 나는 목걸이(고양이 냄새 그룹, 검은색 원) 또는 고양이 냄새가 없는 목걸이(냄새 없음 그룹, 열린 원)에 추가로 10분(TEST) 노출시켰습니다. 원은 순진한 쥐가 표시한 동결(B) 및 위험 평가(C)에 소요된 시간의 백분율을 보여줍니다. 데이터는 평균 +SEM으로 표현됩니다. *p < 0.05. 이 수치는 8에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 실험실 앞에 비디오 카메라를 설치하고 동물의 행동을 기록하여 실험 조건을 알지 못하는 실험자가 나중에 행동 점수를 매길 수 있습니다.
- 고양이 냄새 세션이 끝나면 동물을 집 우리로 되돌리고 다음 세션까지 동물 시설에 다시 넣습니다.
- 세션 사이에 5%(v/v) 에탄올로 테스트 챔버를 청소합니다.
- 고양이 냄새 세션(1일차) 후 24시간이 지나면 테스트 상황에 대한 방어 반응을 평가합니다.
- 필요한 경우 상황에 노출되기 전에 4.2단계를 반복합니다.
- 쥐를 착용하지 않은 친숙한 목걸이가 있는 동일한 실험실로 되돌려 놓고 10분 동안 상황별 위협 기억을 측정하기 위해 방어 행동에 대한 점수를 매깁니다(그림 4).
- 실험실 앞에 비디오 카메라를 설치하고 동물의 행동을 기록하여 실험 조건을 알지 못하는 실험자가 나중에 행동 점수를 매길 수 있습니다.
- 다음 10분 동안 착용하지 않은 익숙한 목걸이를 교체하고, 고양이 냄새가 나는 목걸이에 동물을 다시 노출시키고, 방어 행동을 측정합니다.
- 고양이 냄새에 두 번째 노출된 후에는 동물을 가정용 케이지로 되돌리고 5%(v/v) 에탄올로 실험실을 청소합니다. 쥐를 동물 시설에 다시 넣으십시오.
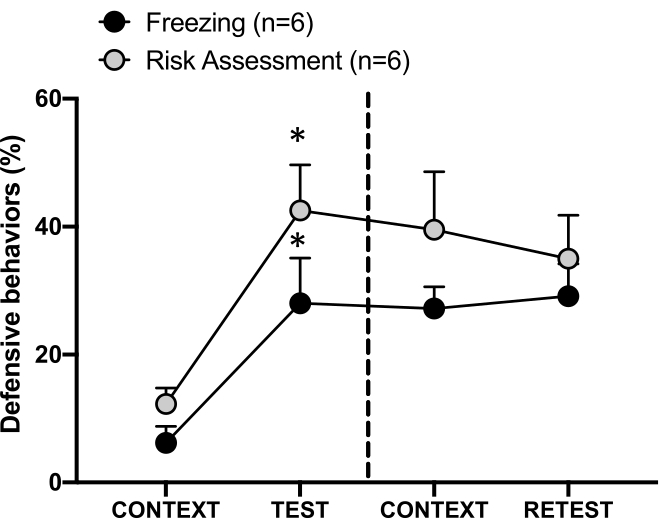
그림 4: 고양이 냄새 조우는 상황별 위협 학습을 유도합니다. 원은 동결에 소요된 시간(검은색 원)과 위험 평가 동작(회색 원)을 보여줍니다. 점선은 타고난 공포 테스트(0일차, 왼쪽)와 상황별 두려움 테스트(1일차, 오른쪽)를 구분합니다. 데이터는 means + SEM으로 표현됩니다. *p < 0.05. 이 수치는 8에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 면역조직화학적 절차
- 실험 완료 90분 후 케타민(0.45mg/kg)과 자일라진(0.05mg/kg)의 복강 내 혼합물로 동물을 마취합니다. 그런 다음 4% 파라포름알데히드를 경심 관류하여 쥐를 안락사시킵니다.
참고: 첫 번째 고양이 냄새 노출, 상황에 대한 조건화된 반응 또는 고양이 냄새에 대한 재노출을 평가해야 하는 경우 이러한 각 실험 상황 후에 이 단계를 수행하십시오. 장갑과 실험복을 착용하고 화학 흄 후드 아래에서 파라포름알데히드를 조심스럽게 다루십시오. - 관류 후 동일한 고정액에 뇌를 2시간 동안 고정한 다음 뇌가 바닥으로 가라앉을 때까지 인산염 완충 식염수(PBS)에 0.02% 아지드화나트륨이 포함된 30% 자당으로 전환합니다. 뇌는 4 °C에서 보관하십시오.
- 드라이아이스를 사용하여 뇌를 얼리고 슬라이딩 마이크로톰에서 50μm 두께의 연속 관상 절편으로 자릅니다. 관심 영역의 뇌 절편 3세트를 수집하여 하나는 캐뉼라 배치 검증을 위해, 두 세트는 면역조직화학 절차를 위해 남습니다.
- PBS의 0.3% H2O2 에서 자유 부유 뇌 절편을 30분 동안 배양하고 PBS에서 세척한 다음 이 절편을 차단(PBS의 0.4% Triton X-100, 0.02% 아지드화나트륨, 3% 일반 염소 혈청) 용액으로 1시간 동안 옮깁니다.
- 차단 용액에 1:20,000으로 희석된 c-Fos 항체를 함유한 1차 항체 배양 용액으로 절편을 옮기고 실온에서 밤새 방치합니다.
- PBS에서 절편을 1시간 동안 헹군 다음 PBS에서 0.4% Triton X-100 및 1.5% 일반 염소 혈청에 1:1,000으로 희석된 2차 항체 용액에서 배양합니다.
- 절편을 40분 동안 헹구고 PBS에서 1:500으로 희석된 avidin/biotin 기반 peroxidase 시스템( 재료 표 참조)에서 1시간 동안 배양합니다.
- 0.003% H,2, O2 및 0.05% 염화니켈을 포함하는 3-3' 디아미노벤지딘 염산염(DAB)의 0.05% 용액에서 섹션을 헹구고 배양하여 진한 파란색 반응 생성물을 얻습니다.
6. 세포 계수
- 저전력(10x) 대물렌즈를 사용하여 카메라 루시다 아래의 단면을 검사하여 뉴런 핵에서 c-Fos 반점 염색의 국소화를 수행합니다(그림 5).
- 관심 영역의 크기와 관련된 계수 그리드를 사용합니다. 예를 들어 Bregma 0.95에서 -0.26까지의 pIC의 경우 0.25mm x 1mm 계수 그리드를 사용합니다. Bregma -0.51에서 -2.45mm까지 0.5mm x 1mm 계수 그리드를 사용합니다.
- 숫자 수동 카운터를 사용하여 절편당 c-Fos 면역반응성(Fos-ir) 세포의 수를 정량화합니다.
- 관심 있는 모든 코로나 단면을 두 번 세고 실험 조건에 익숙하지 않은 동일한 관찰자가 계수를 수행하는지 확인합니다.
- 디지털 카메라와 결합된 현미경을 사용하여 사진을 촬영합니다.
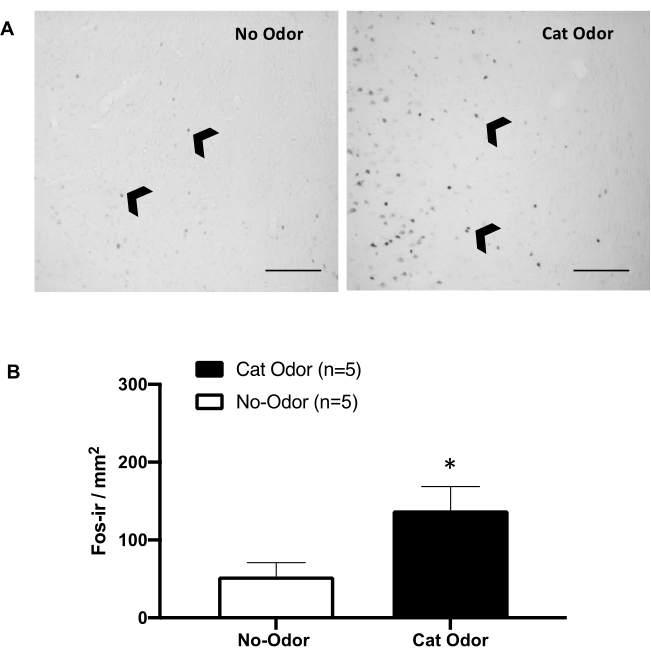
그림 5: 고양이 냄새는 1차 내부수용성 피질(primary interoceptive cortex)에서 뉴런 활성화를 유도합니다. (A) 고양이 냄새에 노출된 쥐에서 c-Fos-ir 세포의 수가 현저히 증가한 것과 비교하여(냄새가 나지 않음, 왼쪽) c-Fos-ir 세포의 수가 현저히 증가한 것과 비교하여 착용하지 않은 고양이 목걸이(냄새 없음, 왼쪽)에서 c-Fos-ir 세포(검은색 화살촉)가 거의 없음을 보여주는 pIC의 대표적인 현미경 사진. (B) 두 실험 조건 모두에서 pIC의 c-Fos-ir 세포의 정량화. 데이터는 means + SEM으로 표현됩니다. *p < 0.05. 스케일 바 = 200μm. 이 수치는 8에서 수정되었습니다. 약어: pIC = primary interoceptive cortex; c-Fos-ir = c-Fos-면역반응성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 데이터 분석
- 비디오로 녹화된 실험에서 방어 행동에 점수를 매기고 통계 소프트웨어를 사용하여 분석합니다.
- 10분 동안 얼어붙는 데 소요된 시간의 백분율로 표현되는 타이밍 시합으로 얼어붙음을 평가합니다. Eq (1)를 사용하여 동결 비율을 계산합니다.
동결 = (동결에 소요된 시간/600초) × 100 (1)
참고: 동결은 최소 1초28 동안 호흡을 제외하고는 완전한 움직임이 없는 것으로 정의되었습니다. - 타이밍 바이질런트 스캐닝 시합을 통해 위험 평가에 점수를 매기고 10분 동안 위험 평가에 소요된 시간의 백분율로 표현합니다. Eq (2)를 사용하여 위험 평가의 백분율을 계산합니다.
위험 평가 비율 = (위험 평가에 소요된 시간/600초) × 100 (2)
참고: 위험 평가 행동은 최소 1초 동안 주의 스캔(천문대, 기관차 없이 좌우 머리 움직임)으로 정의되었습니다29. - 이러한 행동 매개변수에 수동으로 점수를 매기고 실험 조건(즉, 냄새 및 약물 상태)에 대해 눈이 먼 실험자가 계산하는지 확인합니다. 데이터 세트의 정규성에 따라 모수 또는 비모수 검정을 사용하여 둘 이상의 그룹을 비교할 수 있습니다.
참고: 이 연구에서 모든 통계 테스트는 SPSS 소프트웨어를 사용하여 수행되었습니다.- 그룹 간의 쌍별 비교를 위해 Kruskal-Wallis H-검정을 Mann-Whitney U-검정과 함께 사용합니다.
- Friedman 검정을 사용하여 시간 경과에 따른 그룹 내 비교를 분석한 다음 쌍별 비교를 위해 Wilcoxon 부호 순위 검정을 분석합니다.
참고: 모든 그림에서 유의 수준은 p < 0.05 (*) 및 p < 0.01 (**)로 설정되었습니다.
- 특정 뇌 영역에서의 c-Fos 발현을 분석하기 위해 mm2당 c-Fos-ir 세포의 밀도를 계산하여 섹션당 c-Fos 양성 세포의 수를 세고 대조군(냄새 없음)과 자극(고양이 냄새) 상태 간의 평균 수를 비교합니다.
- 데이터의 정규성에 따라 쌍을 이루지 않은 학생의 t-검정 또는 Mann-Whitney U-검정을 사용합니다.
참고: 이 연구에서는 Mann-Whitney U-test가 사용되었습니다. p < 0.05(*)인 경우 차이가 중요한 것으로 간주되었습니다.
- 데이터의 정규성에 따라 쌍을 이루지 않은 학생의 t-검정 또는 Mann-Whitney U-검정을 사용합니다.
결과
이 프로토콜에서 동결 및 위험 평가 비율은 각각 쥐의 두려움과 불안과 유사한 상태의 지표로 측정되었습니다. 실험 설계의 타임라인은 그림 2에 나와 있습니다. 0일차에 고양이 냄새에 노출된 동물의 결과는 그림 3에 나와 있습니다. 쥐는 익숙한 상황(CONTEXT)보다 고양이 냄새(TEST)에 반응하여 동결 수준(그림 2A, 고양이 냄새 그룹, Wilcoxon 서명 등급 검정, Z = -2.201, p = 0.028)과 위험 평가(그림 2B, 고양이 냄새 그룹, Wilcoxon 서명 등급 검정 Z = -2.336 p = 0.018)를 유의하게 높게 보였습니다. 테스트의 두 번째 부분에서 착용하지 않은 목걸이에 노출된 쥐에서 낮은 수준의 동결(그림 2A, 무취 그룹, Wilcoxon 서명 등급 테스트, Z = -0.184, p = 0.854) 및 위험 평가(그림 2B, 무취 그룹, Wilcoxon 서명 등급 테스트, Z = -1.753, p = 0.08)가 관찰되었습니다.
추가 분석을 통해 결빙 수준(그림 2A, Mann-Whitney 검정, U = 0.000, p = 0.004) 및 위험 평가(그림 2B, Mann-Whitney 검정, U = 4.000, p = 0.025)가 테스트의 두 번째 부분에서 냄새가 없는 그룹보다 고양이 냄새 그룹에서 더 높았습니다. 익숙한 상황(CONTEXT)에 노출된 첫 10분 동안 두 그룹 간에 동결(그림 2A, Mann-Whitney 검정, U = 11.000, p = 0.256)과 위험 평가(그림 2B, Mann-Whitney 검정, U = 15.00, p = 0.627)에는 유의미한 차이가 없었습니다. 이러한 결과는 이 프로토콜이 고양이 털/피부 냄새에 대한 방어 행동을 테스트하는 데 적합하다는 것을 보여줍니다.
1일차의 테스트 컨텍스트(CONTEXT)에 대한 조건별 위협 반응은 그림 4에 나와 있습니다. 고양이 냄새에 노출된 쥐는 첫 번째 포식자가 냄새를 만난 후 24시간이 지나면 실험실로 되돌려 보냈습니다. 1일차에 동물들은 0일차보다 실험 상황에 대한 반응에서 더 높은 동결(Wilcoxon Signed-ranks test, Z = -2.366, p = 0.018) 및 위험 평가(Wilcoxon Signed-ranks test, Z = -2.201, p = 0.028) 수준을 보였다. 또한 CONTEXT와 RETEST 간에 동결(Wilcoxon Signed-ranks 검정, Z = -0.841, p = 0.400) 또는 위험 평가(Wilcoxon Signed-ranks 검정, Z = -0.943, p = 0.345) 수준에는 차이가 없었습니다. 쥐는 재검사와 시험에서 동일한 동결 수준(Wilcoxon Signed-ranks 검정, Z = -0.105, p = 0.917)과 위험 평가(Wilcoxon Signed-ranks 검정, Z = -0.980, p = 0.327)를 보였습니다. 이러한 결과는 고양이 털/피부 냄새에 10분 동안 한 번 노출되면 동물이 포식자 냄새에 직면한 상황에 대해 학습된 위협 반응으로 이어진다는 것을 보여주었습니다.
그림 5와 그림 6은 이 기사에 제시된 프로토콜을 사용하는 두 세트의 실험을 보여줍니다. 우리는 감정 처리 8,30,31,32에 관여하는 뇌 영역인 1차 내부수용성 피질(pIC)이 방어 행동의 발현에 필요한지 여부를 테스트했습니다. 고양이 냄새 유발 뉴런 활성화는 분리된 동물 그룹(무취 및 고양이 냄새 상태)에서 c-Fos-ir 세포를 계수하여 pIC에서 평가되었습니다. 이 쥐들은 TEST 완료 후 90분 후에 안락사되었습니다. 고양이 냄새 그룹(Mann-Whitney 테스트, U = 3.000, p = 0.016)의 pIC에서 c-Fos-ir 뉴런 수가 대조군에 비해 유의하게 증가한 것이 관찰되었습니다(그림 5).
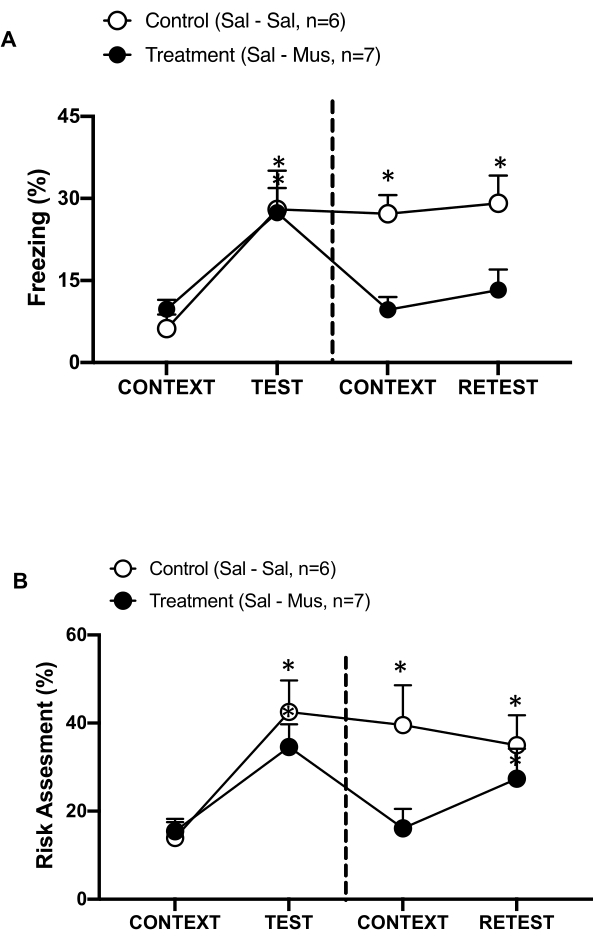
그림 6: 1차 내부수용성 피질(primary interoceptive cortex)의 무시몰(Muscimol) 비활성화는 전후 관계상 위협 기억을 손상시킨다. (가, 나) pIC(치료군)에서 치료군은 0일째에 식염수를, 1일째에 무시몰을 주사했습니다. 대조군 쥐는 이틀 동안 pIC에 식염수를 주입했습니다. 1일차에 동물을 익숙한 실험실로 되돌려 보내 10분 동안 CONTEXT에 노출시킨 후 추가로 10분 동안 고양이 냄새에 재노출(RETEST)했습니다. 원은 동결에 소요된 시간(검은색 원)과 위험 평가 동작(열린 원)을 표시합니다. 점선은 타고난 공포 테스트(0일차, 왼쪽)와 상황별 두려움 테스트(1일차, 오른쪽)를 구분합니다. 데이터는 means + SEM으로 표현됩니다. *p < 0.05. 이 수치는 8에서 수정되었습니다. 약어: pIC = primary interoceptive cortex; Sal-Sal = 0일과 1일에 주입된 식염수; Sal-Mus = 0일째에 식염수 주입, 1일째에 muscimol 주입. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
또한 pIC의 muscimol 비활성화가 상황별 위협 기억에 미치는 영향을 측정했습니다(그림 6). 치료군(sal-mus rats)은 0일째에 pIC에 식염수 주사를, 1일째에 GABA-A 작용제 muscimol을 투여받았습니다. 이 동물 그룹은 익숙한 상황에 대한 반응으로 0일차와 비교하여 1일차에 동결(그림 6A, Wilcoxon Signed-ranks 검정, Z = -0.140, p = 0.889) 또는 위험 평가(그림 6B, Wilcoxon Signed-ranks 검정, Z = -0.700, p = 0.484) 수준에서 차이를 보이지 않았으며, 이는 맥락적 위협 기억의 손상을 나타냅니다. 흥미롭게도, 동결(그림 6A, Wilcoxon Signed-ranks 검정, Z = -2.100, p = 0.036)은 위험 평가가 아닌 동결(그림 6B, Wilcoxon Signed-ranks 검정, Z = -0.980, p = 0.327)이 TEST에 비해 재테스트 중에 현저히 감소했습니다. 이 마지막 발견은 1일차에 pIC를 침묵시키는 것이 포식자의 냄새에 대한 두려움 반응을 선택적으로 손상시켰지만 불안은 아니라는 것을 나타냅니다. 종합하면, 이러한 결과는 위에서 설명한 실험 프로토콜이 약탈적 위협에 대한 선천적 및 학습된 방어 반응 연구에 적합하다는 것을 뒷받침합니다.
토론
여기에 설명된 프로토콜은 선천적이고 학습된 혐오 자극에 의해 유발되는 방어 행동을 평가하는 혁신적인 접근 방식을 제공합니다. 안전한 은신처가 없는 실험실(그림 1)과 난소 절제술을 받은 암컷 집고양이의 피부/털 냄새가 스며든 목걸이를 사용하여 쥐에게 강력하고 지속적인 위협 상태를 유도했으며, 이는 적응 및 부적응 방어 반응의 기저에 있는 신경 회로를 조사하는 데 유용할 수 있습니다.
특정 방어 반응의 표시는 위협 자극과 동물이 마주치는 상황/환경의 특징에 따라 달라진다는 것은 잘 알려진 사실이다21,33. 회피, 위험 평가 및 동결은 위협적인 자극에 의해 유발될 수 있는 동물 방어 반응의 방대한 레퍼토리의 일부입니다 9,19. 그러나, 우세한 방어 반응의 선택은 위협(33)으로부터의 거리 또는 테스트 챔버(21,33) 내부의 안전한 장소의 존재와 같은 환경 조건에 따라 달라집니다. 예를 들어, 쥐가 은신처가 있는 투기장에 고양이 냄새가 나는 곳에 배치되면 스트레칭/참석 자세, 은신처 상자 밖으로 머리를 내밀기, 회피와 같은 방어 행동을 보입니다 6,24,25. 이와는 대조적으로, 동결 행동, 경계 태깅, 스트레칭/어텐디 자세는 탈출이 불가능하고 위협까지의 거리가 지나치게 짧지 않은 상황에서 강력하게 유발된다33,34.
연구에 따르면 통제할 수 없는 스트레스 요인에 노출되면 스트레스 요인이 통제 가능할 때 발생하는 결과와는 다른 다양한 행동 결과가 발생한다고 합니다 35,36,37,38. 예를 들어, 피할 수는 없지만 피할 수 없는 꼬리 쇼크는 배쪽 두부 핵의 세로토닌을 크게 증가시키고35 혐오적 경험 후 24시간 후에 측정된 불안 유사 행동36. 더욱이, 통제할 수 없는 스트레스 요인은 동물36,37과 인간38의 공포 조건화를 강화한다. 프로토콜을 개발하기 위한 우리의 초기 근거는 쥐를 혐오적 자극을 통제할 수 없는 상황에 노출시켜 강력하고 지속적인 위협 반응을 보이고 고양이 냄새에 한 번 짧게 노출된 후 향상된 맥락 학습을 개발하는 것이었습니다.
여기에 설명된 실험 설계에서 은폐 상자가 없다는 것은 일반적으로 설치류의 두려움과 불안과 같은 상태의 행동 징후로 간주되는 동결(즉, 호흡을 제외한 완전한 부동성28)과 위험 평가(즉, 경계 스캔 및 스트레칭/참석 자세29) 행동 사이를 번갈아 가며 강력하고 지속적인 방어 상태를 유발했습니다(그림 3). 특히, 쥐가 실험 상황에 다시 노출되었을 때 24시간 후에 동일한 패턴의 방어 반응이 발생했으며, 이는 이전에 보고된바와 같이 10분 동안 고양이 털/피부 냄새에 노출되는 것이 오래 지속되는 상황별 위협 학습을 유도하기에 충분하다는 것을 나타냅니다 7,10,11,14,15,34,39 (그림 4).
내부 펠트 라이닝이 있는 고양이 목걸이는 냄새/냄새를 효율적으로 수집하고 가두는 데 사용되어 강력한 방어 반응을 유발하는 위협 자극의 신뢰할 수 있는 샘플을 얻었습니다. 연구자들은 유사한 연구에서 고양이 배설물, 소변 또는 트리메틸티아졸린(TMT, 여우 배설물의 구성 요소)과 같은 혐오 자극을 사용했습니다. 그럼에도 불구하고, 이러한 자극은 맥락적 학습을 유도할 수 있는 능력이 적기 때문에 포식자의 즉각적인 존재를 예측하기 어려운 것으로 보인다40,41. 이전 연구 결과 2,4,8,9,10,11,20,34,39에 따르면 고양이 냄새는 쥐에게 지속적인 방어 반응과 맥락적 위협 기억을 유발할 수 있는 신뢰할 수 있는 타고난 혐오 자극입니다. 수년에 걸쳐 이러한 종류의 행동학적 동물 모델은 PTSD와 같은 부적응적 공포 기억과 관련된 스트레스 및 스트레스 관련 장애13,14,15,16,17,23,42를 연구하기 위해 연구자들의 관심을 점점 더 사로잡았습니다.
이 프로토콜은 예를 들어 깨어 있고 행동하는 동물에 대한 분자 및 세포 생물학 접근 방식 및 전기 생리학을 포함한 다양한 실험 기술과 함께 사용하도록 고안되었으며, 이는 열린 질문에 답하고 적응 및 부적응 위협 반응에 대한 이해를 향상시킬 수 있는 기회를 제공합니다. 이 연구에서 우리는 감정 처리에 관여하는 뇌 영역인 pIC가 방어 행동의 표현에 필요하다는 아이디어를 테스트했습니다. 행동 실험은 c-Fos 면역조직화학과 결합되어 고양이 냄새 및 GABA-A 수용체 작용제인 muscimol의 뇌내 주입에 반응하는 pIC의 신경 세포 활동 패턴을 매핑하여 pIC를 가역적으로 침묵시키고 포식자 냄새에 대한 선천적 및 학습된 위협 반응에 대한 관여를 확인했습니다. 이러한 결과는 고양이 냄새가 pIC의 신경 활동을 증가시킨다는 것을 보여주었으며(그림 5), pIC를 침묵시키면 상황별 위협 기억의 심각한 결핍으로 이어진다는 것을 보여주었습니다(그림 6).
여기에 설명된 프로토콜은 구현 및 수행이 기술적으로 간단하지만 몇 가지 문제가 발생할 수 있습니다. 예를 들어, 착용하지 않은 목걸이가 착용한 고양이 목걸이와 접촉하면 고양이 냄새 교차 오염이 발생할 수 있습니다. 따라서 칼라는 모든 절차 중에 별도로 보관해야 하며, 마모된 칼라를 테스트 챔버에 배치한 후 장갑을 교체해야 합니다. 실험자가 동일한 테스트 챔버를 사용하여 냄새 및 무취 조건을 수행하려는 경우 실험은 다른 날에 수행되어야 합니다. 이러한 실험을 위해 두 개의 동일한 실험실을 사용할 수 있으며34, 쥐는 사회적 의사소통을 피하기 위해 별도의 방에 보관해야 한다43. 낯선 환경에서 새로운 자극에 노출되어 유발되는 스트레스도 문제가 될 수 있습니다. 따라서 동물은 새로운 상황에서 쥐가 일반적으로 보여주는 스트레스와 방어 태도를 줄이기 위해 테스트 환경과 절차에 최소 3일 동안 익숙해져야 합니다. 또한 습관화 기간에 필요한 시간은 테스트 기간보다 길어야 합니다. 예를 들어, 테스트에 10분이 걸리는 경우 습관화 기간에 20분 또는 30분을 할당해야 합니다.
마지막으로, 방어 행동은 쥐가 활동하는 주기의 어두운 단계에서 바람직하게 평가되어야 합니다. 쥐는 쥐와 실험자가 모두 활성 단계에 있는 동안 실험 절차가 수행될 수 있도록 역밝기/암흑 주기 하에서 유지되어야 합니다34. 명암 주기의 변화는 정착하는 데 10일 이상 걸리지 않으며, 경험에 비추어 볼 때 이 상태에 있는 대부분의 쥐는 고양이 냄새에 적절하게 반응합니다. 그러나 Sprague-Dawley 쥐가 Wistar 쥐보다 오래 지속되는 위협 조건화와 불안에 덜 취약하다는 것을 보여주는 몇 가지 연구가 있습니다44. 따라서 Sprague-Dawley 균주 쥐 대신 Wistar 쥐를 사용하면 더 강력한 결과를 얻을 수 있습니다.
결론적으로, 고양이 냄새는 쥐에서 신뢰할 수 있는 신경세포, 내분비 및 행동 반응을 이끌어내는 윤리학적으로 관련된 위협적인 자극입니다. 피할 수 없는 방에서 고양이 냄새를 마주하면 쥐는 강력하고 장기적인 두려움/불안 반응을 일으켜 빠르고 지속적인 상황별 위협 학습을 할 수 있습니다. 위에서 설명한 프로토콜은 공포와 적응 및 부적응 위협 메모리 인코딩 메커니즘을 연구하는 데 유용한 도구가 될 수 있습니다.
공개
이 원고의 저자는 공개할 경쟁적인 재정적 이해관계나 다른 이해 상충이 없습니다.
감사의 말
저자는 실험실 절차를 도와준 Marcela Gonzalez, 프로토콜 설계에 기여한 Mabel Matamala, 일러스트레이션을 도와준 Miguel Rojas에게 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 3-3′ diaminobenzidine hydrochloride (DAB) | Bio-Rad | Colorimetric blotting substrate; used with peroxidase antibody conjugate | |
| Airtight plastic container | comercial | Used to store cat collars | |
| Cat Collar | comercial | dimensions: width 1.5, thickness 0.5, length 30 cm | |
| Cat Odor | domestic cat | Ovariectomized indoor-outdoor female cat fed with regular commercial cat food. | |
| Enrofloxacin 5% | Bayer | Antibiotic (19mg/Kg i.p.). Used in the surgery protocol. | |
| Ethanol | Sigma-Aldrich | 5% v/v for cleaning testing box | |
| Guide cannulae | Plastic One | 26 gauge. Consists of a threaded cylindrical plastic pedestal molded around a piece of stainless steel tubing which is implanted into the specific target area of the brain following stereotaxic coordinates. | |
| Hamilton syringe | Sigma-Aldrich | 1 uL. Used in the inactivation protocol | |
| Hydrogen Peroxide 30% | Merck Millipore | Used in immunohistochemical procedure | |
| Injection cannula | Plastic One | 33 gauge. This cannula is inserted into the guide cannula for fluids to be dosed into the specific target area of the brain. | |
| Ketamine (Imalgene) | Rhodia Merieux | Sedative (100mg/Kg i.p.). Used in the surgery and immunohistochemical protocols | |
| Ketoprofen 1% | Rhodia Merieux | Anti-infammatory (0,2mg/Kg i.p.). Used in the surgery protocol. | |
| Male rats | Universidad Catòlica de Chile | Sprague dawley strain (270–290 g) | |
| Mechanical digit manual counter | Comercial | Used for cell counting | |
| Muscimol | Sigma-Aldrich | 0,5 ug/uL into the localized brain area | |
| Normal goat serum | Life Technologies | Used in immunohistochemical procedure | |
| Occluder canulae | Plastic One | Inserted into guide cannula to seal it and prevent the outflow of tissue fluid after injection. | |
| Paraformaldehyde powder | Sigma-Aldrich | Used to tissue fixiation | |
| PBS 10x, pH 7.4 | Life Technologies | Used in immunohistochemical procedure | |
| Primary antibody | Sigma, St Louis | Rabbit polyclonal F7799 used in immunohitochemical procedure | |
| Red light bulb (80 watts) | Cromptom | Used during the behavioral protocol | |
| Screws | Plastic One | Used in the surgery protocol for anchoring guide cannulae in the skull | |
| Secondary antibody | Jackson immunoresearch | Anti-rabbit IgG (H+L) used in immunohitochemical procedure | |
| Single-dose sterile saline 0.9% | SalJet | 0,5 ug/uL into the localized brain area | |
| Sodium azide | Sigma-Aldrich | Used in immunohistochemical procedure | |
| SPSS for windows | IBM | Version 20.0. Software used for statistical data analysis | |
| Stereotaxis apparatus | Kopf | Used in the surgery protocol | |
| Transparent Plexiglas rectangular chamber | assembled | 60 x 40 x 40 cm, L, W, H); transparent poly(methyl methacrylate) rectangular chamber | |
| Triton X-100 | Merck Millipore | Used in immunohistochemical procedure | |
| Vectastain ABC Elite kit | Vector Laboratories | avidin/biotin-based peroxidase system used for the detection of biotin-conjugated secondary antibodies | |
| Videocamera | Sony | Prefer the use of a night vision camera | |
| Xylazine (Rompun) | Bayer | Sedative (20mg/Kg i.p.). Used in the surgery and immunohistochemical protocols. |
참고문헌
- Steimer, T. The biology of fear- and anxiety-related behaviors. Dialogues in Clinical Neuroscience. 4 (3), 231-249 (2002).
- Gross, C. T., Canteras, N. S. The many paths to fear. Nature Reviews. Neuroscience. 13 (9), 651-658 (2012).
- Harrison, L. A., Ahn, C., Adolphs, R. Exploring the structure of human defensive responses from judgments of threat scenarios. PLoS One. 10 (8), 0133682 (2015).
- Papes, F., Logan, D. W., Stowers, L. The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell. 141 (4), 692-703 (2010).
- Blanchard, R. J., Griebel, G., Andrew Henrie, J., Blanchard, D. C. Differentiation of anxiolytic and panicolytic drugs by effects on rat and mouse defense test batteries. Neuroscience and Biobehavioral Reviews. 21 (6), 783-789 (1997).
- Dielenberg, R. A., McGregor, I. S. Defensive behavior in rats towards predatory odors: a review. Neuroscience and Biobehavioral Reviews. 25 (7-8), 597-609 (2001).
- Muñoz-Abellan, C., Daviu, N., Rabasa, C., Nadal, R., Armario, A. Cat odor causes long-lasting contextual fear conditioning and increased pituitary-adrenal activation, without modifying anxiety. Hormones and Behavior. 56 (4), 465-471 (2009).
- Rodriguez, M., et al. Interoceptive insular cortex mediates both innate fear and contextual threat conditioning to predator odor. Frontiers in Behavioral Neuroscience. 13, 283 (2020).
- Blanchard, R. J., Yang, M., Li, C. I., Gervacio, A., Blanchard, D. C. Cue and context conditioning of defensive behaviors to cat odor stimuli. Neuroscience and Biobehavioral Reviews. 25 (7-8), 587-595 (2001).
- Takahashi, L. K., Chan, M. M., Pilar, M. L. Predator odor fear conditioning: current perspectives and new directions. Neuroscience and Biobehavioral Reviews. 32 (7), 1218-1227 (2008).
- de Lima, M. A. X., Baldo, M. V. C., Canteras, N. S. Revealing a cortical circuit responsive to predatory threats and mediating contextual fear memory. Cerebral Cortex. 29 (7), 3074-3090 (2019).
- Blanchard, D. C., Blanchard, R. J., Blanchard, R. J., Blanchard, D. C., Griebel, G., Nutt, D. J. Defensive behaviors, fear and anxiety. Handbook of anxiety and Fear. , 63-76 (2008).
- Armario, A., Escorihuela, R. M., Nadal, R. Long-term neuroendocrine and behavioural effects of a single exposure to stress in adult animals. Neuroscience and Biobehavioral Reviews. 32 (6), 1121-1135 (2008).
- Cohen, H., Matar, M. A., Joseph, Z. Animal models of posttraumatic stress. Preclinical models of neurologic and psychiatric disorders. Current Protocols in Neuroscience. 9, 45 (2013).
- Liang, Z., King, J., Zhang, N. Neuroplasticity to a single-episode traumatic stress revealed by resting-state fMRI in awake rats. NeuroImage. 103, 485-491 (2014).
- Dengler, B. A., Hawksworth, S. A., Berardo, L., McDougall, I., Papanastassiou, A. M. Bilateral amygdala stimulation reduces avoidance behavior in a predator scent post-traumatic stress disorder model. Neurosurgical Focus. 45 (2), 16 (2018).
- Ozbeyli, D., et al. Protective effects of vortioxetine in predator scent stress model of post-traumatic stress disorder in rats: role on neuroplasticity and apoptosis. Journal of Physiology and Pharmacology. 70 (4), 557-571 (2019).
- Graeff, F. G., Del-Ben, C. M. Neurobiology of panic disorder: From animal models to brain neuroimaging. Neuroscience and Biobehavioral Reviews. 32 (7), 1326-1335 (2008).
- Blanchard, D. C., Griebelb, G., Pobbec, R., Blanchard, R. J. Risk assessment as an evolved threat detection and analysis process. Brain Research. 35 (4), 991-998 (2011).
- Apfelbach, R., Blanchard, C. D., Blanchard, R. J., Hayes, R. A., McGregor, I. S. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neuroscience and Biobehavioral Reviews. 29 (8), 1123-1144 (2005).
- Blanchard, D. C., Blanchard, R. J., Griebel, G. Defensive responses to predator threat in the rat and mouse. Current Protocols in Neuroscience. , (2005).
- Zoladz, P. R., Conrad, C. D., Fleshner, M., Diamond, D. M. Acute episodes of predator exposure in conjunction with chronic social instability as an animal model of post-traumatic stress disorder. Stress. 11 (4), 259-281 (2008).
- Shallcross, J., et al. The divergent effects of CDPPB and cannabidiol on fear extinction and anxiety in a predator scent stress model of PTSD in rats. Frontiers in Behavioral Neuroscience. 13, 91 (2019).
- Dielenberg, R. A., Carrive, P., McGregor, I. S. The cardiovascular and behavioral response to cat odor in rats: unconditioned and conditioned effects. Brain Research. 897 (1), 228-237 (2001).
- Dielenberg, R. A., Leman, S., Carrive, P. Effect of dorsal periaqueductal gray lesions on cardiovascular and behavioral responses to cat odor exposure in rats. Behavioral Brain Research. 153 (2), 487-496 (2004).
- Paxinos, G., Watson, C. . The rat brain in stereotaxic coordinates. , (1997).
- Swanson, L. W. . Brain maps: Structure of the rat brain. A laboratory guide with printed and electronic templates for data, models, and schematics. , (1998).
- Blanchard, R. J., Blanchard, D. C. Crouching as an index of fear. Journal of Comparative and Physiological Psychology. 67 (3), 370-375 (1969).
- Choy, K. H. C., Yu, J., Hawkes, D., Mayorov, D. N. Analysis of vigilant scanning behavior in mice using two-point digital video tracking. Psychopharmacology. 221 (4), 649-657 (2012).
- Casanova, J. P., et al. A role for the interoceptive insular cortex in the consolidation of learned fear. Behavioral Brain Research. 296, 70-77 (2016).
- Casanova, J. P., Aguilar-Rivera, M., Rodriguez, M., Coleman, T. P., Torrealba, F. The activity of discrete sets of neurons in the posterior insula correlates with the behavioral expression and extinction of conditioned fear. Journal of Neurophysiology. 120 (4), 1906-1913 (2018).
- Contreras, M., Ceric, F., Torrealba, F. Inactivation of the interoceptive insula disrupts drug craving and malaise induced by lithium. Science. 318 (3850), 655-658 (2007).
- McNaughton, N., Corr, P. J. A two-dimensional neuropsychology of defense: fear/anxiety and defensive distance. Neuroscience and Biobehavioral Reviews. 28 (3), 285-305 (2004).
- Blanchard, D. C., Canteras, N. S., Markham, C. M., Pentkowski, N. S., Blanchard, R. J. Lesions of structures showing FOS expression to cat presentation: effects on responsivity to a cat, cat odor and nonpredator threat. Neuroscience and Biobehavioral Reviews. 29 (8), 1243-1253 (2005).
- Maswood, S., Barter, J. E., Watkins, L. R., Maier, S. F. Exposure to inescapable but not escapable shock increases extracellular levels of 5-HT in the dorsal raphe nucleus of the rat. Brain Research. 783 (1), 115-120 (1998).
- Maier, S. F., et al. The role of the amygdala and dorsal raphe nucleus in mediating the behavioral consequences of inescapable shock. Behavioral Neuroscience. 107 (2), 377 (1993).
- Maier, S. F., Grahn, R. E., Watkins, L. R. 8-OH-DPAT microinjected in the region of the dorsal raphe nucleus blocks and reverses the enhancement of fear conditioning and interference with escape produced by exposure to inescapable shock. Behavioral Neuroscience. 109 (3), 404-412 (1995).
- Hartley, C. A., Gorun, A., Reddan, M. C., Ramirez, F., Phelps, E. A. Stressor controllability modulates fear extinction in humans. Neurobiology of Learning and Memory. 113, 149-156 (2014).
- Staples, L. G., Hunt, G. E., Cornish, J. L., McGregor, I. S. Neural activation during cat odor-induced conditioned fear and 'trial 2' fear in rats. Neuroscience and Biobehavioral Reviews. 29 (8), 1265-1277 (2005).
- Blanchard, D. C., et al. Failure to produce conditioning with low-dose trimethylthiazoline or cat feces as unconditioned stimuli. Behavioral Neuroscience. 117 (2), 360-368 (2003).
- Rosen, J. B., Asok, A., Chakraborty, T. The smell of fear: innate threat of 2,5-dihydro-2,4,5-trimethylthiazoline, a single molecule component of a predator odor. Frontiers in Neuroscience. 9, 292 (2015).
- Verbitsky, A., Dopfel, D., Zhang, N. Rodent models of post-traumatic stress disorder: behavioral assessment. Translational Psychiatry. 10 (1), 132 (2020).
- Fendt, M., et al. Predator odor but not TMT induces 22-kHz ultrasonic vocalizations in rats that lead to defensive behaviors in conspecifics upon replay. Scientific Reports. 8, 11041 (2018).
- Fragale, J. E., et al. Dysfunction in amygdala-prefrontal plasticity and extinction-resistant avoidance: A model for anxiety disorder vulnerability. Experimental Neurology. 275, 59-68 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유