A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
منصة اكتشاف قوية لتحديد الوسطاء الجدد لورم خبيث سرطان الجلد
In This Article
Summary
توضح هذه المقالة سير عمل التقنيات المستخدمة لاختبار الوسطاء المرشحين الجدد لورم خبيث سرطان الجلد وآلية (آليات) عملهم.
Abstract
الانبثاث هو عملية معقدة ، تتطلب من الخلايا التغلب على الحواجز التي يتم نمذجتها بشكل غير كامل فقط من خلال الفحوصات في المختبر . تم إنشاء سير عمل منهجي باستخدام نماذج قوية وقابلة للتكرار في الجسم الحي وطرق موحدة لتحديد اللاعبين الجدد في ورم خبيث سرطان الجلد. يسمح هذا النهج باستنتاج البيانات في مراحل تجريبية محددة لتوصيف دور الجين بدقة في الانبثاث. يتم إنشاء النماذج عن طريق إدخال خلايا سرطان الجلد المعدلة وراثيا عن طريق الحقن داخل القلب أو داخل الأدمة أو تحت الجلد في الفئران ، تليها المراقبة بالتصوير التسلسلي في الجسم الحي . بمجرد الوصول إلى نقاط النهاية المحددة مسبقا ، يتم حصاد الأورام الأولية و / أو الأعضاء الحاملة للنقائل ومعالجتها لإجراء تحليلات مختلفة. يمكن فرز الخلايا السرطانية وإخضاعها لأي من منصات "omics" العديدة ، بما في ذلك تسلسل الحمض النووي الريبي أحادي الخلية. تخضع الأعضاء للتصوير والتحليلات المرضية النسيجية المناعية لتحديد العبء الكلي للنقائل ورسم خريطة لموقعها التشريحي المحدد. يمكن اعتماد خط الأنابيب الأمثل هذا ، بما في ذلك البروتوكولات الموحدة للتطعيم والمراقبة وحصاد الأنسجة ومعالجتها وتحليلها ، للثقافات قصيرة الأجل المشتقة من المريض وخطوط الخلايا البشرية والفئرانية الراسخة لمختلف أنواع السرطان الصلبة.
Introduction
إن ارتفاع معدل الوفيات المرتبط بسرطان الجلد النقيلي إلى جانب زيادة معدل الإصابة بسرطان الجلد في جميع أنحاء العالم1 (زيادة تقدر بنسبة 7.86٪ بحلول عام 2025) يستدعي اتباع نهج علاجية جديدة. يتوقف التقدم في اكتشاف الأهداف على نماذج قابلة للتكرار من ورم خبيث ، وهي عملية معقدة للغاية. خلال خطوات الشلال النقيلي ، يجب على خلايا سرطان الجلد التغلب على حواجز لا حصر لها لتحقيق التهرب من الجهاز المناعي واستعمار الأنسجة البعيدة2. تنشأ مرونة خلايا سرطان الجلد وقدرتها على التكيف من العديد من العوامل ، بما في ذلك عبئها الطفري الجيني العالي 3 وأصلها العصبي ، مما يمنح اللدونة الظاهرية الحاسمة3،4،5. في كل خطوة، تسمح برامج النسخ لخلايا سرطان الجلد المنتشرة بالتحول من حالة إلى أخرى بناء على إشارات من المحادثة المتقاطعة مع البيئة الدقيقة، التي تضم الجهاز المناعي6، والوسط خارج الخلية 7,8، والبنية الخلوية للحواجز المادية9 التي تتلامس معها. على سبيل المثال ، تهرب خلايا سرطان الجلد من المراقبة المناعية عن طريق تقليل تنظيم التعبير عن العوامل المهمة التي يفرزها الورمالمناعي 6.
تصف الدراسات "مكانة ما قبل النقيل" ، حيث تفرز خلايا سرطان الجلد الكيموكينات والسيتوكينات لتمهيد العضو "المستهدف" البعيد للنقائل10. تثير هذه النتائج أسئلة مهمة حول استوائية الأعضاء في خلايا سرطان الجلد النقيلي والطريق التشريحي الذي تسلكه للوصول إلى الأنسجة البعيدة. بعد الأوعية الدموية ، من المعروف أن خلايا سرطان الجلد تنتشر من خلال اللمفاويات (الانتشار اللمفاوي) والأوعية الدموية (الانتشار الدموي)2,11. في حين أن معظم المرضى الذين يعانون من مرض موضعي ، فإن مجموعة فرعية صغيرة من الحالات تظهر مع مرض نقيلي بعيد ولا يوجد انتشار لمفاوي (تورط العقدة الليمفاوية السلبية)11 ، مما يشير إلى وجود مسارات نقلية بديلة للسرطان الميلانيني.
عندما تستعمر خلايا الورم الميلانيني موقعا نقيليا ، تخضع لتعديلات جينية واستقلابية12,13. للوصول إلى مقصورات جديدة وغزوها ، تستخدم خلايا سرطان الجلد البروتياز14 والتعديلات الهيكلية الخلوية11,15 ، والتي تمكنها من العبور إلى موقعها الجديد والنمو فيه. تكمن صعوبة استهداف خلايا سرطان الجلد في تعقيد وعدد هذه التكيفات. وبالتالي ، يجب على الميدان بذل جهود لإعادة إنشاء أكبر عدد ممكن من الخطوات والتعديلات تجريبيا. على الرغم من العديد من التطورات في المقايسات في المختبر مثل المواد العضوية والثقافات ثلاثية الأبعاد 16,17 ، فإن هذه النماذج تلخص فقط بشكل غير كامل الشلال النقيلي في الجسم الحي.
أظهرت نماذج مورين قيمة من خلال تحقيق توازن بين قابلية التكاثر والجدوى التقنية ومحاكاة الأمراض البشرية. تمثل خلايا الورم الميلانيني المزروعة داخل الأوعية الدموية وتقويميا وغير المتجانسة من xenografts المشتقة من المريض أو الثقافات قصيرة الأجل إلى الفئران المعرضة للخطر المناعي أو البشرية العمود الفقري للاكتشاف المستهدف في سرطان الجلد النقيلي. ومع ذلك ، غالبا ما تفتقر هذه الأنظمة إلى قيد بيولوجي حاسم على الانبثاث: الجهاز المناعي. نماذج ورم خبيث في سرطان الجلد المتجانس التي تمتلك هذا القيد نادرة نسبيا في هذا المجال. هذه الأنظمة ، التي تم تطويرها في الفئران ذات الكفاءة المناعية ، بما في ذلك B16-F1018 ، عائلة YUMM من خطوط الخلايا 19 ، SM120 ، D4M321 ، RIM322 أو في الآونة الأخيرة ، RMS 23 و M1 (Mel114433) ، M3 (HCmel1274) ، M4 (B2905) 24 خطوط خلايا سرطان الجلد ، تسهل التحقيق في الدور المعقد للاستجابة المناعية للمضيف في تطور سرطان الجلد.
هنا ، يتم تقديم خط أنابيب لتحديد هدف ورم خبيث في سرطان الجلد. مع زيادة وأكبر مجموعات بيانات "omics" التي يتم إنشاؤها من مجموعات مرضى سرطان الجلد ، نفترض أن الدراسات التي تحمل الوعد الأكثر سريرية هي تلك التي تنبع من تكامل البيانات الضخمة ، مما يؤدي إلى استجواب وظيفي وميكانيكي دقيق25،26،27،28. باستخدام نماذج الفئران لدراسة الأهداف المحتملة في العملية النقيلية ، يمكن للمرء أن يفسر في الأحداث الخاصة بالجسم الحي وتفاعلات الأنسجة ، وبالتالي زيادة احتمال الترجمة السريرية. يتم تحديد طرق متعددة لتحديد العبء النقيلي ، مما يوفر بيانات تكميلية عن نتائج أي تجربة معينة. يتم وصف بروتوكول لعزل الخلية الواحدة من الأورام في مختلف الأعضاء للمساعدة في التوصيف غير المتحيز للتعبير الجيني في الخلايا النقيلية ، والتي قد تسبق تسلسل الحمض النووي الريبي أحادي الخلية أو السائبة.
Protocol
ملاحظة: تمت الموافقة على الإجراءات الحيوانية المشاركة في البروتوكول التالي من قبل لجنة جامعة نيويورك المؤسسية لرعاية الحيوانات واستخدامها (IACUC). يتم إجراء جميع الإجراءات في مرافق معتمدة من قبل جمعية تقييم واعتماد المنظمة الدولية لرعاية المختبرات (AAALAC). ويبين الشكل 1 النهج التجريبي العام.
1. ثقافات سرطان الجلد قصيرة الأجل المشتقة من المريض (STCs)
- ضع الأنسجة في طبق بتري 60 مم مع 1 مل من RPMI الكامل (RPMI 1640 مكمل بمصل بقري جنيني 10٪ (FBS) ، 2 mM L-glutamine ، 1 mM بيروفات الصوديوم ، محلول أحماض أمينية غير أساسية 1x MEM ، والبنسلين (100 وحدة دولية / مل) / ستربتومايسين (100 ميكروغرام / مل)).
ملاحظة: لزيادة نسبة الخلايا السرطانية ، إذا لزم الأمر ، تشريح وإزالة الأنسجة المحيطة بالورم في طبق بتري ، تحت المجهر ، باستخدام أدوات جراحية معقمة. - قطع الأنسجة الطازجة بدقة باستخدام شفرات الحلاقة المعقمة إلى مكعبات 1-2 مم. أضف 4 مل من RPMI الكامل وماصة محتويات اللوحة لأعلى ولأسفل 5-10 مرات باستخدام ماصة مصلية 10 مل.
- انقل تعليق الخلية إلى أنبوب مخروطي من البولي بروبيلين سعة 15 مل وقم بتدوير الخلايا لأسفل (180 × جم لمدة 5 دقائق عند 4 درجات مئوية). شفط supernatant ، وإعادة تعليق بيليه الخلية في 1 مل من الوسط الطازج ، ونقل التعليق إلى قارورة زراعة الأنسجة25 سم 2 .
- لمساعدة شظايا الأنسجة على الالتصاق بالقاع ، اضبط القارورة مائلة بزاوية 20 درجة -30 درجة في حاضنة زراعة الأنسجة عند 37 درجة مئوية ، 5٪ CO2 لمدة 20 دقيقة.
- ضع القارورة لأسفل بشكل مسطح للسماح للوسط بتغطية الأنسجة ، وتحقق من حالة الثقافة يوميا. تقسيم الخلايا عندما تصل إلى 90-100 ٪ التقاء. الحفاظ على الثقافات قصيرة الأجل عند رقم مرور "منخفض".
ملاحظة: سيتم إنشاء STCs حوالي 2 أشهر بعد عزل الخلايا وزراعتها ، على الرغم من أن الجدول الزمني الفعلي يختلف بين العينات وأنواع الأورام. بعد 10 إلى 14 مقطعا ، تصل خطوط الخلايا إلى نقاء 100٪ ، وتحتوي فقط على خلايا سرطان الجلد29. يتم تحديد عتبة رقم المرور تجريبيا من خلال ملاحظة التغيرات في مورفولوجيا الخلية ، ومضاعفة الوقت ، والسلوك في الجسم الحي. للحفاظ على عدم التجانس والخصائص الأخرى للورم الأم ، لا تقسم الخلايا أكثر من 1: 5. - عند إنشاء STC ومع أي نموذج خط خلية ليتم حقنه في الحيوانات كما هو موضح في الخطوات اللاحقة ، قم بنقل الخلايا مع مراسل.
ملاحظة: على سبيل المثال، تسمح علامة الفلورسنت (على سبيل المثال، بروتين الفلورسنت الأحمر (RFP)، والبروتين الفلوري الأخضر (GFP))، بتصوير التألق المناعي خارج الجسم الحي وفرز الخلايا السرطانية عن طريق فرز الخلايا المنشطة بالفلور (FACS). يتيح Luciferase تصوير التلألؤ الحيوي في الجسم الحي ، وهو أداة مفيدة لرصد التقدم التجريبي (القسم 4).
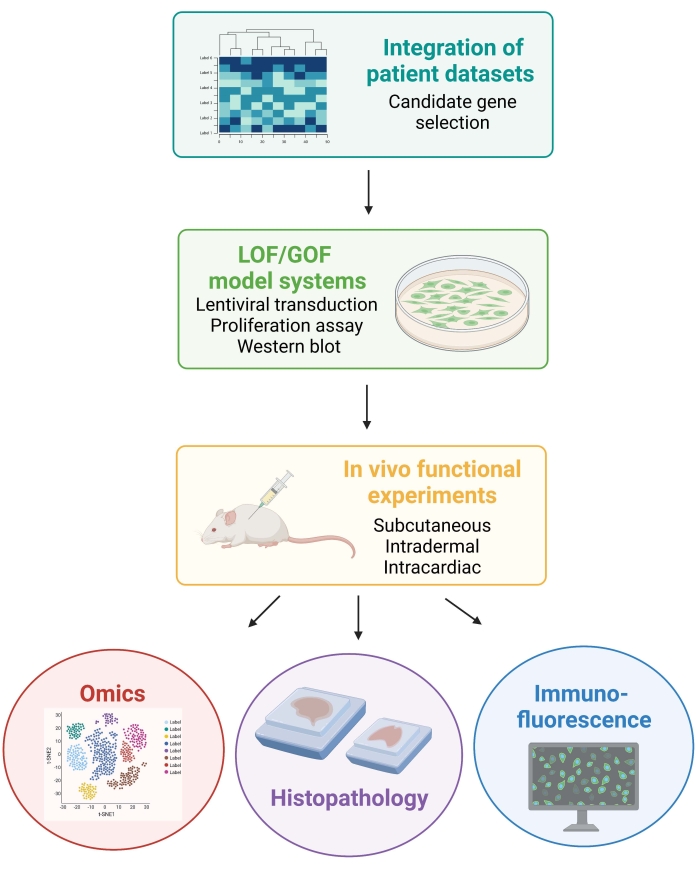
الشكل 1: مخطط يوضح سير العمل الموصوف ، من تكامل بيانات المرضى إلى توليد وتحليل البيانات في الجسم الحي من الفئران. الاختصارات: LOF = فقدان الوظيفة; GOF = كسب الوظيفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. زرع Xenograft
ملاحظة: يتم إجراء الإجراءات التجريبية الموصوفة هنا في الفئران التي أضعفت أجهزة المناعة التكيفية والفطرية ، NOD.Cg-PrkdcscidIl2rgtm1Wjl / SzJ (NSG) الفئران. أو في الفئران التي تفتقر إلى المناعة التكيفية فقط ، مثل الفئران الأثيمية / العارية (NU / J) التي تعاني من نقص الخلايا التائية. الحيوانات من جنس الذكور ، 8 إلى 10 أسابيع من العمر. غالبا ما تظهر الإناث نسبة عالية من النقائل التناسلية عند الحقن داخل القلب للخلايا السرطانية ، مما يقلل من بقائها.
- بالنسبة للحقن تحت الجلد وداخل الأدمة ، قم بإعداد تعليق خلية 1: 1 عن طريق خلط جزء واحد من الخلايا المعلقة في 1x Dulbecco Phosphate-Buffered Saline (DPBS) مع جزء واحد من ركيزة المصفوفة خارج الخلية المذابة (EMS) ، والحفاظ على الجليد عند 4 درجات مئوية. بالنسبة للحقن داخل الأوعية الدموية (داخل القلب أو داخل السباتي أو المدار الرجعي أو الوريد الذيل أو الطحال) ، قم بتعليق الخلايا في DPBS فقط.
ملاحظة: يجب أن يبقى الحجم المناسب للحقن داخل الأدمة منخفضا قدر الإمكان (30 ميكرولتر). بالنسبة للحقن تحت الجلد ، يمكن أن يصل حجم الحقن إلى 150 ميكرولتر ، وبالنسبة للحقن داخل الأوعية الدموية ، يصل إلى 250 ميكرولتر (بناء على وزن الحيوان). أضف إلى تعليق الخلية النهائي 10-30٪ من الحجم الإضافي للحقن ، بناء على الكمية التي تم حقنها والمحقنة المستخدمة لحساب الحجم الميت داخل طرف الانزلاق وحجم الإبرة (على سبيل المثال ، حقنة درنية 1 مل مع إبرة 30 جم ، 25 مم لها حجم ميت يبلغ 100 ميكرولتر). - قم بإجراء تجربة لتوصيف سلوك خطوط الخلايا المستخدمة والجدول الزمني لتطور الورم في الجسم الحي. بالنسبة للحقن داخل الأدمة، ابدأ بحقن 1000 خلية حتى 50000 خلية/30 ميكرولتر. بالنسبة للحقن تحت الجلد ، ابدأ بحقن 10000 حتى 2 × 106 خلايا / 150 ميكرولتر. بالنسبة للحقن داخل الأوعية الدموية (داخل القلب ، داخل السباتي ، المدار الرجعي ، والطحال) ، ابدأ بحقن 50000 خلية / 150 ميكرولتر.
ملاحظة: الحقن داخل الأوعية الدموية تهيئ الحيوانات للأحداث الانسدادية ، إما عن طريق إدخال الهواء إلى الدورة الدموية أو باستخدام عدد مفرط من الخلايا التي تسد الأوعية الصغيرة. امزج تعليق الخلية جيدا لتجنب التكتل. قم بتعبئة المحقنة قبل تحميل تعليق الخلية. قم بإزالة أي فقاعات هواء داخل المحقنة. احتفظ بتعليق الخلية / المحاقن على الجليد حتى وقت التحميل والحقن. - إدارة التخدير عن طريق الاستنشاق. اضبط منظم مستوى الأكسجين بين 1-2 لتر / دقيقة. ضع الحيوان في غرفة الحث مع ضبط مبخر الأيزوفلوران على 2.5-5٪ للحث و 1.5-3٪ للصيانة.
ملاحظة: راقب التنفس ومعدل ضربات القلب للحيوان أثناء وجوده في مرحلة تحريض التخدير. لا تترك الحيوان دون مراقبة. لا تراقب أكثر من واحد في وقت واحد. عيار كمية التخدير إلى وزن الحيوان. - نقل الحيوان من غرفة الحث إلى مخروط الأنف. ضع مرهم الفازلين المعقم على عيون الحيوان لمنع جفاف القرنية أثناء العملية.
- احلق موقع الإجراء باستخدام شفرة حلاقة مستقيمة مائلة بزاوية 30 درجة. نظف جلد منطقة الإجراء باستخدام مسحات كحول الأيزوبروبيل بنسبة 70٪. قبل أي خطوات أخرى ، قم بتقييم مستوى كاف من التخدير عن طريق منعكس الدواسة.
- بالنسبة للحقن داخل الأدمة ، قم بإجراء الإجراء بأكمله داخل خزانة السلامة البيولوجية للحفاظ على الظروف المعقمة.
- تخدير وحلق الحيوان كما هو موضح في الخطوات 2.3-2.5.
- أمسك الجلد وسحبه إلى الوراء ضد مسار طعنة الإبرة. باستخدام إبرة حقنة الأنسولين 31 غرام ، طولها 6 مم ، مثبتة بزاوية حادة ، قم بثقب الجلد بلطف مع توجيه الشطبة لأعلى.
- اشعر بتحرير الضغط عند طرف الإبرة. تقدم بلطف للبقاء داخل المقصورة داخل الأدمة وعدم المرور عبر عمق الجلد بأكمله إلى تحت الجلد. أمر بالغ الأهمية: إذا انزلق المرء إلى الفضاء تحت الجلد ، فقم بإزالة الإبرة وتغيير منطقة الحقن وإعادة إدخال الإبرة. حقن كامل الحجم (30 ميكرولتر) من تعليق الخلية ببطء حتى يتم ملاحظة الوحل على شكل قبة.
ملاحظة: سيؤدي انخفاض أحجام الحقن إلى تشريح أقل لطبقات الجلد وتشويه معماري أقل. - احتفظ بالإبرة واعدها إلى 5.
ملاحظة: يصبح EMS لزجا في درجة حرارة الجسم ، مما يساعد على تجنب التدفق العكسي من خلال جرح ثقب الإبرة. - قم بإزالة الإبرة ومنزل الحيوان في قفص على وسادة دافئة للتعافي. إعادة الحيوان إلى قفص vivarium بعد استعادة الوعي ، عندما تكون قصية ومتنقلة.
ملاحظة: راقب الحيوان باستمرار خلال جميع الإجراءات الموضحة في هذا البروتوكول. لا تترك الحيوان دون مراقبة أو تراقب أكثر من واحد في وقت واحد. - راقب تطور نمو الورم وفقدان الوزن والحالة الصحية العامة بالتعاون مع الموظفين البيطريين يوميا في مرحلة النمو الأولية وبشكل أكثر كثافة ، إذا لزم الأمر ، بعد أن تبدأ الحيوانات في فقدان الوزن. خلال جلسات المراقبة هذه: وزن الحيوانات ورسم مخطط لمراقبة فقدان الوزن ، والتحقق من علامات تقرح الورم ، والعلامات العصبية ، والحركية ، و / أو السلوكية (الخمول ، ونقص الاستمالة ، وانخفاض تناول الطعام أو الماء).
ملاحظة: القتل الرحيم للحيوانات مباشرة بعد ملاحظة علامات المرض المتقدم (أكثر من 20٪ فقدان الوزن ، ودرجة حالة الجسم من <2 ، وانخفاض مستويات النشاط للغاية ، والشلل ، أو النوبات). استخدم طريقة القتل الرحيم المعتمدة من قبل IACUC التابع للمؤسسة (على سبيل المثال ، يتم استخدام غرفة CO 2 الآلية على الطاولة لتعريض الحيوانات لثاني أكسيد الكربون2 لمدة 15 دقيقة تليها طريقة ثانوية للقتل الرحيم ، إما خلع عنق الرحم أو قطع الرأس أو استرواح الصدر الناجم ثنائيا عن طريق شق القفص الصدري). - خذ القياسات باستخدام الفرجار واستخدم أبعاد الطول (L) والعرض (W) للورم لحساب الحجم (V) باستخدام الصيغة:
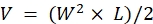
- للحقن تحت الجلد:
- تنفيذ الإجراء بأكمله داخل خزانة السلامة الأحيائية للحفاظ على الظروف المعقمة26,27.
- تخدير وحلق الحيوان كما هو موضح في الخطوات 2.3-2.5.
- باستخدام إبرة حقنة الأنسولين 28 جم إلى 31 جم ، بطول 6 مم ، مثبتة بزاوية حادة ، قم بثقب الجلد بلطف مع توجيه الشطبة لأعلى. اشعر بإطلاق الضغط عند طرف الإبرة مرتين أثناء المرور عبر البشرة والأدمة وتحت الجلد.
ملاحظة: تشير المرة الثانية التي يتم فيها الشعور بتحرير الضغط عند طرف الإبرة إلى أنه تم الوصول إلى المقصورة تحت الجلد. - حقن الحجم بأكمله (30-150 ميكرولتر) من تعليق الخلية ببطء حتى يتم ملاحظة شفاء ممدود على شكل قطع ناقص. احتفظ بالإبرة واعدها إلى 5. عد إلى 10 لأحجام أكبر (أكثر من 50 ميكرولتر).
ملاحظة: يصبح EMS لزجا في درجة حرارة الجسم ، مما يساعد على تجنب التدفق العكسي من خلال جرح ثقب الإبرة. - قم بإزالة الإبرة ومنزل الحيوان في قفص على وسادة دافئة للتعافي. إعادة الحيوان إلى قفص vivarium بعد استعادة الوعي ، عندما تكون قصية ومتنقلة.
ملاحظة: أثناء المراقبة اللاحقة للإجراءات ، راقب أي علامات للمضاعفات (انخفاض معدل التنفس ، النزيف ، الشفاء البطيء) ومعالجتها بشكل مناسب. إذا لم يلاحظ أي تحسن، انتقل إلى إجراءات القتل الرحيم الإنسانية الموضحة في ملاحظة الخطوة 2.6.6. - راقب الحيوان بحثا عن نمو الورم وفقدان الوزن والحالة الصحية العامة كما هو موضح في الخطوات 2.6.6-2.6.7.
- للحقن داخل القلب:
- تنفيذ الإجراء بأكمله داخل خزانة السلامة الأحيائية للحفاظ على الظروف المعقمة26,30.
- تخدير الحيوان كما هو موضح في الخطوات 2.3-2.4.
- انقل الحيوان إلى المنصة الساخنة لجهاز الموجات فوق الصوتية وثبته بشريط هيبوالرجينيك إلى مخروط الأنف.
- احلق الصدر باستخدام شفرة حلاقة مستقيمة مائلة بزاوية 30 درجة. تنظيف الجلد من منطقة الإجراء مع 3 تطبيقات من 10٪ بوفيدون اليود بالتناوب مع 3 تطبيقات من الكحول الأيزوبروبيل.
- قبل أي خطوات أخرى ، قم بتقييم مستوى كاف من التخدير عن طريق منعكس الدواسة. تطبيق هلام الموجات فوق الصوتية على موقع الإجراء.
- التقط نافذة القلب باستخدام مسبار الموجات فوق الصوتية. ضع مسبار الموجات فوق الصوتية في منتصف الصدر على الجانب الأيسر من الحيوان لالتقاط نافذة أفقية موجهة للحصول على رؤية مقطعية (محور قصير) للبطين الأيسر. للتأكد من أن المحور الطويل للمسبار يواجه لأعلى، قم بإصلاح المسبار بزاوية 50 درجة والمنصة المسخنة بزاوية 20 درجة. قفل المسبار وإطار الدعم في موضعه.
- ارسم تعليق الخلية أثناء العمل داخل خزانة السلامة البيولوجية في حقنة درنية سعة 1 مل مع إبرة 30 جم ، 25 مم. قم بإزالة أي فقاعات هواء في المحقنة.
ملاحظة: من المهم إنشاء وصيانة تعليق أحادي الخلية أثناء معالجة الخلايا وحقنها. تعد إزالة فقاعات الهواء خطوة مهمة لتجنب انسداد الهواء. سيمنع نظام إبرة المحاقن المعد جيدا الوفيات التي يمكن تجنبها في المجموعة التجريبية. اسحب دائما حجما أكبر في المحقنة مما سيتم حقنه. سيساعد الحجم الإضافي على إزالة الهواء عن طريق حقن بعض تعليق الخلايا مرة أخرى في أنبوب 1.5 مل. - قفل المحقنة في حاقن التجسيم. تحت توجيه الموجات فوق الصوتية ، تقدم الإبرة من خلال جدار الصدر إلى البطين الأيسر للقلب. حقن الحجم بأكمله (100-250 ميكرولتر) من تعليق الخلية ببطء.
- قم بإزالة الإبرة ومنزل الحيوان في قفص على وسادة دافئة للتعافي. إعادة الحيوان إلى قفص vivarium بعد استعادة الوعي ، عندما تكون قصية ومتنقلة. راقب الحيوان بحثا عن نمو الورم وفقدان الوزن والحالة الصحية العامة كما هو موضح في الخطوة 2.6.6.
- للحقن داخل السبات:
- نفذ الإجراء بأكمله على سطح مطهر بشكل صحيح للمساعدة في الحفاظ على الظروف المعقمة30.
- تخدير الحيوان مع الكيتامين (100 ملغ / كغ) و xylazine (10 ملغ / كغ) كوكتيل عن طريق الحقن داخل الصفاق مع حقنة الأنسولين ، إبرة 28 غرام. ضع مرهم الفازلين المعقم على عيون الحيوان لمنع جفاف القرنية أثناء العملية.
- احلق منطقة الإجراء باستخدام شفرة حلاقة مستقيمة مائلة بزاوية 30 درجة. قبل أي خطوات أخرى ، قم بتقييم مستوى كاف من التخدير عن طريق منعكس الدواسة.
- ضع الحيوان تحت مجهر ستيريو على وسادة الاحترار. تنظيف الجلد من منطقة الإجراء مع 3 تطبيقات من 10٪ بوفيدون اليود بالتناوب مع 3 تطبيقات من الكحول الأيزوبروبيل.
- قم بارتداء معدات الحماية الشخصية المعقمة (PPE) والقفازات المعقمة. تحضير الحقل المعقم عن طريق وضع ستارة معقمة على جسم الحيوان.
ملاحظة: إذا لم يكن للستارة المعقمة ثقب مناسب لحجم وموقع الشق ، فقم بطي الستارة إلى نصفين واستخدم مقص Metzenbaum لقطع ثقب الحجم المناسب في منتصف الستارة المعقمة. - استخدم مشرطا أو مقص قزحية العين لشق الجلد من نصف الرقبة وصولا إلى القص. مع اثنين من ملقط الجراحة المجهرية ، تشريح بصراحة بعيدا عن الغدد اللعابية تحت الفك السفلي 2 في مستوى خط الوسط. استخدم الكي الكهربائي للإرقاء ، إذا لزم الأمر.
- تشريح اللفافة المحيطة بالشريان السباتي المشترك (CCA) من المنبر نحو التشعب والاستمرار في الإنسي لتحرير الجدار الخلفي للشريان السباتي الخارجي. قم بقص الشريان السباتي الخارجي (ECA) مؤقتا قبل الحقن.
ملاحظة: عند التشريح حول محيط CCA ، يجب توخي الحذر لعدم إتلاف العصب المبهم (يكمن جانبيا للشريان). - قم بتحميل تعليق الخلية في حقنة 1 مل بإبرة 33 جم ، 15 مم.
- تمرير اثنين من الحروف المركبة 7-0 تحت CCA ، وتنفيذ عقدة أداة فضفاضة لكل من الرباطين. استخدم مشبك أوعية ضغط 5 مم و 10 جم وقم بقص ECA مؤقتا. ربط الرباط القريب ؛ ثم ، اربط الرباط البعيد بشكل فضفاض (بجانب تشعب CCA). استخدم الحلقة البعيدة لاحقا للتحكم في النزيف بعد الحقن.
- باستخدام المحقنة بإبرة 33 جم ، 15 مم ، قم بثقب CCA بلطف مع توجيه شطبة الإبرة لأعلى وبزاوية حادة. حقن الحجم بأكمله (50-150 ميكرولتر) من تعليق الخلية ببطء.
- أمسك الحلقة البعيدة بالملقط وارفعها أثناء إزالة الإبرة لسد تجويف CCA ووقف النزيف. استبدل المحقنة بملقط #7 Jewelers واربط الحلقة البعيدة.
- رمي عقدة أداة أخرى على الرباط البعيد وإزالة مشبك السفينة من ECA. السيطرة على المجال الجراحي للنزيف وكي أي أوعية نزيف قبل الإغلاق. استخدم جهاز تدبيس 9 مم لإغلاق جلد الحيوان ووضع الحيوان على وسادة دافئة للتعافي.
ملاحظة: قم بإزالة الدبابيس بعد 7-10 أيام من الجراحة. - إعطاء دواء مسكن تحت الجلد - البوبرينورفين (0.3 ملغ / مل) كل 12 ساعة لمدة 72 ساعة بعد الجراحة بتركيز 0.1 ملغ / كغ.
ملاحظة: بدلا من ذلك ، فكر في استخدام دواء مسكن ممتد الإطلاق ، والذي يتطلب جرعة واحدة كل 72 ساعة. - إعادة الحيوان إلى قفص vivarium بعد استعادة الوعي ، عندما تكون قصية ومتنقلة. راقب الحيوانات بعد العملية الجراحية يوميا بحثا عن علامات عدوى أو ألم في الموقع الجراحي والحالة الصحية العامة والمضاعفات.
ملاحظة: يمكن إعطاء الحيوانات التي لا تتعافى بشكل جيد من جراحة البقاء على قيد الحياة جرعات إضافية من مسكنات الألم وسيتم القتل الرحيم بشكل إنساني إذا لم يتم استردادها بالكامل بحلول 72 ساعة بعد الجراحة. - راقب الحيوان بحثا عن نمو الورم وفقدان الوزن والحالة الصحية العامة كما هو موضح في الخطوة 2.6.6.
- للحقن المدارية الرجعية:
ملاحظة: استخدم هذه التقنية كبديل لحقن الوريد الذيل عندما يكون المشغل مدربا وبارعا في هذه التقنية وعندما يكون هناك مبرر علمي قوي. يمكن أن تحفز المعلقات الخلوية التي يتم تسليمها عبر هذا الطريق نمو الورم في الفضاء المداري الرجعي. وبالتالي ، ينبغي النظر بعناية في المخاطر والفوائد عند اختيار هذه التقنية. على سبيل المثال ، للاستفادة من الاتصال المباشر بالدورة الدموية للجيوب الوريدية المدارية الرجعية مع الأوردة داخل المخ عبر المفاغرة ، حدد هذه الطريقة عندما يفشل تكوين ورم الدماغ باستخدام طرق حقن أخرى.- تنفيذ الإجراء بأكمله داخل خزانة السلامة الأحيائية للحفاظ على الظروف المعقمة. دون معدات الوقاية الشخصية المعقمة والقفازات.
- تخدير الحيوان كما هو موضح في الخطوات 2.3-2.4.
ملاحظة: لهذا الإجراء ، لا تضع مرهم الفازلين المعقم على عيون الحيوان لأن هذا سيعيق الحقن ؛ تطبيق قطرات مخدر موضعي فقط. - قم بتحميل تعليق الخلية في حقنة الأنسولين بإبرة 28-31 جم ، 6 مم.
- مع الحيوان في وضع عرضة ، تراجع الجفون حتى تبرز العين. ضع 1 قطرة من المخدر الموضعي في العين على الجانب الذي يخضع للإجراء.
- أدخل الإبرة بزاوية 30-45 درجة بين العين والإبيكانتوس الإنسي مع توجيه الشطبة لأسفل. حقن تعليق الخلية (10-150 ميكرولتر) ببطء.
ملاحظة: تمنع الحركات البطيئة تلف العين والتدفق العكسي للحقن. - نفذ الخطوات الموضحة في 2.7.5-2.7.6.
- لحقن الطحال:
- تنفيذ الإجراء بأكمله داخل خزانة السلامة الأحيائية للحفاظ على الظروف المعقمة31. دون معدات الوقاية الشخصية المعقمة والقفازات المعقمة.
- تخدير وحلق الحيوان كما هو موضح في الخطوات 2.3-2.5.
- ضع الحيوان في وضع راقد جانبي أيمن. تنظيف الجلد من منطقة الإجراء مع 3 تطبيقات من 10٪ البوفيدون اليود بالتناوب مع 3 تطبيقات من الكحول الأيزوبروبيل وإعداد المجال الجراحي كما هو موضح في الخطوة 2.9.5.
- باستخدام مقص Metzenbaum أو مشرط ، قم بعمل شق 1 سم في الجناح الأيسر من جدار البطن متبوعا بشق في الصفاق.
ملاحظة: سيتم رؤية الطحال من خلال جدار البطن الشفاف بعد إجراء شق الجلد. قم بإجراء شق الصفاق بالضبط في هذا الموقع. - كشف الطحال والطحال من خلال الشق. باستخدام إبرة حقنة الأنسولين 28-31 جم ، طولها 6 مم ، قم بثقب الطحال بلطف مع توجيه شطبة الإبرة لأعلى وبزاوية حادة.
ملاحظة: إذا نزف جرح الثقب، قم بكي الموقع للحد من النزيف والتدفق العكسي. - حقن الحجم بأكمله (50-100 ميكرولتر) من تعليق الخلية ببطء. إزالة الإبرة. ضع شاشا صغيرا على الطحال واضغط عليه باستخدام ملقط. قم بتثبيت الطحال برفق بين الشاش باستخدام ملقط البعوض الناعم وانتظر لمدة 15 دقيقة.
- قم بإجراء استئصال الطحال عن طريق ربط الطحال بخياطة حريرية 3-0 أو 4-0 ، مع كي الأوعية إذا لزم الأمر. أغلق الصفاق باستخدام 5-0 بوليديوكسانون (PDS) أو خيط قابل للامتصاص بحمض البولي جليكوليك.
- قم بتنفيذ الخطوات الموضحة في الخطوات 2.7.5-2.7.6.
ملاحظة: الحيوانات التي تعاني من مضاعفات النزيف أو التي لم تتعافى تماما بعد 72 ساعة من الجراحة يجب أن يتم قتلها إنسانيا. تذكر أن رفاهية الفئران هي الأولوية في جميع الأوقات.
3. جراحة البقاء على قيد الحياة المرحلية (SSS)
- استنادا إلى الاستنتاجات التجريبية من الخطوة 2.2 ، حدد الوقت المناسب لجراحة البقاء على قيد الحياة. اعتمادا على خط الخلية والفرضية التجريبية، حدد نقطة زمنية سابقة لاستئصال الورم (عند حجم الورم = 150 مم 3) أو نقطة زمنية لاحقة (عند حجم الورم = 500 مم3)26.
ملاحظة: الحد الأقصى لحجم الورم هو 1500 مم3 عندما يكون عبء الورم مرتفعا بما يكفي ليكون ضارا برفاهية الحيوان ويؤهب للمضاعفات. - تخدير وحلق الحيوان كما هو موضح في الخطوات 2.3-2.5.
ملاحظة: يتم تنفيذ الإجراء بأكمله داخل خزانة السلامة الأحيائية. - تنظيف الجلد من منطقة الإجراء مع 3 تطبيقات من 10٪ البوفيدون اليود بالتناوب مع 3 تطبيقات من الكحول الأيزوبروبيل وإعداد المجال الجراحي كما هو موضح في الخطوة 2.9.5.
- باستخدام مقص القزحية أو مشرط ، قم بشق الجلد ، مع الحفاظ على هامش استئصال 5-7 مم من حافة الورم.
ملاحظة: يعتمد هامش الاستئصال على قدرة الورم على الانتشار محليا. بالنسبة للأورام العدوانية ، قم بزيادة هامش الاستئصال مع التأكد من ترك ما يكفي من الجلد لإجراء إغلاق الجرح. - في حالة الأورام داخل الأدمة ، استئصالك الورم مع الجلد المحيطي.
- بالنسبة للأورام تحت الجلد ، قم بتشريح الورم وإزالته تحت الجلد.
ملاحظة: إذا غزا الورم الصفاق و / أو الجلد ، فقم باستئصاله بشكل جماعي مع الورم وأغلق الصفاق باستخدام خيوط قابلة للامتصاص ب 5-0/4-0 PDS أو حمض البولي جليكوليك. - أغلق الجرح باستخدام جهاز التدبيس مقاس 9 مم.
ملاحظة: قم بإزالة الدبابيس بعد 7-10 أيام من الجراحة. إدارة الأدوية المسكنة ووضع الحيوان على وسادة دافئة للتعافي. استمر في إعطاء الأدوية المسكنة لمدة 72 ساعة بعد الجراحة ، مرة واحدة كل 12 ساعة وفقا للخطوة 2.9.13. يجب قتل الحيوانات التي تعاني من مضاعفات النزيف أو التي لم تستعيد وعيها الكامل بعد الجراحة بشكل إنساني. - منزل واحد الحيوان في قفص ، على وسادة دافئة للتعافي. إعادة الحيوان إلى قفص vivarium بعد استعادة الوعي ، عندما تكون قصية ومتنقلة.
- استمر في مراقبة الحيوان بعد الجراحة بحثا عن التكرار الموضعي ، وفقدان الوزن ، والعلامات العصبية ، والحركية ، و / أو السلوكية (الخمول ، ونقص الاستمالة ، وانخفاض تناول الطعام أو الماء) والحالة الصحية العامة.
4. التصوير في الجسم الحي (الشكل 2 أ)
- إدارة الركيزة D-luciferin (150 ملغم / كغ) للحيوانات عن طريق الحقن داخل الصفاق مع حقنة الأنسولين 1 مل ، إبرة 28 غرام.
ملاحظة: يجب نقل الخلايا السرطانية بثبات باستخدام الحمض النووي cDNA luciferase. - التخدير المحفز كما هو موضح في الخطوات 2.3-2.4 ، بعد 6 دقائق من حقن الركيزة D-luciferin.
- قم بإجراء التصوير باستخدام ماسح ضوئي لتصوير التلألؤ الحيوي (BLI) (نظام التصوير في الجسم الحي )26.
- حرك الحيوان داخل غرفة التصوير وفي مخروط الأنف. تصوير ما يصل إلى 5 في وقت واحد ، اعتمادا على سعة نظام التصوير.
- ابدأ تشغيل الأداة بالضغط على تهيئة. اضبط إعداد وقت التعريض الضوئي على تلقائي (1-120 ثانية).
- التقط صورة فارغة لطرح أي خلفية إذا لزم الأمر. انقر فوق الحصول على الصورة واحفظها بعد اكتمال تسلسل الاستحواذ.
- ضع الحيوان مرة أخرى في قفص ، يجلس مع 50٪ من مساحة سطح القاعدة فوق وسادة الاحترار للتعافي من التخدير. إعادة الحيوان إلى قفص vivarium بعد استعادة الوعي ، عندما تكون قصية ومتنقلة.
- لتحليل البيانات في نفس برنامج التصوير في الجسم الحي الذي تم التقاط الصور به ، انتقل إلى المجلد حيث يتم حفظ الصور ، وافتح صور جميع الفئران المتعلقة بالتجربة في وقت واحد.
ملاحظة: لن يسمح تحليل صورة واحدة في كل مرة بالتطبيع عبر المجموعات. - اضبط الوحدات على الإشراق (وليس العدد). تأكد من عدم تحديد خانة الاختيار التي تشير إلى الفرد، لأن ذلك سيحول دون تطبيع الإشارة عبر المجموعات.
- باستخدام أداة رسم منطقة الاهتمام (ROI) ، ارسم عائد استثمار دائري لمنطقة الدماغ وعائد استثمار مستطيل للجسم. كن حريصا على استبعاد الأذنين والأنف من عائد الاستثمار في الدماغ ، لأنها تميل إلى إصدار لمعان غير محدد. لتقليل التحيز في هذه العملية ، ارسم عائد استثمار على صور الفئران فقط ، دون وضع إشارة مضيئة بشكل مفرط.
- حدد قياس عائد الاستثمار لتحديد كمية الإشارة وتصدير البيانات إلى جدول بيانات. تحليل الاختلافات بين المجموعات عن طريق رسم إجمالي تدفق الإضاءة (p / sec / cm2 / sr) في مناطق الجسم ذات الاهتمام.
ملاحظة: لتقييم الاختلافات بين المجموعات في استوائية الدماغ على وجه التحديد، احسب النسبة بين إشارة الدماغ وإشارة الجسم لكل ماوس. هذا يتحكم في التباين بين الفئران في عبء الورم الكلي والاختلافات في مستويات التعبير luciferase بين المجموعات التجريبية.
5. التصوير بالرنين المغناطيسي خارج الجسم الحي
- إجراء التصوير بالرنين المغناطيسي خارج الجسم الحي مباشرة بعد القتل الرحيم. بدلا من ذلك ، قم بحصاد الأعضاء ذات الأهمية ، وإصلاحها في الفورمالين لمدة تصل إلى 72 ساعة ، وإجراء التصوير في وقت لاحق.
- احصل على الصور باستخدام نظام التصوير بالرنين المغناطيسي الدقيق 7-Tesla (7-T) (300-MHz) المجهز بوحدة تحكم NMR ومغناطيس تجويف أفقي بدون غليان أو معدات مماثلة.
ملاحظة: تعد الحاجة إلى إدراج ملف تدرج محمي بشكل نشط مع المفاضلة الصحيحة للأداء أمرا بالغ الأهمية. يجب أن يوفر خطية متدرجة لا تقل عن 50 مم من الحجم الكروي الديناميكي (DSV) لتغطية مجموعة العينات التي تم فحصها في وقت واحد دون أي تشويه هندسي. إن الجمع بين قوة التدرج (التي تتراوح من 440 إلى 750 mT/m) ودورة العمل التي تتيح أقصى قدر من تيارات التيار المستمر المتزامنة التي تتراوح من 3 × 30 أمبير إلى 3 × 87 أمبير سيمكن من أداء التصوير الكافي. يتيح إدراج ملف التدرج المستخدم (انظر جدول المواد) الأداء التالي: 660 mT/m، ووقت ارتفاع 130 ميكروثانية، و3 × 87 أمبير، وDSV = 80 مم. - قم بإجراء عمليات المسح باستخدام ملف ترددات راديوية لجسم الفأر بالكامل مستقطب بشكل دائري (OD = 59 مم ، معرف = 38 مم ، L = 40 مم) مضبوط على 300.16 ميجاهرتز ، تردد 1 Hproton Larmor.
ملاحظة: يتيح مسبار RF هذا الحصول على مجموعات بيانات ثلاثية الأبعاد بدقة متساوية الخواص دون الملليمترية (<150 ميكرومتر) أثناء عمليات المسح الليلية التي تمتد من 8 إلى 12 ساعة. - الكشف عن عبء الورم باستخدام تسلسلات متعددة30.
ملاحظة: تتعرف الإشارة شديدة الكثافة المكتشفة بواسطة التصوير السريع الموزون T2 مع تسلسل الأصداء المعاد تركيزها (RARE) على الوذمة المحيطة بالأورام. - قم بإجراء تسلسل 3D RARE باستخدام معلمات الاكتساب التالية: [120 ميكرومتر]3 دقة متساوية الخواص ؛ وقت الاستحواذ 5 ساعات ، 27 دقيقة ؛ وقت التكرار (TR) = 500 مللي ثانية ؛ تباعد الصدى (ES) = 12.7 دقيقة ؛ عامل توربو TFx = 12 ؛ وقت الصدى الفعال (TEeff) = 76.2 مللي ثانية ؛ عرض النطاق الترددي (BW) = 75 كيلو هرتز ؛ حجم المصفوفة = 2843; مجال الرؤية (FOV) = [4.0 مم]3 ؛ عدد المتوسطات (Nav) = 6.
- الكشف عن النقائل باستخدام المعلمات التالية.
- بالنسبة للنقائل المصطبغة ذات سطوع الإشارة ، استخدم تسلسل صدى التدرج ثلاثي الأبعاد الموزون T1 مع المعلمات التالية: [120 ميكرومتر]3 دقة متساوي الخواص ؛ وقت الاستحواذ 2 ساعة ، 41 دقيقة ؛ TR = 20 مللي ثانية ؛ وقت الصدى (TE) = 4.0 مللي ثانية ؛ زاوية الوجه (FA) = 18 درجة ؛ BW = 75 كيلو هرتز ؛ حجم المصفوفة = 2843; FOV = [34.0 مم]3; التنقل = 6.
- بالنسبة للنقائل غير المصطبغة و / أو النزفية ، استخدم إشارة منخفضة الكثافة عند الحصول عليها تحت تسلسل صدى متعدد التدرج (MGE) مرجح T2 * (3D MGE ، [120 μm]3 دقة متساوية الخواص ؛ وقت الاكتساب 3 ساعات ، 35 دقيقة ؛ TR = 40 مللي ثانية ؛ TE = 3.6 مللي ثانية ؛ ES = 3.2 مللي ثانية ؛ 4 أصداء FA = 20 درجة; BW = 100 كيلو هرتز ؛ حجم المصفوفة = 2843; FOV = (34.0 مم)3; التنقل = 4.
- استخدم جميع التسلسلات ال 3 لتحديد عبء الورم.
- الرجوع إلى مناطق الورم التي تم تحديدها أثناء التحليل باستخدام الأقسام النسيجية لضمان الدقة. انظر الفرعين 7 و 8.
6. معالجة الأنسجة لتسلسل الحمض النووي الريبي أحادي الخلية أو السائبة
- القتل الرحيم للحيوان باستخدام أي طريقة معتمدة من قبل IACUC المؤسسة. راجع أحد الإجراءات الموضحة في ملاحظة الخطوة 2.6.6.
- تشريح الأعضاء ذات الأهمية ووضعها في آبار منفصلة من طبق يحتوي على محلول الملح المتوازن من هانك (HBSS) على الجليد. اعمل بسرعة وحافظ على الأنسجة على الجليد في جميع الأوقات لزيادة صلاحية الخلايا.
ملاحظة: الخطوات التالية خاصة بمعالجة الدماغ. اضبط نوع الكولاجيناز على الأنسجة المحددة، بناء على احتياجاتك. - قم بإعداد طبق من 6 آبار مع 3 مل من HBSS في كل بئر.
- لتصور التشريح والمساعدة في توجيهه بشكل أكبر ، استخدم مجهر التألق وحدد المناطق الموسومة.
- تشريح مناطق الفلورسنت ووضع شظايا الأنسجة في لوحة 6 بئر (1 جزء لكل بئر إذا كان سيتم تحليل البؤر النقيلية الفردية أو شظايا متعددة من عضو واحد إذا كان سيتم تحليل النقائل المتعددة في نفس العضو). استخدم شفرات حلاقة معقمة لتقطيع الأنسجة إلى شظايا صغيرة قدر الإمكان (دون قضاء أكثر من 1-2 دقيقة في هذه الخطوة لكل عينة).
ملاحظة: الحد من وقت معالجة الأورام يساعد في الحفاظ على صلاحية الخلايا. - شفط ونقل محتويات كل بئر إلى أنبوب مخروطي 15 مل.
ملاحظة: اقطع طرف ماصة 1000 ميكرولتر لتسهيل نقل الأجزاء الأكبر. - أضف 1 مل من HBSS إلى البئر وتأكد من نقل شظايا / خلايا الأنسجة المتبقية إلى أنبوب 15 مل ، والذي سيحتوي على حجم نهائي قدره 4 مل. أضف 50 ميكرولتر من الكولاجيناز من النوع الأول (40 ملغم/مل) و12.5 ميكرولتر DNase I (2000 وحدة/مل) إلى كل أنبوب.
- ضع الأنابيب المخروطية في حمام مائي ساخن عند 37 درجة مئوية لمدة 45 دقيقة. دوامة قصيرة الأنابيب المخروطية كل 5 دقائق.
- قبل تبخير مصفاة 70 ميكرومتر مع HBSS. استخدم الطرف المغطى لأنبوب الطرد المركزي الدقيق المعقم أو الجزء البلاستيكي من مكبس حقنة وطحن الأنسجة المتجانسة من خلال مصفاة 70 ميكرومتر في أنبوب مخروطي جديد سعة 50 مل.
ملاحظة: يسهل ترطيب المصافي مسبقا باستخدام المخزن المؤقت HBSS أو FACS الإجهاد. - اغسل المصفاة ب 1 مل من HBSS. قبل تبخير مصفاة 40 ميكرومتر مع HBSS. قم بتصفية كل عينة مرة أخرى من خلال مصفاة 40μm في أنبوب مخروطي جديد سعة 50 مل. أضف 1 مل من FBS إلى مصفاة 40 ميكرومتر لغسلها. احتفظ بالأنابيب المخروطية على الجليد طوال الوقت.
- املأ الأنبوب المخروطي إلى 50 مل ب DPBS البارد المثلج. قم بتدوير الخلايا (180 × جم لمدة 10 دقائق عند 4 درجات مئوية). تخلص من السوبرناتانت ، مع الحرص على عدم فقدان حبيبات الخلية.
ملاحظة: بالنسبة لعينات الدماغ، أعد تعليق الخلايا في محلول فصل الكثافة بنسبة 38٪ 2.5 مل (تمييع في HBSS وتخزينها في درجة حرارة الغرفة (RT)). نقل إلى 5 مل أنابيب FACS. تدور لمدة 20 دقيقة في 800 × غرام. قطع طرف ماصة 1000 ميكرولتر وإزالة طبقة الدهون العليا. لا تترك أي دهون على جدران الأنابيب. إذا تركت أي دهون ، فقم بالدوران لأسفل مرة أخرى وكرر العملية. وهذه خطوة حاسمة . قم بإزالة بقية المرحلة السائلة (ستكون الكريات شفافة ويصعب تصورها). - أعد تعليق الخلايا في 1 مل من مخزن تحلل خلايا الدم الحمراء (RBC) واحتضنها لمدة 60 ثانية في RT. قم بإخماد محلول التحلل بإضافة 20 مل من DPBS.
- قم بتدوير الخلايا عند 180 × جم لمدة 10 دقائق عند 4 درجات مئوية. قم بإزالة supernatant وإعادة تعليق الخلايا في 2 مل من المخزن المؤقت FACS (5٪ FBS في DPBS).
- تابع فرز الخلايا المصنفة و / أو إعداد المكتبة إما لتسلسل الحمض النووي الريبي المجمع أو أحادي الخلية.
ملاحظة: يمكن نسج الخلايا وتجميدها وتخزينها عند -80 درجة مئوية قبل عزل الحمض النووي الريبي للحمض النووي الريبي السائب.
7. تروية الأنسجة الحيوانية وإعدادها للتحليلات المناعية النسيجية
- تخدير الحيوان بجرعة زائدة من الكيتامين (300 مجم / كجم) وكوكتيل الزيلازين (30 مجم / كجم) عن طريق الحقن داخل الصفاق باستخدام حقنة أنسولين وإبرة 28 جم.
- كشف القلب عن طريق تشريح جسيم وإجراء شق في الأذين الأيمن. امسك القلب بلطف في مكانه باستخدام ملقط طويل منحني مواجه للأمام.
ملاحظة: الفورمالين وبارافورمالدهيد (PFA) هي مواد مسرطنة. اقرأ ورقة بيانات السلامة (SDS) ، وتجنب التعرض للأبخرة ، وارتد معدات الوقاية الشخصية المناسبة. - باستخدام حقنة 10 مل مع إبرة 22 جم ، 22 مم ، حقن 10 مل من DPBS تليها 10 مل من PFA 4٪ في البطين الأيسر.
- المضي قدما في حصاد الأعضاء وتحميلها في أشرطة الكاسيت النسيجية المصنفة مسبقا. ضع الكاسيت في وعاء بحجم مناسب يستوعب ما يكفي من المثبت (الفورمالين) لتغطية الأنسجة.
ملاحظة: من الناحية المثالية ، يجب أن يكون حجم التثبيت 5-10 أضعاف حجم الأنسجة. - إصلاح الأعضاء داخل أشرطة الكاسيت النسيجية في 10 ٪ من الفورمالين لمدة 48-72 ساعة. تخلص من الفورمالين بنسبة 10٪ واغسل الكاسيت مرتين باستخدام 1x DPBS.
- ابدأ عملية الجفاف عن طريق غمر الكاسيت في 70٪ من الإيثانول لمدة 2 ساعة. استمر في غمر الكاسيت على التوالي في زيادة تركيزات الإيثانول: 80٪ ، 95٪ ، 100٪ لمدة 1 ساعة لكل منهما. قم بتغيير الحل بنسبة 100٪ مرتين بعد 1.5 ساعة. اغمر الكاسيت في الزيلين لمدة 1.5 ساعة وقم بإجراء ثلاثة تغييرات على المحلول.
- قم بتضمين الكاسيت في شمع البارافين عند 58-60 درجة مئوية. قسم كتل البارافين. انتقل إلى تلطيخ الهيماتوكسيلين والإيوسين (H & E) أو الكيمياء النسيجية المناعية.
- لتحديد خلايا سرطان الجلد ، استخدم أيا من هذه العلامات أو لوحة: S100 ، Melan-A ، HMB-45 ، Tyrosinase ، MITF. عندما يكون ذلك ممكنا ، استخدم تلطيخ بروتين الجهاز الانقسامي النووي (NuMA) لأنه علامة خلية بشرية محددة للغاية.
ملاحظة: يوفر تلطيخ NuMA ترسيما حادا بين المضيف (الماوس) والخلايا المبطنة (الإنسان) التي تساعد في معالجة الصور ومراحل تحديد كمية الورم اللاحقة.

الشكل 2: أمثلة على صور BLI و brightfield و exvivo fluorescence و H & E التي توضح النهج متعدد الجوانب لتحليل تأثيرات الجينات المرشحة في ورم خبيث سرطان الجلد. (أ) BLI ، (B) BF ، (C) التألق خارج الجسم الحي ، و (D) صور تلطيخ H & E. تتوافق الصور المستخدمة لغرض التوضيح مع تجربة تم فيها حقن خلايا سرطان الجلد 131/6-4L التي تم نقلها باستخدام shRNA غير المستهدف (shNTC) أو shRNA الذي يستهدف FUT8 في الفئران التي تعاني من نقص المناعة (NSG). إسكات FUT8 أضعف الانتشار النقيلي لخلايا سرطان الجلد. أشرطة المقياس وشريط الألوان = p/sec/cm2/sr × 106 (A)، 100 مم (B، C)، 100 ميكرومتر (D). الاختصارات: BLI = تصوير التلألؤ الحيوي. H & E = الهيماتوكسيلين والإيوزين. shRNA = الحمض النووي الريبي قصير دبوس الشعر; shNTC = shRNA للتحكم في عدم الاستهداف; NSG = مرض السكري غير البدين الشديد نقص المناعة المشترك غاما; FUT8 = فوكوزيل ترانسفيراز 8; BF = برايتفيلد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. تلطيخ بروتين الجهاز الانقسامي النووي (NuMA) (الشكل 3)
- استخدم جسما مضادا ل NuMA كعلامة مغزل ميتوتيكية خاصة بالإنسان لتحديد وقياس العبء النقيلي في أقسام الأنسجة. 8.1. يتم تحقيق تحديد محدد وحساس للغاية لخلايا سرطان الجلد.
- إذا تم إجراء الكيمياء النسيجية المناعية اللونية ل NuMA على أداة تلطيخ مناعي تلقائية ، فاتبع الخطوات التالية كما هو موضحفي 32:
- إزالة البارافين من الأقسام في الزيلين وإعادة ترطيبها في تركيزات الإيثانول المتناقصة بالتتابع. احتفظ بالشرائح مغمورة لمدة 15 دقيقة في الزيلين وانقلها إلى الإيثانول بنسبة 100٪ لمدة 15 دقيقة أخرى.
ملاحظة: ما تبقى من خطوات إماهة الإيثانول (95٪ ، 80٪ ، 75٪) تستمر لمدة 3 إلى 5 دقائق لكل منها. - شطف الشرائح في الماء منزوع الأيونات.
- قم بإجراء استرجاع epitope عن طريق غمر الشرائح في حاوية (على سبيل المثال ، جرة تلطيخ كوبلن) في مخزن مؤقت لسترات الصوديوم 10 mM ، درجة الحموضة 6.0 ، في فرن ميكروويف بقوة 1200 واط بقوة 100٪ لمدة 10 دقائق.
- استخدم الجسم المضاد NuMA المضاد للإنسان غير المقترن ومتعدد النسيلة لوضع العلامات ، المخفف بنسبة 1: 7000 في ألبومين مصل Tris-Bovine (BSA) (25 mM Tris ، 15 mM NaCl ، 1٪ BSA ، الرقم الهيدروجيني 7.2). تشغيل الضوابط الإيجابية والسلبية المناسبة بالتوازي مع أقسام الدراسة.
- احتضان الشرائح مع الجسم المضاد الأساسي لمدة 12 ساعة. الكشف عن الجسم المضاد الأولي مع الماعز المضادة للأرانب HRP متعددة مترافقة وتصور المجمع مع 3,3-diaminobenzidine ومحسن كبريتات النحاس.
- اغسل الشرائح في الماء المقطر ، وقم بتلطيخ الهيماتوكسيلين ، وجففها ، وقم بتركيبها بوسط دائم.
ملاحظة: خطوات الجفاف هي عكس خطوات الإماهة الموضحة في الخطوة 8.3. امسح الشرائح ضوئيا باستخدام الماسحة الضوئية المتوفرة بتكبير 20x أو 40x وقم بتحميلها إلى قاعدة بيانات. - باستخدام البرامج ، ارسم عائد الاستثمار لتضمين جميع الخلايا الملطخة ب NuMA داخل أنسجة العضو ، باستثناء حمة الأعضاء الأخرى والمساحات الفارغة.
- اضبط الإعدادات لتصنيف الخلايا الإيجابية NuMA والخلايا السلبية NuMA أثناء استخدام عناصر التحكم الإيجابية والسلبية المناسبة لكل عضو. استخدم خوارزمية برمجية ثابتة لتحديد العدد الإجمالي / النسبة المئوية للخلايا الإيجابية NuMA لكل عينة.
9. التألق المناعي شريحة الأنسجة
لتحديد المرحلة النقيلية التي يكون فيها مرشح جين معين مطلوبا (على سبيل المثال ، الإسراف مقابل البقاء على قيد الحياة بعد البذر) ، يمكن للمرء تحديد التألق المناعي لشريحة الأنسجة في نقاط زمنية مختلفة لتتبع تطور الخلايا السرطانية من الحقن إلى غزو الأعضاء البعيد ، والبذر ، والنمو. يسمح هذا النهج بإضافة علامات للخلايا المجاورة لالتقاط حدث الإسراف وتغيرات البيئة الدقيقة المحيطة بالورم33.
- تخدير الحيوان كما هو موضح في الخطوة 7.1.
- حقن 100 ميكروغرام من الفلوروفور المترافق Lycopersicon Esculentum (الطماطم) Lectin في البطين الأيسر لكل ، قبل 3 دقائق من التروية ، لتحديد بطانة الأوعية الدموية.
ملاحظة: امنح الوقت لإعادة تدوير ليكتين الطماطم في النظام بأكمله. - قم بدمج الحيوان كما هو موضح في الخطوات 7.2-7.3. حصاد الأعضاء ذات الأهمية ونقلها إلى حاويات ملصقة مسبقا مليئة ب PFA بنسبة 4٪. إصلاح الأنسجة لمدة 24 إلى 48 ساعة. قسم الأنسجة باستخدام اهتزاز إلى شرائح سميكة 30-50 ميكرومتر.
ملاحظة: يجب تحسين السماكة. يوصى باستخدام شرائح يتراوح سمكها بين 30 ميكرومتر و 50 ميكرومتر ، خاصة عند إجراء تصوير z-stack. - احتضان الشرائح في المخزن المؤقت المانع (10٪ مصل الماعز العادي ، 2٪ BSA ، 0.25٪ Triton X-100 في DPBS) لمدة 2 ساعة في RT.
- قم بإجراء تجربة تحسين التلطيخ.
ملاحظة: نظرا لأن وقت استرجاع المستضدات ، فإن المخازن المؤقتة المستخدمة لاسترداد المستضدات ودرجة الحرارة والأجسام المضادة المختلفة / الكميات المختلفة ونوع الأنسجة تؤثر على التلطيخ ، وتجارب التحسين ضرورية. - أضف أجساما مضادة أولية عند تخفيف محسن واحتضنها لوقت محسن عند درجة حرارة محسنة (انظر الأمثلة في الجدول 1).
ملاحظة: استخدم عناصر التحكم المناسبة للأجسام المضادة الأولية/الثانوية وعينات الأنسجة غير الملطخة. - اغسل شرائح الأنسجة 3 مرات لمدة 5 دقائق باستخدام 0.25٪ Triton X-100 في DPBS.
- احتضان شرائح الأنسجة في الأجسام المضادة الثانوية المخففة في محلول الحجب للوقت المطلوب (الجدول 1).
- اغسل شرائح الأنسجة 3 مرات لمدة 5 دقائق باستخدام 0.25٪ Triton X-100 في DPBS.
- قم بتلطيخ النوى باستخدام 4′,6-diamidino-2-phenylindole (DAPI) المخفف بنسبة 1:1,000 في DPBS أو المخزن المؤقت المانع لمدة 5 دقائق.
- أضف 2 قطرة من وسط تركيب التألق المضاد للتلاشي إلى غطاء وقم بتركيب الأنسجة على شرائح زجاجية ، مع التأكد من تغطية الشرائح بالكامل بواسطة وسط التركيب.
ملاحظة: تأكد من عدم وجود فقاعات هواء مباشرة على الشرائح لأن هذا يشوه الفحص المجهري. - التقط صورا متحدة البؤرة باستخدام المجهر المتاح باستخدام هدف غمر الزيت بمعدل 60 ضعفا.
ملاحظة: عند الحصول على صور متحدة البؤرة، قم بتطبيق نفس معلمات الإعدادات (الجهد والوحدات متجددة الهواء والكسب) عبر جميع الصور داخل التجربة. - التقط صورا غير متحدة البؤرة باستخدام المجهر بمعدل 10x أو 20x أو 40x.
- قم بتحميل الصور في برنامج تحليل الصور وتحليلها من خلال مقارنة المعلمات المفضلة (أي المساحة أو العدد أو شدة العلامات أو الاتصال بالخلايا المجاورة).
النتائج
توضح الأرقام التالية كيف تم تطبيق سير العمل الموصوف لتحديد الدوافع الجديدة لورم خبيث في سرطان الجلد. يلخص الشكل 2 نتائج دراسة منشورة تمت فيها دراسة آثار إسكات فوكوزيل ترانسفيراز FUT8 في ورم خبيث في الورم الميلانيني في الجسم الحي 26. باختصار ، كشف تحليل بيانا?...
Discussion
الهدف من هذا التقرير الفني هو تقديم سير عمل موحد من أعلى إلى أسفل للتحقيق في الجهات الفاعلة المحتملة في ورم خبيث سرطان الجلد. كما هو الحال في التجارب الحية يمكن أن تكون مكلفة وتستغرق وقتا طويلا ، فإن الاستراتيجيات الرامية إلى تحقيق أقصى قدر من الكفاءة وزيادة قيمة المعلومات التي يتم ال...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان.
Acknowledgements
نشكر قسم تقنيات البحوث المتقدمة (DART) في جامعة نيويورك لانغون هيلث ، وعلى وجه الخصوص ، مختبر أبحاث علم الأمراض التجريبي ، ومركز تكنولوجيا الجينوم ، ومختبر قياس الخلايا وفرز الخلايا ، ونواة التصوير قبل السريرية ، والتي يتم دعمها جزئيا من قبل منحة دعم مركز بيرلموتر للسرطان NIH / NCI 5P30CA016087. نشكر مجموعة جامعة نيويورك التعاونية متعددة التخصصات لسرطان الجلد (PI: الدكتورة إيمان عثمان) على توفير الوصول إلى ثقافات سرطان الجلد قصيرة الأجل المشتقة من المريض + (10-230BM و 12-273BM) ، والتي تم الحصول عليها من خلال بروتوكولات معتمدة من IRB (دراسة الموافقة الشاملة #s16-00122 ودراسة مجموعة سرطان الجلد التعاونية متعددة التخصصات # 10362). نشكر الدكتور روبرت كيربل (جامعة تورنتو) على توفير خطوط خلايا سرطان الجلد 113/6-4L و 131/4-5B1 * والدكتور مينهارد هيرلين (معهد Wistar) لتوفير ثقافات WM 4265-2 و WM 4257s-1 و WM 4257-2 سرطان الجلد على المدى القصير **. E.H. مدعوم من قبل NIH / NCI R01CA243446 ، P01CA206980 ، جائزة العلوم لفريق تحالف أبحاث سرطان الجلد الأمريكية ، و NIH Melanoma SPORE (NCI P50 CA225450; PI: I.O.). تم إنشاء الشكل 1 باستخدام Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| #15 Scapel Blade | WPI | 500242 | For surgical procedures |
| #3 Scapel Handle | WPI | 500236 | For surgical procedures |
| 1 mL Tuberculin syringe, slip tip | BD | 309626 | Injections |
| 10 mL syringe, slip tip | BD | 301029 | Perfusion |
| 10% Formalin Sodium Buffered | EK Industries | 4499-20L | For perfusion/tissue fixative |
| 15 mL Conical | Corning | 430052 | Cell culture |
| 15 mL Conical Polypropylene Centrifuge Tubes | Falcon | 352196 | Cell culture |
| 200 Proof Ethanol | Deacon Labs | 04-355-223 | Histology |
| 22G – 22mm needle | BD | 305156 | Perfusion |
| 4-0 Vicryl Suture | Ethicon | J464G | Suture |
| 4% Carson's phosphate buffered paraformaldehyde | EMS | 15733-10 | For perfusion/tissue fixative |
| 40µm | Corning | 431750 | Tissue processing |
| 5-0 Absorbable Suture | Ethicon | 6542000 | Closure |
| 50 mL Conical | Corning | 430828 | Cell culture |
| 50mL Conical Polypropylene Centrifuge Tubes | Falcon | 352070 | Cell culture |
| 7-0 Silk suture | FST | 18020-70 | Ligature |
| 70µm | Corning | 431751 | Tissue processing |
| Anti-fade mounting media | Vector Labs | H-1000-10 | Immunofluorescence |
| Approximator applying Forceps, 10cm | WPI | 14189 | For microsurgical procedures |
| Avance | Bruker | 3 HD | NMR Console |
| Biospec 7030 | Bruker | 7030 | Micro MRI |
| BSA | Bioreg | A941 | NuMA Staining |
| Castroviejo suturing forceps, straight tips 5.5mm tying platform, 11cm | WPI | WP5025501 | For microsurgical procedures |
| Coplin Staining Jar | Bel-Art | F44208-1000 | Histology |
| DAPI | Sigma-Aldrich | D9542-1MG | Immunofluorescence |
| dCas9-KRAB | Addgene | 110820 | Genetic manipulation |
| DNase I | NEB | M0303L | Tissue processing |
| DPBS | Corning | 21-030-CM | Tissue processing |
| Extra Sharp Uncoated Single Edge Blade | GEM | 62-0167 | Tissue processing |
| Extracellular Matrix Substrate | Corning | 354234 | Consider the Growth Factor Reduced ( as alternative |
| FBS | Cytiva | SH30910.03 | Cell culture |
| Fiji Image J | Fiji Image J | Software | Immunofluorescence |
| Goat anti-rabbit HRP conjugated multimer | Thermo Fisher | A16104 | NuMA Staining |
| Goat Serum | Gibco | PCN5000 | Immunofluorescence |
| HBSS | Corning | 21-020-CV | Tissue processing |
| Hematoxylin | Richard-Allan Scientific | 7231 | Histology |
| Illumina III | PerkinElmer | CLS136334 | BLI Instrument |
| Insulin syringe 28G - 8mm needle | BD | 329424 | Injections |
| Insulin syringe 31G - 6mm needle | BD | 326730 | Injections |
| Iris Forceps, 10.2cm, Full Curve, serrated | WPI | 504478 | For perfusion and surgical procedures |
| Isoflurane USP | Covetrus | 11695067772 | Anesthesia |
| Jewelers #7 Forceps Titanium 11 cm 0.07 x 0.01 mm Tip | WPI | WP6570 | For microsurgical procedures |
| Ketamine HCl 100mg/mL | Mylan Ind. | 1049007 | Anesthesia |
| lentiCRISPRv2 | Addgene | 98290 | Genetic manipulation |
| Lycopersicon Esculentum (Tomato) Lectin, DyLight 649 | Invitrogen | L32472 | Vascular endothelial cells marker |
| MEM non-essential amino acids X 100 | Corning | 25-025-CI | Cell culture |
| Metzenbaum Scissors | WPI | 503269 | For surgical procedures |
| Microinjection Unit | KOPF | 5000 | Intracardiac injections |
| NaCl | Fisher | S25877 | NuMA Staining |
| Needle 30G x 25mm | BD | 305128 | Intracardiac Injection |
| Needle 33G x 15mm | Hamilton | 7747-01 | Intracarotid Injection |
| Needle holder, Castroviejo, 14cm, with lock, 1.2mm Serrated Jaws | WPI | 14137-G | For microsurgical procedures |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ mice | The Jackson Laboratory | 005557 | Murine model |
| NU/J mice | The Jackson Laboratory | 002019 | Murine model |
| Nuclear Mitotic Apparatus Protein polyclonal rabbit anti-human | Abcam | 97585 | NuMA Staining |
| Penicillin-Streptomycin 10000U/mL | Gibco | 15140122 | Cell culture |
| Percoll | GE | 0891-01 | density separation solution |
| PI Classic Surgical Gloves | Cardinal Health | 2D72PT75X | Surgery |
| pLKO Tet-On | Addgene | 21915 | Genetic manipulation |
| Povidone-Iodine 10% Solution | Medline | MDS093943 | Surgery |
| Proparacaine Drops 0.5% | Akorn Pharma | AX0501 | Opthalmic local anesthetic |
| Puralube Petrolatum Opthalmic Ointment | Dechra | 83592 | Anesthesia |
| Razor Blade Double Edge Blades | EMS | 72000 | Shaving and Vibrotome Brain Slicing |
| Reflex 9mm EZ Clip | Braintree | EZC- KIT | Wound closure |
| RPMI 1640 | Corning | 10-040-CM | Cell culture |
| Scissors, Spring 10.5cm Str, 8mm Blades | WPI | 501235 | For microsurgical procedures |
| Semi-Automatic Vibrating Blade Microtome | Leica | VT1200 | Brain Slice Immunofluorescence |
| Single Channel Anesthesia Vaporizer System | Kent Scientific | VetFlo-1210S | Anesthesia |
| Smartbox Tabletop Chamber System and Exhaust Blower | EZ Systems | TT4000 | CO2 Euthanasia |
| Sterile Fenestrated Disposable Drape | Medline | NON21002 | Surgery |
| Sterile Non-Reinforced Aurora Surgical Gowns with Set-In Sleeves | Medline | DYNJP2715 | Surgery |
| T25 Flask | Corning | 430639 | Cell culture |
| Tris | Corning | 46-031-CM | NuMA Staining |
| Triton X-100 | Sigma-Aldrich | X100-500ML | Immunofluorescence |
| Troutman tying forceps, 10cm, Curved G pattern, 0.52mm tip with tying platform | WPI | WP505210 | For microsurgical procedures |
| Vessel clips 10G Pressure 5x 0.8mm Jaws, 5/pkg | WPI | 15911 | For microsurgical procedures |
| Visiopharm | Visiopharm | Visiopharm | NuMA Staining Quantification Software |
| Xylasine 100mg/mL | Akorn Pharma | 59399-111-50 | Anesthesia |
| Xylene | Fisher | X3P-1GAL | Histology |
References
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Adler, N. R., Haydon, A., McLean, C. A., Kelly, J. W., Mar, V. J. Metastatic pathways in patients with cutaneous melanoma. Pigment Cell Melanoma Research. 30 (1), 13-27 (2017).
- Platz, A., Egyhazi, S., Ringborg, U., Hansson, J. Human cutaneous melanoma; a review of NRAS and BRAF mutation frequencies in relation to histogenetic subclass and body site. Molecular Oncology. 1 (4), 395-405 (2008).
- Alonso, S. R., et al. A high-throughput study in melanoma identifies epithelial-mesenchymal transition as a major determinant of metastasis. Cancer Research. 67 (7), 3450-3460 (2007).
- Rowe, C. J., Khosrotehrani, K. Clinical and biological determinants of melanoma progression: Should all be considered for clinical management. Australasian Journal of Dermatology. 57 (3), 175-181 (2016).
- Plebanek, M. P., et al. Pre-metastatic cancer exosomes induce immune surveillance by patrolling monocytes at the metastatic niche. Nature Communications. 8 (1), 1319 (2017).
- Orgaz, J. L., et al. Loss of pigment epithelium-derived factor enables migration, invasion and metastatic spread of human melanoma. Oncogene. 28 (47), 4147-4161 (2009).
- Ladhani, O., Sanchez-Martinez, C., Orgaz, J. L., Jimenez, B., Volpert, O. V. Pigment epithelium-derived factor blocks tumor extravasation by suppressing amoeboid morphology and mesenchymal proteolysis. Neoplasia. 13 (7), 633-642 (2011).
- Ju, R. J., Stehbens, S. J., Haass, N. K. The role of melanoma cell-stroma interaction in cell motility, invasion, and metastasis. Frontiers in Medicine - Dermatology. 5, 307 (2018).
- Wiley, H. E., Gonzalez, E. B., Maki, W., Wu, M. T., Hwang, S. T. Expression of CC chemokine receptor-7 and regional lymph node metastasis of B16 murine melanoma. Journal of the National Cancer Institute. 93 (21), 1638-1643 (2001).
- Meier, F., et al. Metastatic pathways and time courses in the orderly progression of cutaneous melanoma. British Journal of Dermatology. 147 (1), 62-70 (2002).
- Turner, N., Ware, O., Bosenberg, M. Genetics of metastasis: melanoma and other cancers. Clinical & Experimental Metastasis. 35 (5-6), 379-391 (2018).
- Ubellacker, J. M., et al. Lymph protects metastasizing melanoma cells from ferroptosis. Nature. 585 (7823), 113-118 (2020).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Cunningham, C. C., et al. Actin-binding protein requirement for cortical stability and efficient locomotion. Science. 255 (5042), 325-327 (1992).
- Unger, C., et al. Modeling human carcinomas: physiologically relevant 3D models to improve anti-cancer drug development. Advanced Drug Delivery Reviews. 79-80, 50-67 (2014).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Nakamura, K., et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Science. 70 (7), 791-798 (2002).
- Meeth, K., Wang, J. X., Micevic, G., Damsky, W., Bosenberg, M. W. The YUMM lines: a series of congenic mouse melanoma cell lines with defined genetic alterations. Pigment Cell Melanoma Research. 29 (5), 590-597 (2016).
- Koya, R. C., et al. BRAF inhibitor vemurafenib improves the antitumor activity of adoptive cell immunotherapy. Cancer Research. 72 (16), 3928-3937 (2012).
- Jenkins, M. H. Multiple murine BRaf(V600E) melanoma cell lines with sensitivity to PLX4032. Pigment Cell Melanoma Research. 27 (3), 495-501 (2014).
- Tuncer, E., et al. SMAD signaling promotes melanoma metastasis independently of phenotype switching. The Journal of Clinical Investigation. 129 (7), 2702-2716 (2019).
- Schwartz, H., et al. Incipient Melanoma Brain Metastases Instigate Astrogliosis and Neuroinflammation. Cancer Research. 76 (15), 4359-4371 (2016).
- Perez-Guijarro, E., et al. Multimodel preclinical platform predicts clinical response of melanoma to immunotherapy. Nature Medicine. 26 (5), 781-791 (2020).
- Krepler, C., et al. A Comprehensive Patient-Derived Xenograft Collection Representing the Heterogeneity of Melanoma. Cell Reports. 21 (7), 1953-1967 (2017).
- Agrawal, P., et al. A systems biology approach identifies FUT8 as a driver of melanoma metastasis. Cell. 31 (6), 804-819 (2017).
- Hanniford, D., et al. Epigenetic silencing of CDR1as drives IGF2BP3-mediated melanoma invasion and metastasis. Cancer Cell. 37 (1), 55-70 (2020).
- Kim, H., et al. PRMT5 control of cGAS/STING and NLRC5 pathways defines melanoma response to antitumor immunity. Science Translational Medicine. 12 (551), (2020).
- de Miera, E. V., Friedman, E. B., Greenwald, H. S., Perle, M. A., Osman, I. Development of five new melanoma low passage cell lines representing the clinical and genetic profile of their tumors of origin. Pigment Cell Melanoma Research. 25 (3), 395-397 (2012).
- Morsi, A., et al. Development and characterization of a clinically relevant mouse model of melanoma brain metastasis. Pigment Cell Melanoma Research. 26 (5), 743-745 (2013).
- Huynh, C., et al. Efficient in vivo microRNA targeting of liver metastasis. Oncogene. 30 (12), 1481-1488 (2011).
- Zou, C., et al. Experimental variables that affect human hepatocyte AAV transduction in liver chimeric mice. Molecular Therapy Methods and Clinical Development. 18, 189-198 (2020).
- Kleffman, K., et al. Melanoma-secreted Amyloid Beta Suppresses Neuroinflammation and Promotes Brain Metastasis. bioRxiv. , 854885 (2019).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Molecular Imaging and Biology. 13 (6), 1114-1123 (2011).
- Sil, P., Wong, S. W., Martinez, J. More than skin deep: autophagy is vital for skin barrier function. Frontiers in Immunology. 9, 1376 (2018).
- Chen, S., et al. Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell. 160 (6), 1246-1260 (2015).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163 (6), 1515-1526 (2015).
- Wang, T., et al. Identification and characterization of essential genes in the human genome. Science. 350 (6264), 1096-1101 (2015).
- Edgar, R., Domrachev, M., Lash, A. E. Gene Expression Omnibus: NCBI gene expression and hybridization array data repository. Nucleic Acids Research. 30 (1), 207-210 (2002).
- Lappalainen, I., et al. The European Genome-phenome Archive of human data consented for biomedical research. Nature Genetics. 47 (7), 692-695 (2015).
- Cerami, E., et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data. Cancer Discovery. 2 (5), 401-404 (2012).
- Grossman, R. L., et al. Toward a shared vision for cancer genomic data. New England Journal of Medicine. 375 (12), 1109-1112 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved