É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uma plataforma robusta de descoberta para a identificação de novos mediadores de metástase de melanoma
Neste Artigo
Resumo
Este artigo descreve um fluxo de trabalho de técnicas empregadas para testar novos mediadores candidatos de metástase de melanoma e seus mecanismos de ação.
Resumo
A metástase é um processo complexo, exigindo que as células superem barreiras que são apenas modeladas incompletamente por ensaios in vitro . Um fluxo de trabalho sistemático foi estabelecido utilizando modelos in vivo robustos e reprodutíveis e métodos padronizados para identificar novos atores na metástase do melanoma. Essa abordagem permite a inferência de dados em estágios experimentais específicos para caracterizar precisamente o papel de um gene na metástase. Os modelos são estabelecidos pela introdução de células de melanoma geneticamente modificadas através de injeções intracardicascas, intradérmicas ou subcutâneas em camundongos, seguidos pelo monitoramento com imagens in vivo em série. Uma vez alcançados pontos finais pré-estabelecidos, tumores primários e/ou órgãos portadores de metástases são colhidos e processados para várias análises. As células tumorais podem ser classificadas e submetidas a qualquer uma das várias plataformas de "omics", incluindo o sequenciamento de RNA unicelular. Os órgãos passam por análises de imagem e imunohistopatológicas para quantificar a carga global de metástases e mapear sua localização anatômica específica. Este pipeline otimizado, incluindo protocolos padronizados para engrafamento, monitoramento, colheita de tecidos, processamento e análise, pode ser adotado para culturas derivadas do paciente, culturas de curto prazo e linhas celulares humanas e murinas estabelecidas de vários tipos de câncer sólido.
Introdução
A alta mortalidade associada ao melanoma metastático combinada com uma incidência crescente de melanoma em todo o mundo1 (um aumento estimado de 7,86% até 2025) exige novas abordagens de tratamento. Os avanços na descoberta de alvos dependem de modelos reprodutíveis de metástase, um processo altamente complexo. Ao longo das etapas da cascata metastática, as células de melanoma devem superar inúmeras barreiras para alcançar a evasão do sistema imunológico e a colonização de tecidos distantes2. A resiliência e adaptabilidade das células de melanoma surgem de uma infinidade de fatores, incluindo sua alta carga mutacional genética3 e sua origem da crista neural, que confereplastia fenotípica crucial 3,4,5. A cada passo, os programas transcricionais permitem que as células de melanoma metástase mudem de um estado para outro com base em pistas do crosstalk com o microambiente, compreendendo o sistema imunológico6, o meio extracelular 7,8 e a arquitetura celular das barreiras físicas9 com as quais entram em contato. Por exemplo, as células de melanoma escapam da vigilância imunológica, regulando a expressão de importantes fatores imunes-priming secretados por tumor6.
Estudos descrevem um "nicho pré-metastático", no qual as células de melanoma secretam quimiocinas e citocinas para preparar o distante órgão "alvo" para a metástase10. Esses achados levantam questões importantes sobre o tropismo de órgãos das células de melanoma metastático e a rota anatômica que tomam para acessar tecidos distantes. Após a intravasação, as células de melanoma são conhecidas por metástase através de linfáticos (propagação linfática) e vasos sanguíneos (propagação hematógena)2,11. Enquanto a maioria dos pacientes apresenta doença localizada, um pequeno subconjunto de casos apresenta doença metastática distante e nenhuma disseminação linfática (envolvimento negativo do linfonodo)11, sugerindo a existência de vias metastáticas alternativas para o melanoma.
Quando colonizam um sítio metastático, as células de melanoma passam por adaptações epigenéticas e metabólicas12,13. Para acessar e invadir novos compartimentos, as células de melanoma empregam proteases14 e modificações citoesquelletal 11,15, que lhes permitem atravessar e crescer em sua nova localização. A dificuldade em direcionar as células de melanoma reside na complexidade e no número de adaptações; assim, o campo deve fazer esforços para recriar experimentalmente o maior número possível de etapas e adaptações. Apesar de inúmeros avanços em ensaios in vitro, como organoides e culturas 3D16,17, esses modelos apenas recapitulam indevidamente a cascata metastática in vivo.
Os modelos murinos têm mostrado valor ao encontrar um equilíbrio entre reprodutibilidade, viabilidade técnica e simulação de doença humana. Células de melanoma implantadas intravascularmente, ortototónicas e heterotototicamente de xenoenxertos derivados do paciente ou culturas de curto prazo em camundongos imuno-comprometidos ou humanizados representam a espinha dorsal da descoberta de alvos em melanoma metastático. No entanto, esses sistemas muitas vezes não têm uma restrição biológica crucial na metástase: o sistema imunológico. Modelos de metástase de melanoma síngênico que possuem essa restrição são relativamente escassos no campo. Esses sistemas, desenvolvidos em camundongos imunocompetuntes, incluindo B16-F1018, a família YUMM das linhas celulares19, SM120, D4M321, RIM322 ou mais recentemente, as linhascelulares RMS 23 e M1 (Mel114433), M3 (HCmel1274), M4 (B2905)24 linhas de células de melanoma, facilitam a investigação do papel complexo da resposta imune do hospedeiro na progressão do melanoma.
Aqui, é apresentado um pipeline para identificação de metas de metástase de melanoma. Com conjuntos de dados cada vez maiores de "omics" sendo gerados a partir de coortes de pacientes com melanoma, postulamos que os estudos que mais mantêm a promessa clínica são aqueles que decorrem da integração de big data, levando a um interrogatório funcional e mecanicista mecanicista mecático mecáticomecático. Ao usar modelos de camundongos para estudar potenciais alvos no processo metastático, pode-se explicar eventos in vivo e interações teciduais, aumentando assim a probabilidade de tradução clínica. Vários métodos para quantificar a carga metastática são descritos, fornecendo dados complementares sobre os resultados de qualquer experimento. Um protocolo para isolamento unicelular de tumores em vários órgãos é descrito para ajudar a caracterização imparcial da expressão genética em células metastáticas, que podem preceder o sequenciamento de RNA unicelular ou em massa.
Protocolo
NOTA: Os procedimentos animais envolvidos no seguinte protocolo foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Nova York (IACUC). Todos os procedimentos são realizados em instalações aprovadas pela Associação de Avaliação e Acreditação do Laboratório Animal Care International (AAALAC). A Figura 1 retrata a abordagem experimental geral.
1. Culturas de melanoma derivados do paciente (STCs)
- Coloque o tecido em uma placa de Petri de 60 mm com 1 mL de RPMI completo (RPMI 1640 suplementado com 10% de soro bovino fetal (FBS), 2 mM L-glutamina, 1 mM piruvato de sódio, solução de aminoácidos não essenciais de 1x MEM e penicilina (100 UI/mL)/estreptomicina (100 μg/mL)).
NOTA: Para aumentar a proporção de células tumorais, se necessário, disseque e remova o tecido ao redor do tumor na placa de Petri, sob um microscópio, utilizando instrumentos cirúrgicos estéreis. - Corte bem o tecido fresco usando lâminas de barbear esterilizadas em cubos de 1-2 mm. Adicione 4 mL de RPMI completo e pipeta o conteúdo da placa para cima e para baixo 5-10 vezes com uma pipeta sorológica de 10 mL.
- Transfira a suspensão celular para um tubo cônico de polipropileno de 15 mL e gire as células para baixo (180 × g por 5 min a 4 °C). Aspire o supernasal, resuspenque a pelota celular em 1 mL de meio fresco e transfira a suspensão para um frasco de cultura tecidual de25 cm 2 .
- Para ajudar os fragmentos de tecido a se prenderem ao fundo, coloque o frasco inclinado em um ângulo de 20°-30° em uma incubadora de cultura de tecido a 37 °C, 5% de CO2 por 20 minutos.
- Coloque o frasco no plano para permitir que o meio cubra o tecido e verifique o estado da cultura diariamente. Divida as células quando atingirem 90-100% de confluência. Mantenha culturas de curto prazo em um número de passagem "baixo".
NOTA: As STCs serão estabelecidas aproximadamente 2 meses após o isolamento e a cultura das células, embora o cronograma real varie entre amostras e tipos de tumores. Após 10 a 14 passagens, as linhas celulares atingem 100% de pureza, contendo apenas células de melanoma29. O limiar do número de passagem é empiricamente determinado observando alterações na morfologia celular, tempo de duplicação e comportamento in vivo. Para preservar a heterogeneidade e outras características do tumor pai, não divida as células mais de 1:5. - Após o estabelecimento de um STC e com qualquer modelo de linha celular a ser injetado em animais como descrito nas etapas subsequentes, transduza células com um repórter.
NOTA: Uma tag fluorescente (por exemplo, proteína fluorescente vermelha (RFP), proteína fluorescente verde (GFP), por exemplo, permite a imagem de imunofluorescência ex-vivo e a triagem de células tumorais por classificação celular ativada por fluorescência (FACS). A luciferase permite a imagem de bioluminescência in vivo , uma ferramenta útil para monitorar a progressão experimental (seção 4).
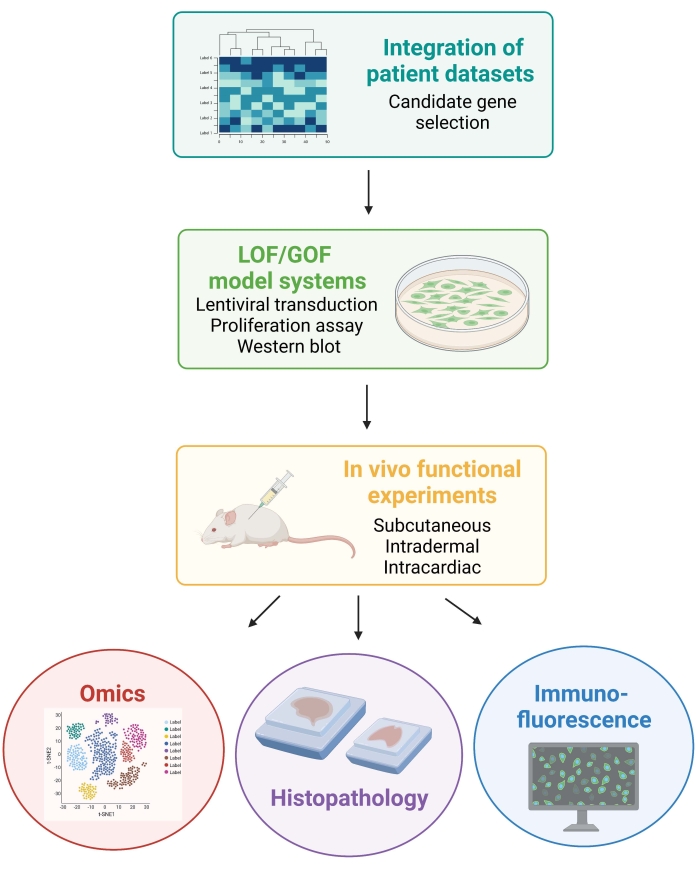
Figura 1: Esquemático ilustrando o fluxo de trabalho descrito, desde a integração de dados do paciente até a geração e análise de dados in vivo de camundongos. Abreviaturas: LOF = perda de função; GOF = ganho de função. Clique aqui para ver uma versão maior desta figura.
2. Implantação de xenoenxerto
NOTA: Os procedimentos experimentais descritos aqui são realizados em camundongos que têm sistemas imunológicos adaptativos e inatas prejudicados, NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG); ou em camundongos que não possuem imunidade adaptativa apenas, como os ratos atímicos/nus deficientes de células T (NU/J). Animais são de sexo masculino, 8 a 10 semanas de idade. As fêmeas frequentemente apresentam uma alta incidência de metástases gonadais após injeção intracardiac de células tumorais, o que reduz sua sobrevivência.
- Para injeções subcutâneas e intradérmicas, prepare uma suspensão celular 1:1 misturando uma parte das células suspensas em 1x Phosphate-Buffered Saline (DPBS) com uma parte descongelada substrato de matriz extracelular (EMS), e mantenha no gelo a 4 °C. Para injeções intravasculares (intracardiac, intracarotóide, retro-orbital, veia da cauda ou esplênica), suspenda as células apenas em DPBS.
NOTA: O volume apropriado para injeções intradérmicas deve ser mantido o mais baixo possível (30 μL). Para injeções subcutâneas, o volume injetado pode ir até 150 μL, e para injeções intravasculares, até 250 μL (com base no peso do animal). Adicione à suspensão celular final 10-30% de volume extra de injeção, com base na quantidade injetada e na seringa usada para explicar o volume morto dentro da ponta de deslizamento e a da agulha (por exemplo, uma seringa tuberculina de 1 mL com uma agulha de 30 G, 25 mm tem um volume morto de 100 μL). - Conduzir um piloto para caracterizar o comportamento das linhas celulares em uso e a linha do tempo de progressão do tumor in vivo. Para injeções intradérmicas, comece injetando de 1.000 até 50.000 células/30 μL. Para injeções subcutâneas, comece injetando de 10.000 até 2 × 106 células/150 μL. Para injeções intravasculares (intracardiac, intracarotídeos, retro-orbitais e esplênicas), comece injetando 50.000 células/150 μL.
NOTA: As injeções intravasculares predispõem os animais a eventos embólicos, seja introduzindo ar no sistema circulatório ou usando um número excessivo de células que ocluem os pequenos vasos. Misture bem a suspensão da célula para evitar a aglomeração. Prime a seringa antes de carregar a suspensão da célula. Remova as bolhas de ar dentro da seringa. Mantenha a suspensão/seringas do celular no gelo até o tempo de carregamento e injeção. - Administrar anestesia por inalação. Defina o regulador de nível de oxigênio entre 1-2 L/min. Coloque o animal na câmara de indução com o vaporizador de isoflurano fixado em 2,5-5% para indução e 1,5-3% para manutenção.
NOTA: Monitore a frequência respiratória e cardíaca do animal durante a fase de indução da anestesia. Não deixe o animal sozinho. Não monitore mais de um animal simultaneamente. Titer a quantidade de anestesia para o peso do animal. - Mova o animal da câmara de indução para o cone do nariz. Aplique pomada oftalmica de petrolatum estéril nos olhos do animal para evitar o ressecamento da córnea durante o procedimento.
- Raspe o local do procedimento com uma lâmina de barbear reto inclinada em um ângulo de 30°. Limpe a pele da área de procedimento com 70% de cotonetes de álcool isopropílico. Antes de qualquer outro passo, avalie um nível suficiente de anestesia por reflexo do pedal.
- Para injeções intradérmicas, realize todo o procedimento dentro de um armário de biossegurança para manter condições assépticas.
- Anestesiar e raspar o animal conforme descrito nas etapas 2.3-2.5.
- Agarre e retraia a pele para trás contra a trajetória da facada da agulha. Usando uma agulha de seringa de insulina de 31 G, de 6 mm de comprimento, mantida em um ângulo agudo, puna suavemente a pele com o bisel voltado para cima.
- Sinta a pressão soltar na ponta da agulha. Avance suavemente para ficar dentro do compartimento intradérmico e não passar por toda a profundidade da pele para dentro do subcutis. Crucial: Se alguém escorregar para o espaço subcutâneo, remova a agulha, mude a área de injeção e reinsera a agulha. Injete todo o volume (30 μL) de suspensão celular lentamente até que uma aveia em forma de cúpula seja observada.
NOTA: Os baixos volumes de injeção induzirão menos dissecção das camadas da pele e menos distorção arquitetônica. - Mantenha a agulha dentro e conte até 5.
NOTA: O EMS torna-se viscoso à temperatura corporal, ajudando a evitar o fluxo de volta através da perfuração da agulha. - Remova a agulha e abriga o animal em uma gaiola em uma almofada quente para se recuperar. Devolva o animal para a gaiola vivarium depois de recuperar a consciência, quando severo e ambulatorial.
NOTA: Monitore o animal continuamente durante todos os procedimentos descritos neste protocolo. Não deixe o animal sozinho ou monitore mais de um animal simultaneamente. - Monitore a progressão do crescimento do tumor, perda de peso e estado geral de saúde em conjunto com a equipe veterinária diariamente na fase inicial de crescimento e mais intensamente, se necessário, após os animais começarem a perder peso. Durante essas sessões de monitoramento: pesar os animais e traçar um gráfico para monitorar a perda de peso, e verificar sinais de ulceração tumoral, neurológica, locomotor e/ou sinais comportamentais (letargia, falta de preparo, baixa ingestão de alimentos ou água).
NOTA: Eutanize os animais imediatamente após observar sinais de doença avançada (mais de 20% de perda de peso, escore de condição corporal de <2, níveis de atividade extremamente reduzidos, paralisia ou convulsões). Use o método de eutanásia aprovado pelo IACUC da instituição (por exemplo, uma câmara automatizada de CO2 de mesa é usada para expor os animais ao CO2 por 15 min seguido de um método secundário de eutanásia, seja deslocamento cervical, decapitação ou pneumotórax induzido bilateralmente pela incisão da caixa torácica). - Faça as medidas com pinças e use as dimensões de comprimento (L) e largura (W) do tumor para calcular o volume (V) com a fórmula:
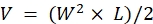
- Para injeções subcutâneas:
- Realize todo o procedimento dentro de um armário de biossegurança para manter as condições assépticas26,27.
- Anestesiar e raspar o animal conforme descrito nas etapas 2.3-2.5.
- Usando uma agulha de seringa de insulina de 28 G a 31 G, 6 mm de comprimento, mantida em um ângulo agudo, puna suavemente a pele com o bisel voltado para cima. Sinta a liberação de pressão na ponta da agulha duas vezes enquanto passa pela epiderme, derme e hipoderme.
NOTA: A segunda vez que uma liberação de pressão é sentida na ponta da agulha indica que o compartimento subcutâneo foi atingido. - Injete todo o volume (30-150 μL) de suspensão celular lentamente até que seja observado um wheal em forma de elipse alongado. Mantenha a agulha dentro e conte até 5. Conte até 10 para volumes maiores (mais de 50 μL).
NOTA: O EMS torna-se viscoso à temperatura corporal, ajudando a evitar o fluxo de volta através da perfuração da agulha. - Remova a agulha e abriga o animal em uma gaiola em uma almofada quente para se recuperar. Devolva o animal à sua gaiola vivarium depois de recuperar a consciência, quando severo e ambulatorial.
NOTA: Durante o monitoramento pós-procedimento, observe para quaisquer sinais de complicações (baixa taxa respiratória, sangramento, recuperação lenta) e aborde-as adequadamente. Caso não seja observada melhora, proceda aos procedimentos humanos de eutanásia descritos na NOTA da etapa 2.6.6. - Monitore o animal para o crescimento do tumor, perda de peso e estado de saúde geral, conforme descrito nas etapas 2.6.6-2.6.7.
- Para injeções intracardicascas:
- Realize todo o procedimento dentro de um armário de biossegurança para manter as condições assépticas26,30.
- Anestesiar o animal conforme descrito nas etapas 2.3-2.4.
- Transfira o animal para a plataforma aquecida da máquina de ultrassom e fixe-o com fita hipoalergênica para o cone do nariz.
- Raspe o tórax com uma lâmina de barbear reto inclinada em um ângulo de 30°. Limpe a pele da área de procedimento com 3 aplicações de 10% de povidone-iodo alternando com 3 aplicações de álcool isopropílico.
- Antes de qualquer outro passo, avalie um nível suficiente de anestesia por reflexo do pedal. Aplique gel de ultrassom no local do procedimento.
- Capture a janela cardíaca com a sonda de ultrassom. Posicione a sonda de ultrassom no meio do tórax do lado esquerdo do animal para capturar uma janela horizontal orientada para obter uma visão transversal (eixo curto) do ventrículo esquerdo. Garantindo que o eixo longo da sonda se depare para cima, fixe a sonda em um ângulo de 50° e a plataforma aquecida em um ângulo de 20°. Bloqueie a sonda e o quadro de suporte em posição.
- Elasenhe a suspensão da célula enquanto trabalha dentro do armário de biossegurança em uma seringa tuberculina de 1 mL com uma agulha de 30 G, 25 mm. Remova as bolhas de ar na seringa.
NOTA: É importante criar e manter uma suspensão unicelular enquanto as células são processadas e injetadas. Remover bolhas de ar é um passo importante para evitar a embolia do ar. Um sistema de agulha de seringa bem preparado evitará mortes evitáveis no grupo experimental. Sempre desenhe mais volume na seringa do que será injetado. O volume extra ajudará a remover o ar injetando parte da suspensão da célula de volta em um tubo de 1,5 mL. - Bloqueie a seringa no injetor estereotático. Sob orientação de ultrassom, avance a agulha através da parede torácica para o ventrículo esquerdo do coração. Injete todo o volume (100-250 μL) de suspensão celular lentamente.
- Remova a agulha e abriga o animal em uma gaiola em uma almofada quente para se recuperar. Devolva o animal à sua gaiola vivarium depois de recuperar a consciência, quando severo e ambulatorial. Monitore o animal para o crescimento do tumor, perda de peso e estado de saúde geral, conforme descrito na etapa 2.6.6.
- Para injeções intracarotíides:
- Realize todo o procedimento em uma superfície adequadamente desinfetada para ajudar a manter as condições assépticas30.
- Anestesiar o animal com um coquetel de cetamina (100 mg/kg) e xilazina (10 mg/kg) por injeção intraperitoneal com uma seringa de insulina, agulha de 28 G. Aplique pomada oftalmica de petrolatum estéril nos olhos do animal para evitar o ressecamento da córnea durante o procedimento.
- Raspe a área de procedimento com uma lâmina de barbear reto inclinada em um ângulo de 30°. Antes de qualquer outro passo, avalie um nível suficiente de anestesia por reflexo do pedal.
- Coloque o animal sob um microscópio estéreo em uma almofada de aquecimento. Limpe a pele da área de procedimento com 3 aplicações de 10% de povidone-iodo alternando com 3 aplicações de álcool isopropílico.
- Don equipamento de proteção individual estéril (EPI) e luvas estéreis. Prepare o campo estéril colocando uma cortina estéril sobre o corpo do animal.
NOTA: Se a cortina estéril não tiver um orifício apropriado para o tamanho e localização da incisão, dobre a cortina ao meio e use a tesoura Metzenbaum para cortar o orifício de tamanho apropriado no meio da cortina estéril. - Use um bisturi ou uma tesoura Iris para incitar a pele de metade do pescoço até o esterno. Com dois fórceps de microcirurgia, disseque sem rodeios as 2 glândulas salivares submandibulares no plano médio. Use um cautery elétrico para hemostasia, se necessário.
- Disseque a fáscia em torno da artéria carótida comum (CCA) do manúbrio em direção à bifurcação e continue medialmente para liberar a parede posterior da carótida externa. Corte a artéria carótida externa (ECA) temporariamente antes de injetar.
NOTA: Ao dissecar ao redor da circunferência da CCA, é preciso ter cuidado para não danificar o nervo vago (fica lateral à artéria). - Carregue a suspensão da célula em uma seringa de 1 mL com uma agulha de 33 G, 15 mm.
- Passe duas ligaduras 7-0 sob a CCA, e execute um nó de instrumento solto para cada uma das duas ligaduras. Use um clipe de vaso de pressão de 5 mm, 10 G e corte temporariamente o ECA. Amarre a ligadura proximal; em seguida, amarre a ligadura distal vagamente (ao lado da bifurcação da CCA). Use o laço distal mais tarde para controlar o sangramento pós-injeção.
- Utilizando a seringa com uma agulha de 33 G, 15 mm, puna suavemente a CCA com o bisel da agulha voltada para cima e para um ângulo agudo. Injete o volume inteiro (50-150 μL) de suspensão celular lentamente.
- Segure o laço distal com os fórceps e levante-o enquanto remove a agulha para ocluir o lúmen da CCA e parar o sangramento. Troque a seringa com um fórceps #7 Joalheiros e amarre o laço distal.
- Jogue outro nó de instrumento na ligadura distal e remova o clipe do vaso do ECA. Controle o campo cirúrgico para sangramento e cauterize qualquer vaso sanguíneo antes do fechamento. Use um dispositivo de grampeamento de 9 mm para fechar a pele do animal e coloque o animal em uma almofada quente para se recuperar.
NOTA: Remova os grampos de 7 a 10 dias após a cirurgia. - Administrar medicação analgésica subcutânea-Buprenorfina (0,3 mg/mL) a cada 12 h para 72 h pós-cirurgia a uma concentração de 0,1 mg/kg.
NOTA: Alternativamente, considere usar um medicamento analgésico de liberação estendida, que requer 1 dose a cada 72 h. - Devolva o animal à sua gaiola vivarium depois de recuperar a consciência, quando severo e ambulatorial. Monitore os animais diariamente para sinais de infecção ou dor no local cirúrgico, estado de saúde geral e complicações.
NOTA: Animais que não se recuperam bem da cirurgia de sobrevivência podem receber doses adicionais de medicação para dor e serão eutanizados humanamente se não totalmente recuperados até 72h após a cirurgia. - Monitore o animal para o crescimento do tumor, perda de peso e estado de saúde geral, conforme descrito na etapa 2.6.6.
- Para injeções retro-orbitais:
NOTA: Use esta técnica como alternativa às injeções de veias traseiras quando o operador é treinado e proficiente nesta técnica e quando há uma forte justificativa científica. As suspensões celulares fornecidas por esta rota podem induzir o crescimento do tumor no espaço retro-orbital; portanto, deve-se considerar cuidadosamente os riscos e benefícios na escolha desta técnica. Por exemplo, para aproveitar a conexão circulatória direta do seio venoso retro-orbital com as veias intracerebrais através de anastomoses, selecione este método quando a formação de tumor cerebral falhou usando outras rotas de injeção.- Realize todo o procedimento dentro de um armário de biossegurança para manter as condições assépticas. Don EPI estéril e luvas.
- Anestesiar o animal conforme descrito nas etapas 2.3-2.4.
NOTA: Para este procedimento, não aplique pomada oftalmica estéril aos olhos do animal, pois isso impedirá a injeção; aplicar apenas gotas anestésicos locais. - Carregue a suspensão celular em uma seringa de insulina com uma agulha de 28-31 G, 6 mm.
- Com o animal em posição propensa, retraia as pálpebras até que o olho se projete. Aplique 1 gota de anestésico local no olho do lado submetido ao procedimento.
- Insira a agulha em um ângulo de 30-45° entre o olho e o epicanthus medial com o bisel voltado para baixo. Injete a suspensão celular (10-150 μL) lentamente.
NOTA: Movimentos mais lentos evitam danos ao olho e o backflow do injetado. - Realize as etapas descritas em 2.7.5-2.7.6.
- Para injeções esplênicas:
- Realize todo o procedimento dentro de um armário de biossegurança para manter as condições assépticas31. Don EPI estéril e luvas estéreis.
- Anestesiar e raspar o animal conforme descrito nas etapas 2.3-2.5.
- Coloque o animal em uma posição lateral direita. Limpe a pele da área de procedimento com 3 aplicações de 10% de povidone-iodo alternando com 3 aplicações de álcool isopropílico e prepare o campo cirúrgico conforme descrito na etapa 2.9.5.
- Usando uma tesoura Metzenbaum ou um bisturi, faça uma incisão de 1 cm no flanco esquerdo da parede abdominal seguida de uma incisão no peritônio.
NOTA: O baço será visto através da parede abdominal translúcida depois de fazer a incisão da pele. Realize a incisão peritoneal exatamente neste site. - Exponha o baço e o hilum esplênico através da incisão. Usando uma agulha de seringa de insulina 28-31 G, 6 mm de comprimento, puna suavemente o baço com o bisel da agulha voltado para cima e para um ângulo agudo.
NOTA: Se a perfuração sangrar, cauterize o local para limitar o sangramento e o fluxo de volta. - Injete o volume inteiro (50-100 μL) de suspensão celular lentamente. Remova a agulha. Coloque uma pequena gaze no baço e aplique pressão com um fórceps. Fixar o baço levemente entre a gaze usando fórceps de mosquitos finos e esperar por 15 min.
- Faça uma esplenectomia amarrando o hilum esplênico com uma sutura de seda 3-0 ou 4-0, cauterizando os vasos, se necessário. Feche o peritônio com uma polidioxina (PDS) 5-0 ou sutura absorvível de ácido poliglicólico.
- Realize as etapas descritas nas etapas 2.7.5-2.7.6.
NOTA: Animais que apresentem complicações hemorrágas ou que não tenham se recuperado totalmente 72h após a cirurgia devem ser humanamente eutanizados. Lembre-se que o bem-estar dos ratos é a prioridade em todos os momentos.
3. Cirurgia de sobrevivência encenada (SSS)
- Com base nas conclusões experimentais da etapa 2.2, determine o tempo adequado para a cirurgia de sobrevivência. Dependendo da linha celular e da hipótese experimental, selecione um ponto de tempo anterior para a ressecção do tumor (em um volume de tumor = 150 mm3) ou um ponto de tempo posterior (em um volume de tumor = 500 mm3)26.
NOTA: O limite de volume do tumor é de 1.500 mm3 quando a carga tumoral é alta o suficiente para ser prejudicial ao bem-estar do animal e predispõe a complicações. - Anestesiar e raspar o animal conforme descrito nas etapas 2.3-2.5.
NOTA: Todo o procedimento é realizado dentro de um armário de biossegurança. - Limpe a pele da área de procedimento com 3 aplicações de 10% de povidone-iodo alternando com 3 aplicações de álcool isopropílico e prepare o campo cirúrgico conforme descrito na etapa 2.9.5.
- Usando uma tesoura iris ou um bisturi, inciso a pele, mantendo uma margem de ressecção de 5-7 mm da borda do tumor.
NOTA: A margem para a ressecção depende da capacidade do tumor de se espalhar localmente. Para tumores agressivos, aumente a margem de ressecção, certificando-se de que a pele suficiente seja deixada para realizar o fechamento da ferida. - No caso de tumores intradérmicos, ressecente o tumor junto com a pele circunferencial.
- Para tumores subcutâneos, disseca e remova o tumor sob a pele.
NOTA: Se o tumor invadir o peritônio e/ou a pele, resseque-o em bloco com o tumor e feche o peritônio com 5-0/4-0 PDS ou suturas absorvíveis de ácido poliglicólico. - Feche a ferida com o dispositivo de grampeamento de 9 mm.
NOTA: Remova os grampos de 7 a 10 dias após a cirurgia. Administre a medicação analgésica e coloque o animal em uma almofada quente para se recuperar. Continue administrando medicação analgésico para 72 h pós-cirurgia, uma vez a cada 12 h de acordo com a etapa 2.9.13. Animais com complicações hemorrágicamente ou que não recuperaram a consciência plena após a cirurgia devem ser humanamente eutanizados. - Casa única o animal em uma gaiola, em uma almofada quente para se recuperar. Devolva o animal para a gaiola vivarium depois de recuperar a consciência, quando severo e ambulatorial.
- Continue monitorando o pós-operatório animal para recidivas locais, perda de peso, sinais neurológicos, locomotores e/ou comportamentais (letargia, falta de preparo, baixa ingestão de alimentos ou água) e estado de saúde geral.
4. Imagem in vivo (Figura 2A)
- Administre substrato de D-luciferina (150 mg/kg) em animais por injeção intraperitoneal com uma seringa de insulina de 1 mL, agulha de 28 G.
NOTA: As células tumorais devem ser transduzidas com a luciferase cDNA. - Induzir anestesia conforme descrito nas etapas 2.3-2.4, 6 min após a injeção de substrato D-luciferin.
- Realize imagens usando um scanner de bioluminescência (BLI) (sistema de imagem in vivo )26.
- Mova o animal para dentro da câmara de imagem e para o cone do nariz. Imagem de até 5 animais simultaneamente, dependendo da capacidade do sistema de imagem.
- Inicie o instrumento pressionando inicializar. Defina a configuração do tempo de exposição para auto (1-120 s).
- Capture uma imagem em branco para subtrair qualquer fundo, se necessário. Clique em adquirir e salvar a imagem após a conclusão da sequência de aquisição.
- Coloque o animal de volta em uma gaiola, que fica com 50% da área da superfície base sobre uma almofada de aquecimento para se recuperar da anestesia. Devolva o animal para a gaiola vivarium depois de recuperar a consciência, quando severo e ambulatorial.
- Para análise de dados no mesmo software de imagem in vivo com o qual as imagens foram capturadas, navegue até a pasta onde as imagens são salvas e abra as imagens de todos os ratos pertencentes ao experimento de uma só vez.
NOTA: A análise de uma imagem por vez não permitirá a normalização entre grupos. - Coloque as unidades em brilho (não conta). Certifique-se de que a caixa de seleção que indica o indivíduo não está controlada, pois isso impedirá a normalização do sinal entre os grupos.
- Utilizando a ferramenta de desenho Região de Interesse (ROI), desenhe ROIs circulares para a região cerebral e ROIs retangulares para o corpo. Tenha cuidado para excluir as orelhas e o nariz do ROI cerebral, pois eles tendem a emitir luminescência inespecífica. Para minimizar o viés nesse processo, desenhe ROIs apenas nas fotografias dos ratos, sem o sinal luminescente sobreposto.
- Selecione Selecionar ROIs de medida para quantificar o sinal e exportar os dados para uma planilha. Analise as diferenças entre os grupos, traçando fluxo luminescente total (p/sec/cm2/sr) em regiões de interesse corporal.
NOTA: Para avaliar as diferenças entre os grupos no tropismo cerebral especificamente, calcule a razão entre o sinal cerebral e o sinal corporal de cada rato. Isso controla a variação intermousa da carga tumoral global e diferenças nos níveis de expressão luciferase entre grupos experimentais.
5. Ressonância magnética ex vivo
- Realize ex vivo MRI imediatamente após a eutanásia. Alternativamente, colher os órgãos de interesse, fixá-los em formalina por até 72 h, e realizar a imagem em um ponto de tempo posterior.
- Adquira as imagens com um sistema de micro-RMS 7-Tesla (7-T) (300 MHz) equipado com um console NMR e um ímã de furo horizontal ou equipamento semelhante.
NOTA: A necessidade de uma inserção de bobina de gradiente ativamente blindada com a troca correta de desempenho é crucial. Deve fornecer linearidade gradiente de pelo menos 50 mm de volume esférico dinâmico (DSV) para cobrir o conjunto de amostras examinadas simultaneamente sem distorção geométrica. A combinação de força gradiente (variando de 440 a 750 mT/m) e ciclo de serviço permitindo correntes de DC simultâneas máximas variando de 3 x 30 A a 3 x 87 A permitirá um desempenho adequado de imagem. A inserção da bobina de gradiente utilizada (ver a Tabela de Materiais) permite o seguinte desempenho: 660 mT/m, 130 μs de tempo de elevação, 3 x 87 A e um DSV = 80 mm. - Realize as varreduras com uma bobina de radiofrequência do corpo do rato circularmente polarizada (OD = 59 mm, ID = 38mm, L = 40 mm) sintonizada a 300,16 MHz, a frequência larmor de próton de 1H.
NOTA: Esta sonda rf permite a aquisição de conjuntos de dados 3D com resolução isotrópica submillimétrica (<150 μm) durante as varreduras durante a noite, abrangendo 8-12 h. - Detecte a carga tumoral usando múltiplas sequências30.
NOTA: O sinal hiperintense detectado por uma sequência de Imagens Rápidas e Ponderadas T2 com Ecos Refocados (RARE) reconhece edema em torno de tumores. - Executar a sequência 3D RARE com os seguintes parâmetros de aquisição: [120 μm]3 resolução isotropica; tempo de aquisição 5 h, 27 min; tempo de repetição (TR) = 500 ms; espaçamento ecológico (ES) = 12,7 min; Fator turbo TFx = 12; tempo de eco efetivo (TEeff) = 76,2 ms; largura de banda (BW) = 75 KHz; Tamanho da matriz = 2843; campo de visão (FOV) = [4,0 mm]3; número de médias (Nav) = 6.
- Detecte metástases usando os seguintes parâmetros.
- Para metástases pigmentadas com brilho de sinal, use uma sequência de eco 3D gradiente 3D ponderada T1 com os seguintes parâmetros: [120 μm]3 resolução isotropica; tempo de aquisição 2 h, 41 min; TR = 20 ms; tempo de eco (TE) = 4,0 ms; ângulo de lançamento (FA) = 18°; BW = 75 KHz; Tamanho da matriz = 2843; FOV = [34,0 mm]3; Nav = 6.
- Para metástases não espigmentadas e/ou hemorrágicas, use um sinal de hipointense ao adquirir sob uma sequência de eco multigradiente t2*(MGE) (3D MGE, [120 μm]3 resolução isotrópica; tempo de aquisição 3 h, 35 min; TR = 40 ms; TE = 3,6 ms; ES = 3,2 ms; 4 ecos; FA = 20°; BW = 100 kHz; Tamanho da matriz = 2843; FOV = (34,0 mm)3; Nav = 4.
- Use todas as 3 sequências para quantificar a carga tumoral.
- Cruze as áreas tumorais identificadas durante a análise com seções histológicas para garantir a precisão. Veja as seções 7 e 8.
6. Processamento de tecido para sequenciamento de RNA unicelular ou a granel
- Eutanize o animal utilizando qualquer método aprovado pelo IACUC da instituição. Veja um dos procedimentos descritos na NOTA da etapa 2.6.6.
- Disseque os órgãos de interesse e coloque-os em poços separados de uma placa contendo a Solução de Sal Balanceado (HBSS) da Hank no gelo. Trabalhe com rapidez e mantenha o tecido no gelo o tempo todo para maximizar a viabilidade celular.
NOTA: As seguintes etapas são específicas para o processamento cerebral. Ajuste o tipo de colagem para o tecido específico, com base em suas necessidades. - Prepare uma placa de 6 poços com 3 mL de HBSS em cada poço.
- Para visualizar e ajudar a orientar ainda mais a dissecção, use um microscópio de fluorescência e identifique as áreas rotuladas.
- Disseque as áreas fluorescentes e coloque os fragmentos de tecido na placa de 6 poços (1 fragmento por poço se os focos metastáticos individuais forem analisados ou múltiplos fragmentos de um órgão se múltiplas metástases no mesmo órgão forem analisadas). Use lâminas de barbear estéreis para picar o tecido em fragmentos o mais pequeno possível (sem gastar mais de 1-2 min nesta etapa para cada amostra).
NOTA: Limitar o tempo de processamento dos tumores ajuda a preservar a viabilidade celular. - Aspire e transfira o conteúdo de cada poço para um tubo cônico de 15 mL.
NOTA: Corte a ponta de uma ponta de pipeta de 1.000 μL para facilitar a transferência de fragmentos maiores. - Adicione 1 mL de HBSS ao poço e certifique-se de que os fragmentos/células de tecido restantes sejam transferidos para o tubo de 15 mL, que conterá um volume final de 4 mL. Adicione 50 μL de colagenase tipo I (40 mg/mL) e 12,5 μL DNase I (2.000 unidades/mL) a cada tubo.
- Coloque os tubos cônicos em um banho de água aquecido a 37 °C por 45 min. Brevemente vórtices os tubos cônicos a cada 5 minutos.
- Prewet um coador de 70 μm com HBSS. Use a extremidade tampada de um tubo de microcentrifuge esterilizado ou a parte plástica de um êmbolo de seringa e triture o tecido homogeneiza através de um coador de 70 μm em um novo tubo cônico de 50 mL.
NOTA: Prewetting os filtros com hbss ou tampão FACS facilita o esforço. - Lave o coador com 1 mL de HBSS. Prewet um coador de 40 μm com HBSS. Filtre cada amostra novamente através de um filtro de 40μm em um novo tubo cônico de 50 mL. Adicione 1 mL de FBS ao coador de 40 μm para lavá-lo. Mantenha os tubos cônicos no gelo o tempo todo.
- Encha o tubo cônico a 50 mL com DPBS gelado. Gire as células (180 × g por 10 min a 4 °C). Descarte o supernatante, tomando cuidado para não perder a pelota celular.
NOTA: Para amostras cerebrais, resuspenco as células em 2,5 mL de solução de separação de densidade de 38% (diluído em HBSS e armazenar à temperatura ambiente (RT)). Transfira para tubos FACS de 5 mL. Gire por 20 min a 800 × g. Corte a ponta de uma ponta de pipeta de 1.000 μL e remova a camada de gordura superior. Não deixe nenhuma gordura nas paredes dos tubos. Se sobrar alguma gordura, gire novamente e repita o processo. Este é um passo crítico . Remova o resto da fase líquida (a pelota será translúcida e difícil de visualizar). - Resuspensar as células em 1 mL de tampão de lise de glóbulos vermelhos (RBC) e incubar por 60 s em RT. Sacie a solução de lise adicionando 20 mL de DPBS.
- Gire as células a 180 × g por 10 min a 4 °C. Remova o supernascimento e resuspense as células em 2 mL de tampão FACS (5% FBS em DPBS).
- Proceda com a triagem de células rotuladas e/ou preparação de biblioteca para sequenciamento de RNA em massa ou unicelular.
NOTA: As células podem ser giradas, congeladas e armazenadas a -80 °C antes do isolamento do RNA para RNA-seq a granel.
7. Perfusão de tecido animal e preparação para análises imunohistológicas
- Anestesiar o animal com uma overdose de cetamina (300 mg/kg) e coquetel de xilazina (30 mg/kg) por injeção intraperitoneal com uma seringa de insulina e uma agulha de 28 G.
- Exponha o coração por dissecção grosseira e faça uma incisão no átrio direito. Segure o coração suavemente no lugar com fórceps longos e curvados voltados anteriormente.
NOTA: Formalina e paraformaldeído (PFA) são cancerígenos. Leia a Ficha técnica de segurança (SDS), evite a exposição a vapores e use o EPI apropriado. - Utilizando uma seringa de 10 mL com uma agulha de 22 G, 22 mm, injete 10 mL de DPBS seguido de 10 mL de 4% pfa no ventrículo esquerdo.
- Vá colher os órgãos e carregá-los em fitas histológicas pré-rotuladas. Coloque as fitas em um recipiente de tamanho apropriado que acomoda fixativo suficiente (formalina) para cobrir os tecidos.
NOTA: Idealmente, o volume fixador deve ser de 5 a 10 vezes o volume dos tecidos. - Fixar os órgãos dentro das fitas histológicas em 10% de formalina por 48-72 h. Descarte a formalina de 10% e lave as fitas duas vezes com 1x DPBS.
- Comece o processo de desidratação imergindo as fitas em 70% de etanol por 2h. Continuem imergindo as fitas sucessivamente no aumento das concentrações de etanol: 80%, 95%, 100% para 1h cada. Mude a solução 100% duas vezes depois de 1,5 h. Mergulhe as fitas em xileno por 1,5 h e realize três mudanças da solução.
- Incorpore as fitas em cera de parafina a 58-60 °C. Seção os blocos de parafina. Prossiga para hematoxilina e eosina (H&E) orimmunohistoquímica.
- Para identificar células de melanoma, use qualquer um desses marcadores ou um painel: S100, Melan-A, HMB-45, Tyrosinase, MITF. Quando possível, use a coloração do Aparelho Mitotístico Nuclear (NuMA), pois é um marcador celular humano altamente específico.
NOTA: A coloração do NuMA oferece um delineamento acentuado entre células hospedeiras (camundongos) e engrafadas (humanas) que auxiliam no processamento de imagens e nas fases subsequentes de quantificação do tumor.

Figura 2: Exemplos de imagens de BLI, brightfield, ex vivo fluorescence e H&E que ilustram a abordagem multifacetado para a análise dos efeitos dos genes candidatos na metástase do melanoma. (A) BLI, (B) BF, (C) ex vivo fluorescence e (D) imagens de coloração de H&E. As imagens utilizadas para fins de ilustração correspondem a um experimento no qual células de melanoma 131/6-4L transduzidas com um shRNA de controle não direcionado (shNTC) ou um shRNA direcionado fut8 foram injetados em camundongos imunodeficientes (NSG). O silenciamento fut8 prejudicou a disseminação metastática das células de melanoma. Barras de escala e barra de cor = p/seg/cm2/sr × 106 (A), 100 mm (B, C), 100 μm (D). Abreviaturas: BLI = bioluminescência por imagem; H&E = hematoxilina e eosina; shRNA = RNA de grampo de cabelo curto; shNTC = shRNA de controle de não-direcionamento; NSG = diabético não obeso grave imunodeficiência gama; FUT8 = fucosyltransferase 8; BF = brightfield. Clique aqui para ver uma versão maior desta figura.
8. Mancha de proteína do aparelho mitotístico nuclear (NuMA) (Figura 3)
- Use um anticorpo anti-NuMA como um marcador de fuso mitotístico altamente específico para a identificação e quantificação da carga metastática nas seções teciduais. 8.1. A identificação altamente específica e sensível das células de melanoma é alcançada.
- Se a imunohistoquímica cromogênica para NuMA for realizada em um instrumento de imunossueração automática, siga estas etapas conforme descrito32:
- Desparafinar as seções em xileno e reidratá-las em concentrações de etanol sequencialmente diminuídas. Mantenha os slides submersos por 15 minutos em xileno e transfira-os para 100% de etanol por mais 15 minutos.
NOTA: O restante das etapas de reidratação do etanol (95%, 80%, 75%) duram de 3 a 5 minutos cada. - Enxágüe os slides em água desionizada.
- Realize a recuperação de epítope submergindo os slides em um recipiente (por exemplo, frasco de coloração coplin) em tampão de citrato de sódio de 10 mM, pH 6.0, em um forno micro-ondas de 1200 Watts a 100% de potência por 10 min.
- Use anticorpo numa anti-humano de coelho não conjugado para rotulagem, diluído 1:7.000 em albumina de soro tris-bovino (BSA) (25 mM Tris, 15 mM NaCl, 1% BSA, pH 7.2). Execute os controles positivos e negativos apropriados em paralelo com as seções de estudo.
- Incubar os slides com o anticorpo primário por 12 h. Detecte o anticorpo primário com anti-coelho de cabra HRP conjugado multimer e visualize o complexo com 3,3 diaminobenzidina e um melhorador de sulfato de cobre.
- Lave os slides em água destilada, contra-retenção com hematoxilina, desidratar e montar com meio permanente.
NOTA: As etapas de desidratação são o inverso das etapas de reidratação descritas na etapa 8.3. Escaneie os slides com o scanner disponível em ampliação de 20x ou 40x e carregue-os em um banco de dados. - Usando software, desenhe ROIs para incluir todas as células manchadas de NuMA dentro do tecido do órgão, excluindo outros órgãos parenchyma e espaços vazios.
- Ajuste as configurações para categorizar as células NuMA positivas e NuMA-negativas, usando controles positivos e negativos apropriados para cada órgão. Use um algoritmo de software estabelecido para quantificar o número/porcentagem total de células positivas do NuMA para cada amostra.
9. Imunofluorescência de fatia de tecido
Para identificar o estágio metastático em que um determinado candidato genético é necessário (por exemplo, extravasação versus sobrevivência após a semeadura), pode-se determinar a imunofluorescência de fatia de tecido em diferentes pontos de tempo para rastrear a progressão das células tumorais da injeção para invasão de órgãos distantes, semeadura e crescimento. Essa abordagem permite a adição de marcadores para as células vizinhas capturarem o evento de extravasação e as alterações do microambiente tumoral circundante33.
- Anestesiar o animal como descrito na etapa 7.1.
- Injete 100 μg de fluoróforo conjugado Lycopersicon Esculentum (Tomate) Lectina no ventrículo esquerdo de cada animal, 3 minutos antes da perfusão, para delinear o endotélio vascular.
NOTA: Dê tempo para o Tomate Lectin recircular em todo o sistema. - Perfunda o animal conforme descrito nas etapas 7.2-7.3. Colher os órgãos de interesse e transferi-los para recipientes pré-rotulados cheios de 4% de PFA. Fixar o tecido por 24 a 48 h. Sele o tecido usando um vibratome em fatias de 30-50 μm de espessura.
NOTA: A espessura deve ser otimizada. São recomendadas fatias entre 30 μm e 50 μm de espessura, especialmente quando se realiza imagens de pilha de z. - Incubar as fatias no tampão de bloqueio (10% Soro normal de cabra, 2% BSA, 0,25% Triton X-100 em DPBS) por 2 h na RT.
- Realize um experimento de otimização de manchas.
NOTA: Como tempo de recuperação de antígeno, tampões usados para recuperação de antígenos, temperatura, diferentes anticorpos/lotes diferentes, e o tipo de tecido influencia a coloração, experimentos de otimização são necessários. - Adicione anticorpos primários em uma diluição otimizada e incubar por um tempo otimizado a uma temperatura otimizada (veja exemplos na Tabela 1).
NOTA: Utilize controles apropriados para anticorpos primários/secundários e amostras de tecido não manchados. - Lave as fatias de tecido 3 vezes por 5 min com 0,25% Triton X-100 em DPBS.
- Incubar as fatias de tecido em anticorpos secundários diluídos na solução de bloqueio para o tempo desejado (Tabela 1).
- Lave as fatias de tecido 3 vezes por 5 min com 0,25% Triton X-100 em DPBS.
- Colorir os núcleos com 4′,6-diamidino-2-fenilôndole (DAPI) diluído 1:1.000 em DPBS ou tampão de bloqueio por 5 min.
- Adicione 2 gotas de fluorescência antifade montagem média a um deslizamento de tampa e monte o tecido em lâminas de vidro, certificando-se de que as fatias estão totalmente cobertas pelo meio de montagem.
NOTA: Certifique-se de que não há bolhas de ar diretamente nas fatias, pois isso distorce a microscopia. - Capture imagens confocal com o microscópio disponível usando um objetivo de imersão em óleo de 60x.
NOTA: Ao adquirir imagens confocal, aplique os mesmos parâmetros de configurações (tensão, unidades arejadas e ganho) em todas as imagens dentro do experimento. - Capture imagens não confocal usando o microscópio em 10x, 20x ou 40x.
- Carregue as imagens em um software de análise de imagem e analise-as comparando os parâmetros de escolha (ou seja, área, número, intensidade dos marcadores ou contato com células adjacentes).
Resultados
Os números a seguir ilustram como o fluxo de trabalho descrito tem sido aplicado para a identificação de novos condutores de metástase de melanoma. A Figura 2 resume os resultados de um estudo publicado em que foram estudados26 os efeitos do silenciamento do fucosyltransferase FUT8 in vivo melanoma. Resumidamente, a análise dos dados glicomicomicos do paciente humano (obtidos por matrizes de lectina) e o perfil transcriômico revelaram níveis aumentados...
Discussão
O objetivo deste relatório técnico é oferecer um fluxo de trabalho padronizado, de ponta a ponta para a investigação de potenciais atores em metástase de melanoma. Como os experimentos in vivo podem ser caros e demorados, estratégias para maximizar a eficiência e aumentar o valor das informações obtidas são primordiais.
É imprescindível a utilização de abordagens complementares ao longo de todo para cruzar os achados dentro do mesmo experimento. Por exemplo, tanto a col...
Divulgações
Os autores não têm conflitos de interesse para declarar.
Agradecimentos
Agradecemos à Divisão de Tecnologias avançadas de Pesquisa (DART) da NYU Langone Health, e, em particular, ao Laboratório de Pesquisa em Patologia Experimental, ao Centro de Tecnologia do Genoma, ao Laboratório de Citometria e Triagem Celular, ao Núcleo de Imagem Pré-Clínica, que são parcialmente apoiados pelo Perlmutter Cancer Center Support Grant NIH/NCI 5P30CA016087. Agradecemos ao Grupo Cooperativo Interdisciplinar de Melanoma da NYU (PI: Dr. Iman Osman) por fornecer acesso a culturas de curto prazo de melanoma derivados do paciente+ (10-230BM e 12-273BM), que foram obtidos por meio de protocolos aprovados pelo IRB (Estudo de Consentimento Universal #s16-00122 e estudo do Grupo Cooperativo Interdisciplinar de Melanoma #10362). Agradecemos ao Dr. Robert Kerbel (Universidade de Toronto) por fornecer linhas de células de melanoma 113/6-4L e 131/4-5B1* e Dr. Meenhard Herlyn (Instituto Wistar) por fornecerem culturas WM 4265-2, WM 4257s-1, WM 4257-2 melanoma culturas de curto prazo**. E.H. é apoiado pelo NIH/NCI R01CA243446, P01CA206980, um American Cancer Society-Melanoma Research Alliance Team Science Award, e um NIH Melanoma SPORE (NCI P50 CA225450; PI: I.O.). A Figura 1 foi criada com Biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| #15 Scapel Blade | WPI | 500242 | For surgical procedures |
| #3 Scapel Handle | WPI | 500236 | For surgical procedures |
| 1 mL Tuberculin syringe, slip tip | BD | 309626 | Injections |
| 10 mL syringe, slip tip | BD | 301029 | Perfusion |
| 10% Formalin Sodium Buffered | EK Industries | 4499-20L | For perfusion/tissue fixative |
| 15 mL Conical | Corning | 430052 | Cell culture |
| 15 mL Conical Polypropylene Centrifuge Tubes | Falcon | 352196 | Cell culture |
| 200 Proof Ethanol | Deacon Labs | 04-355-223 | Histology |
| 22G – 22mm needle | BD | 305156 | Perfusion |
| 4-0 Vicryl Suture | Ethicon | J464G | Suture |
| 4% Carson's phosphate buffered paraformaldehyde | EMS | 15733-10 | For perfusion/tissue fixative |
| 40µm | Corning | 431750 | Tissue processing |
| 5-0 Absorbable Suture | Ethicon | 6542000 | Closure |
| 50 mL Conical | Corning | 430828 | Cell culture |
| 50mL Conical Polypropylene Centrifuge Tubes | Falcon | 352070 | Cell culture |
| 7-0 Silk suture | FST | 18020-70 | Ligature |
| 70µm | Corning | 431751 | Tissue processing |
| Anti-fade mounting media | Vector Labs | H-1000-10 | Immunofluorescence |
| Approximator applying Forceps, 10cm | WPI | 14189 | For microsurgical procedures |
| Avance | Bruker | 3 HD | NMR Console |
| Biospec 7030 | Bruker | 7030 | Micro MRI |
| BSA | Bioreg | A941 | NuMA Staining |
| Castroviejo suturing forceps, straight tips 5.5mm tying platform, 11cm | WPI | WP5025501 | For microsurgical procedures |
| Coplin Staining Jar | Bel-Art | F44208-1000 | Histology |
| DAPI | Sigma-Aldrich | D9542-1MG | Immunofluorescence |
| dCas9-KRAB | Addgene | 110820 | Genetic manipulation |
| DNase I | NEB | M0303L | Tissue processing |
| DPBS | Corning | 21-030-CM | Tissue processing |
| Extra Sharp Uncoated Single Edge Blade | GEM | 62-0167 | Tissue processing |
| Extracellular Matrix Substrate | Corning | 354234 | Consider the Growth Factor Reduced ( as alternative |
| FBS | Cytiva | SH30910.03 | Cell culture |
| Fiji Image J | Fiji Image J | Software | Immunofluorescence |
| Goat anti-rabbit HRP conjugated multimer | Thermo Fisher | A16104 | NuMA Staining |
| Goat Serum | Gibco | PCN5000 | Immunofluorescence |
| HBSS | Corning | 21-020-CV | Tissue processing |
| Hematoxylin | Richard-Allan Scientific | 7231 | Histology |
| Illumina III | PerkinElmer | CLS136334 | BLI Instrument |
| Insulin syringe 28G - 8mm needle | BD | 329424 | Injections |
| Insulin syringe 31G - 6mm needle | BD | 326730 | Injections |
| Iris Forceps, 10.2cm, Full Curve, serrated | WPI | 504478 | For perfusion and surgical procedures |
| Isoflurane USP | Covetrus | 11695067772 | Anesthesia |
| Jewelers #7 Forceps Titanium 11 cm 0.07 x 0.01 mm Tip | WPI | WP6570 | For microsurgical procedures |
| Ketamine HCl 100mg/mL | Mylan Ind. | 1049007 | Anesthesia |
| lentiCRISPRv2 | Addgene | 98290 | Genetic manipulation |
| Lycopersicon Esculentum (Tomato) Lectin, DyLight 649 | Invitrogen | L32472 | Vascular endothelial cells marker |
| MEM non-essential amino acids X 100 | Corning | 25-025-CI | Cell culture |
| Metzenbaum Scissors | WPI | 503269 | For surgical procedures |
| Microinjection Unit | KOPF | 5000 | Intracardiac injections |
| NaCl | Fisher | S25877 | NuMA Staining |
| Needle 30G x 25mm | BD | 305128 | Intracardiac Injection |
| Needle 33G x 15mm | Hamilton | 7747-01 | Intracarotid Injection |
| Needle holder, Castroviejo, 14cm, with lock, 1.2mm Serrated Jaws | WPI | 14137-G | For microsurgical procedures |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ mice | The Jackson Laboratory | 005557 | Murine model |
| NU/J mice | The Jackson Laboratory | 002019 | Murine model |
| Nuclear Mitotic Apparatus Protein polyclonal rabbit anti-human | Abcam | 97585 | NuMA Staining |
| Penicillin-Streptomycin 10000U/mL | Gibco | 15140122 | Cell culture |
| Percoll | GE | 0891-01 | density separation solution |
| PI Classic Surgical Gloves | Cardinal Health | 2D72PT75X | Surgery |
| pLKO Tet-On | Addgene | 21915 | Genetic manipulation |
| Povidone-Iodine 10% Solution | Medline | MDS093943 | Surgery |
| Proparacaine Drops 0.5% | Akorn Pharma | AX0501 | Opthalmic local anesthetic |
| Puralube Petrolatum Opthalmic Ointment | Dechra | 83592 | Anesthesia |
| Razor Blade Double Edge Blades | EMS | 72000 | Shaving and Vibrotome Brain Slicing |
| Reflex 9mm EZ Clip | Braintree | EZC- KIT | Wound closure |
| RPMI 1640 | Corning | 10-040-CM | Cell culture |
| Scissors, Spring 10.5cm Str, 8mm Blades | WPI | 501235 | For microsurgical procedures |
| Semi-Automatic Vibrating Blade Microtome | Leica | VT1200 | Brain Slice Immunofluorescence |
| Single Channel Anesthesia Vaporizer System | Kent Scientific | VetFlo-1210S | Anesthesia |
| Smartbox Tabletop Chamber System and Exhaust Blower | EZ Systems | TT4000 | CO2 Euthanasia |
| Sterile Fenestrated Disposable Drape | Medline | NON21002 | Surgery |
| Sterile Non-Reinforced Aurora Surgical Gowns with Set-In Sleeves | Medline | DYNJP2715 | Surgery |
| T25 Flask | Corning | 430639 | Cell culture |
| Tris | Corning | 46-031-CM | NuMA Staining |
| Triton X-100 | Sigma-Aldrich | X100-500ML | Immunofluorescence |
| Troutman tying forceps, 10cm, Curved G pattern, 0.52mm tip with tying platform | WPI | WP505210 | For microsurgical procedures |
| Vessel clips 10G Pressure 5x 0.8mm Jaws, 5/pkg | WPI | 15911 | For microsurgical procedures |
| Visiopharm | Visiopharm | Visiopharm | NuMA Staining Quantification Software |
| Xylasine 100mg/mL | Akorn Pharma | 59399-111-50 | Anesthesia |
| Xylene | Fisher | X3P-1GAL | Histology |
Referências
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Adler, N. R., Haydon, A., McLean, C. A., Kelly, J. W., Mar, V. J. Metastatic pathways in patients with cutaneous melanoma. Pigment Cell Melanoma Research. 30 (1), 13-27 (2017).
- Platz, A., Egyhazi, S., Ringborg, U., Hansson, J. Human cutaneous melanoma; a review of NRAS and BRAF mutation frequencies in relation to histogenetic subclass and body site. Molecular Oncology. 1 (4), 395-405 (2008).
- Alonso, S. R., et al. A high-throughput study in melanoma identifies epithelial-mesenchymal transition as a major determinant of metastasis. Cancer Research. 67 (7), 3450-3460 (2007).
- Rowe, C. J., Khosrotehrani, K. Clinical and biological determinants of melanoma progression: Should all be considered for clinical management. Australasian Journal of Dermatology. 57 (3), 175-181 (2016).
- Plebanek, M. P., et al. Pre-metastatic cancer exosomes induce immune surveillance by patrolling monocytes at the metastatic niche. Nature Communications. 8 (1), 1319 (2017).
- Orgaz, J. L., et al. Loss of pigment epithelium-derived factor enables migration, invasion and metastatic spread of human melanoma. Oncogene. 28 (47), 4147-4161 (2009).
- Ladhani, O., Sanchez-Martinez, C., Orgaz, J. L., Jimenez, B., Volpert, O. V. Pigment epithelium-derived factor blocks tumor extravasation by suppressing amoeboid morphology and mesenchymal proteolysis. Neoplasia. 13 (7), 633-642 (2011).
- Ju, R. J., Stehbens, S. J., Haass, N. K. The role of melanoma cell-stroma interaction in cell motility, invasion, and metastasis. Frontiers in Medicine - Dermatology. 5, 307 (2018).
- Wiley, H. E., Gonzalez, E. B., Maki, W., Wu, M. T., Hwang, S. T. Expression of CC chemokine receptor-7 and regional lymph node metastasis of B16 murine melanoma. Journal of the National Cancer Institute. 93 (21), 1638-1643 (2001).
- Meier, F., et al. Metastatic pathways and time courses in the orderly progression of cutaneous melanoma. British Journal of Dermatology. 147 (1), 62-70 (2002).
- Turner, N., Ware, O., Bosenberg, M. Genetics of metastasis: melanoma and other cancers. Clinical & Experimental Metastasis. 35 (5-6), 379-391 (2018).
- Ubellacker, J. M., et al. Lymph protects metastasizing melanoma cells from ferroptosis. Nature. 585 (7823), 113-118 (2020).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Cunningham, C. C., et al. Actin-binding protein requirement for cortical stability and efficient locomotion. Science. 255 (5042), 325-327 (1992).
- Unger, C., et al. Modeling human carcinomas: physiologically relevant 3D models to improve anti-cancer drug development. Advanced Drug Delivery Reviews. 79-80, 50-67 (2014).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Nakamura, K., et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Science. 70 (7), 791-798 (2002).
- Meeth, K., Wang, J. X., Micevic, G., Damsky, W., Bosenberg, M. W. The YUMM lines: a series of congenic mouse melanoma cell lines with defined genetic alterations. Pigment Cell Melanoma Research. 29 (5), 590-597 (2016).
- Koya, R. C., et al. BRAF inhibitor vemurafenib improves the antitumor activity of adoptive cell immunotherapy. Cancer Research. 72 (16), 3928-3937 (2012).
- Jenkins, M. H. Multiple murine BRaf(V600E) melanoma cell lines with sensitivity to PLX4032. Pigment Cell Melanoma Research. 27 (3), 495-501 (2014).
- Tuncer, E., et al. SMAD signaling promotes melanoma metastasis independently of phenotype switching. The Journal of Clinical Investigation. 129 (7), 2702-2716 (2019).
- Schwartz, H., et al. Incipient Melanoma Brain Metastases Instigate Astrogliosis and Neuroinflammation. Cancer Research. 76 (15), 4359-4371 (2016).
- Perez-Guijarro, E., et al. Multimodel preclinical platform predicts clinical response of melanoma to immunotherapy. Nature Medicine. 26 (5), 781-791 (2020).
- Krepler, C., et al. A Comprehensive Patient-Derived Xenograft Collection Representing the Heterogeneity of Melanoma. Cell Reports. 21 (7), 1953-1967 (2017).
- Agrawal, P., et al. A systems biology approach identifies FUT8 as a driver of melanoma metastasis. Cell. 31 (6), 804-819 (2017).
- Hanniford, D., et al. Epigenetic silencing of CDR1as drives IGF2BP3-mediated melanoma invasion and metastasis. Cancer Cell. 37 (1), 55-70 (2020).
- Kim, H., et al. PRMT5 control of cGAS/STING and NLRC5 pathways defines melanoma response to antitumor immunity. Science Translational Medicine. 12 (551), (2020).
- de Miera, E. V., Friedman, E. B., Greenwald, H. S., Perle, M. A., Osman, I. Development of five new melanoma low passage cell lines representing the clinical and genetic profile of their tumors of origin. Pigment Cell Melanoma Research. 25 (3), 395-397 (2012).
- Morsi, A., et al. Development and characterization of a clinically relevant mouse model of melanoma brain metastasis. Pigment Cell Melanoma Research. 26 (5), 743-745 (2013).
- Huynh, C., et al. Efficient in vivo microRNA targeting of liver metastasis. Oncogene. 30 (12), 1481-1488 (2011).
- Zou, C., et al. Experimental variables that affect human hepatocyte AAV transduction in liver chimeric mice. Molecular Therapy Methods and Clinical Development. 18, 189-198 (2020).
- Kleffman, K., et al. Melanoma-secreted Amyloid Beta Suppresses Neuroinflammation and Promotes Brain Metastasis. bioRxiv. , 854885 (2019).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Molecular Imaging and Biology. 13 (6), 1114-1123 (2011).
- Sil, P., Wong, S. W., Martinez, J. More than skin deep: autophagy is vital for skin barrier function. Frontiers in Immunology. 9, 1376 (2018).
- Chen, S., et al. Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell. 160 (6), 1246-1260 (2015).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163 (6), 1515-1526 (2015).
- Wang, T., et al. Identification and characterization of essential genes in the human genome. Science. 350 (6264), 1096-1101 (2015).
- Edgar, R., Domrachev, M., Lash, A. E. Gene Expression Omnibus: NCBI gene expression and hybridization array data repository. Nucleic Acids Research. 30 (1), 207-210 (2002).
- Lappalainen, I., et al. The European Genome-phenome Archive of human data consented for biomedical research. Nature Genetics. 47 (7), 692-695 (2015).
- Cerami, E., et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data. Cancer Discovery. 2 (5), 401-404 (2012).
- Grossman, R. L., et al. Toward a shared vision for cancer genomic data. New England Journal of Medicine. 375 (12), 1109-1112 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados