需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于鉴定黑色素瘤转移新介质的强大发现平台
摘要
本文介绍了用于测试黑色素瘤转移的新型候选介质及其作用机制的技术工作流程。
摘要
转移是一个复杂的过程,需要细胞克服仅通过 体外 测定不完全建模的障碍。使用稳健,可重复 的体内 模型和标准化方法建立了系统工作流程,以识别黑色素瘤转移的新参与者。这种方法允许在特定实验阶段进行数据推断,以精确表征基因在转移中的作用。通过将转基因黑色素瘤细胞通过心内,皮内或皮下注射引入小鼠,然后用连续 体内 成像进行监测来建立模型。一旦达到预先确定的终点,就会收获和处理原发性肿瘤和/或携带转移瘤的器官以进行各种分析。肿瘤细胞可以进行分类并经受几种"组学"平台中的任何一种,包括单细胞RNA测序。器官接受影像学和免疫组织病理学分析,以量化转移的总体负担并绘制其特定的解剖位置。这种优化的管道,包括用于移植,监测,组织收获,处理和分析的标准化方案,可以用于患者来源的短期培养物以及各种固体癌症类型的已建立的人和小鼠细胞系。
引言
与转移性黑色素瘤相关的高死亡率加上全球黑色素瘤发病率的增加1 (预计到2025年将增加7.86%),需要新的治疗方法。靶标发现的进步取决于可重复的转移模型,这是一个高度复杂的过程。在转移级联反应的整个步骤中,黑色素瘤细胞必须克服无数障碍才能实现免疫系统的规避和远处组织的定植2。黑色素瘤细胞的弹性和适应性来自多种因素,包括它们的高基因突变负担3 和它们的神经嵴起源,这赋予了关键的表型可塑性3,4,5。在每个步骤中,转录程序允许转移性黑色素瘤细胞根据与微环境的串扰的线索从一种状态切换到另一种状态,包括免疫系统6,细胞外环境7,8和它们接触的物理屏障9 的细胞结构。例如,黑色素瘤细胞通过下调重要的免疫启动肿瘤分泌因子6的表达来逃避免疫监视。
研究描述了一种"前转移生态位",其中黑色素瘤细胞分泌趋化因子和细胞因子来启动远处的"靶"器官进行转移10。这些发现提出了关于转移性黑色素瘤细胞的器官趋向性以及它们进入远处组织的解剖途径的重要问题。已知在静脉内渗后,黑色素瘤细胞通过淋巴管(淋巴扩散)和血管(血源性扩散)转移2,11。虽然大多数患者表现为局限性疾病,但一小部分病例表现为远处转移性疾病且无淋巴播散(阴性淋巴结受累)11,提示存在黑色素瘤的替代转移途径。
当它们定植于转移部位时,黑色素瘤细胞经历表观遗传和代谢适应12,13。为了进入和侵入新的隔室,黑色素瘤细胞使用蛋白酶14 和细胞骨架修饰11,15,使它们能够穿越并在新位置生长。靶向黑色素瘤细胞的困难在于这种适应的复杂性和数量;因此,该领域应该努力在实验中重建尽可能多的步骤和适应。尽管 体外 测定(如类器官和3D培养物)取得了许多进展16,17,但这些模型仅不完全概括 体内 转移级联反应。
小鼠模型通过在可重复性,技术可行性和人类疾病模拟之间取得平衡而显示出价值。血管内,原位和异位植入黑色素瘤细胞从患者来源的异种移植物或短期培养物到免疫受损或人源化小鼠中代表了转移性黑色素瘤靶标发现的骨干。然而,这些系统通常缺乏对转移的关键生物学约束:免疫系统。具有这种约束的同源黑色素瘤转移模型在该领域相对稀缺。这些系统,在免疫功能小鼠中开发,包括B16-F1018、YUMM家族细胞系19、SM120、D4M321、RIM322 或更近、RMS23 和M1(Mel114433)、M3(HCmel1274)、M4(B2905)24 黑色素瘤细胞系,有助于研究宿主免疫应答在黑色素瘤进展中的复杂作用。
这里,提出了黑色素瘤转移靶标鉴定的管道。随着黑色素瘤患者队列中生成的"组学"数据集越来越多,我们假设具有最大临床前景的研究是那些源于大数据集成的研究,从而导致细致的功能和机制询问25,26,27,28。通过使用小鼠模型来研究转移过程中的潜在靶标,可以解释 体内特异性事件和组织相互作用,从而增加临床转化的可能性。概述了多种量化转移负荷的方法,提供了任何给定实验结果的补充数据。描述了从各种器官中的肿瘤中分离单细胞的方案,以帮助转移细胞中基因表达的无偏倚表征,这可能先于单细胞或本体RNA测序。
研究方案
注:以下协议中涉及的动物程序已获得纽约大学机构动物护理和使用委员会(IACUC)的批准。所有程序均在实验室动物护理国际评估和认证协会(AAALAC)批准的设施中进行。 图1 描述了一般的实验方法。
1. 患者来源的黑色素瘤短期培养 (STCs)
- 将组织置于60mm培养皿中,其中1mL完全RPMI(RPMI 1640补充10%胎牛血清(FBS),2mM L-谷氨酰胺,1mM丙酮酸钠,1x MEM非必需氨基酸溶液和青霉素(100 IU / mL)/链霉素(100μg/ mL))。
注意:为了增加肿瘤细胞的比例,如果需要,使用无菌手术器械在显微镜下解剖并去除培养皿中肿瘤周围的组织。 - 使用灭菌剃须刀刀片将新鲜组织精细切割成1-2毫米的立方体。加入4 mL完全RPMI,并用10 mL血清学移液管将板的内容物上下移液5-10次。
- 将细胞悬浮液转移到15mL聚丙烯锥形管中,并在4°C下将细胞向下旋转(180× g5 分钟)。吸出上清液,将细胞沉淀重悬于1mL新鲜培养基中,并将悬浮液转移到25cm2 组织培养瓶中。
- 为了帮助组织片段附着在底部,将烧瓶在37°C,5%CO 2 的组织培养箱中以20°-30°角倾斜20分钟。
- 将烧瓶平放,让培养基覆盖组织,并每天检查培养物的状态。当细胞达到90-100%汇合时,将它们分开。将短期培养维持在"低"传代数。
注意:STCs将在细胞分离和培养后约2个月建立,尽管实际时间线因样品和肿瘤类型而异。10至14次传代后,细胞系达到100%纯度,仅含有黑色素瘤细胞29。通过观察细胞形态、倍增时间和体内行为的变化,根据经验确定传代次数阈 值。为了保持母体肿瘤的异质性和其他特征,不要分裂细胞超过1:5。 - 在建立STC并且按照后续步骤所述将任何要注射到动物中的细胞系模型时,用报告基因转导细胞。
注意:例如,荧光标签(例如,红色荧光蛋白(RFP),绿色荧光蛋白(GFP))允许通过荧光活化细胞分选(FACS)进行 离体 免疫荧光成像和肿瘤细胞分选。荧光素酶使 体内 生物发光成像成为可能,这是监测实验进展的有用工具(第4节)。
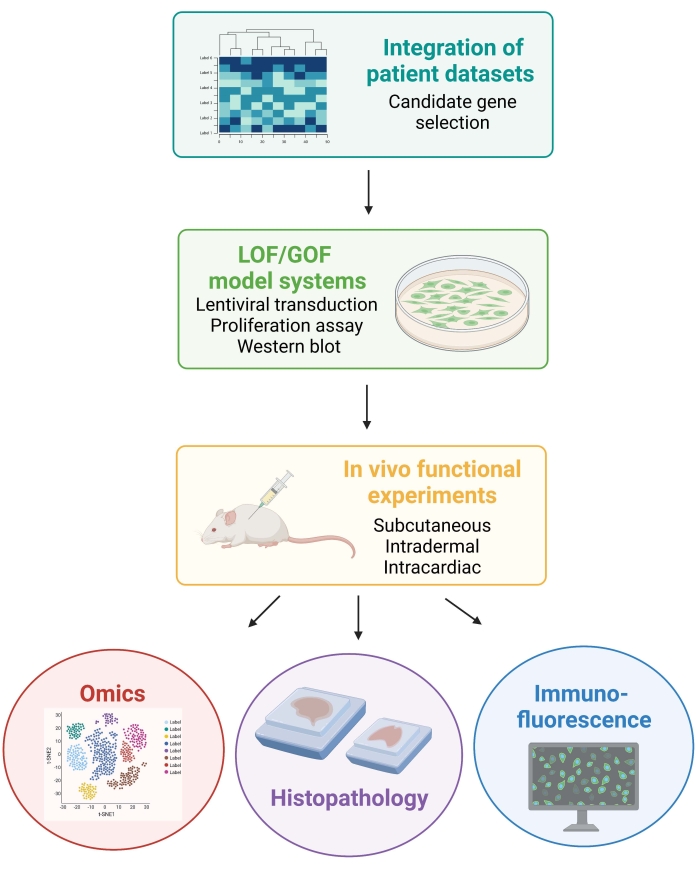
图1:说明所述工作流程的示意图,从患者数据集成到小鼠 体内 数据的生成和分析。 缩写:LOF = 功能丧失;GOF = 函数增益。 请点击此处查看此图的大图。
2. 异种移植植入
注意:这里描述的实验程序是在适应性和先天免疫系统受损的小鼠中进行的,NOD.Cg-PrkdcscidIl2rgtm1Wjl / SzJ(NSG)小鼠;或仅在缺乏适应性免疫的小鼠中,例如T细胞缺乏的无胸腺/裸体(NU / J)小鼠。动物为雄性,8至10周龄。女性在心内注射肿瘤细胞时通常表现出高发生性腺转移的发生率,这降低了它们的存活率。
- 对于皮下和皮内注射,通过将悬浮在1x Dulbecco的磷酸盐缓冲盐水(DPBS)中的一部分细胞与一部分解冻的细胞外基质底物(EMS)混合来制备1:1的细胞悬浮液,并保持在4°C的冰上。 对于血管内(心内、颈内、眶后、尾静脉或脾)注射,仅将细胞悬浮在DPBS中。
注意:皮内注射的适当体积应尽可能低(30μL)。对于皮下注射,注射体积可高达150μL,对于血管内注射,高达250μL(基于动物的重量)。根据注射的量和用于解释滑针尖端内和针头内死体积的注射器(例如,1mL结核菌素注射器与30G,25mm针头的死体积),向最终细胞悬浮液中加入10-30%的额外体积注射液。 - 进行试点,以表征正在使用的细胞系的行为以及 肿瘤在体内进展的时间线。对于皮内注射,首先注射1,000至50,000个细胞/ 30μL。对于皮下注射,首先注射10,000至2×106 个细胞/ 150μL。对于血管内(心内、颈内、眶后和脾)注射,首先注射 50,000 个细胞/150 μL。
注意:血管内注射使动物易患栓塞事件,方法是将空气引入循环系统或使用过多的细胞来阻塞小血管。充分混合细胞悬浮液以避免结块。在加载细胞悬浮液之前启动注射器。去除注射器内的任何气泡。将细胞悬浮液/注射器保存在冰上,直到加载和注射时间。 - 通过吸入进行麻醉。将氧气水平调节器设置在1-2 L / min之间。将动物置于诱导室中,异氟醚汽化器设置为2.5-5%用于诱导,1.5-3%用于维护。
注意:在麻醉诱导阶段监测动物的呼吸和心率。 不要让 动物无人看管。 不要 同时监测多只动物。 将 麻醉量滴定为动物的重量。 - 将动物从诱导室移入鼻锥。在动物的眼睛上涂抹无菌的凡士林眼药膏,以防止手术过程中角膜干燥。
- 用倾斜30°角的直剃须刀片剃除手术部位。用70%异丙醇拭子清洁手术区域的皮肤。在任何进一步的步骤之前,通过踏板反射评估足够的麻醉水平。
- 对于皮内注射,在生物安全柜内执行整个过程以保持无菌条件。
- 按照步骤2.3-2.5所述麻醉和剃须动物。
- 抓住并向后缩回皮肤,以针刺的轨迹为准。使用31克胰岛素注射器针头,长6毫米,以锐角握住,轻轻刺穿皮肤,斜面朝上。
- 感受针尖处的压力释放。轻轻前进以留在皮内隔室内,不要穿过整个皮肤深度进入皮下。 关键:如果滑入皮下空间,请取下针头,更换注射区域并重新插入针头。缓慢注入整个体积(30μL)的细胞悬浮液,直到观察到圆顶形的风团。
注意:低注射量将减少皮层的解剖和结构变形。 - 保持针头并计数至5。
注意:EMS在体温下变得粘稠,有助于避免通过针头穿刺伤口回流。 - 取出针头,将动物单独放在笼子里,放在温暖的垫子上恢复。恢复意识后,当胸骨和行走时,将动物送回动物笼。
注意:在本方案中描述的所有程序中连续监测动物。 不要让 动物无人看管或同时监视多只动物。 - 在初始生长阶段,每天与兽医工作人员一起监测肿瘤生长,体重减轻和整体健康状况的进展,如果需要,在动物开始减肥后更强烈地监测。在这些监测过程中:称量动物体重并绘制图表以监测体重减轻,并检查肿瘤溃疡,神经,运动和/或行为体征(嗜睡,缺乏梳理,食物或水摄入量低)的迹象。
注意:在观察到晚期疾病的迹象(体重减轻超过20%,身体状况评分为<2,活动水平极度下降,瘫痪或癫痫发作)后立即对动物实施安乐死。使用该机构IACUC批准的安乐死方法(例如,使用自动台式CO2 室将动物暴露于CO2 中15分钟,然后进行二次安乐死方法,宫颈脱位,斩首或通过切开胸腔双侧诱导气胸)。 - 使用卡尺进行测量,并使用肿瘤的长度(L)和宽度(W)尺寸计算体积(V),公式为:
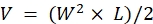
- 对于皮下注射:
- 在生物安全柜内执行整个过程以保持无菌条件26,27。
- 按照步骤2.3-2.5所述麻醉和剃须动物。
- 使用28 G至31 G胰岛素注射器针头,长度为6 mm,以锐角握住,轻轻刺穿皮肤,斜面朝上。在通过表皮,真皮和皮下组织时,感觉针尖的压力释放 两次 。
注意:第二次在针尖感觉到压力释放表明已经到达皮下隔室。 - 缓慢注入整个体积(30-150μL)的细胞悬浮液,直到观察到细长的椭圆形风团。保持针头并计数至5。对于较大体积(超过 50 μL)的计数至 10。
注意:EMS在体温下变得粘稠,有助于避免通过针头穿刺伤口回流。 - 取出针头,将动物单独放在笼子里,放在温暖的垫子上恢复。恢复意识后,当胸骨和行走时,将动物送回其动物笼。
注意:在过程监测期间,观察任何并发症的迹象(低呼吸频率,出血,恢复缓慢)并适当地解决它们。如果没有观察到任何改善,请继续执行步骤2.6.6的NOTE中描述的人道安乐死程序。 - 监测动物的肿瘤生长,体重减轻和整体健康状况,如步骤2.6.6-2.6.7所述。
- 对于心内注射:
- 在生物安全柜内执行整个过程以保持无菌条件26,30。
- 按照步骤2.3-2.4所述麻醉动物。
- 将动物转移到超声波机器的加热平台上,并用低过敏性胶带将其固定在鼻锥上。
- 用倾斜30°角的直剃须刀片剃除胸部。用3次施用10%聚维酮碘与3次异丙醇交替使用来清洁手术区域的皮肤。
- 在任何进一步的步骤之前,通过踏板反射评估足够的麻醉水平。在手术部位涂抹超声凝胶。
- 用超声探头捕获心脏窗口。将超声探头放置在动物左侧胸部的中间,以捕获水平窗口,以获得左心室的横截面视图(短轴)。确保探头的长轴朝上,将探头固定在50°角,加热平台固定在20°角。将探头和支撑架锁定到位。
- 在生物安全柜内用30 G,25mm针头在结核菌素1 mL注射器中工作时绘制细胞悬浮液。去除注射器中的任何气泡。
注意:在处理和注射细胞时,创建和维持单细胞悬浮液非常重要。去除气泡是避免空气栓塞的重要步骤。准备充分的注射器针头系统将防止实验组中可避免的死亡。始终将比注射器中吸入的体积更多的体积。额外的体积将通过将一些细胞悬浮液注射回1.5 mL管中来帮助去除空气。 - 将注射器锁定在立体定向注射器中。在超声引导下,将针穿过胸壁进入心脏的左心室。缓慢注入整个体积(100-250μL)的细胞悬浮液。
- 取出针头,将动物单独放在笼子里,放在温暖的垫子上恢复。恢复意识后,当胸骨和行走时,将动物送回其动物笼。监测动物的肿瘤生长,体重减轻和整体健康状况,如步骤2.6.6中所述。
- 对于颈内注射:
- 在适当消毒的表面上执行整个过程,以帮助维持无菌状态30。
- 用氯胺酮(100mg / kg)和甲苯噻嗪(10mg / kg)鸡尾酒麻醉动物,腹膜内注射胰岛素注射器,28G针头。在动物的眼睛上涂抹无菌的凡士林眼药膏,以防止手术过程中角膜干燥。
- 用倾斜 30° 角的直剃须刀剃除手术区域。在任何进一步的步骤之前,通过踏板反射评估足够的麻醉水平。
- 将动物放在保温垫上的体视显微镜下。用3次施用10%聚维酮碘与3次异丙醇交替使用来清洁手术区域的皮肤。
- 不要携带无菌个人防护装备(PPE)和无菌手套。通过在动物的身体上铺设无菌帷幔来准备无菌场。
注意:如果无菌悬垂没有适合切口大小和位置的孔,请将悬垂物对折,并使用Metzenbaum剪刀在无菌悬垂的中间切出适当尺寸的孔。 - 使用手术刀或虹膜剪刀将皮肤从半脖子切开到胸骨。用两个显微外科镊子,钝切开中线平面的2个下颌下唾液腺。如有必要,使用电灼止血。
- 从手管向分叉方向解剖颈总动脉 (CCA) 周围的筋膜,并继续向内侧释放颈外动脉的后壁。注射前暂时修剪颈外动脉(ECA)。
注意:在CCA周围解剖时,必须注意不要损伤迷走神经(位于动脉外侧)。 - 将细胞悬浮液装入1 mL注射器中,使用33 G,15 mm针头。
- 在CCA下传递两个7-0连字,并为两个连字中的每一个执行松动的乐器结。使用 5 mm、10 G 压力容器夹并暂时夹住 ECA。绑住近端连字;然后,松散地绑住远端结扎(在CCA的分叉旁边)。稍后使用远端袢来控制注射后的出血。
- 使用注射器和33 G,15 mm针头,轻轻刺穿CCA,针头的斜面朝上并以锐角。缓慢注入整个体积(50-150μL)的细胞悬浮液。
- 用镊子抓住远端袢并抬起它,同时取下针头以闭塞CCA的管腔并止血。用#7 Jewelers镊子交换注射器,并绑住远端环。
- 在远端结扎上再打一个器械结,然后从ECA上取下血管夹。控制手术区域出血,并在闭合前烧灼任何出血血管。使用9毫米的吻合装置关闭动物的皮肤,并将动物放在温暖的垫子上以恢复。
注意:手术后7-10天取下订书钉。 - 皮下注射镇痛药 - 丁丙诺啡(0.3mg / mL),每12小时一次,术后72小时,浓度为0.1mg / kg。
注意:或者,考虑使用缓释镇痛药,每72小时需要1剂。 - 恢复意识后,当胸骨和行走时,将动物送回其动物笼。每天术后监测动物是否有手术部位感染或疼痛的迹象、一般健康状况和并发症。
注意:从生存手术中恢复不佳的动物可能会给予额外剂量的止痛药,如果在手术后72小时没有完全恢复,将被人道地安乐死。 - 监测动物的肿瘤生长,体重减轻和整体健康状况,如步骤2.6.6中所述。
- 对于逆眼眶注射:
注意:当操作员经过培训并精通该技术并且有强有力的科学依据时,请使用此技术作为尾静脉注射的替代方案。通过这种途径递送的细胞悬浮液可以诱导肿瘤在眶后空间中生长;因此,在选择这种技术时,应仔细考虑风险和益处。例如,为了利用眶后静脉窦通过吻合术与脑内静脉的直接循环连接,当使用其他注射途径进行脑肿瘤形成失败时,选择此方法。- 在生物安全柜内执行整个过程,以保持无菌条件。不要穿无菌个人防护用品和手套。
- 按照步骤2.3-2.4所述麻醉动物。
注意:对于此程序,请勿将无菌凡士林眼药膏涂抹在动物的眼睛上,因为这会阻碍注射;仅使用局部麻醉滴剂。 - 用28-31G,6mm针头将细胞悬浮液加载到胰岛素注射器中。
- 当动物处于俯卧位时,缩回眼睑,直到眼睛突出。将1滴局部麻醉剂涂抹在接受手术的一侧的眼睛中。
- 将针头以30-45°角插入眼睛和内上髁之间,斜面朝下。缓慢注射细胞悬浮液(10-150μL)。
注意:较慢的运动可防止眼睛损伤和注射液的回流。 - 执行 2.7.5-2.7.6 中描述的步骤。
- 对于脾脏注射:
- 在生物安全柜内执行整个过程以保持无菌条件31.不要穿无菌个人防护用品和无菌手套。
- 按照步骤2.3-2.5所述麻醉和剃须动物。
- 将动物置于右侧侧卧位。用3次施用10%聚维酮碘与3次异丙醇交替施用来清洁手术区域的皮肤,并按照步骤2.9.5所述准备手术场。
- 使用Metzenbaum剪刀或手术刀,在腹壁的左侧切口1厘米,然后在腹膜上切开一个切口。
注意:做皮肤切口后,脾脏将通过半透明的腹壁看到。完全在这个部位进行腹膜切口。 - 通过切口暴露脾脏和脾肺门。使用28-31 G胰岛素注射器针头,长度为6 mm,轻轻刺穿脾脏,针头的斜面朝上并以锐角。
注意:如果穿刺伤口出血,请烧灼部位以限制出血和回流。 - 缓慢注入整个体积(50-100μL)的细胞悬浮液。取下针头。在脾脏上放置一个小纱布,并用镊子施加压力。使用细蚊子镊子将脾脏轻轻夹在纱布之间,等待15分钟。
- 通过用3-0或4-0丝缝合线绑住脾门进行脾切除术,必要时烧灼血管。用5-0聚二氧六酮(PDS)或聚乙醇酸可吸收缝合线关闭腹膜。
- 执行步骤 2.7.5-2.7.6 中描述的步骤。
注意:出现出血并发症或术后72小时尚未完全康复的动物应人道安乐死。请记住,老鼠的健康始终是重中之重。
3. 分期生存手术
- 根据步骤2.2的实验结论,确定手术的适宜生存时间。根据细胞系和实验假设,选择较早的时间点进行肿瘤切除(在肿瘤体积= 150mm3时)或较晚的时间点(在肿瘤体积= 500mm3时)26。
注意:当肿瘤负荷高到足以损害动物的健康并易患并发症时,肿瘤体积限制为1,500 mm3 。 - 按照步骤2.3-2.5所述麻醉和剃须动物。
注:整个过程在生物安全柜内进行。 - 用3次施用10%聚维酮碘与3次异丙醇交替施用来清洁手术区域的皮肤,并按照步骤2.9.5所述准备手术场。
- 使用Iris剪刀或手术刀切开皮肤,从肿瘤边缘保持5-7毫米的切缘。
注意:切除的边缘取决于肿瘤局部扩散的能力。对于侵袭性肿瘤,增加切除边缘,同时确保留下足够的皮肤来进行伤口闭合。 - 在皮内肿瘤的情况下,将肿瘤与周围皮肤一起切除。
- 对于皮下肿瘤,解剖并切除皮下肿瘤。
注意:如果肿瘤侵入腹膜和/或皮肤,则将其与肿瘤 整体 切除,并用5-0 / 4-0 PDS或聚乙醇酸可吸收缝合线闭合腹膜。 - 用9毫米装订装置关闭伤口。
注意:手术后7-10天取下订书钉。给予镇痛药,并将动物放在温暖的垫子上恢复。术后继续给予镇痛药72小时,根据步骤2.9.13每12小时一次。有出血并发症或术后未完全恢复意识的动物应人道安乐死。 - 将动物单独关在笼子里,放在温暖的垫子上恢复。恢复意识后,当胸骨和行走时,将动物送回动物笼。
- 术后继续监测动物的局部复发、体重减轻、神经、运动和/或行为体征(嗜睡、缺乏修饰、食物或水摄入量低)和整体健康状况。
4. 体内 成像(图2A)
- 通过腹膜内注射1mL胰岛素注射器,28G针头向动物施用D-荧光素底物(150mg / kg)。
注意:肿瘤细胞必须用荧光素酶cDNA稳定地转导。 - 诱导麻醉如步骤2.3-2.4所述,在D-荧光素底物注射后6分钟。
- 使用生物发光成像(BLI)扫描仪(体内 成像系统)进行成像26。
- 将动物移入成像室并进入鼻锥。根据成像系统的容量,同时对多达 5 只动物进行成像。
- 通过按 初始化启动仪器。将曝光时间设置设为 自动 (1-120秒)。
- 如果需要,捕获空白图像以减去任何背景。单击 采集 ,采集序列完成后保存图像。
- 将动物放回笼子里,笼子里有50%的基表面积,放在温暖的垫子上,以从麻醉中恢复过来。恢复意识后,当胸骨和行走时,将动物送回动物笼。
- 对于在捕获图像的同一 体内 成像软件中进行数据分析,请导航到保存图像的文件夹,然后立即打开与实验相关的所有小鼠的图像。
注意:一次分析一个图像将不允许跨组进行归一化。 - 将单位设置为"辐射度"(不计数)。确保未选中指示个人的复选框,因为这将阻止跨组的信号规范化。
- 使用 感兴趣区域 (ROI) 绘制工具,为大脑区域绘制圆形 ROI,为身体绘制矩形 ROI。小心从大脑ROI中排除耳朵和鼻子,因为它们往往会发出非特异性发光。为了最大限度地减少这一过程中的偏差,请仅在小鼠的照片上绘制ROI,而不覆盖发光信号。
- 选择 测量投资回报率 以量化信号并将数据导出到电子表格。通过绘制感兴趣体区域的总光通量(p/秒/厘米2/sr)来分析组之间的差异。
注意:为了评估大脑向性组之间的差异,请计算每只小鼠的大脑信号和身体信号之间的比率。这控制了整个肿瘤负荷的鼠间变化和实验组之间荧光素酶表达水平的差异。
5. 离体 磁共振成像
- 安乐死后立即进行 体外 MRI。或者,收获感兴趣的器官,将它们固定在福尔马林中长达72小时,并在以后的时间点进行成像。
- 使用配备 NMR 控制台和零蒸发水平孔磁铁或类似设备的 7 特斯拉 (7-T) (300-MHz) 微型 MRI 系统采集图像。
注:需要主动屏蔽梯度线圈插件,并正确权衡性能至关重要。它必须提供至少50 mm动态球面体积(DSV)的梯度线性度,以覆盖同时检查的样品集,而不会出现几何变形。梯度强度(范围从 440 到 750 mT/m)和占空比的组合可实现 3 x 30 A 至 3 x 87 A 的最大同步直流电流,从而实现足够的成像性能。所使用的梯度线圈插件(参见 材料表)可实现以下性能:660 mT/m,130 μs 上升时间,3 x 87 A,DSV = 80 mm。 - 使用商用发射 - 接收圆极化整鼠标体射频线圈(OD = 59 mm,ID = 38mm,L = 40 mm)进行扫描,调谐至300.16 MHz, 1H质子Larmor频率。
注意:该RF探头能够在8-12小时的夜间扫描期间以亚毫米级各向同性分辨率(<150μm)采集3D数据集。 - 使用多个序列30检测肿瘤负荷。
注意:通过 T2 加权快速成像和重聚焦回声 (RARE) 序列检测到的高智能信号可识别肿瘤周围的水肿。 - 使用以下采集参数执行3D RARE序列:[120μm]3 各向同性分辨率;采集时间5小时,27分钟;重复时间 (TR) = 500 ms;回声间距(ES)= 12.7分钟;涡轮系数 TFx = 12;有效回波时间(TEeff) = 76.2 ms;带宽 (BW) = 75 千赫;矩阵大小 = 2843;视场角 = [4.0 毫米]3;平均数 (导航) = 6。
- 使用以下参数检测转移。
- 对于具有信号增亮的色素转移瘤,请使用具有以下参数的T1加权3D梯度回波序列:[120μm]3 各向同性分辨率;采集时间2小时,41分钟;TR = 20 毫秒;回声时间 (TE) = 4.0 毫秒;翻转角度 (FA) = 18°;BW = 75 千赫;矩阵大小 = 2843;视场角 = [34.0 毫米]3;导航 = 6。
- 对于未色素沉着和/或出血性转移,在T 2 *加权多级回声(MGE)序列(3D MGE,[120μm]3各向同性分辨率;采集时间3小时,35分钟;采集时间3小时,35分钟;采集时间3小时,35分钟;采集时间3小时,35 分钟;TR = 40 毫秒;TE = 3.6 毫秒;ES = 3.2 毫秒;4回声;FA = 20°;带宽 = 100 千赫;矩阵大小 = 2843;视场角 = (34.0 毫米)3;导航 = 4。
- 使用所有3个序列来量化肿瘤负担。
- 使用组织学切片交叉引用分析过程中确定的肿瘤区域,以确保准确性。见第7节和第8节。
6. 用于单细胞或本体RNA测序的组织处理
- 使用该机构IACUC批准的任何方法对动物实施安乐死。请参阅步骤 2.6.6 的注释中描述的过程之一。
- 解剖感兴趣的器官,并将它们放在含有冰上Hank平衡盐溶液(HBSS)的板的单独孔中。快速工作,并始终将组织保持在冰上,以最大限度地提高细胞活力。
注意:以下步骤特定于大脑处理。根据您的需要,根据特定组织调整胶原酶类型。 - 准备一个6孔板,每个孔中含有3 mL HBSS。
- 为了可视化并进一步帮助指导解剖,请使用荧光显微镜并识别标记区域。
- 解剖荧光区域并将组织片段置于6孔板中(如果要分析单个转移灶,则每孔1个片段;如果要分析同一器官中的多个转移,则每个孔1个片段);如果要分析同一器官中的多个转移,则每孔1个片段)。使用无菌剃须刀片将组织切碎成尽可能小的碎片(每个样品在此步骤上花费的时间不超过1-2分钟)。
注意:限制肿瘤的处理时间有助于保持细胞活力。 - 吸出每个孔的内容物并将其转移到15 mL锥形管中。
注意:切割1,000μL移液器吸头的尖端,以促进较大片段的转移。 - 向孔中加入1 mL HBSS,并确保将剩余的组织片段/细胞转移到15 mL管中,该管将包含4 mL的最终体积。向每个试管中加入50μLI型胶原酶(40mg / mL)和12.5μL脱氢酶I(2,000单位/ mL)。
- 将锥形管置于37°C加热的水浴中45分钟。每5分钟短暂涡旋锥形管。
- 用HBSS预湿70μm过滤器。使用灭菌微量离心管的封盖端或注射器柱塞的塑料部分,并通过70μm过滤器将组织匀浆研磨成新的50mL锥形管。
注意:用HBSS或FACS缓冲液对过滤器进行预润湿有助于过滤。 - 用1毫升HBSS清洗过滤器。用HBSS预湿40μm过滤器。通过40μm过滤器再次过滤每个样品,进入新的50 mL锥形管中。向40μm过滤器中加入1mL FBS进行洗涤。始终将锥形管放在冰上。
- 用冰冷的DPBS将锥形管填充至50 mL。在4°C下旋转细胞(180× g10 分钟)。丢弃上清液,小心不要丢失细胞沉淀。
注意:对于 脑样品,将细胞重悬于2.5mL的38%密度分离溶液中(在HBSS中稀释并在室温(RT)下储存)。转移到 5 mL FACS 试管中。以800× 克旋转20分钟。切下1,000μL移液器吸头的尖端,并去除顶部脂肪层。不要在管壁上留下任何脂肪。如果有任何脂肪残留,请再次旋转并重复该过程。这是 关键 的一步。去除液相的其余部分(沉淀将是半透明的,难以可视化)。 - 将细胞重悬于1mL红细胞(RBC)裂解缓冲液中,并在室温下孵育60秒,通过加入20mL DPBS淬灭裂解液。
- 在4°C下以180× g 旋转细胞10分钟。 除去上清液并将细胞重悬于2mL FACS缓冲液(DPBS中5%FBS)中。
- 继续对标记的细胞进行分类和/或文库制备,以进行本体或单细胞RNA测序。
注意:细胞可以旋转,快速冷冻,并在RNA分离之前储存在-80°C用于本体RNA-seq。
7. 动物组织灌注和制备免疫组学分析
- 通过腹腔注射器和28G针头腹腔注射,过量的氯胺酮(300mg / kg)和甲苯噻嗪(30mg / kg)鸡尾酒麻醉动物。
- 通过粗切术暴露心脏,并在右心房做一个切口。用面向前方的长弯曲镊子轻轻地将心脏保持在适当的位置。
注意:福尔马林和多聚甲醛(PFA)是致癌物质。阅读安全数据表(SDS),避免接触烟雾,并穿戴适当的PPE。 - 使用 10 mL 注射器和 22 G、22 mm 针头,向左心室注射 10 mL DPBS,然后注射 10 mL 4% PFA。
- 继续收获器官并将其装入预先标记的组织学盒中。将盒式磁带放在适当大小的容器中,该容器可容纳足够的固定剂(福尔马林)来覆盖组织。
注意:理想情况下,固定剂量应为组织体积的5-10倍。 - 将组织学盒内的器官固定在10%福尔马林中48-72小时。丢弃10%福尔马林,并用1x DPBS洗涤盒两次。
- 通过将盒式盒浸入70%乙醇中2小时开始脱水过程。继续将盒式连续浸入增加的乙醇浓度:80%,95%,100%,每次1小时。1.5小时后两次更换100%溶液。将盒浸入二甲苯中1.5小时,并对溶液进行三次更换。
- 将盒式磁带在58-60°C下嵌入石蜡中。 将石蜡块切成薄片。进行苏木精和曙红(H&E)或免疫组织化学染色。
- 要鉴定黑色素瘤细胞,请使用以下标记物或面板:S100,Melan-A,HMB-45,酪氨酸酶,MITF。如果可能,使用核有丝分裂装置蛋白质(NuMA)染色,因为它是一种高度特异性的人类细胞标志物。
注意:NuMA染色在宿主(小鼠)和植入细胞(人类)之间提供了清晰的划定,有助于图像处理和随后的肿瘤定量阶段。

图2:BLI,明场, 离体 荧光和H&E染色图像的示例,说明了用于分析候选基因在黑色素瘤转移中的作用的多管齐下的方法。 (A)BLI,(B)BF,(C) 离体 荧光和(D)H&E染色图像。用于说明目的的图像对应于将131/ 6-4L黑色素瘤细胞与非靶向对照shRNA(shNTC)或靶向FUT8的shRNA转导的实验注射到免疫缺陷(NSG)小鼠中。FUT8沉默损害了黑色素瘤细胞的转移性播散。比例尺和色条 = p/秒/厘米2/sr × 106 (A)、100 mm (B、 C)、100 μm (D)。缩写:BLI =生物发光成像;H&E = 苏木精和曙红;shRNA = 短发夹RNA;shNTC = 非靶向对照 shRNA;NSG =非肥胖糖尿病严重联合免疫缺陷γ;FUT8 = 岩藻糖基转移酶 8;BF = 明场。 请点击此处查看此图的大图。
8. 核有丝分裂器械蛋白质(NuMA)染色(图3)
- 使用抗 NuMA 抗体作为高度人类特异性的有丝分裂纺锤体标志物,用于鉴定和定量组织切片中的转移负荷。实现黑色素瘤细胞的高度特异性和灵敏的鉴定。
- 如果在自动免疫染色仪器上对 NuMA 进行显色免疫组化,请按照所述步骤32 操作:
- 脱蜡二甲苯中的切片,并以顺序降低乙醇浓度重新水化它们。将载玻片浸没在二甲苯中15分钟,然后将其转移到100%乙醇中15分钟。
注意:乙醇再水化步骤的其余部分(95%,80%,75%)每个步骤持续3至5分钟。 - 用去离子水冲洗载玻片。
- 通过将载玻片浸入容器(例如Coplin染色罐)中, 在10mM柠檬酸钠缓冲液中,pH 6.0,在1200瓦微波炉中以100%功率浸泡10分钟,进行表位检索。
- 使用未结合的多克隆兔抗人 NuMA 抗体进行标记,稀释 1:7,000 在 Tris-Bovine 血清白蛋白 (BSA) (25 mM Tris,15 mM NaCl,1% BSA,pH 7.2) 中。与研究部分并行运行适当的阳性和阴性对照。
- 将载玻片与一抗一致孵育12小时。用山羊抗兔HRP偶联多聚体检测一抗,并用3,3-二氨基联苯胺和硫酸铜增强剂可视化复合物。
- 在蒸馏水中洗涤载玻片,用苏木精复染,脱水,并用永久介质安装。
注:脱水步骤与步骤8.3中描述的再冻结步骤相反。使用可用的扫描仪以20倍或40倍放大倍率扫描载玻片,并将其上传到数据库。 - 使用软件,绘制ROI以包括器官组织内所有NuMA染色的细胞,不包括其他器官实质和空白空间。
- 调整设置以对 NuMA 阳性和 NuMA 阴性细胞进行分类,同时对每个器官使用适当的阳性和阴性对照。使用已建立的软件算法来量化每个样品的 NuMA 阳性细胞的总数/百分比。
9. 组织切片免疫荧光
为了确定需要特定候选基因的转移阶段(例如, 外渗与播种后的存活率),可以确定不同时间点的组织切片免疫荧光,以跟踪肿瘤细胞从注射到远处器官侵袭,播种和生长的进展。这种方法允许为邻近细胞添加标记物以捕获外渗事件和周围肿瘤微环境的变化33。
- 按照步骤7.1中描述的麻醉动物。
- 在灌注前3分钟,将100μg荧光团偶联的Lycopersicon Esculentum(番茄)凝集素注射到每只动物的左心室中,以描绘血管内皮。
注意:让番茄凝集素在整个系统中再循环的时间。 - 按照步骤7.2-7.3中所述对动物进行灌注。收获感兴趣的器官并将其转移到装有4%PFA的预标记容器中。固定组织24至48小时。使用振动切片机将组织切片成30-50μm厚的切片。
注:厚度应优化。建议使用厚度在 30 μm 至 50 μm 之间的切片,尤其是在执行 z-stack 成像时。 - 将切片在封闭缓冲液(10%正常山羊血清,2%BSA,0.25%Triton X-100在DPBS中)中孵育2小时,在室温下。
- 执行染色优化实验。
注意:由于抗原检索时间,用于抗原检索的缓冲液,温度,不同的抗体/不同的批次以及组织的类型会影响染色,优化实验是必要的。 - 以优化的稀释液加入一抗,并在优化的温度下孵育优化的时间(参见 表1中的示例)。
注意:对一抗/二抗和未染色的组织样品使用适当的对照。 - 用DPBS中0.25%Triton X-100洗涤组织切片3次5分钟。
- 将组织切片在二抗中孵育在封闭溶液中稀释的所需时间(表1)。
- 用DPBS中0.25%Triton X-100洗涤组织切片3次5分钟。
- 用在DPBS或封闭缓冲液中以1:1,000稀释的4',6-二脒基-2-苯基吲哚(DAPI)染色细胞核5分钟。
- 将2滴抗淬灭荧光安装介质添加到盖玻片中,并将组织安装到载玻片上,确保切片被安装介质完全覆盖。
注意:确保切片上没有气泡,因为这会使显微镜失真。 - 使用可用的显微镜使用60倍油浸物镜捕获共聚焦图像。
注意:采集共聚焦图像时,对实验中的所有图像应用相同的设置参数(电压、通风单位和增益)。 - 使用显微镜以10倍,20倍或40倍的速度捕获非共聚焦图像。
- 将图片上传到图像分析软件中,并通过比较所选参数(即面积, 数量,标记强度或与相邻细胞的接触)对其进行分析。
结果
下图说明了所描述的工作流程如何应用于鉴定黑色素瘤转移的新驱动因素。 图2 总结了一项已发表的研究的结果,其中研究了沉默岩藻糖基转移酶FUT8 在体内 黑色素瘤转移中的作用26。简而言之,对人类患者血糖数据(通过凝集素阵列获得)和转录组学分析的分析显示,与从原发性到转移性黑色素瘤进展相关的α-1,6-岩藻糖水平升高,与相应岩藻糖?...
讨论
本技术报告的目的是为黑色素瘤转移中潜在参与者的调查提供标准化的自上而下的工作流程。由于 体内 实验可能既昂贵又耗时,因此最大限度地提高效率和增加所获信息价值的策略至关重要。
必须始终使用互补方法在同一实验中交叉验证结果。例如,NuMA免疫组化染色和BLI都是定量转移负荷的补充方法,因为两者都不是全面的。虽然BLI是一种在 体内跟踪肿瘤进?...
披露声明
作者没有利益冲突需要声明。
致谢
我们感谢纽约大学朗格尼健康高级研究技术部(DART),特别是实验病理学研究实验室,基因组技术中心,细胞术和细胞分选实验室,临床前成像核心,这些实验室部分由Perlmutter癌症中心支持赠款NIH / NCI 5P30CA016087。我们感谢纽约大学跨学科黑色素瘤合作小组(PI:Iman Osman博士)提供患者来源的黑色素瘤短期培养+ (10-230BM和12-273BM)的途径,这些培养物是通过IRB批准的方案获得的(通用同意研究#s16-00122和跨学科黑色素瘤合作小组研究#10362)。我们感谢Robert Kerbel博士(多伦多大学)提供113 / 6-4L和131 / 4-5B1黑色素瘤细胞系*,以及Meenhard Herlyn博士(Wistar研究所)提供WM 4265-2,WM 4257s-1,WM 4257-2黑色素瘤短期培养**。E.H.由NIH / NCI R01CA243446,P01CA206980,美国癌症协会 - 黑色素瘤研究联盟团队科学奖和NIH黑色素瘤孢子(NCI P50 CA225450;PI:I.O.)。 图 1 是使用 Biorender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| #15 Scapel Blade | WPI | 500242 | For surgical procedures |
| #3 Scapel Handle | WPI | 500236 | For surgical procedures |
| 1 mL Tuberculin syringe, slip tip | BD | 309626 | Injections |
| 10 mL syringe, slip tip | BD | 301029 | Perfusion |
| 10% Formalin Sodium Buffered | EK Industries | 4499-20L | For perfusion/tissue fixative |
| 15 mL Conical | Corning | 430052 | Cell culture |
| 15 mL Conical Polypropylene Centrifuge Tubes | Falcon | 352196 | Cell culture |
| 200 Proof Ethanol | Deacon Labs | 04-355-223 | Histology |
| 22G – 22mm needle | BD | 305156 | Perfusion |
| 4-0 Vicryl Suture | Ethicon | J464G | Suture |
| 4% Carson's phosphate buffered paraformaldehyde | EMS | 15733-10 | For perfusion/tissue fixative |
| 40µm | Corning | 431750 | Tissue processing |
| 5-0 Absorbable Suture | Ethicon | 6542000 | Closure |
| 50 mL Conical | Corning | 430828 | Cell culture |
| 50mL Conical Polypropylene Centrifuge Tubes | Falcon | 352070 | Cell culture |
| 7-0 Silk suture | FST | 18020-70 | Ligature |
| 70µm | Corning | 431751 | Tissue processing |
| Anti-fade mounting media | Vector Labs | H-1000-10 | Immunofluorescence |
| Approximator applying Forceps, 10cm | WPI | 14189 | For microsurgical procedures |
| Avance | Bruker | 3 HD | NMR Console |
| Biospec 7030 | Bruker | 7030 | Micro MRI |
| BSA | Bioreg | A941 | NuMA Staining |
| Castroviejo suturing forceps, straight tips 5.5mm tying platform, 11cm | WPI | WP5025501 | For microsurgical procedures |
| Coplin Staining Jar | Bel-Art | F44208-1000 | Histology |
| DAPI | Sigma-Aldrich | D9542-1MG | Immunofluorescence |
| dCas9-KRAB | Addgene | 110820 | Genetic manipulation |
| DNase I | NEB | M0303L | Tissue processing |
| DPBS | Corning | 21-030-CM | Tissue processing |
| Extra Sharp Uncoated Single Edge Blade | GEM | 62-0167 | Tissue processing |
| Extracellular Matrix Substrate | Corning | 354234 | Consider the Growth Factor Reduced ( as alternative |
| FBS | Cytiva | SH30910.03 | Cell culture |
| Fiji Image J | Fiji Image J | Software | Immunofluorescence |
| Goat anti-rabbit HRP conjugated multimer | Thermo Fisher | A16104 | NuMA Staining |
| Goat Serum | Gibco | PCN5000 | Immunofluorescence |
| HBSS | Corning | 21-020-CV | Tissue processing |
| Hematoxylin | Richard-Allan Scientific | 7231 | Histology |
| Illumina III | PerkinElmer | CLS136334 | BLI Instrument |
| Insulin syringe 28G - 8mm needle | BD | 329424 | Injections |
| Insulin syringe 31G - 6mm needle | BD | 326730 | Injections |
| Iris Forceps, 10.2cm, Full Curve, serrated | WPI | 504478 | For perfusion and surgical procedures |
| Isoflurane USP | Covetrus | 11695067772 | Anesthesia |
| Jewelers #7 Forceps Titanium 11 cm 0.07 x 0.01 mm Tip | WPI | WP6570 | For microsurgical procedures |
| Ketamine HCl 100mg/mL | Mylan Ind. | 1049007 | Anesthesia |
| lentiCRISPRv2 | Addgene | 98290 | Genetic manipulation |
| Lycopersicon Esculentum (Tomato) Lectin, DyLight 649 | Invitrogen | L32472 | Vascular endothelial cells marker |
| MEM non-essential amino acids X 100 | Corning | 25-025-CI | Cell culture |
| Metzenbaum Scissors | WPI | 503269 | For surgical procedures |
| Microinjection Unit | KOPF | 5000 | Intracardiac injections |
| NaCl | Fisher | S25877 | NuMA Staining |
| Needle 30G x 25mm | BD | 305128 | Intracardiac Injection |
| Needle 33G x 15mm | Hamilton | 7747-01 | Intracarotid Injection |
| Needle holder, Castroviejo, 14cm, with lock, 1.2mm Serrated Jaws | WPI | 14137-G | For microsurgical procedures |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ mice | The Jackson Laboratory | 005557 | Murine model |
| NU/J mice | The Jackson Laboratory | 002019 | Murine model |
| Nuclear Mitotic Apparatus Protein polyclonal rabbit anti-human | Abcam | 97585 | NuMA Staining |
| Penicillin-Streptomycin 10000U/mL | Gibco | 15140122 | Cell culture |
| Percoll | GE | 0891-01 | density separation solution |
| PI Classic Surgical Gloves | Cardinal Health | 2D72PT75X | Surgery |
| pLKO Tet-On | Addgene | 21915 | Genetic manipulation |
| Povidone-Iodine 10% Solution | Medline | MDS093943 | Surgery |
| Proparacaine Drops 0.5% | Akorn Pharma | AX0501 | Opthalmic local anesthetic |
| Puralube Petrolatum Opthalmic Ointment | Dechra | 83592 | Anesthesia |
| Razor Blade Double Edge Blades | EMS | 72000 | Shaving and Vibrotome Brain Slicing |
| Reflex 9mm EZ Clip | Braintree | EZC- KIT | Wound closure |
| RPMI 1640 | Corning | 10-040-CM | Cell culture |
| Scissors, Spring 10.5cm Str, 8mm Blades | WPI | 501235 | For microsurgical procedures |
| Semi-Automatic Vibrating Blade Microtome | Leica | VT1200 | Brain Slice Immunofluorescence |
| Single Channel Anesthesia Vaporizer System | Kent Scientific | VetFlo-1210S | Anesthesia |
| Smartbox Tabletop Chamber System and Exhaust Blower | EZ Systems | TT4000 | CO2 Euthanasia |
| Sterile Fenestrated Disposable Drape | Medline | NON21002 | Surgery |
| Sterile Non-Reinforced Aurora Surgical Gowns with Set-In Sleeves | Medline | DYNJP2715 | Surgery |
| T25 Flask | Corning | 430639 | Cell culture |
| Tris | Corning | 46-031-CM | NuMA Staining |
| Triton X-100 | Sigma-Aldrich | X100-500ML | Immunofluorescence |
| Troutman tying forceps, 10cm, Curved G pattern, 0.52mm tip with tying platform | WPI | WP505210 | For microsurgical procedures |
| Vessel clips 10G Pressure 5x 0.8mm Jaws, 5/pkg | WPI | 15911 | For microsurgical procedures |
| Visiopharm | Visiopharm | Visiopharm | NuMA Staining Quantification Software |
| Xylasine 100mg/mL | Akorn Pharma | 59399-111-50 | Anesthesia |
| Xylene | Fisher | X3P-1GAL | Histology |
参考文献
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Adler, N. R., Haydon, A., McLean, C. A., Kelly, J. W., Mar, V. J. Metastatic pathways in patients with cutaneous melanoma. Pigment Cell Melanoma Research. 30 (1), 13-27 (2017).
- Platz, A., Egyhazi, S., Ringborg, U., Hansson, J. Human cutaneous melanoma; a review of NRAS and BRAF mutation frequencies in relation to histogenetic subclass and body site. Molecular Oncology. 1 (4), 395-405 (2008).
- Alonso, S. R., et al. A high-throughput study in melanoma identifies epithelial-mesenchymal transition as a major determinant of metastasis. Cancer Research. 67 (7), 3450-3460 (2007).
- Rowe, C. J., Khosrotehrani, K. Clinical and biological determinants of melanoma progression: Should all be considered for clinical management. Australasian Journal of Dermatology. 57 (3), 175-181 (2016).
- Plebanek, M. P., et al. Pre-metastatic cancer exosomes induce immune surveillance by patrolling monocytes at the metastatic niche. Nature Communications. 8 (1), 1319 (2017).
- Orgaz, J. L., et al. Loss of pigment epithelium-derived factor enables migration, invasion and metastatic spread of human melanoma. Oncogene. 28 (47), 4147-4161 (2009).
- Ladhani, O., Sanchez-Martinez, C., Orgaz, J. L., Jimenez, B., Volpert, O. V. Pigment epithelium-derived factor blocks tumor extravasation by suppressing amoeboid morphology and mesenchymal proteolysis. Neoplasia. 13 (7), 633-642 (2011).
- Ju, R. J., Stehbens, S. J., Haass, N. K. The role of melanoma cell-stroma interaction in cell motility, invasion, and metastasis. Frontiers in Medicine - Dermatology. 5, 307 (2018).
- Wiley, H. E., Gonzalez, E. B., Maki, W., Wu, M. T., Hwang, S. T. Expression of CC chemokine receptor-7 and regional lymph node metastasis of B16 murine melanoma. Journal of the National Cancer Institute. 93 (21), 1638-1643 (2001).
- Meier, F., et al. Metastatic pathways and time courses in the orderly progression of cutaneous melanoma. British Journal of Dermatology. 147 (1), 62-70 (2002).
- Turner, N., Ware, O., Bosenberg, M. Genetics of metastasis: melanoma and other cancers. Clinical & Experimental Metastasis. 35 (5-6), 379-391 (2018).
- Ubellacker, J. M., et al. Lymph protects metastasizing melanoma cells from ferroptosis. Nature. 585 (7823), 113-118 (2020).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Cunningham, C. C., et al. Actin-binding protein requirement for cortical stability and efficient locomotion. Science. 255 (5042), 325-327 (1992).
- Unger, C., et al. Modeling human carcinomas: physiologically relevant 3D models to improve anti-cancer drug development. Advanced Drug Delivery Reviews. 79-80, 50-67 (2014).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Nakamura, K., et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Science. 70 (7), 791-798 (2002).
- Meeth, K., Wang, J. X., Micevic, G., Damsky, W., Bosenberg, M. W. The YUMM lines: a series of congenic mouse melanoma cell lines with defined genetic alterations. Pigment Cell Melanoma Research. 29 (5), 590-597 (2016).
- Koya, R. C., et al. BRAF inhibitor vemurafenib improves the antitumor activity of adoptive cell immunotherapy. Cancer Research. 72 (16), 3928-3937 (2012).
- Jenkins, M. H. Multiple murine BRaf(V600E) melanoma cell lines with sensitivity to PLX4032. Pigment Cell Melanoma Research. 27 (3), 495-501 (2014).
- Tuncer, E., et al. SMAD signaling promotes melanoma metastasis independently of phenotype switching. The Journal of Clinical Investigation. 129 (7), 2702-2716 (2019).
- Schwartz, H., et al. Incipient Melanoma Brain Metastases Instigate Astrogliosis and Neuroinflammation. Cancer Research. 76 (15), 4359-4371 (2016).
- Perez-Guijarro, E., et al. Multimodel preclinical platform predicts clinical response of melanoma to immunotherapy. Nature Medicine. 26 (5), 781-791 (2020).
- Krepler, C., et al. A Comprehensive Patient-Derived Xenograft Collection Representing the Heterogeneity of Melanoma. Cell Reports. 21 (7), 1953-1967 (2017).
- Agrawal, P., et al. A systems biology approach identifies FUT8 as a driver of melanoma metastasis. Cell. 31 (6), 804-819 (2017).
- Hanniford, D., et al. Epigenetic silencing of CDR1as drives IGF2BP3-mediated melanoma invasion and metastasis. Cancer Cell. 37 (1), 55-70 (2020).
- Kim, H., et al. PRMT5 control of cGAS/STING and NLRC5 pathways defines melanoma response to antitumor immunity. Science Translational Medicine. 12 (551), (2020).
- de Miera, E. V., Friedman, E. B., Greenwald, H. S., Perle, M. A., Osman, I. Development of five new melanoma low passage cell lines representing the clinical and genetic profile of their tumors of origin. Pigment Cell Melanoma Research. 25 (3), 395-397 (2012).
- Morsi, A., et al. Development and characterization of a clinically relevant mouse model of melanoma brain metastasis. Pigment Cell Melanoma Research. 26 (5), 743-745 (2013).
- Huynh, C., et al. Efficient in vivo microRNA targeting of liver metastasis. Oncogene. 30 (12), 1481-1488 (2011).
- Zou, C., et al. Experimental variables that affect human hepatocyte AAV transduction in liver chimeric mice. Molecular Therapy Methods and Clinical Development. 18, 189-198 (2020).
- Kleffman, K., et al. Melanoma-secreted Amyloid Beta Suppresses Neuroinflammation and Promotes Brain Metastasis. bioRxiv. , 854885 (2019).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Molecular Imaging and Biology. 13 (6), 1114-1123 (2011).
- Sil, P., Wong, S. W., Martinez, J. More than skin deep: autophagy is vital for skin barrier function. Frontiers in Immunology. 9, 1376 (2018).
- Chen, S., et al. Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell. 160 (6), 1246-1260 (2015).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163 (6), 1515-1526 (2015).
- Wang, T., et al. Identification and characterization of essential genes in the human genome. Science. 350 (6264), 1096-1101 (2015).
- Edgar, R., Domrachev, M., Lash, A. E. Gene Expression Omnibus: NCBI gene expression and hybridization array data repository. Nucleic Acids Research. 30 (1), 207-210 (2002).
- Lappalainen, I., et al. The European Genome-phenome Archive of human data consented for biomedical research. Nature Genetics. 47 (7), 692-695 (2015).
- Cerami, E., et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data. Cancer Discovery. 2 (5), 401-404 (2012).
- Grossman, R. L., et al. Toward a shared vision for cancer genomic data. New England Journal of Medicine. 375 (12), 1109-1112 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。