Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Melanom Metastazının Yeni Arabulucularının Belirlenmesi için Sağlam Bir Keşif Platformu
Bu Makalede
Özet
Bu makalede, melanom metastazının yeni aday aracılarını ve etki mekanizmalarını test etmek için kullanılan tekniklerin bir iş akışı açıklanmaktadır.
Özet
Metastaz, hücrelerin in vitro tahlillerle sadece eksik modellenen engellerin üstesinden gelmelerini gerektiren karmaşık bir süreçtir. Melanom metastazındaki yeni oyuncuları tanımlamak için sağlam, tekrarlanabilir in vivo modeller ve standartlaştırılmış yöntemler kullanılarak sistematik bir iş akışı oluşturulmuştur. Bu yaklaşım, bir genin metastazdaki rolünü tam olarak karakterize etmek için belirli deneysel aşamalarda veri çıkarımına izin verir. Modeller, genetiği değiştirilmiş melanom hücrelerinin intrakardiyak, intradermal veya subkutan enjeksiyonlar yoluyla farelere sokulması ve ardından seri in vivo görüntüleme ile izlenmesiyle oluşturulur. Önceden belirlenmiş son noktalara ulaşıldıktan sonra, primer tümörler ve / veya metastaz taşıyan organlar toplanır ve çeşitli analizler için işlenir. Tümör hücreleri, tek hücreli RNA dizilimi de dahil olmak üzere çeşitli 'omik' platformlardan herhangi birine sıralanabilir ve tabi tutulabilir. Organlar, metastazların genel yükünü ölçmek ve spesifik anatomik konumlarını haritalamak için görüntüleme ve immünohistopatolojik analizlere tabi tutulur. Engraftma, izleme, doku hasadı, işleme ve analiz için standartlaştırılmış protokoller de dahil olmak üzere bu optimize edilmiş boru hattı, hasta tarafından türetilmiş, kısa vadeli kültürler ve çeşitli katı kanser türlerinin insan ve murin hücre hatları için benimsenebilir.
Giriş
Metastatik melanom ile ilişkili yüksek mortalite, dünya çapında melanom insidansının artmasıyla birleştiğinde1 (2025 yılına kadar tahminen% 7.86'lık bir artış) yeni tedavi yaklaşımları gerektirmektedir. Hedef keşfindeki ilerlemeler, oldukça karmaşık bir süreç olan tekrarlanabilir metastaz modellerine dayanmaktadır. Metastatik kaskadın adımları boyunca, melanom hücreleri bağışıklık sisteminden kaçmak ve uzak dokuların kolonizasyonunu sağlamak için sayısız engelin üstesinden gelmelidir2. Melanom hücrelerinin esnekliği ve uyarlanabilirliği, yüksek genetik mutasyon yükü 3 ve nöral tepe kökeni de dahil olmak üzere çok sayıda faktörden kaynaklanır ve bu da çok önemli fenotipik plastisite 3,4,5'i sağlar. Her adımda, transkripsiyonel programlar, metastaz yapan melanom hücrelerinin, bağışıklık sistemi6, hücre dışı ortam 7,8 ve temas ettikleri fizikselbariyerlerin hücresel mimarisini içeren mikro çevre ile çapraz konuşmadan gelen ipuçlarına dayanarak bir durumdan diğerine geçmesine izin verir. Örneğin, melanom hücreleri, önemli bağışıklık astarlayıcı tümör salgılanan faktörlerin ekspresyonunu azaltarak bağışıklık gözetimindenkaçarlar 6.
Çalışmalar, melanom hücrelerinin metastaz10 için uzak "hedef" organı hazırlamak için kemokinler ve sitokinler salgıladığı bir "premetastatik niş" tanımlamaktadır. Bu bulgular, metastatik melanom hücrelerinin organ tropizmi ve uzak dokulara erişmek için izledikleri anatomik yol hakkında önemli sorular ortaya çıkarmaktadır. İntravazasyondan sonra, melanom hücrelerinin lenfatikler (lenfatik yayılım) ve kan damarları (hematojen yayılım) yoluyla metastaz yaptıkları bilinmektedir2,11. Hastaların çoğu lokalize hastalık ile başvururken, olguların küçük bir alt kümesi uzak metastatik hastalık ile başvurmakta ve lenfatik yayılım göstermemektedir (negatif lenf nodu tutulumu)11, melanom için alternatif metastatik yolakların varlığını düşündürmektedir.
Metastatik bir bölgeyi kolonize ettiklerinde, melanom hücreleri epigenetik ve metabolik adaptasyonlara uğrar12,13. Yeni bölmelere erişmek ve istila etmek için, melanom hücreleri proteazlar 14 ve sitoiskelet modifikasyonları11,15 kullanır, bu da yeni konumlarına geçmelerini ve büyümelerini sağlar. Melanom hücrelerini hedeflemedeki zorluk, bu tür adaptasyonların karmaşıklığında ve sayısında yatmaktadır; Bu nedenle, alan mümkün olduğunca çok sayıda adımı ve uyarlamayı deneysel olarak yeniden yaratmak için çaba göstermelidir. Organoidler ve 3D kültürler16,17 gibi in vitro tahlillerdeki sayısız ilerlemeye rağmen, bu modeller sadece in vivo metastatik kaskadı tam olarak özetlememektedir.
Murin modelleri, tekrarlanabilirlik, teknik fizibilite ve insan hastalığının simülasyonu arasında bir denge kurarak değer göstermiştir. İntravasküler, ortopik ve heterotopik olarak implante edilmiş melanom hücreleri, hasta kaynaklı ksenogreftlerden veya kısa süreli kültürlerden bağışıklık sistemi baskılanmış veya insanlaştırılmış farelere metastatik melanomda hedef keşfinin bel kemiğini temsil eder. Bununla birlikte, bu sistemler genellikle metastaz üzerinde çok önemli bir biyolojik kısıtlamadan yoksundur: bağışıklık sistemi. Bu kısıtlamaya sahip olan sinjenik melanom metastazı modelleri bu alanda nispeten azdır. B16-F1018, YUMM hücre hatları ailesi 19, SM1 20, D4M3 21, RIM3 22veya daha yakın zamanda immünokompetan farelerde geliştirilen bu sistemler, RMS 23 veM1 (Mel114433), M3 (HCmel1274), M4 (B2905) 24 melanom hücre hatları dahil olmak üzere, melanom progresyonunda konakçı immün yanıtının karmaşık rolünün araştırılmasını kolaylaştırır.
Burada, melanom metastazı hedef tanımlaması için bir boru hattı sunulmaktadır. Melanom hasta kohortlarından üretilen artan ve daha büyük 'omik' veri kümeleri ile, en klinik vaat eden çalışmaların, büyük veri entegrasyonundan kaynaklanan çalışmalar olduğunu ve titiz fonksiyonel ve mekanik sorgulamaya yol açtığını varsayıyoruz25,26,27,28. Metastatik süreçteki potansiyel hedefleri incelemek için fare modellerini kullanarak, in vivo-spesifik olayları ve doku etkileşimlerini açıklayabilir, böylece klinik çeviri olasılığını artırabilir. Metastatik yükü ölçmek için birden fazla yöntem özetlenmiş ve herhangi bir deneyin sonuçları hakkında tamamlayıcı veriler sağlanmıştır. Çeşitli organlardaki tümörlerden tek hücreli izolasyon için bir protokol, metastatik hücrelerde gen ekspresyonunun tarafsız karakterizasyonuna yardımcı olmak için tanımlanmıştır, bu da tek hücreli veya toplu RNA diziliminden önce gelebilir.
Protokol
NOT: Aşağıdaki protokolde yer alan hayvan prosedürleri, New York Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylanmıştır. Tüm prosedürler, Uluslararası Laboratuvar Hayvanları Bakımı Değerlendirme ve Akreditasyon Derneği (AAALAC) tarafından onaylanan tesislerde yürütülmektedir. Şekil 1, genel deneysel yaklaşımı göstermektedir.
1. Hasta kaynaklı melanom kısa süreli kültürler (STC'ler)
- Dokuyu 1 mL tam RPMI (% 10 fetal sığır serumu (FBS), 2 mM L-glutamin, 1 mM sodyum piruvat, 1x MEM esansiyel olmayan amino asit çözeltisi ve penisilin (100 IU / mL) / streptomisin (100 μg / mL) ile desteklenmiş RPMI 1640) ile 60 mm'lik bir Petri kabına yerleştirin.
NOT: Tümör hücrelerinin oranını artırmak için, gerekirse, Petri kabındaki tümörü çevreleyen dokuyu steril cerrahi aletler kullanarak mikroskop altında diseke edin ve çıkarın. - Sterilize edilmiş tıraş bıçağı kullanarak taze dokuyu 1-2 mm'lik küpler halinde ince bir şekilde kesin. 4 mL tam RPMI ekleyin ve 10 mL'lik serolojik pipetle plakanın içeriğini 5-10 kez yukarı ve aşağı pipetleyin.
- Hücre süspansiyonunu 15 mL'lik bir polipropilen konik tüpe aktarın ve hücreleri aşağı doğru döndürün (4 ° C'de 5 dakika boyunca 180 × g). Süpernatanı aspire edin, hücre peletini 1 mL taze ortamda yeniden askıya alın ve süspansiyonu 25cm2'lik bir doku kültürü şişesine aktarın.
- Doku parçalarının tabana yapışmasına yardımcı olmak için, şişeyi bir doku kültürü inkübatöründe 20 ° -30 ° açıyla 37 ° C'de, 20 dakika boyunca% 5 CO2'de eğilmiş olarak ayarlayın.
- Ortamın dokuyu örtmesine izin vermek için şişeyi düz bir şekilde yerleştirin ve kültürün durumunu günlük olarak kontrol edin. Hücreleri% 90-100 akıcılığa ulaştıklarında bölün. Kısa vadeli kültürleri "düşük" bir geçiş sayısında tutun.
NOT: STC'ler, hücre izolasyonu ve kültüründen yaklaşık 2 ay sonra kurulacaktır, ancak gerçek zaman çizelgesi örnekler ve tümör tipleri arasında değişmektedir. 10 ila 14 pasajdan sonra, hücre hatları sadece melanom hücrelerini içeren% 100 saflığa ulaşır29. Geçiş sayısı eşiği, hücre morfolojisindeki değişiklikleri, iki katına çıkma süresini ve davranışı in vivo olarak gözlemleyerek ampirik olarak belirlenir. Ana tümörün heterojenliğini ve diğer özelliklerini korumak için, hücreleri 1: 5'ten fazla bölmeyin. - Bir STC'nin kurulması ve sonraki adımlarda açıklandığı gibi hayvanlara enjekte edilecek herhangi bir hücre hattı modeli ile, hücreleri bir muhabirle dönüştürün.
NOT: Örneğin, bir floresan etiketi (örneğin, kırmızı floresan proteini (RFP), yeşil floresan proteini (GFP)), ex-vivo immünofloresan görüntülemeye ve floresanla aktive edilen hücre sıralama (FACS) ile tümör hücrelerinin sıralanmasına izin verir. Lusiferaz, deneysel ilerlemeyi izlemek için yararlı bir araç olan in vivo biyolüminesans görüntülemeyi mümkün kılar (bölüm 4).
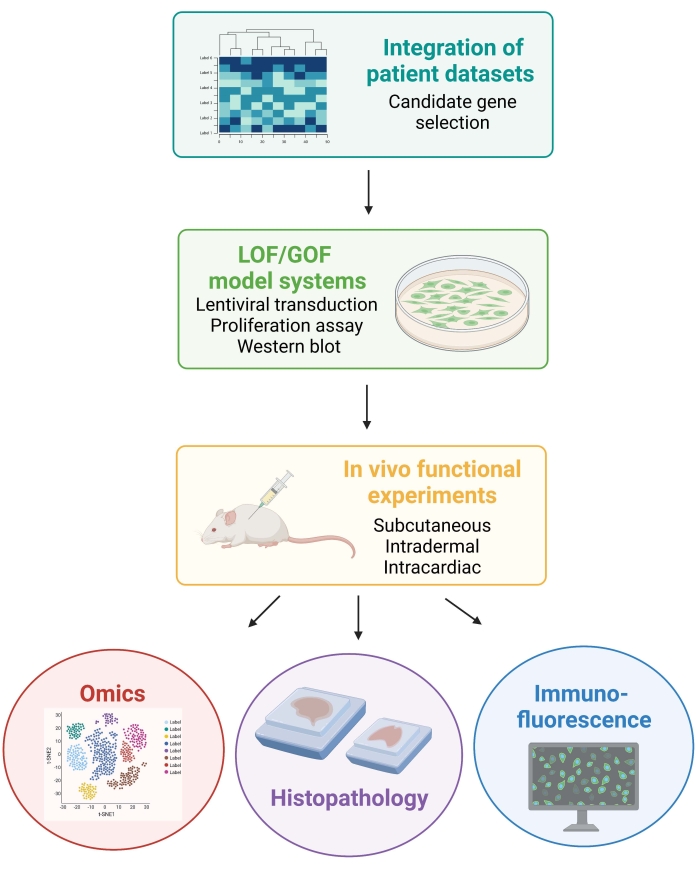
Şekil 1: Hasta veri entegrasyonundan farelerden gelen in vivo verilerin oluşturulmasına ve analizine kadar açıklanan iş akışını gösteren şematik. Kısaltmalar: LOF = fonksiyon kaybı; GOF = fonksiyon kazancı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Ksenograft implantasyonu
NOT: Burada açıklanan deneysel prosedürler, adaptif ve doğuştan gelen bağışıklık sistemlerini bozmuş farelerde, NOD.Cg-PrkdcscidIl2rgtm1Wjl / SzJ (NSG) fareleri; veya T hücresi eksikliği olan atimik / çıplak (NU / J) fareler gibi yalnızca adaptif bağışıklığa sahip olmayan farelerde. Hayvanlar erkek cinsiyetten, 8 ila 10 haftalıktır. Dişiler sıklıkla tümör hücrelerinin intrakardiyak enjeksiyonu üzerine yüksek bir gonadal metastaz insidansı sergiler ve bu da sağkalımlarını azaltır.
- Subkutan ve intradermal enjeksiyonlar için, 1x Dulbecco'nun Fosfat Tamponlu Salin'inde (DPBS) asılı hücrelerin bir kısmını bir kısmı çözülmüş hücre dışı matriks substratı (EMS) ile karıştırarak 1: 1 hücre süspansiyonu hazırlayın ve 4 ° C'de buz üzerinde tutun. İntravasküler (intrakardiyak, intrakarotid, retro-orbital, kuyruk veni veya splenik) enjeksiyonlar için, hücreleri yalnızca DPBS'de askıya alın.
NOT: İntradermal enjeksiyonlar için uygun hacim mümkün olduğunca düşük tutulmalıdır (30 μL). Subkutan enjeksiyonlar için, enjekte edilen hacim 150 μL'ye kadar çıkabilir ve intravasküler enjeksiyonlar için 250 μL'ye kadar (hayvanın ağırlığına bağlı olarak). Son hücre süspansiyonuna, enjekte edilen miktara ve kayma ucunun içindeki ölü hacmi ve iğneninkini hesaba katmak için kullanılan şırıngaya bağlı olarak% 10-30 ekstra enjekte hacmi ekleyin (örneğin, 30 G, 25 mm'lik bir iğnenin ölü hacmi 100 μL'dir). - Kullanılan hücre hatlarının davranışını ve in vivo tümör ilerlemesinin zaman çizelgesini karakterize etmek için bir pilot uygulama yapın. İntradermal enjeksiyonlar için, 1.000'den 50.000 hücreye / 30 μL'ye kadar enjekte ederek başlayın. Subkutan enjeksiyonlar için, 10.000'den 2'ye kadar 106 hücre / 150 μL × enjekte ederek başlayın. İntravasküler (intrakardiyak, intrakaroti, retro-orbital ve splenik) enjeksiyonlar için, 50.000 hücre / 150 μL enjekte ederek başlayın.
NOT: İntravasküler enjeksiyonlar, dolaşım sistemine hava sokarak veya küçük damarları tıkayan aşırı sayıda hücre kullanarak hayvanları embolik olaylara yatkınlaştırır. Topaklanmayı önlemek için hücre süspansiyonunu iyice karıştırın. Hücre süspansiyonunu yüklemeden önce şırıngayı astarlayın. Şırınganın içindeki hava kabarcıklarını çıkarın. Hücre süspansiyonunu / şırıngalarını yükleme ve enjeksiyon zamanına kadar buz üzerinde tutun. - Anesteziyi inhalasyon yoluyla uygulayın. Oksijen seviyesi regülatörünü 1-2 L/dak arasında ayarlayın. Hayvanı, indüksiyon için% 2.5-5 ve bakım için% 1.5-3 olarak ayarlanmış izofluran buharlaştırıcısı ile indüksiyon odasına yerleştirin.
NOT: Anestezi indüksiyon aşamasındayken hayvanın solunum ve kalp atış hızını izleyin. Hayvanı gözetimsiz bırakmayın . Aynı anda birden fazla hayvanı izlemeyin . Anestezi miktarını hayvanın ağırlığına titretin. - Hayvanı indüksiyon odasından burun konisine taşıyın. İşlem sırasında kornea kuruluğunu önlemek için hayvanın gözlerine steril petrolatum oftalmik merhem uygulayın.
- İşlem bölgesini 30° açıyla eğilmiş düz bir tıraş bıçağı ile tıraş edin. İşlem alanının cildini% 70 izopropil alkollü çubuklarla temizleyin. Daha sonraki adımlardan önce, pedal refleksi ile yeterli düzeyde anestezi olup olmadığını değerlendirin.
- İntradermal enjeksiyonlar için, aseptik koşulları korumak için tüm prosedürü bir biyogüvenlik kabini içinde gerçekleştirin.
- Hayvanı adım 2.3-2.5'te açıklandığı gibi anestezi altına alın ve tıraş edin.
- İğne sapının yörüngesine karşı cildi geriye doğru kavrayın ve geri çekin. Akut bir açıyla tutulan 6 mm uzunluğunda 31 G insülin şırınga iğnesi kullanarak, eğim yukarı bakacak şekilde cildi nazikçe delin.
- İğnenin ucundaki basınç salınımını hissedin. İntradermal bölmenin içinde kalmak ve tüm cilt derinliğinden subkutise geçmemek için yavaşça ilerleyin. Önemli: Biri deri altı boşluğa kayarsa, iğneyi çıkarın, enjeksiyon alanını değiştirin ve iğneyi yeniden takın. Kubbe şeklinde bir kabarma gözlenene kadar hücre süspansiyonunun tüm hacmini (30 μL) yavaşça enjekte edin.
NOT: Düşük enjeksiyon hacimleri, cilt katmanlarının daha az diseksiyonuna ve daha az mimari bozulmaya neden olacaktır. - İğneyi içeride tutun ve 5'e kadar sayın.
NOT: EMS, vücut sıcaklığında viskoz hale gelir ve iğne delinme yarasından geri akışı önlemeye yardımcı olur. - İğneyi çıkarın ve iyileşmek için hayvanı ılık bir ped üzerindeki bir kafeste tek başına barındırın. Sternal ve ambulatuar olduğunda, bilinci yeniden kazandıktan sonra hayvanı vivaryum kafesine geri döndürün.
NOT: Bu protokolde açıklanan tüm prosedürler sırasında hayvanı sürekli olarak izleyin. Hayvanı gözetimsiz bırakmayın veya aynı anda birden fazla hayvanı izlemeyin . - Tümör büyümesinin, kilo kaybının ve genel sağlık durumunun ilerlemesini, ilk büyüme aşamasında günlük olarak veteriner personeli ile birlikte ve gerekirse hayvanlar kilo vermeye başladıktan sonra daha yoğun bir şekilde izleyin. Bu izleme seansları sırasında: hayvanları tartın ve kilo kaybını izlemek için bir çizelge çizin ve tümör ülserasyonu, nörolojik, lokomotor ve / veya davranışsal belirtiler (uyuşukluk, tımar eksikliği, düşük yiyecek veya su alımı) belirtilerini kontrol edin.
NOT: İleri hastalık belirtilerini gözlemledikten hemen sonra hayvanları ötenazi yapın (% 20'den fazla kilo kaybı, <2 vücut durumu skoru, aşırı derecede azalmış aktivite seviyeleri, felç veya nöbetler). Kurumun IACUC tarafından onaylanan ötenazi yöntemini kullanın (örneğin; hayvanları 15 dakika boyunca CO 2'ye maruz bırakmak için otomatik bir masa üstü CO2 odası kullanılır, ardından ikincil bir ötenazi yöntemi, servikal çıkık, kafa kesme veya göğüs kafesini keserek iki taraflı olarak indüklenen pnömotoraks). - Kaliperlerle ölçümler yapın ve aşağıdaki formülle hacmi (V) hesaplamak için tümörün uzunluk (L) ve genişlik (W) boyutlarını kullanın:
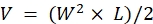
- Subkutan enjeksiyonlar için:
- Aseptik koşulları korumak için tüm prosedürü bir biyogüvenlik kabini içinde gerçekleştirin26,27.
- Hayvanı adım 2.3-2.5'te açıklandığı gibi anestezi altına alın ve tıraş edin.
- Akut bir açıyla tutulan 6 mm uzunluğunda 28 G ila 31 G insülin şırınga iğnesi kullanarak, eğim yukarı bakacak şekilde cildi hafifçe delin. Epidermis, dermis ve hipodermisten geçerken iğnenin ucundaki basınç salınımını iki kez hissedin.
NOT: İğnenin ucunda ikinci kez basınç salınımı hissedildiğinde, deri altı bölmesine ulaşıldığını gösterir. - Uzun elips şeklinde bir kabarma gözlenene kadar hücre süspansiyonunun tüm hacmini (30-150 μL) yavaşça enjekte edin. İğneyi içeride tutun ve 5'e kadar sayın. Daha büyük hacimler (50 μL'den fazla) için 10'a kadar sayın.
NOT: EMS, vücut sıcaklığında viskoz hale gelir ve iğne delinme yarasından geri akışı önlemeye yardımcı olur. - İğneyi çıkarın ve iyileşmek için hayvanı ılık bir ped üzerindeki bir kafeste tek başına barındırın. Sternal ve ambulatuar olduğunda, bilincini yeniden kazandıktan sonra hayvanı vivaryum kafesine geri döndürün.
NOT: İşlem sonrası izleme sırasında, herhangi bir komplikasyon belirtisi (düşük solunum hızı, kanama, yavaş iyileşme) gözlemleyin ve bunları uygun şekilde ele alın. Herhangi bir iyileşme gözlenmezse, adım 2.6.6'nın NOTUNDA açıklanan insani ötenazi prosedürlerine geçin. - Hayvanı tümör büyümesi, kilo kaybı ve 2.6.6-2.6.7 adımlarında açıklandığı gibi genel sağlık durumu açısından izleyin.
- İntrakardiyak enjeksiyonlar için:
- Aseptik koşulları korumak için tüm prosedürü bir biyogüvenlik kabini içinde gerçekleştirin26,30.
- Hayvanı 2.3-2.4 adımlarında açıklandığı gibi anestezi altına alın.
- Hayvanı ultrason makinesinin ısıtılmış platformuna aktarın ve hipoalerjenik bantla burun konisine sabitleyin.
- Toraksı 30° açıyla eğilmiş düz bir tıraş bıçağı ile tıraş edin. 3 izopropil alkol uygulaması ile dönüşümlü olarak% 10 povidon-iyot 3 uygulama ile işlem alanının cildini temizleyin.
- Daha sonraki adımlardan önce, pedal refleksi ile yeterli düzeyde anestezi olup olmadığını değerlendirin. İşlem bölgesine ultrason jeli uygulayın.
- Ultrason probu ile kardiyak pencereyi yakalayın. Sol ventrikülün kesitsel bir görünümünü (kısa eksen) elde etmek için yönlendirilmiş yatay bir pencere yakalamak için ultrason probunu hayvanın sol tarafındaki toraksın ortasına yerleştirin. Probun uzun ekseninin yukarı bakmasını sağlamak için, probu 50° açıyla ve ısıtılmış platformu 20° açıyla sabitleyin. Probu ve destek çerçevesini yerine kilitleyin.
- Biyogüvenlik kabininin içinde çalışırken hücre süspansiyonunu 30 G, 25 mm'lik bir iğne ile tüberkülin 1 mL şırıngada hazırlayın. Şırıngadaki hava kabarcıklarını çıkarın.
NOT: Hücreler işlenirken ve enjekte edilirken tek hücreli bir süspansiyon oluşturmak ve sürdürmek önemlidir. Hava kabarcıklarının giderilmesi, hava embolisini önlemek için önemli bir adımdır. İyi astarlanmış bir şırınga iğnesi sistemi, deney grubunda önlenebilir ölümleri önleyecektir. Şırıngaya her zaman enjekte edilenden daha fazla hacim çekin. Ekstra hacim, hücre süspansiyonunun bir kısmını 1,5 mL'lik bir tüpe geri enjekte ederek havanın giderilmesine yardımcı olacaktır. - Şırıngayı stereotaktik enjektöre kilitleyin. Ultrason rehberliğinde, iğneyi torasik duvardan kalbin sol ventrikülüne ilerletin. Hücre süspansiyonunun tüm hacmini (100-250 μL) yavaşça enjekte edin.
- İğneyi çıkarın ve iyileşmek için hayvanı ılık bir ped üzerindeki bir kafeste tek başına barındırın. Sternal ve ambulatuar olduğunda, bilincini yeniden kazandıktan sonra hayvanı vivaryum kafesine geri döndürün. Hayvanı tümör büyümesi, kilo kaybı ve adım 2.6.6'da açıklandığı gibi genel sağlık durumu açısından izleyin.
- İntrakarotis enjeksiyonları için:
- Aseptik koşulların korunmasına yardımcı olmak için tüm prosedürü uygun şekilde dezenfekte edilmiş bir yüzeyde gerçekleştirin30.
- İnsülin şırıngası, 28 G iğne ile intraperitoneal enjeksiyon ile ketamin (100 mg / kg) ve ksilazin (10 mg / kg) kokteyli ile hayvanı anestezi altına alın. İşlem sırasında kornea kuruluğunu önlemek için hayvanın gözlerine steril petrolatum oftalmik merhem uygulayın.
- İşlem alanını 30° açıyla eğilmiş düz bir tıraş bıçağı ile tıraş edin. Daha sonraki adımlardan önce, pedal refleksi ile yeterli düzeyde anestezi olup olmadığını değerlendirin.
- Hayvanı bir ısıtma pedi üzerinde stereo mikroskop altına yerleştirin. 3 izopropil alkol uygulaması ile dönüşümlü olarak% 10 povidon-iyot 3 uygulama ile işlem alanının cildini temizleyin.
- Steril kişisel koruma ekipmanları (KKD) ve steril eldivenler takın. Steril alanı, hayvanın vücudunun üzerine steril bir örtü koyarak hazırlayın.
NOT: Steril örtünün insizyonun boyutuna ve konumuna uygun bir deliği yoksa, örtüyü ikiye katlayın ve steril örtünün ortasındaki uygun boyuttaki deliği kesmek için Metzenbaum makası kullanın. - Cildi boynun yarısından sternuma kadar kesmek için bir neşter veya İris makası kullanın. İki mikrocerrahi forseps ile, orta hat düzlemindeki 2 submandibuler tükürük bezini açıkça parçalara ayırın. Gerekirse hemostaz için elektrikli koter kullanın.
- Ortak karotis arteri (CCA) çevreleyen fasyayı manubriyumdan bifurkasyona doğru diseke edin ve eksternal karotidin arka duvarını serbest bırakmak için medial olarak devam edin. Enjekte etmeden önce harici karotis arteri (ECA) geçici olarak klipsleyin.
NOT: CCA'nın çevresi etrafında diseksiyon yaparken, vagus sinirine zarar vermemeye özen gösterilmelidir (artere yanal olarak uzanır). - Hücre süspansiyonunu 33 G, 15 mm'lik bir iğne ile 1 mL'lik bir şırıngaya yükleyin.
- CCA'nın altındaki iki 7-0 bağı geçin ve iki bağın her biri için gevşek bir alet düğümü gerçekleştirin. 5 mm, 10 G basınçlı kap klipsi kullanın ve ECA'yı geçici olarak klipsleyin. Proksimal ligatürü bağlayın; daha sonra, distal ligattürü gevşek bir şekilde bağlayın (CCA'nın çatallanmasının yanında). Enjeksiyon sonrası kanamayı kontrol etmek için distal döngüyü daha sonra kullanın.
- Şırıngayı 33 G, 15 mm'lik bir iğne ile kullanarak, CCA'yı iğnenin eğimi yukarı bakacak şekilde ve keskin bir açıyla hafifçe delin. Hücre süspansiyonunun tüm hacmini (50-150 μL) yavaşça enjekte edin.
- Distal halkayı forseps ile tutun ve CCA'nın lümenini tıkamak ve kanamayı durdurmak için iğneyi çıkarırken kaldırın. Şırıngayı #7 Kuyumcu forseps ile değiştirin ve distal halkayı bağlayın.
- Distal ligatür üzerine başka bir alet düğümü atın ve damar klipsi ECA'dan çıkarın. Cerrahi alanı kanama için kontrol edin ve kapanmadan önce kanayan damarları koterize edin. Hayvanın derisini kapatmak için 9 mm'lik bir zımbalama cihazı kullanın ve iyileşmek için hayvanı ılık bir ped üzerine yerleştirin.
NOT: Zımbaları ameliyattan 7-10 gün sonra çıkarın. - Analjezik ilaçları deri altından Buprenorfin (0.3 mg / mL) cerrahi sonrası 72 saat boyunca her 12 saatte bir 0.1 mg / kg konsantrasyonda uygulayın.
NOT: Alternatif olarak, her 72 saatte bir 1 doz gerektiren uzatılmış salımlı bir analjezik ilaç kullanmayı düşünün. - Sternal ve ambulatuar olduğunda, bilincini yeniden kazandıktan sonra hayvanı vivaryum kafesine geri döndürün. Cerrahi alan enfeksiyonu veya ağrısı, genel sağlık durumu ve komplikasyonlar için ameliyat sonrası günlük olarak hayvanları izleyin.
NOT: Hayatta kalma ameliyatından iyi iyileşmeyen hayvanlara ek dozlarda ağrı kesici ilaç verilebilir ve ameliyat sonrası 72 saat içinde tamamen iyileşmezse insani olarak ötenazi yapılır. - Hayvanı tümör büyümesi, kilo kaybı ve adım 2.6.6'da açıklandığı gibi genel sağlık durumu açısından izleyin.
- Retro-orbital enjeksiyonlar için:
NOT: Bu tekniği, operatör bu teknikte eğitimli ve yetkin olduğunda ve güçlü bir bilimsel gerekçe olduğunda kuyruk damarı enjeksiyonlarına alternatif olarak kullanın. Bu yolla verilen hücre süspansiyonları, retro-orbital alanda tümör büyümesini indükleyebilir; Bu nedenle, bu tekniği seçerken risklere ve faydalara dikkat edilmelidir. Örneğin, retro-orbital venöz sinüsün anastomozlar yoluyla intraserebral venlerle doğrudan dolaşım bağlantısından yararlanmak için, diğer enjeksiyon yollarını kullanarak beyin tümörü oluşumu başarısız olduğunda bu yöntemi seçin.- Aseptik koşulları korumak için tüm prosedürü bir biyogüvenlik kabini içinde gerçekleştirin. Steril KKD ve eldivenler giyin.
- Hayvanı 2.3-2.4 adımlarında açıklandığı gibi anestezi altına alın.
NOT: Bu prosedür için, hayvanın gözlerine steril petrolatum oftalmik merhem uygulamayın, çünkü bu enjeksiyonu engelleyecektir; sadece lokal anestezik damlalar uygulayın. - Hücre süspansiyonunu 28-31 G, 6 mm'lik bir iğne ile bir insülin şırıngasına yükleyin.
- Hayvan yüzüstü pozisyondayken, göz çıkıntısı yapana kadar göz kapaklarını geri çekin. İşlemden geçen taraftaki göze 1 damla lokal anestezik uygulayın.
- İğneyi göz ile medial epikanthus arasına 30-45°'lik bir açıyla eğimi aşağıya bakacak şekilde yerleştirin. Hücre süspansiyonunu (10-150 μL) yavaşça enjekte edin.
NOT: Daha yavaş hareketler gözün zarar görmesini ve enjekte edilen kısmın geri akışını önler. - 2.7.5-2.7.6'da açıklanan adımları gerçekleştirin.
- Dalak enjeksiyonları için:
- Aseptik koşulları korumak için tüm prosedürü bir biyogüvenlik kabini içinde gerçekleştirin31. Steril KKD ve steril eldivenler giyin.
- Hayvanı adım 2.3-2.5'te açıklandığı gibi anestezi altına alın ve tıraş edin.
- Hayvanı sağ yanal yaslanmış pozisyona getirin. 3 izopropil alkol uygulaması ile dönüşümlü olarak% 10 povidon-iyotun 3 uygulaması ile işlem alanının derisini temizleyin ve cerrahi alanı adım 2.9.5'te açıklandığı gibi hazırlayın.
- Metzenbaum makası veya neşter kullanarak, karın duvarının sol kanadında 1 cm'lik bir kesi yapın ve ardından periton içine bir kesi yapın.
NOT: Dalak, deri kesisi yapıldıktan sonra yarı saydam karın duvarından görülecektir. Peritoneal insizyonu tam olarak bu bölgede yapın. - Dalağı ve dalak hilumunu insizyondan geçirin. 6 mm uzunluğunda 28-31 G insülin şırınga iğnesi kullanarak, dalağı iğnenin eğimi yukarı bakacak şekilde ve keskin bir açıyla hafifçe delin.
NOT: Delinme yarası kanarsa, kanamayı ve geri akışı sınırlamak için bölgeyi koterize edin. - Hücre süspansiyonunun tüm hacmini (50-100 μL) yavaşça enjekte edin. İğneyi çıkarın. Dalağın üzerine küçük bir gazlı bez yerleştirin ve forseps ile basınç uygulayın. Dalağı ince sivrisinek forseps kullanarak gazlı bez arasında hafifçe kelepçeleyin ve 15 dakika bekleyin.
- Dalak hilumunu 3-0 veya 4-0 ipek sütür ile bağlayarak, gerekirse damarları koterize ederek bir splenektomi yapın. Periton 5-0 polidioksanon (PDS) veya poliglikolik asit emilebilir sütür ile kapatın.
- 2.7.5-2.7.6 adımlarında açıklanan adımları gerçekleştirin.
NOT: Kanama komplikasyonları gösteren veya ameliyat sonrası 72 saat sonra tam olarak iyileşmemiş hayvanlar insani olarak ötenazi yapılmalıdır. Farelerin refahının her zaman öncelik olduğunu unutmayın.
3. Aşamalı sağkalım cerrahisi (SSS)
- Adım 2.2'deki deneysel sonuçlara dayanarak, hayatta kalma cerrahisi için uygun zamanı belirleyin. Hücre çizgisine ve deneysel hipoteze bağlı olarak, tümör rezeksiyonu için daha erken bir zaman noktası (tümör hacminde = 150 mm 3) veya daha sonraki bir zaman noktası (tümör hacminde = 500 mm3)26 seçin.
NOT: Tümör hacmi sınırı, tümör yükü hayvanın refahına zarar verecek kadar yüksek olduğunda ve komplikasyonlara yatkın olduğunda 1.500mm3'tür . - Hayvanı adım 2.3-2.5'te açıklandığı gibi anestezi altına alın ve tıraş edin.
NOT: Tüm prosedür bir biyogüvenlik kabini içinde gerçekleştirilir. - 3 izopropil alkol uygulaması ile dönüşümlü olarak% 10 povidon-iyotun 3 uygulaması ile işlem alanının derisini temizleyin ve cerrahi alanı adım 2.9.5'te açıklandığı gibi hazırlayın.
- İris makası veya neşter kullanarak, tümörün kenarından 5-7 mm'lik bir rezeksiyon marjını koruyarak cildi kesin.
NOT: Rezeksiyon marjı, tümörün lokal olarak yayılma kabiliyetine bağlıdır. Agresif tümörler için, yara kapatmayı gerçekleştirmek için yeterli cildin bırakıldığından emin olurken rezeksiyon marjını artırın. - İntradermal tümörler durumunda, tümörü çevresel cilt ile birlikte rezeke edin.
- Subkutan tümörler için, tümörü deri altında disseke edin ve çıkarın.
NOT: Tümör periton ve/veya cildi istila ederse, tümörle blok halinde rezeke edin ve peritonu, 5-0/4-0 PDS veya poliglikolik asit emilebilir sütürlerle kapatın. - 9 mm zımbalama cihazı ile yarayı kapatın.
NOT: Zımbaları ameliyattan 7-10 gün sonra çıkarın. Analjezik ilaç uygulayın ve iyileşmek için hayvanı ılık bir ped üzerine yerleştirin. Ameliyat sonrası 72 saat boyunca analjezik ilaç vermeye devam edin, adım 2.9.13'e göre her 12 saatte bir. Kanama komplikasyonları olan veya ameliyat sonrası tam bilinçliliğe kavuşmamış hayvanlar insani olarak ötenazi yapılmalıdır. - Hayvanı bir kafeste, iyileşmek için sıcak bir pedde tek ev yapın. Sternal ve ambulatuar olduğunda, bilinci yeniden kazandıktan sonra hayvanı vivaryum kafesine geri döndürün.
- Ameliyat sonrası hayvanı lokal nüksler, kilo kaybı, nörolojik, lokomotor ve / veya davranışsal belirtiler (uyuşukluk, tımar eksikliği, düşük yiyecek veya su alımı) ve genel sağlık durumu açısından izlemeye devam edin.
4. İn vivo görüntüleme (Şekil 2A)
- D-lusiferin substratını (150 mg / kg) hayvanlara 1 mL insülin şırıngası, 28 G iğne ile intraperitoneal enjeksiyonla uygulayın.
NOT: Tümör hücreleri, lusiferaz cDNA ile kararlı bir şekilde dönüştürülmelidir. - D-lusiferin substrat enjeksiyonundan 6 dakika sonra, 2.3-2.4 adımlarında açıklandığı gibi anesteziyi indükleyin.
- Biyolüminesans görüntüleme (BLI) tarayıcı (in vivo görüntüleme sistemi) kullanarak görüntüleme gerçekleştirin26.
- Hayvanı görüntüleme odasının içine ve burun konisine doğru hareket ettirin. Görüntüleme sisteminin kapasitesine bağlı olarak aynı anda 5 hayvana kadar görüntü alın.
- Başlat'a basarak aleti başlatın. Pozlama süresi ayarını otomatik (1-120 sn) olarak ayarlayın.
- Gerekirse herhangi bir arka planı çıkarmak için boş bir görüntü yakalayın. Edin'e tıklayın ve alma sırası tamamlandıktan sonra görüntüyü kaydedin.
- Hayvanı, anesteziden kurtulmak için taban yüzey alanının% 50'sini bir ısıtma pedi üzerine oturan bir kafese geri yerleştirin. Sternal ve ambulatuar olduğunda, bilinci yeniden kazandıktan sonra hayvanı vivaryum kafesine geri döndürün.
- Görüntülerin yakalandığı aynı in vivo görüntüleme yazılımında veri analizi için, görüntülerin kaydedildiği klasöre gidin ve deneyle ilgili tüm farelerin görüntülerini bir kerede açın.
NOT: Bir seferde bir görüntünün analizi, gruplar arasında normalleştirmeye izin vermez. - Birimleri parlaklık olarak ayarlayın ( sayılmaz). Bireyi gösteren onay kutusunun işaretli olmadığından emin olun, çünkü bu, gruplar arasında sinyalin normalleşmesini engelleyecektir.
- İlgi Çekici Bölge (ROI) çizim aracını kullanarak, beyin bölgesi için dairesel ROI'ler ve vücut için dikdörtgen ROI'ler çizin. Kulakları ve burnu beyin yatırım getirisinden dışlamaya dikkat edin, çünkü spesifik olmayan lüminesans yayma eğilimindedirler. Bu işlemdeki önyargıyı en aza indirmek için, ışıldayan sinyal üst üste binmeden yalnızca farelerin fotoğraflarına yatırım getirileri çizin.
- Sinyali ölçmek ve verileri bir elektronik tabloya aktarmak için YG'leri ölç'ü seçin. İlgilenilen vücut bölgelerindeki toplam ışıldayan akıyı (p / sn / cm2 / sr) çizerek gruplar arasındaki farklılıkları analiz edin.
NOT: Özellikle beyin tropizmindeki gruplar arasındaki farklılıkları değerlendirmek için, her fare için beyin sinyali ile vücut sinyali arasındaki oranı hesaplayın. Bu, genel tümör yükündeki fareler arası varyasyonu ve deney grupları arasındaki lusiferaz ekspresyon seviyelerindeki farklılıkları kontrol eder.
5. Ex vivo manyetik rezonans görüntüleme
- Ötanaziden hemen sonra ex vivo MRG yapın. Alternatif olarak, ilgilenilen organları toplayın, 72 saate kadar formalin içinde sabitleyin ve görüntülemeyi daha sonraki bir zaman noktasında gerçekleştirin.
- Görüntüleri, bir NMR konsolu ve sıfır kaynama, yatay delikli mıknatıs veya benzeri bir ekipmanla donatılmış 7-Tesla (7-T) (300-MHz) mikro MRI sistemi ile elde edin.
NOT: Doğru performans dengesine sahip aktif korumalı bir gradyan bobini kesici ucuna duyulan ihtiyaç çok önemlidir. Geometrik bozulma olmadan aynı anda incelenen numune kümesini kapsayacak şekilde en az 50 mm dinamik küresel hacim (DSV) gradyan doğrusallığı sağlamalıdır. Gradyan mukavemeti (440 ila 750 mT / m arasında değişen) ve 3 x 30 A ila 3 x 87 A arasında değişen maksimum eşzamanlı DC akımları sağlayan çalışma döngüsünün kombinasyonu, yeterli görüntüleme performansı sağlayacaktır. Kullanılan gradyan bobini kesici ucu ( Malzeme Tablosuna bakınız) aşağıdaki performansı sağlar: 660 mT/m, 130 μs yükselme süresi, 3 x 87 A ve DSV = 80 mm. - Taramaları, 1H proton Larmor frekansı olan 300.16 MHz'e ayarlanmış ticari bir iletim-alma dairesel polarize tüm fare gövdesi radyofrekans bobini (OD = 59 mm, ID = 38mm, L = 40 mm) ile gerçekleştirin.
NOT: Bu rf probu, 8-12 saate yayılan gece taramaları sırasında milialtı izotropik çözünürlüğe (<150 μm) sahip 3B veri kümelerinin elde edilmesini sağlar. - Birden fazla sekans kullanarak tümör yükünü tespit edin30.
NOT:T2 ağırlıklı, Yeniden Odaklanmış Yankılarla Hızlı Görüntüleme (RARE) dizisi ile tespit edilen hiperintens sinyali, tümörleri çevreleyen ödemi tanır. - 3B RARE dizisini aşağıdaki alma parametreleriyle gerçekleştirin: [120 μm]3 izotropik çözünürlük; edinme süresi 5 saat, 27 dakika; tekrarlama süresi (TR) = 500 ms; yankı aralığı (ES) = 12,7 dakika; Turbo faktörü TFx = 12; etkili yankı süresi (TEeff) = 76,2 ms; bant genişliği (BW) = 75 KHz; Matris boyutu = 2843; görüş alanı (FOV) = [4,0 mm]3; ortalama sayısı (Nav) = 6.
- Aşağıdaki parametreleri kullanarak metastazları tespit edin.
- Sinyal parlatmalı pigmentli metastazlar için, aşağıdaki parametrelere sahip T1 ağırlıklı 3D Degrade yankı dizisi kullanın: [120 μm]3 izotropik çözünürlük; edinme süresi 2 saat, 41 dakika; TR = 20 ms; yankı süresi (TE) = 4.0 ms; çevirme açısı (FA) = 18°; BW = 75 KHz; Matris boyutu = 2843; FOV = [34,0 mm]3; Nav = 6.
- Pigmentlenmemiş ve/veya hemorajik metastazlar için, T2* ağırlıklı, çok gradyanlı eko (MGE) dizisi altında elde ederken hipointens bir sinyal kullanın (3D MGE, [120 μm]3 izotropik çözünürlük; edinme süresi 3 saat, 35 dakika; TR = 40 ms; TE = 3,6 ms; ES = 3,2 ms; 4 yankı; FA = 20°; BW = 100 kHz; Matris boyutu = 2843; FOV = (34,0 mm)3; Nav = 4.
- Tümör yükünü ölçmek için 3 dizinin tümünü kullanın.
- Doğruluğu sağlamak için analiz sırasında tespit edilen tümör bölgelerini histolojik kesitlerle çapraz referans alın. Bölüm 7 ve 8'e bakın.
6. Tek hücreli veya toplu RNA dizilimi için doku işleme
- Kurumun IACUC'si tarafından onaylanan herhangi bir yöntemi kullanarak hayvanı ötenazileştirin. Adım 2.6.6'nın NOTUNDA açıklanan yordamlardan birine bakın.
- İlgilenilen organları inceleyin ve bunları buz üzerinde Hank'in Dengeli Tuz Çözeltisini (HBSS) içeren bir plakanın ayrı kuyucuklarına yerleştirin. Hızlı çalışın ve hücre canlılığını en üst düzeye çıkarmak için dokuyu her zaman buz üzerinde tutun.
NOT: Aşağıdaki adımlar beyin işlemeye özeldir. Kollajenaz tipini ihtiyaçlarınıza göre belirli dokuya göre ayarlayın. - Her kuyucukta 3 mL HBSS içeren 6 delikli bir plaka hazırlayın.
- Diseksiyonu görselleştirmek ve daha fazla yönlendirmeye yardımcı olmak için, bir floresan mikroskobu kullanın ve etiketli alanları tanımlayın.
- Floresan alanları disseke edin ve doku parçalarını 6 delikli plakaya yerleştirin (bireysel metastatik odaklar analiz edilecekse kuyucuk başına 1 parça veya aynı organdaki birden fazla metastaz analiz edilecekse bir organdan birden fazla parça). Dokuyu mümkün olduğunca küçük parçalara ayırmak için steril tıraş bıçağı kullanın (her numune için bu adımda 1-2 dakikadan fazla harcamadan).
NOT: Tümörlerin işlem süresini sınırlamak, hücre canlılığının korunmasına yardımcı olur. - Her bir kuyucuğun içeriğini aspire edin ve 15 mL'lik bir konik tüpe aktarın.
NOT: Daha büyük parçaların transferini kolaylaştırmak için 1.000 μL'lik pipet ucunun ucunu kesin. - Kuyuya 1 mL HBSS ekleyin ve kalan doku parçalarının / hücrelerinin 4 mL'lik bir son hacim içerecek olan 15 mL tüpe aktarıldığından emin olun. Her tüpe 50 μL kollajenaz tip I (40 mg / mL) ve 12.5 μL DNaz I (2.000 birim / mL) ekleyin.
- Konik tüpleri 45 dakika boyunca 37 ° C'de ısıtılmış bir su banyosuna yerleştirin. Konik tüpleri her 5 dakikada bir kısaca vorteksleyin.
- HBSS ile 70 μm'lik bir süzgeci önceden ıslatın. Sterilize edilmiş bir mikrosantrifüj tüpünün kapaklı ucunu veya bir şırınga pistonunun plastik kısmını kullanın ve doku homojenatlarını 70 μm'lik bir süzgeçten yeni bir 50 mL konik tüpe öğütün.
NOT: Süzgeçlerin HBSS veya FACS tamponu ile önceden ıslatılması gerilmeyi kolaylaştırır. - Süzgeci 1 mL HBSS ile yıkayın. HBSS ile 40 μm'lik bir süzgeci önceden ıslatın. Her numuneyi 40μm'lik bir süzgeçten 50 mL'lik yeni bir konik tüpe tekrar filtreleyin. Yıkamak için 40 μm süzgecin üzerine 1 mL FBS ekleyin. Konik tüpleri her zaman buz üzerinde tutun.
- Konik tüpü buz gibi soğuk DPBS ile 50 mL'ye kadar doldurun. Hücreleri aşağı doğru döndürün (4 ° C'de 10 dakika boyunca 180 × g). Hücre peletini kaybetmemeye dikkat ederek süpernatanı atın.
NOT: Beyin örnekleri için, hücreleri 2,5 mL% 38 yoğunluk ayırma çözeltisinde yeniden askıya alın (HBSS'de seyreltin ve oda sıcaklığında (RT) saklayın). 5 mL FACS tüplerine aktarın. 800 × g'da 20 dakika boyunca döndürün. 1.000 μL'lik pipet ucunun ucunu kesin ve üst yağ tabakasını çıkarın. Tüplerin duvarlarında yağ bırakmayın. Herhangi bir yağ kalırsa, tekrar aşağı dönün ve işlemi tekrarlayın. Bu kritik bir adımdır. Sıvı fazın geri kalanını çıkarın (pelet yarı saydam ve görselleştirmesi zor olacaktır). - Hücreleri 1 mL kırmızı kan hücresi (RBC) lizis tamponunda yeniden askıya alın ve RT'de 60 s inkübe edin.
- Hücreleri 180 × g'da 4 ° C'de 10 dakika boyunca döndürün. Süpernatantı çıkarın ve hücreleri 2 mL FACS tamponunda (DPBS'de% 5 FBS) yeniden askıya alın.
- Toplu veya tek hücreli RNA dizilimi için etiketli hücreleri ve / veya kütüphane hazırlığını sıralamaya devam edin.
NOT: Hücreler döndürülebilir, çırpılabilir ve toplu RNA-seks için RNA izolasyonundan önce -80 ° C'de saklanabilir.
7. Hayvan dokusu perfüzyonu ve immünohistolojik analizlere hazırlık
- Hayvanı aşırı dozda ketamin (300 mg / kg) ve ksilazin (30 mg / kg) kokteyli ile insülin şırıngası ve 28 G iğne ile intraperitoneal enjeksiyonla anestezi yapın.
- Kalbi brüt diseksiyonla açığa çıkarın ve sağ atriyumda bir kesi yapın. Uzun, kavisli forseps önden bakacak şekilde kalbi yavaşça yerinde tutun.
NOT: Formalin ve paraformaldehit (PFA) kanserojenlerdir. Güvenlik Bilgi Formu'nu (SDS) okuyun, dumana maruz kalmaktan kaçının ve uygun KKD'yi takın. - 22 G, 22 mm'lik bir iğne ile 10 mL'lik bir şırınga kullanarak, sol ventriküle 10 mL DPBS ve ardından 10 mL% 4 PFA enjekte edin.
- Organları toplamaya devam edin ve önceden etiketlenmiş histolojik kasetlere yükleyin. Kasetleri, dokuları örtmek için yeterli fiksatif (formalin) barındıran uygun büyüklükte bir kaba yerleştirin.
NOT: İdeal olarak, fiksatif hacim dokuların hacminin 5-10 katı olmalıdır. - Histolojik kasetlerin içindeki organları 48-72 saat boyunca% 10 formalin içinde sabitleyin. %10'luk formalini atın ve kasetleri 1x DPBS ile iki kez yıkayın.
- Kasetleri 2 saat boyunca% 70 etanol içine batırarak dehidrasyon işlemine başlayın. Kasetleri artan etanol konsantrasyonlarına art arda daldırmaya devam edin: her biri 1 saat boyunca% 80,% 95,% 100. % 100 çözeltiyi 1,5 saat sonra iki kez değiştirin. Kasetleri 1,5 saat boyunca ksilene batırın ve çözeltide üç değişiklik yapın.
- Kasetleri 58-60 °C'de parafin mumuna yerleştirin. Parafin bloklarını kesitleyin. Hematoksilin ve eozin (H & E) veya immünohistokimya boyamasına devam edin.
- Melanom hücrelerini tanımlamak için, bu belirteçlerden birini veya bir paneli kullanın: S100, Melan-A, HMB-45, Tyrosinase, MITF. Mümkün olduğunda, oldukça spesifik bir insan hücresi belirteci olduğu için Nükleer Mitotik Aparat Proteini (NuMA) boyamasını kullanın.
NOT: NuMA boyama, konakçı (fare) ve aşılanmış hücreler (insan) arasında, görüntü işlemeye ve sonraki tümör niceleme aşamalarına yardımcı olan keskin bir tanımlama sunar.

Şekil 2: Melanom metastazında aday genlerin etkilerinin analizi için çok yönlü yaklaşımı gösteren BLI, brightfield, ex vivo floresan ve H&E boyama görüntülerine örnekler. (A) BLI, (B) BF, (C) ex vivo floresan ve (D) H&E boyama görüntüleri. Gösterim amacıyla kullanılan görüntüler, hedeflenmeyen bir kontrol shRNA'sı (shNTC) veya FUT8'i hedefleyen bir shRNA ile dönüştürülen 131/6-4L melanom hücrelerinin immün yetmezlikli (NSG) farelere enjekte edildiği bir deneye karşılık gelmektedir. FUT8 susturma, melanom hücrelerinin metastatik yayılımını bozmuştur. Ölçek çubukları ve renk çubuğu = p/sn/cm2/sr × 106 (A), 100 mm (B, C), 100 μm (D). Kısaltmalar: BLI = biyolüminesans görüntüleme; H&E = hematoksilin ve eozin; shRNA = kısa saç tokası RNA; shNTC = hedeflemeyen kontrol shRNA; NSG = obez olmayan diyabetik şiddetli kombine immün yetmezlik gaması; FUT8 = fukoziltransferaz 8; BF = parlak alan. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
8. Nükleer Mitotik Aparat Proteini (NuMA) boyama (Şekil 3)
- Doku kesitlerinde metastatik yükün tanımlanması ve ölçülmesi için yüksek oranda insana özgü mitotik bir iğ belirteci olarak bir anti-NuMA antikoru kullanın. 8.1. Melanom hücrelerinin son derece spesifik ve hassas tanımlanması sağlanır.
- NuMA için kromojenik immünohistokimya otomatik bir immünoboyama aleti üzerinde gerçekleştirilirse, aşağıdaki adımları açıklandığı gibiizleyin 32:
- Bölümleri ksilen cinsinden deparaffinize edin ve sırayla azaltan etanol konsantrasyonlarında rehidre edin. Slaytları 15 dakika boyunca ksilen içinde suya batırın ve 15 dakika daha% 100 etanol'e aktarın.
NOT: Etanol rehidrasyon adımlarının geri kalanı (% 95,% 80,% 75) her biri 3 ila 5 dakika sürer. - Slaytları deiyonize suda durulayın.
- Slaytları 10 mM sodyum sitrat tamponunda, pH 6.0'da , 1200 Watt'lık bir mikrodalga fırında 10 dakika boyunca% 100 güçte bir kaba (örneğin, Coplin boyama kavanozu) batırarak epitop alımı gerçekleştirin.
- Etiketleme için konjuge edilmemiş, poliklonal tavşan anti-insan NuMA antikoru kullanın, Tris-Bovine serum albümininde (BSA) 1:7.000 seyreltilmiş (25 mM Tris, 15 mM NaCl,% 1 BSA, pH 7.2). Etüt bölümlerine paralel olarak uygun pozitif ve negatif kontrolleri çalıştırın.
- Slaytları 12 saat boyunca birincil antikor ile inkübe edin. Keçi anti-tavşan HRP konjuge multimer ile birincil antikoru tespit edin ve kompleksi 3,3-diaminobenzidin ve bir bakır sülfat arttırıcı ile görselleştirin.
- Slaytları damıtılmış suda yıkayın, hematoksilin ile karşı lekeleyin, kurutun ve kalıcı bir ortamla monte edin.
NOT: Dehidrasyon adımları, adım 8.3'te açıklanan rehidrasyon adımlarının tersidir. Slaytları mevcut tarayıcıyla 20x veya 40x büyütmede tarayın ve bir veritabanına yükleyin. - Yazılımı kullanarak, diğer organ parankimi ve boş alanlar hariç, organ dokusundaki tüm NuMA lekeli hücreleri içerecek şekilde yatırım getirilerini çizin.
- Her organ için uygun pozitif ve negatif denetimleri kullanırken NuMA-pozitif ve NuMA-negatif hücreleri kategorilere ayırmak için ayarları yapın. Her örnek için NuMA-pozitif hücrelerin toplam sayısını / yüzdesini ölçmek için yerleşik bir yazılım algoritması kullanın.
9. Doku dilimi immünofloresan
Belirli bir gen adayının gerekli olduğu metastatik aşamayı tanımlamak için (örneğin, ekstravazasyon ve tohumlamadan sonra hayatta kalma), enjeksiyondan uzak organ invazyonuna, tohumlamaya ve büyümeye tümör hücresi ilerlemesini izlemek için farklı zaman noktalarında doku dilimi immünofloresansı belirlenebilir. Bu yaklaşım, ekstravazasyon olayını yakalamak için komşu hücreler için belirteçlerin eklenmesine izin verir ve çevredeki tümör mikroçevre değişiklikleri33.
- Hayvanı adım 7.1'de açıklandığı gibi anestezi altına alın.
- Vasküler endoteli tanımlamak için perfüzyondan 3 dakika önce, her hayvanın sol ventrikülüne 100 μg florofor konjuge Lycopersicon Esculentum (Domates) Lectin'i enjekte edin.
NOT: Domates Lektininin tüm sistemde yeniden dolaşması için zaman tanıyın. - Hayvanı adım 7.2-7.3'te açıklandığı gibi perfüze edin. İlgilenilen organları toplayın ve% 4 PFA ile doldurulmuş önceden etiketlenmiş kaplara aktarın. Dokuyu 24 ila 48 saat boyunca sabitleyin. Bir vibratom kullanarak dokuyu 30-50 μm kalınlığında dilimler halinde bölün.
NOT: Kalınlık optimize edilmelidir. Özellikle z-stack görüntüleme yapılırken 30 μm ile 50 μm kalınlık arasındaki dilimler önerilir. - RT'de 2 saat boyunca bloke edici tampondaki dilimleri (% 10 Normal Keçi Serumu,% 2 BSA, DPBS'de% 0.25 Triton X-100) inkübe edin.
- Boyama optimizasyonu deneyi gerçekleştirin.
NOT: Antijen geri kazanım süresi olarak, antijen alımı için kullanılan tamponlar, sıcaklık, farklı antikorlar / farklı lotlar ve doku tipi boyamayı etkiler, optimizasyon deneyleri gereklidir. - Optimize edilmiş bir seyreltmede birincil antikorlar ekleyin ve optimize edilmiş bir sıcaklıkta optimize edilmiş bir süre boyunca inkübe edin ( Tablo 1'deki örneklere bakın).
NOT: Birincil/ikincil antikorlar ve lekesiz doku örnekleri için uygun kontrolleri kullanın. - Doku dilimlerini DPBS'de% 0.25 Triton X-100 ile 5 dakika boyunca 3 kez yıkayın.
- Bloke edici çözeltide seyreltilmiş sekonder antikordaki doku dilimlerini istenen süre boyunca inkübe edin (Tablo 1).
- Doku dilimlerini DPBS'de% 0.25 Triton X-100 ile 5 dakika boyunca 3 kez yıkayın.
- Çekirdekleri 4′,6-diamidino-2-fenilindol (DAPI) ile sabitleyin, DPBS'de 1:1.000 seyreltilmiş veya 5 dakika boyunca tamponu bloke edin.
- Bir kapak kaymasına 2 damla antifade floresan montaj ortamı ekleyin ve doku camı slaytlara monte ederek dilimlerin montaj ortamı ile tamamen kaplandığından emin olun.
NOT: Mikroskopiyi bozduğu için doğrudan dilimlerin üzerinde hava kabarcığı olmadığından emin olun. - 60x yağ daldırma hedefi kullanarak mevcut mikroskopla konfokal görüntüler yakalayın.
NOT: Konfokal görüntüler elde ederken, deneydeki tüm görüntülere aynı ayar parametrelerini (voltaj, havadar birimler ve kazanç) uygulayın. - Mikroskopu kullanarak 10x, 20x veya 40x'te konfokal olmayan görüntüler yakalayın.
- Resimleri bir görüntü analiz yazılımına yükleyin ve seçilen parametreleri (yani, alan, sayı, işaretleyicilerin yoğunluğu veya bitişik hücrelerle temas) karşılaştırarak analiz edin.
Sonuçlar
Aşağıdaki rakamlar, melanom metastazının yeni sürücülerinin tanımlanması için açıklanan iş akışının nasıl uygulandığını göstermektedir. Şekil 2 , fukoziltransferaz FUT8'in in vivo melanom metastazının susturulmasının etkilerinin incelendiği yayınlanmış bir çalışmanın sonuçlarını özetlemektedir26. Kısaca, insan hasta glikomik verilerinin analizi (lektin dizileri ile elde edilen) ve transkriptomik profilleme, karşılı...
Tartışmalar
Bu teknik raporun amacı, melanom metastazındaki potansiyel aktörlerin araştırılması için standartlaştırılmış, yukarıdan aşağıya bir iş akışı sunmaktır. İn vivo deneyler maliyetli ve zaman alıcı olabileceğinden, verimliliği en üst düzeye çıkarma ve elde edilen bilgilerin değerini artırma stratejileri çok önemlidir.
Aynı deneydeki bulguları çapraz doğrulamak için tamamlayıcı yaklaşımların kullanılması zorunludur. Örneğin, hem NuMA immüno...
Açıklamalar
Yazarların beyan edecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
NYU Langone Health'teki İleri Araştırma Teknolojileri Bölümü'ne (DART) ve özellikle Perlmutter Kanser Merkezi Destek Hibe / NCI 5P30CA016087 tarafından kısmen desteklenen Deneysel Patoloji Araştırma Laboratuvarı, Genom Teknoloji Merkezi, Sitometri ve Hücre Sıralama Laboratuvarı, Klinik Öncesi Görüntüleme Çekirdeği'ne teşekkür ederiz. NYU Disiplinlerarası Melanom İşbirliği Grubu'na (PI: Dr. Iman Osman), IRB onaylı protokoller (Universal Consent study #s16-00122 ve Interdisciplinary Melanom Cooperative Group study #10362) aracılığıyla elde edilen hasta kaynaklı melanom kısa süreli kültürlerine+ (10-230BM ve 12-273BM) erişim sağladığı için teşekkür ederiz. 113/6-4L ve 131/4-5B1 melanom hücre hatları* sağladığı için Dr. Robert Kerbel'e (Toronto Üniversitesi) ve WM 4265-2, WM 4257s-1, WM 4257-2 melanom kısa süreli kültürleri sağladığı için Dr. Meenhard Herlyn'e (Wistar Enstitüsü) teşekkür ederiz**. E.H., NIH / NCI R01CA243446, P01CA206980, Amerikan Kanser Derneği-Melanom Araştırma İttifakı Ekibi Bilim Ödülü ve bir NIH Melanom SPORE (NCI P50 CA225450; PI: I.O.). Şekil 1, Biorender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #15 Scapel Blade | WPI | 500242 | For surgical procedures |
| #3 Scapel Handle | WPI | 500236 | For surgical procedures |
| 1 mL Tuberculin syringe, slip tip | BD | 309626 | Injections |
| 10 mL syringe, slip tip | BD | 301029 | Perfusion |
| 10% Formalin Sodium Buffered | EK Industries | 4499-20L | For perfusion/tissue fixative |
| 15 mL Conical | Corning | 430052 | Cell culture |
| 15 mL Conical Polypropylene Centrifuge Tubes | Falcon | 352196 | Cell culture |
| 200 Proof Ethanol | Deacon Labs | 04-355-223 | Histology |
| 22G – 22mm needle | BD | 305156 | Perfusion |
| 4-0 Vicryl Suture | Ethicon | J464G | Suture |
| 4% Carson's phosphate buffered paraformaldehyde | EMS | 15733-10 | For perfusion/tissue fixative |
| 40µm | Corning | 431750 | Tissue processing |
| 5-0 Absorbable Suture | Ethicon | 6542000 | Closure |
| 50 mL Conical | Corning | 430828 | Cell culture |
| 50mL Conical Polypropylene Centrifuge Tubes | Falcon | 352070 | Cell culture |
| 7-0 Silk suture | FST | 18020-70 | Ligature |
| 70µm | Corning | 431751 | Tissue processing |
| Anti-fade mounting media | Vector Labs | H-1000-10 | Immunofluorescence |
| Approximator applying Forceps, 10cm | WPI | 14189 | For microsurgical procedures |
| Avance | Bruker | 3 HD | NMR Console |
| Biospec 7030 | Bruker | 7030 | Micro MRI |
| BSA | Bioreg | A941 | NuMA Staining |
| Castroviejo suturing forceps, straight tips 5.5mm tying platform, 11cm | WPI | WP5025501 | For microsurgical procedures |
| Coplin Staining Jar | Bel-Art | F44208-1000 | Histology |
| DAPI | Sigma-Aldrich | D9542-1MG | Immunofluorescence |
| dCas9-KRAB | Addgene | 110820 | Genetic manipulation |
| DNase I | NEB | M0303L | Tissue processing |
| DPBS | Corning | 21-030-CM | Tissue processing |
| Extra Sharp Uncoated Single Edge Blade | GEM | 62-0167 | Tissue processing |
| Extracellular Matrix Substrate | Corning | 354234 | Consider the Growth Factor Reduced ( as alternative |
| FBS | Cytiva | SH30910.03 | Cell culture |
| Fiji Image J | Fiji Image J | Software | Immunofluorescence |
| Goat anti-rabbit HRP conjugated multimer | Thermo Fisher | A16104 | NuMA Staining |
| Goat Serum | Gibco | PCN5000 | Immunofluorescence |
| HBSS | Corning | 21-020-CV | Tissue processing |
| Hematoxylin | Richard-Allan Scientific | 7231 | Histology |
| Illumina III | PerkinElmer | CLS136334 | BLI Instrument |
| Insulin syringe 28G - 8mm needle | BD | 329424 | Injections |
| Insulin syringe 31G - 6mm needle | BD | 326730 | Injections |
| Iris Forceps, 10.2cm, Full Curve, serrated | WPI | 504478 | For perfusion and surgical procedures |
| Isoflurane USP | Covetrus | 11695067772 | Anesthesia |
| Jewelers #7 Forceps Titanium 11 cm 0.07 x 0.01 mm Tip | WPI | WP6570 | For microsurgical procedures |
| Ketamine HCl 100mg/mL | Mylan Ind. | 1049007 | Anesthesia |
| lentiCRISPRv2 | Addgene | 98290 | Genetic manipulation |
| Lycopersicon Esculentum (Tomato) Lectin, DyLight 649 | Invitrogen | L32472 | Vascular endothelial cells marker |
| MEM non-essential amino acids X 100 | Corning | 25-025-CI | Cell culture |
| Metzenbaum Scissors | WPI | 503269 | For surgical procedures |
| Microinjection Unit | KOPF | 5000 | Intracardiac injections |
| NaCl | Fisher | S25877 | NuMA Staining |
| Needle 30G x 25mm | BD | 305128 | Intracardiac Injection |
| Needle 33G x 15mm | Hamilton | 7747-01 | Intracarotid Injection |
| Needle holder, Castroviejo, 14cm, with lock, 1.2mm Serrated Jaws | WPI | 14137-G | For microsurgical procedures |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ mice | The Jackson Laboratory | 005557 | Murine model |
| NU/J mice | The Jackson Laboratory | 002019 | Murine model |
| Nuclear Mitotic Apparatus Protein polyclonal rabbit anti-human | Abcam | 97585 | NuMA Staining |
| Penicillin-Streptomycin 10000U/mL | Gibco | 15140122 | Cell culture |
| Percoll | GE | 0891-01 | density separation solution |
| PI Classic Surgical Gloves | Cardinal Health | 2D72PT75X | Surgery |
| pLKO Tet-On | Addgene | 21915 | Genetic manipulation |
| Povidone-Iodine 10% Solution | Medline | MDS093943 | Surgery |
| Proparacaine Drops 0.5% | Akorn Pharma | AX0501 | Opthalmic local anesthetic |
| Puralube Petrolatum Opthalmic Ointment | Dechra | 83592 | Anesthesia |
| Razor Blade Double Edge Blades | EMS | 72000 | Shaving and Vibrotome Brain Slicing |
| Reflex 9mm EZ Clip | Braintree | EZC- KIT | Wound closure |
| RPMI 1640 | Corning | 10-040-CM | Cell culture |
| Scissors, Spring 10.5cm Str, 8mm Blades | WPI | 501235 | For microsurgical procedures |
| Semi-Automatic Vibrating Blade Microtome | Leica | VT1200 | Brain Slice Immunofluorescence |
| Single Channel Anesthesia Vaporizer System | Kent Scientific | VetFlo-1210S | Anesthesia |
| Smartbox Tabletop Chamber System and Exhaust Blower | EZ Systems | TT4000 | CO2 Euthanasia |
| Sterile Fenestrated Disposable Drape | Medline | NON21002 | Surgery |
| Sterile Non-Reinforced Aurora Surgical Gowns with Set-In Sleeves | Medline | DYNJP2715 | Surgery |
| T25 Flask | Corning | 430639 | Cell culture |
| Tris | Corning | 46-031-CM | NuMA Staining |
| Triton X-100 | Sigma-Aldrich | X100-500ML | Immunofluorescence |
| Troutman tying forceps, 10cm, Curved G pattern, 0.52mm tip with tying platform | WPI | WP505210 | For microsurgical procedures |
| Vessel clips 10G Pressure 5x 0.8mm Jaws, 5/pkg | WPI | 15911 | For microsurgical procedures |
| Visiopharm | Visiopharm | Visiopharm | NuMA Staining Quantification Software |
| Xylasine 100mg/mL | Akorn Pharma | 59399-111-50 | Anesthesia |
| Xylene | Fisher | X3P-1GAL | Histology |
Referanslar
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Adler, N. R., Haydon, A., McLean, C. A., Kelly, J. W., Mar, V. J. Metastatic pathways in patients with cutaneous melanoma. Pigment Cell Melanoma Research. 30 (1), 13-27 (2017).
- Platz, A., Egyhazi, S., Ringborg, U., Hansson, J. Human cutaneous melanoma; a review of NRAS and BRAF mutation frequencies in relation to histogenetic subclass and body site. Molecular Oncology. 1 (4), 395-405 (2008).
- Alonso, S. R., et al. A high-throughput study in melanoma identifies epithelial-mesenchymal transition as a major determinant of metastasis. Cancer Research. 67 (7), 3450-3460 (2007).
- Rowe, C. J., Khosrotehrani, K. Clinical and biological determinants of melanoma progression: Should all be considered for clinical management. Australasian Journal of Dermatology. 57 (3), 175-181 (2016).
- Plebanek, M. P., et al. Pre-metastatic cancer exosomes induce immune surveillance by patrolling monocytes at the metastatic niche. Nature Communications. 8 (1), 1319 (2017).
- Orgaz, J. L., et al. Loss of pigment epithelium-derived factor enables migration, invasion and metastatic spread of human melanoma. Oncogene. 28 (47), 4147-4161 (2009).
- Ladhani, O., Sanchez-Martinez, C., Orgaz, J. L., Jimenez, B., Volpert, O. V. Pigment epithelium-derived factor blocks tumor extravasation by suppressing amoeboid morphology and mesenchymal proteolysis. Neoplasia. 13 (7), 633-642 (2011).
- Ju, R. J., Stehbens, S. J., Haass, N. K. The role of melanoma cell-stroma interaction in cell motility, invasion, and metastasis. Frontiers in Medicine - Dermatology. 5, 307 (2018).
- Wiley, H. E., Gonzalez, E. B., Maki, W., Wu, M. T., Hwang, S. T. Expression of CC chemokine receptor-7 and regional lymph node metastasis of B16 murine melanoma. Journal of the National Cancer Institute. 93 (21), 1638-1643 (2001).
- Meier, F., et al. Metastatic pathways and time courses in the orderly progression of cutaneous melanoma. British Journal of Dermatology. 147 (1), 62-70 (2002).
- Turner, N., Ware, O., Bosenberg, M. Genetics of metastasis: melanoma and other cancers. Clinical & Experimental Metastasis. 35 (5-6), 379-391 (2018).
- Ubellacker, J. M., et al. Lymph protects metastasizing melanoma cells from ferroptosis. Nature. 585 (7823), 113-118 (2020).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Cunningham, C. C., et al. Actin-binding protein requirement for cortical stability and efficient locomotion. Science. 255 (5042), 325-327 (1992).
- Unger, C., et al. Modeling human carcinomas: physiologically relevant 3D models to improve anti-cancer drug development. Advanced Drug Delivery Reviews. 79-80, 50-67 (2014).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Nakamura, K., et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Science. 70 (7), 791-798 (2002).
- Meeth, K., Wang, J. X., Micevic, G., Damsky, W., Bosenberg, M. W. The YUMM lines: a series of congenic mouse melanoma cell lines with defined genetic alterations. Pigment Cell Melanoma Research. 29 (5), 590-597 (2016).
- Koya, R. C., et al. BRAF inhibitor vemurafenib improves the antitumor activity of adoptive cell immunotherapy. Cancer Research. 72 (16), 3928-3937 (2012).
- Jenkins, M. H. Multiple murine BRaf(V600E) melanoma cell lines with sensitivity to PLX4032. Pigment Cell Melanoma Research. 27 (3), 495-501 (2014).
- Tuncer, E., et al. SMAD signaling promotes melanoma metastasis independently of phenotype switching. The Journal of Clinical Investigation. 129 (7), 2702-2716 (2019).
- Schwartz, H., et al. Incipient Melanoma Brain Metastases Instigate Astrogliosis and Neuroinflammation. Cancer Research. 76 (15), 4359-4371 (2016).
- Perez-Guijarro, E., et al. Multimodel preclinical platform predicts clinical response of melanoma to immunotherapy. Nature Medicine. 26 (5), 781-791 (2020).
- Krepler, C., et al. A Comprehensive Patient-Derived Xenograft Collection Representing the Heterogeneity of Melanoma. Cell Reports. 21 (7), 1953-1967 (2017).
- Agrawal, P., et al. A systems biology approach identifies FUT8 as a driver of melanoma metastasis. Cell. 31 (6), 804-819 (2017).
- Hanniford, D., et al. Epigenetic silencing of CDR1as drives IGF2BP3-mediated melanoma invasion and metastasis. Cancer Cell. 37 (1), 55-70 (2020).
- Kim, H., et al. PRMT5 control of cGAS/STING and NLRC5 pathways defines melanoma response to antitumor immunity. Science Translational Medicine. 12 (551), (2020).
- de Miera, E. V., Friedman, E. B., Greenwald, H. S., Perle, M. A., Osman, I. Development of five new melanoma low passage cell lines representing the clinical and genetic profile of their tumors of origin. Pigment Cell Melanoma Research. 25 (3), 395-397 (2012).
- Morsi, A., et al. Development and characterization of a clinically relevant mouse model of melanoma brain metastasis. Pigment Cell Melanoma Research. 26 (5), 743-745 (2013).
- Huynh, C., et al. Efficient in vivo microRNA targeting of liver metastasis. Oncogene. 30 (12), 1481-1488 (2011).
- Zou, C., et al. Experimental variables that affect human hepatocyte AAV transduction in liver chimeric mice. Molecular Therapy Methods and Clinical Development. 18, 189-198 (2020).
- Kleffman, K., et al. Melanoma-secreted Amyloid Beta Suppresses Neuroinflammation and Promotes Brain Metastasis. bioRxiv. , 854885 (2019).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Molecular Imaging and Biology. 13 (6), 1114-1123 (2011).
- Sil, P., Wong, S. W., Martinez, J. More than skin deep: autophagy is vital for skin barrier function. Frontiers in Immunology. 9, 1376 (2018).
- Chen, S., et al. Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell. 160 (6), 1246-1260 (2015).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163 (6), 1515-1526 (2015).
- Wang, T., et al. Identification and characterization of essential genes in the human genome. Science. 350 (6264), 1096-1101 (2015).
- Edgar, R., Domrachev, M., Lash, A. E. Gene Expression Omnibus: NCBI gene expression and hybridization array data repository. Nucleic Acids Research. 30 (1), 207-210 (2002).
- Lappalainen, I., et al. The European Genome-phenome Archive of human data consented for biomedical research. Nature Genetics. 47 (7), 692-695 (2015).
- Cerami, E., et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data. Cancer Discovery. 2 (5), 401-404 (2012).
- Grossman, R. L., et al. Toward a shared vision for cancer genomic data. New England Journal of Medicine. 375 (12), 1109-1112 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır