JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
흑색종 전이의 새로운 중재자 식별을 위한 강력한 발견 플랫폼
요약
이 기사는 흑색종 전이의 새로운 후보 매개체와 그 작용 메커니즘을 테스트하는 데 사용되는 기술의 워크 플로우에 대해 설명합니다.
초록
전이는 복잡한 과정으로, 세포가 시험관내 분석에 의해서만 불완전하게 모델링되는 장벽을 극복해야 합니다. 강력하고 재현 가능한 생체 내 모델과 흑색종 전이에서 새로운 선수를 식별하기위한 표준화 된 방법을 사용하여 체계적인 워크 플로우가 수립되었습니다. 이 접근법은 특정 실험 단계에서 데이터 추론을 허용하여 전이에서 유전자의 역할을 정확하게 특성화합니다. 모델은 마우스에 심장내, 피내 또는 피하 주사를 통해 유전자 변형 흑색종 세포를 도입한 다음, 일련의 생체내 영상으로 모니터링함으로써 확립된다. 일단 미리 확립된 종점에 도달하면, 원발성 종양 및/또는 전이-보유 장기가 다양한 분석을 위해 수확되고 처리된다. 종양 세포를 분류하고 단일 세포 RNA 시퀀싱을 포함한 여러 'omics'플랫폼 중 하나를 실시할 수 있습니다. 장기는 전이의 전반적인 부담을 정량화하고 특정 해부학 적 위치를지도화하기 위해 이미징 및 면역 조직 병리학 적 분석을 거칩니다. 생착, 모니터링, 조직 수확, 처리 및 분석을 위한 표준화된 프로토콜을 포함하는 이 최적화된 파이프라인은 환자 유도, 단기 배양 및 다양한 고형암 유형의 확립된 인간 및 뮤린 세포주에 채택될 수 있다.
서문
전이성 흑색종과 관련된 높은 사망률과 전 세계적으로 흑색종의 발생률 증가와 결합 1 (2025 년까지 약 7.86 % 증가)은 새로운 치료 접근법을 요구합니다. 표적 발견의 발전은 매우 복잡한 과정인 재현 가능한 전이 모델에 달려 있습니다. 전이성 캐스케이드의 단계를 통틀어, 흑색종 세포는 면역계 회피 및 먼 조직의 식민지화를 달성하기 위해 무수한 장벽을 극복해야 한다2. 흑색종 세포의 탄력성과 적응성은 높은 유전 적 돌연변이 부담 3과 신경 볏 기원을 포함한 다양한 요인에서 발생하며, 이는 중요한 표현형 가소성 3,4,5를 부여합니다. 각 단계에서, 전사 프로그램은 전이된 흑색종 세포가 면역계(6), 세포외 환경(7,8), 및 이들이 접촉하는 물리적 장벽(9)의 세포 구조를 포함하는 미세환경과의 누화로부터의 단서에 기초하여 한 상태에서 다른 상태로 전환하도록 허용한다. 예를 들어, 흑색종 세포는 중요한 면역프라이밍 종양-분비 인자6의 발현을 하향조절함으로써 면역 감시를 탈출한다.
연구는 흑색종 세포가 전이를 위해 먼 "표적"기관을 프라이밍하기 위해 케모카인과 사이토카인을 분비하는 "전이성 틈새 시장"을 기술합니다10. 이러한 발견은 전이성 흑색종 세포의 장기 기증과 먼 조직에 접근하기 위해 취하는 해부학 적 경로에 대한 중요한 질문을 제기합니다. 혈관 내 후, 흑색종 세포는 림프학(림프성 확산) 및 혈관(hematogenous spread)2,11을 통해 전이되는 것으로 알려져 있다. 대부분의 환자들이 국소화된 질환을 앓고 있는 반면, 소수의 사례들은 먼 전이성 질환과 림프 전파(음성 림프절 침범)11를 나타내지 않으며, 이는 흑색종에 대한 대안적인 전이성 경로의 존재를 시사한다.
그들이 전이성 부위를 식민지화할 때, 흑색종 세포는 후성유전학적 및 대사적 적응을 겪는다12,13. 새로운 구획에 접근하고 침범하기 위해, 흑색종 세포는 프로테아제 14 및 세포골격 변형11,15를 이용하여, 이들이 그들의 새로운 위치로 횡단하고 성장할 수 있게 한다. 흑색종 세포를 표적화하는 어려움은 그러한 적응의 복잡성과 수에 상주한다; 따라서 이 분야는 가능한 한 많은 단계와 적응을 실험적으로 재현하기 위해 노력해야 한다. 오가노이드 및 3D 배양물(16,17)과 같은 시험관내 분석에서의 수많은 진보에도 불구하고, 이들 모델은 단지 생체내 전이성 캐스케이드를 불완전하게 재분석한다.
뮤린 모델은 재현성, 기술적 타당성 및 인간 질병의 시뮬레이션 사이의 균형을 유지함으로써 가치를 보여주었습니다. 혈관내, 직교적 및 이종국적으로 이식된 흑색종 세포는 환자 유래 이종이식편 또는 단기 배양물로부터 면역-손상 또는 인간화 마우스로 전이성 흑색종에서 표적 발견의 중추를 나타낸다. 그러나 이러한 시스템은 종종 전이에 대한 중요한 생물학적 제약 조건, 즉 면역 체계가 부족합니다. 이 제약을 가진 합성 흑색종 전이 모델은 현장에서 상대적으로 부족합니다. 이들 시스템은, B16-F10 18, YUMM 패밀리 세포주19, SM1 20, D4M3 21, RIM322 또는 보다 최근에, RMS 23 및M1 (Mel114433),M3 (HCmel1274), M4 (B2905)24 흑색종 세포주를 포함하는 면역적격 마우스에서 개발되어, 흑색종 진행에서 숙주 면역 반응의 복잡한 역할의 조사를 용이하게 한다.
여기서, 흑색종 전이 표적 식별을 위한 파이프라인이 제시된다. 흑색종 환자 코호트에서 점점 더 큰 'omics'데이터 세트가 생성됨에 따라, 우리는 가장 임상 적 약속을 지키고있는 연구가 빅 데이터 통합에서 비롯된 연구이며 세심한 기능 및 기계론적 심문25,26,27,28로 이어진다고 가정합니다. 마우스 모델을 사용하여 전이성 과정에서 잠재적 표적을 연구함으로써, 생체내 특이적 사건 및 조직 상호작용을 설명할 수 있고, 따라서 임상 번역의 확률을 증가시킬 수 있다. 전이성 부담을 정량화하는 여러 가지 방법이 요약되어 주어진 실험 결과에 대한 보완적인 데이터를 제공합니다. 다양한 기관에서 종양으로부터 단리하기 위한 프로토콜이 단일 세포 또는 벌크 RNA 시퀀싱에 선행할 수 있는 전이성 세포에서 유전자 발현의 편향되지 않은 특성화를 돕기 위해 기술된다.
프로토콜
참고 : 다음 프로토콜과 관련된 동물 절차는 뉴욕 대학 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받았습니다. 모든 절차는 실험실 동물 관리 국제 평가 및 인증 협회 (AAALAC)가 승인 한 시설에서 수행됩니다. 도 1은 일반적인 실험 접근법을 도시한다.
1. 환자 유래 흑색종 단기 배양(STCs)
- 조직을 1mL의 완전 RPMI(10% 태아 소 혈청(FBS), 2mM L-글루타민, 1mM 피루베이트 나트륨, 1x MEM 비필수 아미노산 용액, 페니실린(100 IU/mL)/스트렙토마이신(100 μg/mL)으로 보충된 RPMI 1640)이 있는 60mm 페트리 접시에 넣습니다.
참고 : 종양 세포의 비율을 높이려면 필요한 경우 멸균 수술 도구를 사용하여 현미경으로 페트리 접시에서 종양을 둘러싼 조직을 해부하고 제거하십시오. - 멸균 된 면도날을 사용하여 신선한 조직을 1-2mm 큐브로 잘게 자릅니다. 완전한 RPMI 4 mL를 첨가하고 10 mL 혈청 학적 피펫으로 플레이트의 내용물을 5-10 회 위아래로 피펫하십시오.
- 세포 현탁액을 15 mL 폴리프로필렌 원뿔형 튜브로 옮기고 세포를 아래로 스핀링한다(4°C에서 5분 동안 180 × g ). 상청액을 흡인하고, 세포 펠릿을 1 mL의 신선한 배지에 재현탁시키고, 현탁액을 25cm2 조직 배양 플라스크로 옮긴다.
- 조직 단편이 바닥에 부착되도록 돕기 위해, 조직 배양 인큐베이터에서 20°C, 5% CO2에서20분 동안 20 °-30° 각도로 기울어진 플라스크를 설정한다.
- 배지가 조직을 덮을 수 있도록 플라스크를 평평하게 깔고 매일 배양 상태를 확인하십시오. 90-100 % 합류율에 도달하면 세포를 분할하십시오. 단기 문화를 "낮은"통로 번호로 유지하십시오.
참고: STC는 세포 분리 및 배양 후 약 2개월 후에 확립될 것이지만, 실제 타임라인은 샘플과 종양 유형에 따라 다릅니다. 10 내지 14회의 계대 후, 세포주는 흑색종 세포(29)만을 함유하는 100% 순도에 도달한다. 통과 수 역치는 생체내에서 세포 형태학, 배가화 시간 및 행동의 변화를 관찰함으로써 경험적으로 결정된다. 부모 종양의 이질성 및 기타 특성을 보존하려면 세포를 1:5 이상 분할하지 마십시오. - STC의 확립 및 후속 단계에서 설명된 바와 같이 동물에 주입될 임의의 세포주 모델과 함께, 세포를 리포터로 형질도입한다.
참고: 형광 태그(예를 들어, 적색 형광 단백질(RFP), 녹색 형광 단백질(GFP))는 예를 들어, 형광 활성화 세포 분류(FACS)에 의한 종양 세포의 생체외 면역형광 이미징 및 분류를 가능하게 한다. 루시퍼라아제는 실험 진행을 모니터링하는 데 유용한 도구인 생체 내 생체 발광 이미징을 가능하게 합니다(섹션 4).
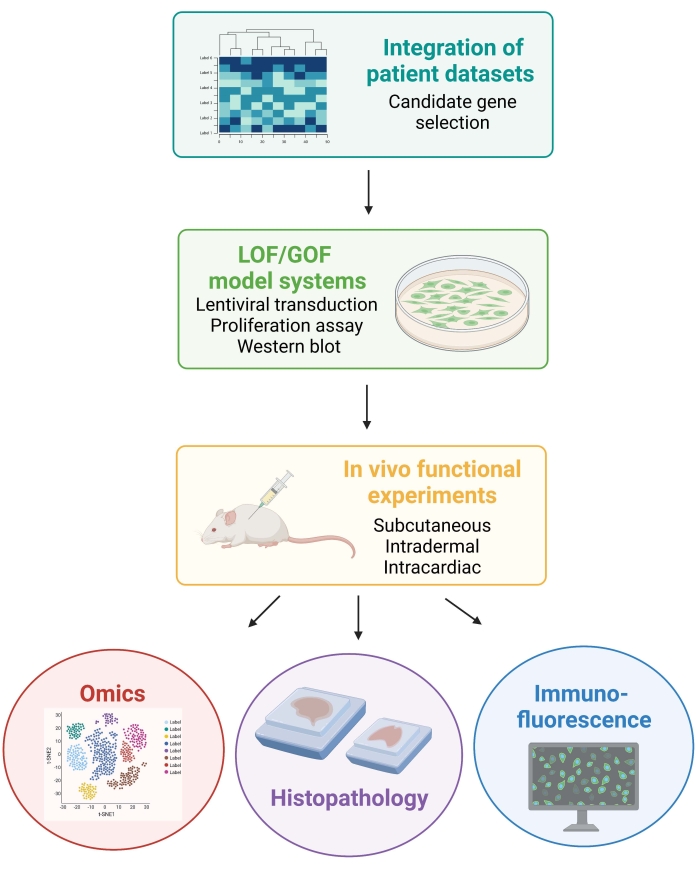
그림 1: 환자 데이터 통합에서 마우스로부터의 생체내 데이터의 생성 및 분석에 이르기까지 설명된 워크플로우를 설명하는 개략도. 약어: LOF = 기능 손실; GOF = 함수의 이득. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 이종이식편 이식
참고: 여기에 설명된 실험 절차는 적응 및 선천적 면역계가 손상된 마우스, NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG) 마우스에서 수행됩니다. 또는 T 세포 결핍 흉선 / 누드 (NU / J) 마우스와 같이 적응 면역이 부족한 마우스에서만 가능합니다. 동물은 남성의 성별, 8 ~ 10 주령입니다. 암컷은 종종 종양 세포의 심장 내 주사시 성선 전이의 높은 발생률을 나타내며, 이는 생존을 감소시킵니다.
- 피하 및 피내 주사의 경우, 1x 둘베코의 인산염 완충 식염수(DPBS)에 현탁된 세포의 1 부분을 1부 해동된 세포외 매트릭스 기질(EMS)과 혼합하여 1:1 세포 현탁액을 제조하고, 4°C에서 얼음 위에 유지한다. 혈관 내 (심장 내, 경동맥 내, 역궤도, 꼬리 정맥 또는 비장) 주사의 경우 DPBS에서만 세포를 일시 중단하십시오.
참고: 피내 주사에 적합한 부피는 가능한 한 낮게 유지되어야 합니다(30μL). 피하 주사의 경우, 주입 된 부피는 최대 150 μL까지 갈 수 있으며, 혈관 내 주사의 경우 최대 250 μL (동물의 체중 기준)까지 갈 수 있습니다. 최종 세포 현탁액에 10-30% 추가 부피의 주입물을 첨가하고, 주사 양 및 주사기 바늘의 슬립 팁 내부의 죽은 부피를 설명하기 위해 사용된 주사기 (예를 들어, 30 G를 갖는 1 mL 투베르쿨린 주사기, 25mm 바늘은 100 μL의 죽은 부피를 갖는다). - 사용중인 세포주의 거동과 생체 내에서 종양 진행의 타임 라인을 특성화하기 위해 파일럿을 수행하십시오. 피내 주사의 경우, 먼저 1,000개에서 최대 50,000개의 세포/30μL를 주입합니다. 피하 주사의 경우, 10,000 최대 2 × 106 세포 / 150 μL를 주입하여 시작하십시오. 혈관 내 (심장 내, 경동맥 내, 역궤도 및 비장) 주사의 경우 50,000 세포 / 150 μL를 주입하여 시작하십시오.
참고 : 혈관 내 주사는 순환계에 공기를 도입하거나 작은 혈관을 막는 과도한 수의 세포를 사용하여 동물을 색전성 사건에 걸리게합니다. 뭉침을 피하기 위해 세포 현탁액을 잘 섞으십시오. 세포 현탁액을 로딩하기 전에 주사기를 프라임한다. 주사기 내부의 기포를 제거하십시오. 로딩 및 주입 시간까지 세포 현탁액 / 주사기를 얼음 위에 보관하십시오. - 흡입에 의한 마취를 투여하십시오. 산소 레벨 조절기를 1-2 L/min 사이로 설정하십시오. 유도를 위해 2.5-5 %, 유지 보수를 위해 1.5-3 %로 설정된 이소플루란 기화기로 동물을 유도 챔버에 놓습니다.
참고: 마취 유도 단계에서 동물의 호흡과 심박수를 모니터링하십시오. 동물을 무인 상태로 두지 마십시오 . 둘 이상의 동물을 동시에 모니터링 하지 마십시오 . 마 취의 양을 동물의 체중에 역가하십시오. - 유도 챔버에서 코 콘으로 동물을 옮깁니다. 절차 중에 각막 건조를 방지하기 위해 동물의 눈에 멸균 된 페트롤라툼 안과 연고를 바르십시오.
- 30° 각도로 기울어진 직선 면도날로 절차 부위를 면도합니다. 70 % 이소프로필 알코올 면봉으로 절차 부위의 피부를 닦으십시오. 추가 단계 전에 페달 반사에 의한 충분한 수준의 마취를 평가하십시오.
- 피내 주사의 경우, 무균 상태를 유지하기 위해 생물 안전 캐비닛 내부에서 전체 절차를 수행하십시오.
- 단계 2.3-2.5에 설명된 대로 동물을 마취시키고 면도한다.
- 바늘 찔림의 궤적에 대해 피부를 뒤로 잡고 수축시킵니다. 6mm 길이의 31G 인슐린 주사기 바늘을 사용하여 예각으로 잡고 경사가 위쪽을 향하도록 부드럽게 구멍을 뚫습니다.
- 바늘 끝에서 압력 방출을 느껴보십시오. 부드럽게 전진하여 피내 구획 안에 머무르고 전체 피부 깊이를 통해 subcutis로 통과하지 마십시오. 중요 : 피하 공간으로 미끄러지면 바늘을 제거하고 주사 영역을 변경 한 다음 바늘을 다시 삽입하십시오. 돔 모양의 wheal이 관찰 될 때까지 세포 현탁액의 전체 부피 (30 μL)를 천천히 주입하십시오.
참고 : 낮은 주입량은 피부 층의 해부를 줄이고 건축 왜곡을 줄입니다. - 바늘을 넣고 5로 계산하십시오.
참고: EMS는 체온에서 점성이 되어 바늘 펑크 상처를 통한 역류를 방지합니다. - 바늘을 제거하고 따뜻한 패드의 새장에서 동물을 독집하여 회복하십시오. 의식을 회복 한 후, 흉골과 외래 할 때 동물을 vivarium 케이지로 돌려 보내십시오.
참고: 이 프로토콜에 설명된 모든 절차 동안 동물을 지속적으로 모니터링합니다. 동물을 무인 상태로 두거나 둘 이상의 동물을 동시에 모니터링 하지 마십시오 . - 초기 성장 단계에서 매일 수의과 직원과 함께 종양 성장, 체중 감소 및 전반적인 건강 상태의 진행을 모니터링하고, 필요한 경우 동물이 체중 감량을 시작한 후보다 강렬하게 모니터링하십시오. 이러한 모니터링 세션 동안 : 동물의 체중을 측정하고 체중 감소를 모니터링하기위한 차트를 플롯하고 종양 궤양, 신경학적, 운동 운동 및 / 또는 행동 징후 (혼수, 손질 부족, 낮은 음식 또는 물 섭취량)의 징후를 확인합니다.
참고: 진행성 질환의 징후(20% 이상의 체중 감소, <2의 신체 상태 점수, 극히 감소된 활동 수준, 마비 또는 발작)를 관찰한 직후에 동물을 안락사시킨다. 기관의 IACUC에 의해 승인된 안락사 방법을 사용한다 (예를 들어, 자동화된 탁상 CO2 챔버는 동물을 15분 동안CO2에 노출시키기 위해 사용되고, 이어서 흉곽을 절개함으로써 양측으로 유도되는 자궁경부 탈구, 감금 또는 기흉의 2차 안락사 방법이 뒤따른다). - 캘리퍼로 측정하고 종양의 길이 (L) 및 너비 (W) 치수를 사용하여 수식으로 부피 (V)를 계산하십시오.
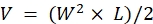
- 피하 주사의 경우:
- 무균 조건26,27을 유지하기 위해 생물 안전 캐비닛 내부에서 전체 절차를 수행하십시오.
- 단계 2.3-2.5에 설명된 대로 동물을 마취시키고 면도한다.
- 28 G 내지 31 G 인슐린 주사기 바늘을 사용하여 길이 6 mm, 급성 각도로 유지, 부드럽게 베벨이 위쪽을 향하게하여 피부에 구멍을 뚫습니다. 표피, 진피 및 피하피를 통과하는 동안 바늘 끝에서 압력 방출을 두 번 느껴보십시오.
참고: 바늘 끝에서 압력 방출이 두 번째로 느껴지면 피하 구획에 도달했음을 나타냅니다. - 길쭉한 타원 모양의 wheal이 관찰 될 때까지 세포 현탁액의 전체 부피 (30-150 μL)를 천천히 주입하십시오. 바늘을 넣고 5로 계산하십시오. 더 큰 볼륨(50μL 이상)의 경우 10개까지 계산합니다.
참고: EMS는 체온에서 점성이 되어 바늘 펑크 상처를 통한 역류를 방지합니다. - 바늘을 제거하고 따뜻한 패드의 새장에서 동물을 독집하여 회복하십시오. 의식을 회복 한 후, 흉골과 외래 할 때 동물을 그 vivarium 케이지로 돌려 보내십시오.
참고: 사후 절차 모니터링 중에 합병증의 징후 (낮은 호흡률, 출혈, 느린 회복)를 관찰하고 적절하게 해결하십시오. 개선이 관찰되지 않으면 단계 2.6.6의 노트에 설명된 인도적 안락사 절차를 진행하십시오. - 단계 2.6.6-2.6.7에 설명된 바와 같이 종양 성장, 체중 감소 및 전반적인 건강 상태에 대해 동물을 모니터링한다.
- 심장 내 주사의 경우:
- 무균 조건26,30을 유지하기 위해 생물 안전 캐비닛 내부에서 전체 절차를 수행하십시오.
- 단계 2.3-2.4에 설명된 대로 동물을 마취시킨다.
- 동물을 초음파 기계의 가열 된 플랫폼으로 옮기고 저자 극성 테이프로 코 콘에 고정시킵니다.
- 30° 각도로 기울어진 직선 면도날로 흉부를 면도합니다. 이소프로필 알코올의 3 가지 적용과 번갈아 가며 10 % 포비돈 - 요오드의 3 가지 적용으로 절차 부위의 피부를 닦으십시오.
- 추가 단계 전에 페달 반사에 의한 충분한 수준의 마취를 평가하십시오. 절차 부위에 초음파 젤을 바르십시오.
- 초음파 프로브로 심장 창을 캡처하십시오. 초음파 프로브를 동물의 좌측에 흉부의 중앙에 위치시켜 좌심실의 단면도(짧은 축)를 얻기 위해 배향된 수평 창을 캡처한다. 프로브의 긴 축이 위쪽을 향하도록 보장하고 프로브를 50° 각도로 고정하고 가열된 플랫폼을 20° 각도로 고정합니다. 프로브와 지지 프레임을 제자리에 고정시킵니다.
- 30 G, 25mm 바늘이 있는 투베르쿨린 1 mL 주사기에서 생물안전 캐비닛 내부에서 작업하면서 세포 현탁액을 그립니다. 주사기의 기포를 제거하십시오.
참고: 세포가 처리되고 주입되는 동안 단일 세포 현탁액을 만들고 유지하는 것이 중요합니다. 기포를 제거하는 것은 공기 색전증을 피하는 중요한 단계입니다. 잘 프라이밍 된 주사기 바늘 시스템은 실험 그룹에서 피할 수있는 사망을 예방합니다. 항상 주사기에 주입되는 것보다 더 많은 부피를 주사기로 그립니다. 여분의 부피는 세포 현탁액 중 일부를 다시 1.5 mL 튜브에 주입하여 공기를 제거하는 데 도움이됩니다. - 스테레오택틱 인젝터에 주사기를 잠급니다. 초음파 지침에 따라 흉벽을 통해 바늘을 심장의 좌심실로 밀어 넣으십시오. 세포 현탁액의 전체 부피 (100-250 μL)를 천천히 주입하십시오.
- 바늘을 제거하고 따뜻한 패드의 새장에서 동물을 독집하여 회복하십시오. 의식을 회복 한 후, 흉골과 외래 할 때 동물을 그 vivarium 케이지로 돌려 보내십시오. 단계 2.6.6에 설명된 바와 같이 종양 성장, 체중 감소 및 전반적인 건강 상태에 대해 동물을 모니터링한다.
- 경동맥 주사의 경우:
- 무균 조건(30)을 유지하는 것을 돕기 위해 적절하게 소독된 표면에서 전체 절차를 수행한다.
- 케타민 (100 mg / kg)과 자일라진 (10 mg / kg) 칵테일로 동물을 인슐린 주사기, 28 G 바늘로 복강 내 주사하여 마취하십시오. 절차 중에 각막 건조를 방지하기 위해 동물의 눈에 멸균 된 페트롤라툼 안과 연고를 바르십시오.
- 30° 각도로 기울어진 직선 면도날로 절차 영역을 면도합니다. 추가 단계 전에 페달 반사에 의한 충분한 수준의 마취를 평가하십시오.
- 동물을 온난화 패드의 스테레오 현미경 아래에 놓습니다. 이소프로필 알코올의 3 가지 적용과 번갈아 가며 10 % 포비돈 - 요오드의 3 가지 적용으로 절차 부위의 피부를 닦으십시오.
- 돈 멸균 개인 보호 장비 (PPE) 및 멸균 장갑. 동물의 몸 위에 멸균 드레이프를 놓아 멸균 필드를 준비하십시오.
참고: 멸균 드레이프에 절개의 크기와 위치에 적합한 구멍이 없는 경우 드레이프를 반으로 접고 Metzenbaum 가위를 사용하여 멸균 드레이프 중간에 적절한 크기의 구멍을 자릅니다. - 메스 또는 아이리스 가위를 사용하여 목의 절반에서 흉골까지 피부를 절개하십시오. 두 개의 미세 수술 포셉으로 중간 선 평면에서 2 개의 턱밑 타액선을 무뚝뚝하게 해부하십시오. 필요한 경우 지혈을 위해 전기 소작기를 사용하십시오.
- 일반적인 경동맥 (CCA)을 둘러싼 근막을 manubrium에서 분기쪽으로 해부하고 외부 경동맥의 후부 벽을 확보하기 위해 내측으로 계속하십시오. 주사하기 전에 외부 경동맥 (ECA)을 일시적으로 클립하십시오.
참고 : CCA의 둘레 주위를 해부 할 때, 미주 신경을 손상시키지 않도록주의해야합니다 (동맥에 측면으로 놓여 있음). - 세포 현탁액을 33 G, 15 mm 바늘로 1 mL 주사기에 로딩한다.
- CCA 아래에 두 개의 7-0 합자를 통과시키고 두 합자 각각에 대해 느슨한 악기 매듭을 수행하십시오. 5mm, 10G 압력 용기 클립을 사용하고 ECA를 임시로 클립합니다. 근위 합자를 묶는 것; 그런 다음 원위 합자를 느슨하게 묶습니다 (CCA의 분기 옆). 나중에 원위 루프를 사용하여 주사 후 출혈을 제어하십시오.
- 33G, 15mm 바늘이 있는 주사기를 사용하여 바늘의 경사가 위쪽을 향하고 예리한 각도로 CCA를 부드럽게 뚫습니다. 세포 현탁액의 전체 부피 (50-150 μL)를 천천히 주입하십시오.
- 원위 루프를 포셉으로 잡고 바늘을 제거하면서 들어 올려 CCA의 내강을 막고 출혈을 막으십시오. 주사기를 #7 보석상 포셉으로 교환하고 원위 루프를 묶으십시오.
- 원위 합자에 다른 악기 매듭을 던지고 ECA에서 용기 클립을 제거하십시오. 출혈에 대한 수술 필드를 제어하고 폐쇄 전에 출혈 혈관을 소작하십시오. 9mm 스테이플링 장치를 사용하여 동물의 피부를 닫고 동물을 따뜻한 패드에 올려 놓고 회복하십시오.
참고 : 수술 후 7-10 일 후에 스테이플을 제거하십시오. - 진통제를 피하 Buprenorphine (0.3 mg / mL)을 0.1 mg / kg의 농도로 수술 후 72 시간 동안 12 시간마다 투여하십시오.
참고 : 또는 72 시간마다 1 회 투여해야하는 연장 방출 진통제를 사용하는 것을 고려하십시오. - 의식을 회복 한 후, 흉골과 외래 할 때 동물을 그 vivarium 케이지로 돌려 보내십시오. 수술 후 매일 동물을 모니터링하여 수술 부위 감염 또는 통증, 전반적인 건강 상태 및 합병증의 징후가 있는지 확인하십시오.
참고 : 생존 수술에서 잘 회복되지 않는 동물에게는 진통제를 추가로 투여 할 수 있으며 수술 후 72 시간까지 완전히 회복되지 않으면 인도적으로 안락사됩니다. - 단계 2.6.6에 설명된 바와 같이 종양 성장, 체중 감소 및 전반적인 건강 상태에 대해 동물을 모니터링한다.
- 역궤도 주입의 경우:
참고 :이 기술을 사용하여 작업자가이 기술에 능숙하고 강력한 과학적 정당성이있을 때 꼬리 정맥 주사의 대안으로 사용하십시오. 이 경로를 통해 전달된 세포 현탁액은 역궤도 공간에서 종양 성장을 유도할 수 있고; 따라서이 기술을 선택할 때 위험과 이점을주의 깊게 고려해야합니다. 예를 들어, 역궤도 정맥 부비동과 아나스토모스를 통한 뇌척수 정맥의 직접적인 순환 연결을 이용하려면 다른 주사 경로를 사용하여 뇌 종양 형성이 실패한 경우이 방법을 선택하십시오.- 무균 상태를 유지하기 위해 생물 안전 캐비닛 내부에서 전체 절차를 수행하십시오. 돈 멸균 PPE와 장갑.
- 단계 2.3-2.4에 설명된 대로 동물을 마취시킨다.
참고 :이 절차를 위해 멸균 된 페트롤라툼 안과 연고를 동물의 눈에 바르면 주사가 방해 될 수 있으므로 사용하지 마십시오. 국소 마취제 방울 만 바르십시오. - 세포 현탁액을 28-31 G, 6 mm 바늘로 인슐린 주사기에 로딩하십시오.
- 동물이 쉬운 위치에 있으면 눈이 튀어 나올 때까지 눈꺼풀을 수축시킵니다. 절차를 겪고있는 쪽의 눈에 국소 마취제 1 방울을 바르십시오.
- 바늘을 눈과 내측 에피칸투스 사이에 30-45° 각도로 삽입하고 베벨이 아래쪽을 향하도록 합니다. 세포 현탁액 (10-150 μL)을 천천히 주입하십시오.
참고: 느린 움직임은 눈의 손상과 주사제의 역류를 방지합니다. - 2.7.5-2.7.6에 설명된 단계를 수행합니다.
- 비장 주사의 경우 :
- 무균 조건(31)을 유지하기 위해 생물안전 캐비닛 내부에서 전체 절차를 수행한다. 돈 멸균 PPE와 멸균 장갑.
- 단계 2.3-2.5에 설명된 대로 동물을 마취시키고 면도한다.
- 동물을 오른쪽 측면 현직 위치에 놓습니다. 이소프로필 알코올의 3 가지 적용으로 번갈아 가며 10 % 포비돈 요오드의 3 가지 적용으로 수술 부위의 피부를 닦고 단계 2.9.5에 설명 된대로 수술 분야를 준비하십시오.
- Metzenbaum 가위 또는 메스를 사용하여 복벽의 왼쪽 측면을 1cm 절개 한 다음 복막을 절개하십시오.
참고 : 비장은 피부 절개를 한 후 반투명 복벽을 통해 볼 수 있습니다. 이 부위에서 복막 절개를 정확하게 수행하십시오. - 절개를 통해 비장과 비장 힐룸을 노출하십시오. 길이 6mm의 28-31G 인슐린 주사기 바늘을 사용하여 바늘의 경사가 위쪽을 향하고 급성 각도로 비장을 부드럽게 뚫습니다.
참고: 펑크 상처가 피를 흘리면 부위를 소작하여 출혈과 역류를 제한하십시오. - 세포 현탁액의 전체 부피 (50-100 μL)를 천천히 주입하십시오. 바늘을 제거하십시오. 비장에 작은 거즈를 놓고 집게로 압력을 가하십시오. 미세한 모기 포셉을 사용하여 거즈 사이에 비장을 가볍게 고정하고 15 분 동안 기다리십시오.
- 비장 힐룸을 3-0 또는 4-0 실크 봉합사로 묶고 필요한 경우 혈관을 소작하여 비장 절제술을 수행하십시오. 복막을 5-0 폴리다이옥사논(PDS) 또는 폴리글리콜산 흡수성 봉합사로 닫는다.
- 2.7.5-2.7.6단계에서 설명한 단계를 수행합니다.
참고: 출혈 합병증이 있거나 수술 후 72시간 동안 완전히 회복되지 않은 동물은 인도적으로 안락사시켜야 합니다. 생쥐의 웰빙은 항상 최우선 과제라는 것을 기억하십시오.
3. 단계적 생존 수술 (SSS)
- 2.2 단계의 실험 결론에 기초하여, 생존 수술에 대한 적절한 시간을 결정하십시오. 세포주 및 실험 가설에 따라, 종양 절제를위한 초기 시점 (종양 부피 = 150 mm3에서) 또는 이후 시점 (종양 부피 = 500mm3에서)26을 선택하십시오.
참고: 종양 부피 제한은 종양 부담이 동물의 웰빙에 해로울 정도로 충분히 높을 때 1,500mm3이며 합병증을 유발하기 쉽습니다. - 단계 2.3-2.5에 설명된 대로 동물을 마취시키고 면도한다.
참고: 전체 절차는 생물 안전 캐비닛 내부에서 수행됩니다. - 이소프로필 알코올의 3 가지 적용으로 번갈아 가며 10 % 포비돈 요오드의 3 가지 적용으로 수술 부위의 피부를 닦고 단계 2.9.5에 설명 된대로 수술 분야를 준비하십시오.
- 홍채 가위 또는 메스를 사용하여 피부를 절개하고 종양 가장자리에서 5-7mm 절제 여백을 유지하십시오.
참고 : 절제술의 마진은 종양이 국부적으로 퍼지는 능력에 달려 있습니다. 공격적인 종양의 경우, 절제 마진을 높이면서 상처 폐쇄를 수행하기에 충분한 피부가 남아 있는지 확인하십시오. - 피내 종양의 경우 원주 피부와 함께 종양을 절제하십시오.
- 피하 종양의 경우 피부 아래의 종양을 해부하고 제거하십시오.
참고: 종양이 복막 및/또는 피부에 침입하는 경우, 종양과 함께 블록 에 절제하고 5-0/4-0 PDS 또는 폴리글리콜산 흡수성 봉합사로 복막을 닫으십시오. - 9mm 스테이플링 장치로 상처를 닫습니다.
참고 : 수술 후 7-10 일 후에 스테이플을 제거하십시오. 진통제를 투여하고 동물을 따뜻한 패드에 올려 놓고 회복하십시오. 2.9.13 단계에 따라 수술 후 72 시간 동안 진통제를 계속 투여하고, 12 시간마다 한 번씩 투여하십시오. 출혈 합병증이 있거나 수술 후 완전한 의식을 회복하지 못한 동물은 인도적으로 안락사해야합니다. - 회복하기 위해 따뜻한 패드에 새장에있는 동물을 싱글 하우스. 의식을 회복 한 후, 흉골과 외래 할 때 동물을 vivarium 케이지로 돌려 보내십시오.
- 국소 재발, 체중 감소, 신경학적, 운동 운동 및 / 또는 행동 징후 (혼수, 손질 부족, 낮은 음식 또는 물 섭취) 및 전반적인 건강 상태에 대해 수술 후 동물을 계속 모니터링하십시오.
4. 생체 내 이미징 (그림 2A)
- D-루시페린 기질 (150 mg / kg)을 1 mL 인슐린 주사기, 28 G 바늘로 복강 주사하여 동물에게 투여하십시오.
참고: 종양 세포는 루시퍼라제 cDNA로 안정적으로 형질도입되어야 한다. - 단계 2.3-2.4, 6분 후에 D-루시페린 기질 주사에 기재된 바와 같이 마취를 유도한다.
- 생체 발광 이미징 (BLI) 스캐너 (생체 내 이미징 시스템)26을 사용하여 이미징을 수행합니다.
- 동물을 이미징 챔버 내부와 코 콘으로 옮깁니다. 이미징 시스템의 용량에 따라 최대 5마리의 동물을 동시에 촬영할 수 있습니다.
- 초기화를 눌러 계측기를 시작합니다. 노출 시간 설정을 자동(1-120초)으로 설정합니다.
- 빈 이미지를 캡처하여 필요한 경우 배경을 뺍니다. 획득을 클릭하고 획득 순서가 완료된 후 이미지를 저장합니다.
- 마취에서 회복하기 위해 온난화 패드 위에 기본 표면적의 50 %로 앉아있는 새장에 동물을 다시 넣으십시오. 의식을 회복 한 후, 흉골과 외래 할 때 동물을 vivarium 케이지로 돌려 보내십시오.
- 이미지가 캡처된 동일한 생체내 이미징 소프트웨어에서 데이터 분석을 위해, 이미지가 저장되는 폴더로 이동하고, 실험과 관련된 모든 마우스의 이미지를 한 번에 엽니다.
참고: 한 번에 하나의 이미지를 분석해도 그룹 간 정규화가 허용되지 않습니다. - 단위를 광채 (카운트 아님) 로 설정합니다. 개인을 나타내는 확인란이 그룹 간 신호 정규화를 배제하므로 선택 취소되어 있는지 확인하십시오.
- 관심 영역(ROI) 그리기 도구를 사용하여 뇌 영역에 대한 원형 ROI와 신체에 대한 직사각형 ROI를 그립니다. 귀와 코가 뇌 ROI에서 제외되도록 주의하십시오, 그들은 비특이적 발광을 방출하는 경향이 있기 때문에. 이 과정에서 편향을 최소화하려면 발광 신호가 겹쳐지지 않고 마우스의 사진에만 ROI를 그립니다.
- ROI 측정을 선택하여 신호를 정량화하고 데이터를 스프레드시트로 내보냅니다. 관심 있는 신체 영역에서 총 발광 플럭스(p/sec/cm2/sr)를 플로팅하여 그룹 간의 차이를 분석합니다.
참고 : 뇌 트로피즘의 그룹 간의 차이를 구체적으로 평가하려면 각 마우스의 뇌 신호와 신체 신호 사이의 비율을 계산하십시오. 이는 전체 종양 부담의 마우스간 변화와 실험군 간의 루시퍼라제 발현 수준의 차이를 조절한다.
5. 생체 외 자기 공명 영상
- 안락사 직후 생체외 MRI를 시행한다. 또는 관심있는 장기를 수확하여 포르말린에 최대 72 시간 동안 고정시키고 나중에 이미징을 수행하십시오.
- NMR 콘솔과 제로 증발, 수평 보어 자석 또는 이와 유사한 장비가 장착된 7-Tesla(7-T)(300MHz) 마이크로 MRI 시스템으로 이미지를 획득합니다.
참고: 성능의 올바른 트레이드오프를 갖는 능동적으로 차폐된 그래디언트 코일 인서트의 필요성은 매우 중요합니다. 기하학적 왜곡 없이 동시에 검사된 샘플 세트를 커버하기 위해 최소 50mm의 동적 구형 볼륨(DSV)의 기울기 선형성을 제공해야 합니다. 기울기 강도(440 ~ 750mT/m 범위)와 듀티 사이클의 조합은 3 x 30A ~ 3 x 87A 범위의 최대 동시 DC 전류를 가능하게 하여 적절한 이미징 성능을 제공합니다. 사용된 그래디언트 코일 인서트( 재료 표 참조)는 660mT/m, 130μs 상승 시간, 3 x 87A 및 DSV = 80mm의 성능을 제공합니다. - 상용 전송 수신 원형 편광된 전체 마우스 몸체 무선 주파수 코일(OD = 59 mm, ID = 38mm, L = 40 mm)을 300.16 MHz로 튜닝된 1H양성자 Larmor 주파수로 스캔을 수행합니다.
참고: 이 rf 프로브를 사용하면 8-12시간에 걸친 야간 스캔 중에 <150μm의 아밀리미터 등방성 분해능을 가진 3D 데이터 세트를 수집할 수 있습니다. - 다중 서열(30)을 사용하여 종양 부담을 검출한다.
참고: T2 가중치의 재집중 에코(RARE) 시퀀스를 사용한 고속 이미징에 의해 감지된 초강력 신호는 종양 주변의 부종을 인식합니다. - 다음 획득 파라미터로 3D RARE 시퀀스를 수행한다: [120 μm]3 등방성 분해능; 획득 시간 5 시간, 27 분; 반복 시간 (TR) = 500 ms; 에코 간격 (ES) = 12.7 분; 터보 팩터 TFx = 12; 유효 에코 시간 (TEeff) = 76.2 ms; 대역폭 (BW) = 75 KHz; 매트릭스 크기 = 2843; 시야각(FOV) = [4.0 mm]3; 평균 수(Nav) = 6.
- 다음 매개 변수를 사용하여 전이를 감지합니다.
- 신호 밝아짐이 있는 색소 전이의 경우, 다음 파라미터와 함께T1-가중 3D 그라디언트 에코 시퀀스를 사용하십시오: [120 μm]3 등방성 분해능; 획득 시간 2 시간, 41 분; TR = 20 ms; 에코 시간 (TE) = 4.0 ms; 플립 각도 (FA) = 18 °; BW = 75 킬로바이트; 매트릭스 크기 = 2843; FOV = [34.0 mm]3; 탐색 = 6.
- 비색소성 및/또는 출혈성 전이의 경우,T2*-가중, 다중 구배 에코(MGE) 서열(3D MGE, [120 μm]3 등방성 분해능; 획득 시간 3h, 35 분; TR = 40 ms; TE = 3.6 ms; ES = 3.2 ms; 4 에코; FA = 20°; BW = 100 kHz; 매트릭스 크기 = 2843; FOV = (34.0 mm)3; 탐색 = 4.
- 종양 부담을 정량화하기 위해 3 개의 서열을 모두 사용하십시오.
- 분석 중에 확인된 종양 부위를 조직학적 절편으로 상호 참조하여 정확성을 보장합니다. 섹션 7과 8을 참조한다.
6. 단일 세포 또는 벌크 RNA 시퀀싱을 위한 조직 처리
- 기관의 IACUC가 승인 한 방법을 사용하여 동물을 안락사시킵니다. 단계 2.6.6의 참고에 설명된 절차 중 하나를 참조하십시오.
- 관심있는 기관을 해부하고 얼음 위에 행크의 균형 잡힌 소금 용액 (HBSS)이 들어있는 접시의 별도의 우물에 놓습니다. 신속하게 작업하고 세포를 항상 얼음 위에 두어 세포 생존력을 극대화하십시오.
참고: 다음 단계는 뇌 처리에만 해당됩니다. 필요에 따라 콜라게나제 유형을 특정 조직에 맞게 조정하십시오. - 각 웰에 3mL의 HBSS가 있는 6웰 플레이트를 준비합니다.
- 해부를 시각화하고 더 나아가 안내하려면 형광 현미경을 사용하고 표지 된 영역을 확인하십시오.
- 형광 영역을 해부하고 조직 단편을 6-웰 플레이트에 배치한다 (개별 전이성 초점이 분석되어야 하는 경우 웰당 1개의 단편 또는 동일한 기관에서의 다중 전이가 분석되어야 하는 경우 한 기관으로부터의 다중 단편). 멸균 면도날을 사용하여 조직을 가능한 한 작은 조각으로 다듬습니다 (각 샘플에 대해이 단계에서 1-2 분 이상을 소비하지 않음).
참고: 종양의 처리 시간을 제한하면 세포 생존력을 보존하는 데 도움이 됩니다. - 흡인하고 각 웰의 내용물을 15 mL 원뿔형 튜브로 옮긴다.
참고: 더 큰 조각의 전달을 용이하게 하기 위해 1,000μL 피펫 팁의 팁을 자릅니다. - HBSS 1 mL를 웰에 첨가하고 나머지 조직 단편/세포가 4 mL의 최종 부피를 포함할 15 mL 튜브로 옮겨지도록 하십시오. 50 μL의 콜라게나제 유형 I (40 mg/mL) 및 12.5 μL DNase I (2,000 units/mL)를 각 튜브에 첨가하십시오.
- 원뿔형 튜브를 37°C에서 45분 동안 가열된 수조에 놓는다. 5 분마다 원뿔형 튜브를 간단히 와류하십시오.
- 70μm 스트레이너를 HBSS로 미리 적셔주십시오. 멸균된 마이크로원심분리 튜브의 캡핑된 끝 또는 주사기 플런저의 플라스틱 부분을 사용하고, 70 μm 스트레이너를 통해 조직 균질물을 새로운 50 mL 원뿔형 튜브로 분쇄한다.
참고: HBSS 또는 FACS 버퍼로 스트레이너를 미리 습윤하면 긴장이 완화됩니다. - 스트레이너를 HBSS 1mL로 씻으십시오. 40μm 스트레이너를 HBSS로 미리 적시십시오. 각 샘플을 40μm 스트레이너를 통해 다시 새로운 50 mL 코니컬 튜브로 여과한다. FBS 1 mL를 40 μm 스트레이너에 첨가하여 세척한다. 원뿔형 튜브를 항상 얼음 위에 보관하십시오.
- 원뿔형 튜브를 얼음처럼 차가운 DPBS로 50mL까지 채웁니다. 세포를 스핀다운시킨다(4°C에서 10분 동안 180 × g ). 상층액을 버리고 세포 펠렛을 잃지 않도록주의하십시오.
참고: 뇌 샘플의 경우, 세포를 2.5mL의 38% 밀도 분리 용액에 재현탁하십시오(HBSS로 희석하고 실온(RT)에서 보관). 5 mL FACS 튜브로 옮깁니다. 800 × g에서 20 분 동안 회전하십시오. 1,000 μL 피펫 팁의 팁을 자르고 상부 지방층을 제거하였다. 튜브 벽에 지방을 남기지 마십시오. 지방이 남아 있으면 다시 아래로 회전하고 과정을 반복하십시오. 이것은 중요한 단계입니다. 나머지 액상을 제거하십시오 (펠렛은 반투명하고 시각화하기가 어렵습니다). - 세포를 1 mL의 적혈구(RBC) 용해 완충액에 재현탁시키고, RT에서 60초 동안 인큐베이션한다.
- 세포를 4°C에서 10분 동안 180 × g 에서 스핀다운시킨다. 상청액을 제거하고 세포를 FACS 완충액 2 mL (DPBS 중 5% FBS)에 재현탁시켰다.
- 벌크 또는 단일 세포 RNA 시퀀싱을 위해 표지된 세포 분류 및/또는 라이브러리 준비를 진행하십시오.
참고: 세포는 벌크 RNA-seq에 대한 RNA 분리 전에 -80°C에서 회전, 스냅-냉동 및 저장될 수 있다.
7. 동물조직 관류 및 면역조직학적 분석을 위한 준비
- 인슐린 주사기와 28G 바늘로 복강 내 주사하여 케타민 (300 mg / kg)과 자일라진 (30 mg / kg) 칵테일을 과다 복용하여 동물을 마취하십시오.
- 심한 해부로 심장을 노출시키고 오른쪽 심방을 절개하십시오. 길고 구부러진 포셉이 앞쪽을 향하도록 심장을 부드럽게 잡으십시오.
참고: 포르말린과 파라포름알데히드(PFA)는 발암물질입니다. 안전 데이터 시트 (SDS)를 읽고 연기에 노출되지 않도록하고 적절한 PPE를 착용하십시오. - 22 G, 22 mm 바늘이 있는 10 mL 주사기를 사용하여, DPBS 10 mL를 주입한 다음, 4% PFA 10 mL를 좌심실에 주입하였다.
- 장기를 수확하여 미리 표지 된 조직 학적 카세트에로드하십시오. 카세트를 조직을 덮기에 충분한 고정 장치 (포르말린)를 수용 할 수있는 적절한 크기의 용기에 넣으십시오.
참고 : 이상적으로, 고정 부피는 조직의 부피의 5-10 배가되어야합니다. - 조직 학적 카세트 내부의 장기를 48-72 시간 동안 10 % 포르말린으로 고정하십시오. 10 % 포르말린을 버리고 1x DPBS로 카세트를 두 번 씻으십시오.
- 카세트를 2시간 동안 70% 에탄올에 침지하여 탈수 과정을 시작한다. 카세트를 에탄올 농도를 증가시키는 데 연속적으로 담그십시오 : 각각 80 %, 95 %, 100 % 1 시간 동안. 1.5 시간 후에 100 % 용액을 두 번 변경하십시오. 카세트를 자일렌에 1.5 시간 동안 담그고 용액의 세 가지 변화를 수행하십시오.
- 카세트를 58-60°C에서 파라핀 왁스에 내장한다. 파라핀 블록을 절편합니다. 헤마톡실린 및 에오신(H&E) 또는 면역조직화학 염색을 진행한다.
- 흑색종 세포를 확인하려면 S100, Melan-A, HMB-45, Tyrosinase, MITF 중 하나를 사용하십시오. 가능한 경우, 핵 유사분열 장치 단백질 (NuMA) 염색은 고도로 특이적인 인간 세포 마커이기 때문에 사용하십시오.
참고: NuMA 염색은 이미지 처리 및 후속 종양 정량화 단계를 돕는 숙주(마우스)와 생착된 세포(인간) 사이의 선명한 묘사를 제공합니다.

도 2: BLI, 브라이트필드, 생체외 형광 및 흑색종 전이에 대한 후보 유전자의 효과 분석을 위한 다각적 접근법을 보여주는 H&E 염색 이미지의 예. (A) BLI, (B) BF, (C) 생체외 형광, 및 (D) H&E 염색 이미지. 예시의 목적으로 사용된 이미지는 비표적화 대조군 shRNA(shNTC) 또는 FUT8을 표적화하는 shRNA로 형질도입된 131/6-4L 흑색종 세포를 면역결핍(NSG) 마우스에 주입한 실험에 해당한다. FUT8 침묵은 흑색종 세포의 전이성 보급을 손상시켰다. 스케일 막대 및 색상 막대 = p/sec/cm2/sr × 106 (A), 100 mm (B, C), 100 μm (D). 약어: BLI = 생체발광 영상; H&E = 헤마톡실린 및 에오신; shRNA = 짧은 헤어핀 RNA; shNTC = 비표적화 대조군 shRNA; NSG = 비비만 당뇨병 중증 복합 면역 결핍 감마; FUT8 = 푸코실트랜스퍼라제 8; BF = 밝은 필드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 핵유사분열장치 단백질(NuMA) 염색(도 3)
- 조직 절편에서 전이성 부담의 확인 및 정량화를 위해 고도로 인간-특이적 유사분열 스핀들 마커로서 항-NuMA 항체를 사용한다. 8.1. 흑색종 세포의 매우 구체적이고 민감한 식별이 달성됩니다.
- NuMA에 대한 발색 면역 조직 화학이 자동 면역 염색 장비에서 수행되는 경우32에 설명 된대로 다음 단계를 수행하십시오.
- 자일렌의 절편을 탈파라핀화하고 순차적으로 감소하는 에탄올 농도로 재수화시킨다. 슬라이드를 자일렌에 15 분 동안 담그고 100 % 에탄올로 옮겨 15 분 동안 유지하십시오.
참고: 에탄올 재수화 단계의 나머지 부분(95%, 80%, 75%)은 각각 3 내지 5분 동안 지속된다. - 슬라이드를 탈이온수로 헹구십시오.
- 슬라이드를 용기 (예를 들어, 코플린 염색 항아리)에 10 mM 시트르산 나트륨 완충액, pH 6.0, 100% 전력으로 1200 와트 마이크로웨이브 오븐에서 10분 동안 침지시킴으로써 에피토프 검색을 수행한다.
- 표지를 위해 접합되지 않은, 폴리클로날 토끼 항-인간 NuMA 항체를 사용하고, 트리스-소 혈청 알부민 (BSA) (25 mM 트리스, 15 mM NaCl, 1% BSA, pH 7.2)에 1:7,000으로 희석하였다. 적절한 양성 및 음성 대조군을 연구 섹션과 병행하여 실행하십시오.
- 슬라이드를 일차 항체로 12시간 동안 인큐베이션한다. 염소 항-토끼 HRP 접합 다량체로 일차 항체를 검출하고, 3,3-디아미노벤지딘 및 황산구리 증진제와의 복합체를 시각화한다.
- 슬라이드를 증류수로 세척하고, 헤마톡실린으로 염색하고, 탈수하고, 영구 배지로 장착하십시오.
참고: 탈수 단계는 8.3 단계에서 설명한 재수화 단계의 반대입니다. 사용 가능한 스캐너로 슬라이드를 20x 또는 40x 배율로 스캔하여 데이터베이스에 업로드합니다. - 소프트웨어를 사용하여 ROI를 그려 다른 장기 실질과 빈 공간을 제외한 장기 조직 내의 모든 NuMA 염색 된 세포를 포함합니다.
- NuMA 양성 및 NuMA 음성 세포를 분류하도록 설정을 조정하면서 각 장기에 대해 적절한 양성 및 음성 대조군을 사용합니다. 확립된 소프트웨어 알고리즘을 사용하여 각 샘플에 대한 NuMA 양성 세포의 총 수/백분율을 정량화합니다.
9. 조직 슬라이스 면역형광
특정 유전자 후보가 요구되는 전이성 단계 (예를 들어, 혈관외 대 시딩 후 생존)를 확인하기 위해, 주입으로부터 먼 기관 침윤, 시딩 및 성장에 이르는 종양 세포 진행을 추적하기 위해 상이한 시점들에서 조직 슬라이스 면역형광을 결정할 수 있다. 이러한 접근법은 혈관외 사건 및 주변 종양 미세환경 변화(33)를 포획하기 위해 이웃 세포에 대한 마커의 첨가를 허용한다.
- 단계 7.1에 설명된 대로 동물을 마취시킨다.
- 100 μg의 형광단 접합된 리코페르시콘 에스큘렌툼(토마토) 렉틴을 각 동물의 좌심실에 주입하고, 관류 3분 전에, 혈관 내피를 묘사한다.
참고: 토마토 렉틴이 전체 시스템에서 재순환될 때까지 시간을 허용하십시오. - 단계 7.2-7.3에 설명된 바와 같이 동물을 퍼퓨즈한다. 관심있는 장기를 수확하여 4 % PFA로 채워진 미리 라벨이 붙은 용기로 옮깁니다. 조직을 24 ~ 48 시간 동안 고정하십시오. 비브라톰을 이용하여 조직을 30-50 μm 두께의 슬라이스로 절편한다.
참고: 두께는 최적화되어야 합니다. 30μm에서 50μm 두께 사이의 슬라이스가 권장되며, 특히 z-스택 이미징을 수행할 때 더욱 그렇습니다. - 슬라이스를 RT에서 2시간 동안 블로킹 완충액(DPBS에서 10% 노멀 염소 혈청, 2% BSA, 0.25% 트리톤 X-100)에서 인큐베이션한다.
- 염색 최적화 실험을 수행합니다.
참고 : 항원 검색 시간, 항원 검색에 사용되는 버퍼, 온도, 다른 항체 / 다른 로트 및 조직 유형이 염색에 영향을 미치기 때문에 최적화 실험이 필요합니다. - 최적화된 희석에서 일차 항체를 첨가하고, 최적화된 온도에서 최적화된 시간 동안 인큐베이션한다 ( 표 1의 실시예 참조).
참고: 일차/이차 항체 및 염색되지 않은 조직 샘플에 대해 적절한 대조군을 사용하십시오. - 조직 절편을 DPBS에서 0.25% 트리톤 X-100으로 5분 동안 3회 세척한다.
- 조직 절편을 원하는 시간 동안 블로킹 용액에 희석된 이차 항체로 인큐베이션한다(표 1).
- 조직 절편을 DPBS에서 0.25% 트리톤 X-100으로 5분 동안 3회 세척한다.
- DPBS에 1:1,000으로 희석된 4',6-디아미디노-2-페닐인돌(DAPI) 또는 5분 동안 블로킹 완충액으로 핵을 착색시킨다.
- 커버슬립에 페이드 방지 형광 장착 매체 2방울을 넣고 티슈를 유리 슬라이드에 장착하여 슬라이스가 장착 매체로 완전히 덮여 있는지 확인합니다.
참고: 현미경을 왜곡하므로 조각에 직접 기포가 없는지 확인하십시오. - 60x 오일 침지 목표를 사용하여 사용 가능한 현미경으로 공초점 이미지를 캡처합니다.
참고: 공초점 이미지를 획득할 때는 실험 내의 모든 이미지에 동일한 설정 매개변수(전압, 통풍이 잘되는 단위 및 게인)를 적용합니다. - 현미경을 사용하여 10x, 20x 또는 40x에서 비공초점 이미지를 캡처합니다.
- 이미지 분석 소프트웨어에 사진을 업로드하고 선택한 매개 변수 (즉, 영역, 수, 마커의 강도 또는 인접한 세포와의 접촉)를 비교하여 분석하십시오.
결과
다음 그림은 흑색종 전이의 새로운 동인을 식별하기 위해 설명 된 워크 플로가 어떻게 적용되었는지 보여줍니다. 도 2 는 생체내 흑색종 전이에서 푸코실트랜스퍼라제 FUT8을 침묵시키는 효과가 연구되었던 공개된 연구의 결과를 요약한 것이다(26). 간략하게, 인간 환자 글리코믹 데이터(렉틴 어레이에 의해 얻어짐) 및 전사 프로파일링의 분석은 1차 ?...
토론
이 기술 보고서의 목적은 흑색종 전이의 잠재적 인 행위자에 대한 조사를위한 표준화 된 상하 워크 플로우를 제공하는 것입니다. 생체 내 실험은 비용이 많이 들고 시간이 많이 소요될 수 있으므로 효율성을 극대화하고 획득한 정보의 가치를 높이기 위한 전략이 가장 중요합니다.
동일한 실험 내에서 결과를 교차 검증하기 위해 보완적인 접근법을 사용하는 것이 필수?...
공개
저자는 선언 할 이해 상충이 없습니다.
감사의 말
우리는 NYU Langone Health의 DART(Advanced Research Technologies) 부서, 특히 Perlmutter Cancer Center Support Grant NIH/NCI 5P30CA016087에 의해 부분적으로 지원되는 실험 병리학 연구소, 게놈 기술 센터, 세포측정 및 세포 분류 실험실, 전임상 이미징 코어에 감사드립니다. 우리는 IRB 승인 프로토콜 (Universal Consent study #s16-00122 및 학제 간 흑색종 협동 그룹 연구 #10362)을 통해 얻은 환자 유래 흑색종 단기 배양 + (10-230BM 및 12-273BM)에 대한 액세스를 제공 한 NYU 학제 간 흑색종 협력 그룹 (PI : Iman Osman 박사)에게 감사드립니다. 113/6-4L 및 131/4-5B1 흑색종 세포주*를 제공해주신 Robert Kerbel 박사(토론토 대학교)와 WM 4265-2, WM 4257s-1, WM 4257-2 흑색종 단기 배양**을 제공해주신 Meenhard Herlyn 박사(Wistar Institute)에게 감사드립니다. E.H.는 NIH/NCI R01CA243446, P01CA206980, American Cancer Society-Melanoma Research Alliance Team Science Award 및 NIH Melanoma SPORE(NCI P50 CA225450; 파이 : I.O.). 그림 1은 Biorender.com 로 작성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| #15 Scapel Blade | WPI | 500242 | For surgical procedures |
| #3 Scapel Handle | WPI | 500236 | For surgical procedures |
| 1 mL Tuberculin syringe, slip tip | BD | 309626 | Injections |
| 10 mL syringe, slip tip | BD | 301029 | Perfusion |
| 10% Formalin Sodium Buffered | EK Industries | 4499-20L | For perfusion/tissue fixative |
| 15 mL Conical | Corning | 430052 | Cell culture |
| 15 mL Conical Polypropylene Centrifuge Tubes | Falcon | 352196 | Cell culture |
| 200 Proof Ethanol | Deacon Labs | 04-355-223 | Histology |
| 22G – 22mm needle | BD | 305156 | Perfusion |
| 4-0 Vicryl Suture | Ethicon | J464G | Suture |
| 4% Carson's phosphate buffered paraformaldehyde | EMS | 15733-10 | For perfusion/tissue fixative |
| 40µm | Corning | 431750 | Tissue processing |
| 5-0 Absorbable Suture | Ethicon | 6542000 | Closure |
| 50 mL Conical | Corning | 430828 | Cell culture |
| 50mL Conical Polypropylene Centrifuge Tubes | Falcon | 352070 | Cell culture |
| 7-0 Silk suture | FST | 18020-70 | Ligature |
| 70µm | Corning | 431751 | Tissue processing |
| Anti-fade mounting media | Vector Labs | H-1000-10 | Immunofluorescence |
| Approximator applying Forceps, 10cm | WPI | 14189 | For microsurgical procedures |
| Avance | Bruker | 3 HD | NMR Console |
| Biospec 7030 | Bruker | 7030 | Micro MRI |
| BSA | Bioreg | A941 | NuMA Staining |
| Castroviejo suturing forceps, straight tips 5.5mm tying platform, 11cm | WPI | WP5025501 | For microsurgical procedures |
| Coplin Staining Jar | Bel-Art | F44208-1000 | Histology |
| DAPI | Sigma-Aldrich | D9542-1MG | Immunofluorescence |
| dCas9-KRAB | Addgene | 110820 | Genetic manipulation |
| DNase I | NEB | M0303L | Tissue processing |
| DPBS | Corning | 21-030-CM | Tissue processing |
| Extra Sharp Uncoated Single Edge Blade | GEM | 62-0167 | Tissue processing |
| Extracellular Matrix Substrate | Corning | 354234 | Consider the Growth Factor Reduced ( as alternative |
| FBS | Cytiva | SH30910.03 | Cell culture |
| Fiji Image J | Fiji Image J | Software | Immunofluorescence |
| Goat anti-rabbit HRP conjugated multimer | Thermo Fisher | A16104 | NuMA Staining |
| Goat Serum | Gibco | PCN5000 | Immunofluorescence |
| HBSS | Corning | 21-020-CV | Tissue processing |
| Hematoxylin | Richard-Allan Scientific | 7231 | Histology |
| Illumina III | PerkinElmer | CLS136334 | BLI Instrument |
| Insulin syringe 28G - 8mm needle | BD | 329424 | Injections |
| Insulin syringe 31G - 6mm needle | BD | 326730 | Injections |
| Iris Forceps, 10.2cm, Full Curve, serrated | WPI | 504478 | For perfusion and surgical procedures |
| Isoflurane USP | Covetrus | 11695067772 | Anesthesia |
| Jewelers #7 Forceps Titanium 11 cm 0.07 x 0.01 mm Tip | WPI | WP6570 | For microsurgical procedures |
| Ketamine HCl 100mg/mL | Mylan Ind. | 1049007 | Anesthesia |
| lentiCRISPRv2 | Addgene | 98290 | Genetic manipulation |
| Lycopersicon Esculentum (Tomato) Lectin, DyLight 649 | Invitrogen | L32472 | Vascular endothelial cells marker |
| MEM non-essential amino acids X 100 | Corning | 25-025-CI | Cell culture |
| Metzenbaum Scissors | WPI | 503269 | For surgical procedures |
| Microinjection Unit | KOPF | 5000 | Intracardiac injections |
| NaCl | Fisher | S25877 | NuMA Staining |
| Needle 30G x 25mm | BD | 305128 | Intracardiac Injection |
| Needle 33G x 15mm | Hamilton | 7747-01 | Intracarotid Injection |
| Needle holder, Castroviejo, 14cm, with lock, 1.2mm Serrated Jaws | WPI | 14137-G | For microsurgical procedures |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ mice | The Jackson Laboratory | 005557 | Murine model |
| NU/J mice | The Jackson Laboratory | 002019 | Murine model |
| Nuclear Mitotic Apparatus Protein polyclonal rabbit anti-human | Abcam | 97585 | NuMA Staining |
| Penicillin-Streptomycin 10000U/mL | Gibco | 15140122 | Cell culture |
| Percoll | GE | 0891-01 | density separation solution |
| PI Classic Surgical Gloves | Cardinal Health | 2D72PT75X | Surgery |
| pLKO Tet-On | Addgene | 21915 | Genetic manipulation |
| Povidone-Iodine 10% Solution | Medline | MDS093943 | Surgery |
| Proparacaine Drops 0.5% | Akorn Pharma | AX0501 | Opthalmic local anesthetic |
| Puralube Petrolatum Opthalmic Ointment | Dechra | 83592 | Anesthesia |
| Razor Blade Double Edge Blades | EMS | 72000 | Shaving and Vibrotome Brain Slicing |
| Reflex 9mm EZ Clip | Braintree | EZC- KIT | Wound closure |
| RPMI 1640 | Corning | 10-040-CM | Cell culture |
| Scissors, Spring 10.5cm Str, 8mm Blades | WPI | 501235 | For microsurgical procedures |
| Semi-Automatic Vibrating Blade Microtome | Leica | VT1200 | Brain Slice Immunofluorescence |
| Single Channel Anesthesia Vaporizer System | Kent Scientific | VetFlo-1210S | Anesthesia |
| Smartbox Tabletop Chamber System and Exhaust Blower | EZ Systems | TT4000 | CO2 Euthanasia |
| Sterile Fenestrated Disposable Drape | Medline | NON21002 | Surgery |
| Sterile Non-Reinforced Aurora Surgical Gowns with Set-In Sleeves | Medline | DYNJP2715 | Surgery |
| T25 Flask | Corning | 430639 | Cell culture |
| Tris | Corning | 46-031-CM | NuMA Staining |
| Triton X-100 | Sigma-Aldrich | X100-500ML | Immunofluorescence |
| Troutman tying forceps, 10cm, Curved G pattern, 0.52mm tip with tying platform | WPI | WP505210 | For microsurgical procedures |
| Vessel clips 10G Pressure 5x 0.8mm Jaws, 5/pkg | WPI | 15911 | For microsurgical procedures |
| Visiopharm | Visiopharm | Visiopharm | NuMA Staining Quantification Software |
| Xylasine 100mg/mL | Akorn Pharma | 59399-111-50 | Anesthesia |
| Xylene | Fisher | X3P-1GAL | Histology |
참고문헌
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Adler, N. R., Haydon, A., McLean, C. A., Kelly, J. W., Mar, V. J. Metastatic pathways in patients with cutaneous melanoma. Pigment Cell Melanoma Research. 30 (1), 13-27 (2017).
- Platz, A., Egyhazi, S., Ringborg, U., Hansson, J. Human cutaneous melanoma; a review of NRAS and BRAF mutation frequencies in relation to histogenetic subclass and body site. Molecular Oncology. 1 (4), 395-405 (2008).
- Alonso, S. R., et al. A high-throughput study in melanoma identifies epithelial-mesenchymal transition as a major determinant of metastasis. Cancer Research. 67 (7), 3450-3460 (2007).
- Rowe, C. J., Khosrotehrani, K. Clinical and biological determinants of melanoma progression: Should all be considered for clinical management. Australasian Journal of Dermatology. 57 (3), 175-181 (2016).
- Plebanek, M. P., et al. Pre-metastatic cancer exosomes induce immune surveillance by patrolling monocytes at the metastatic niche. Nature Communications. 8 (1), 1319 (2017).
- Orgaz, J. L., et al. Loss of pigment epithelium-derived factor enables migration, invasion and metastatic spread of human melanoma. Oncogene. 28 (47), 4147-4161 (2009).
- Ladhani, O., Sanchez-Martinez, C., Orgaz, J. L., Jimenez, B., Volpert, O. V. Pigment epithelium-derived factor blocks tumor extravasation by suppressing amoeboid morphology and mesenchymal proteolysis. Neoplasia. 13 (7), 633-642 (2011).
- Ju, R. J., Stehbens, S. J., Haass, N. K. The role of melanoma cell-stroma interaction in cell motility, invasion, and metastasis. Frontiers in Medicine - Dermatology. 5, 307 (2018).
- Wiley, H. E., Gonzalez, E. B., Maki, W., Wu, M. T., Hwang, S. T. Expression of CC chemokine receptor-7 and regional lymph node metastasis of B16 murine melanoma. Journal of the National Cancer Institute. 93 (21), 1638-1643 (2001).
- Meier, F., et al. Metastatic pathways and time courses in the orderly progression of cutaneous melanoma. British Journal of Dermatology. 147 (1), 62-70 (2002).
- Turner, N., Ware, O., Bosenberg, M. Genetics of metastasis: melanoma and other cancers. Clinical & Experimental Metastasis. 35 (5-6), 379-391 (2018).
- Ubellacker, J. M., et al. Lymph protects metastasizing melanoma cells from ferroptosis. Nature. 585 (7823), 113-118 (2020).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Cunningham, C. C., et al. Actin-binding protein requirement for cortical stability and efficient locomotion. Science. 255 (5042), 325-327 (1992).
- Unger, C., et al. Modeling human carcinomas: physiologically relevant 3D models to improve anti-cancer drug development. Advanced Drug Delivery Reviews. 79-80, 50-67 (2014).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Nakamura, K., et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Science. 70 (7), 791-798 (2002).
- Meeth, K., Wang, J. X., Micevic, G., Damsky, W., Bosenberg, M. W. The YUMM lines: a series of congenic mouse melanoma cell lines with defined genetic alterations. Pigment Cell Melanoma Research. 29 (5), 590-597 (2016).
- Koya, R. C., et al. BRAF inhibitor vemurafenib improves the antitumor activity of adoptive cell immunotherapy. Cancer Research. 72 (16), 3928-3937 (2012).
- Jenkins, M. H. Multiple murine BRaf(V600E) melanoma cell lines with sensitivity to PLX4032. Pigment Cell Melanoma Research. 27 (3), 495-501 (2014).
- Tuncer, E., et al. SMAD signaling promotes melanoma metastasis independently of phenotype switching. The Journal of Clinical Investigation. 129 (7), 2702-2716 (2019).
- Schwartz, H., et al. Incipient Melanoma Brain Metastases Instigate Astrogliosis and Neuroinflammation. Cancer Research. 76 (15), 4359-4371 (2016).
- Perez-Guijarro, E., et al. Multimodel preclinical platform predicts clinical response of melanoma to immunotherapy. Nature Medicine. 26 (5), 781-791 (2020).
- Krepler, C., et al. A Comprehensive Patient-Derived Xenograft Collection Representing the Heterogeneity of Melanoma. Cell Reports. 21 (7), 1953-1967 (2017).
- Agrawal, P., et al. A systems biology approach identifies FUT8 as a driver of melanoma metastasis. Cell. 31 (6), 804-819 (2017).
- Hanniford, D., et al. Epigenetic silencing of CDR1as drives IGF2BP3-mediated melanoma invasion and metastasis. Cancer Cell. 37 (1), 55-70 (2020).
- Kim, H., et al. PRMT5 control of cGAS/STING and NLRC5 pathways defines melanoma response to antitumor immunity. Science Translational Medicine. 12 (551), (2020).
- de Miera, E. V., Friedman, E. B., Greenwald, H. S., Perle, M. A., Osman, I. Development of five new melanoma low passage cell lines representing the clinical and genetic profile of their tumors of origin. Pigment Cell Melanoma Research. 25 (3), 395-397 (2012).
- Morsi, A., et al. Development and characterization of a clinically relevant mouse model of melanoma brain metastasis. Pigment Cell Melanoma Research. 26 (5), 743-745 (2013).
- Huynh, C., et al. Efficient in vivo microRNA targeting of liver metastasis. Oncogene. 30 (12), 1481-1488 (2011).
- Zou, C., et al. Experimental variables that affect human hepatocyte AAV transduction in liver chimeric mice. Molecular Therapy Methods and Clinical Development. 18, 189-198 (2020).
- Kleffman, K., et al. Melanoma-secreted Amyloid Beta Suppresses Neuroinflammation and Promotes Brain Metastasis. bioRxiv. , 854885 (2019).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Molecular Imaging and Biology. 13 (6), 1114-1123 (2011).
- Sil, P., Wong, S. W., Martinez, J. More than skin deep: autophagy is vital for skin barrier function. Frontiers in Immunology. 9, 1376 (2018).
- Chen, S., et al. Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell. 160 (6), 1246-1260 (2015).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163 (6), 1515-1526 (2015).
- Wang, T., et al. Identification and characterization of essential genes in the human genome. Science. 350 (6264), 1096-1101 (2015).
- Edgar, R., Domrachev, M., Lash, A. E. Gene Expression Omnibus: NCBI gene expression and hybridization array data repository. Nucleic Acids Research. 30 (1), 207-210 (2002).
- Lappalainen, I., et al. The European Genome-phenome Archive of human data consented for biomedical research. Nature Genetics. 47 (7), 692-695 (2015).
- Cerami, E., et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data. Cancer Discovery. 2 (5), 401-404 (2012).
- Grossman, R. L., et al. Toward a shared vision for cancer genomic data. New England Journal of Medicine. 375 (12), 1109-1112 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유