Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Una plataforma de descubrimiento robusta para la identificación de nuevos mediadores de la metástasis del melanoma
En este artículo
Resumen
Este artículo describe un flujo de trabajo de técnicas empleadas para probar nuevos mediadores candidatos de metástasis de melanoma y sus mecanismos de acción.
Resumen
La metástasis es un proceso complejo que requiere que las células superen barreras que solo se modelan de manera incompleta mediante ensayos in vitro . Se estableció un flujo de trabajo sistemático utilizando modelos in vivo robustos y reproducibles y métodos estandarizados para identificar nuevos actores en la metástasis del melanoma. Este enfoque permite la inferencia de datos en etapas experimentales específicas para caracterizar con precisión el papel de un gen en la metástasis. Los modelos se establecen mediante la introducción de células de melanoma modificadas genéticamente a través de inyecciones intracardíacas, intradérmicas o subcutáneas en ratones, seguidas de monitoreo con imágenes seriales in vivo . Una vez que se alcanzan los criterios de valoración preestablecidos, los tumores primarios y / o los órganos portadores de metástasis se extraen y procesan para diversos análisis. Las células tumorales se pueden clasificar y someter a cualquiera de varias plataformas "ómicas", incluida la secuenciación de ARN unicelular. Los órganos se someten a análisis de imagen e inmunohistopatológicos para cuantificar la carga general de metástasis y mapear su ubicación anatómica específica. Esta tubería optimizada, que incluye protocolos estandarizados para el injerto, monitoreo, recolección de tejidos, procesamiento y análisis, se puede adoptar para cultivos a corto plazo derivados de pacientes y líneas celulares humanas y murinas establecidas de varios tipos de cáncer sólido.
Introducción
La alta mortalidad asociada con el melanoma metastásico combinada con una incidencia creciente de melanoma en todo el mundo1 (un aumento estimado del 7,86% para 2025) requiere nuevos enfoques de tratamiento. Los avances en el descubrimiento de objetivos dependen de modelos reproducibles de metástasis, un proceso altamente complejo. A lo largo de los pasos de la cascada metastásica, las células de melanoma deben superar innumerables barreras para lograr la evasión del sistema inmune y la colonización de tejidos distantes2. La resiliencia y adaptabilidad de las células de melanoma surgen de multitud de factores, entre ellos su elevada carga mutacional genética3 y su origen en la cresta neural, que confieren una plasticidad fenotípica crucial 3,4,5. En cada paso, los programas transcripcionales permiten que las células de melanoma en metástasis cambien de un estado a otro en función de las señales de la diafonía con el microambiente, que comprende el sistema inmune6, el medio extracelular 7,8 y la arquitectura celular de las barreras físicas9 con las que entran en contacto. Por ejemplo, las células de melanoma escapan a la vigilancia inmune al regular a la baja la expresión de importantes factores secretos por tumores inmunocebadores6.
Los estudios describen un "nicho premetastático", en el que las células de melanoma secretan quimiocinas y citoquinas para preparar el órgano "objetivo" distante para la metástasis10. Estos hallazgos plantean preguntas importantes sobre el tropismo de los órganos de las células de melanoma metastásico y la ruta anatómica que toman para acceder a tejidos distantes. Después de la intravasación, se sabe que las células de melanoma hacen metástasis a través de los linfáticos (diseminación linfática) y los vasos sanguíneos (diseminación hematógena)2,11. Si bien la mayoría de los pacientes presentan enfermedad localizada, un pequeño subconjunto de casos se presenta con enfermedad metastásica a distancia y sin diseminación linfática (afectación negativa de los ganglios linfáticos)11, lo que sugiere la existencia de vías metastásicas alternativas para el melanoma.
Cuando colonizan un sitio metastásico, las células de melanoma experimentan adaptaciones epigenéticas y metabólicas12,13. Para acceder e invadir nuevos compartimentos, las células de melanoma emplean proteasas14 y modificaciones citoesqueléticas 11,15, que les permiten atravesar y crecer en su nueva ubicación. La dificultad para atacar las células de melanoma reside en la complejidad y el número de tales adaptaciones; por lo tanto, el campo debe hacer esfuerzos para recrear experimentalmente tantos pasos y adaptaciones como sea posible. A pesar de los numerosos avances en ensayos in vitro como organoides y cultivos 3D16,17, estos modelos solo recapitulan incompletamente la cascada metastásica in vivo.
Los modelos murinos han demostrado valor al lograr un equilibrio entre la reproducibilidad, la viabilidad técnica y la simulación de enfermedades humanas. Las células de melanoma implantadas intravascular, ortotópica y heterotópicamente a partir de xenoinjertos derivados del paciente o cultivos a corto plazo en ratones inmunocomprometidos o humanizados representan la columna vertebral del descubrimiento de dianas en el melanoma metastásico. Sin embargo, estos sistemas a menudo carecen de una restricción biológica crucial en la metástasis: el sistema inmunológico. Los modelos de metástasis de melanoma singénico que poseen esta restricción son relativamente escasos en el campo. Estos sistemas, desarrollados en ratones inmunocompetentes, incluyendo B16-F1018, la familia YUMM de líneascelulares 19, SM120, D4M321, RIM322 o más recientemente, las líneas celulares de melanoma RMS23 y M1 (Mel114433), M3 (HCmel1274), M4 (B2905)24 , facilitan la investigación del complejo papel de la respuesta inmune del huésped en la progresión del melanoma.
Aquí, se presenta una tubería para la identificación del objetivo de metástasis de melanoma. Con el aumento y la generación de conjuntos de datos ómicos a partir de cohortes de pacientes con melanoma, postulamos que los estudios que tienen la promesa más clínica son los que se derivan de la integración de big data, lo que lleva a un meticuloso interrogatorio funcional y mecanicista 25,26,27,28. Mediante el uso de modelos de ratón para estudiar objetivos potenciales en el proceso metastásico, se pueden tener en cuenta los eventos específicos in vivo y las interacciones tisulares, lo que aumenta la probabilidad de traducción clínica. Se describen múltiples métodos para cuantificar la carga metastásica, proporcionando datos complementarios sobre los resultados de cualquier experimento dado. Se describe un protocolo para el aislamiento unicelular de tumores en varios órganos para ayudar a la caracterización imparcial de la expresión génica en células metastásicas, que puede preceder a la secuenciación de ARN unicelular o a granel.
Protocolo
NOTA: Los procedimientos de animales involucrados en el siguiente protocolo fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Nueva York (IACUC). Todos los procedimientos se llevan a cabo en instalaciones aprobadas por la Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC). La Figura 1 muestra el enfoque experimental general.
1. Cultivos a corto plazo de melanoma derivado del paciente (STC)
- Coloque el tejido en una placa de Petri de 60 mm con 1 ml de RPMI completo (RPMI 1640 suplementado con suero bovino fetal (FBS) al 10%, 2 mM de L-glutamina, 1 mM de piruvato de sodio, 1 solución de aminoácidos no esenciales MEM y penicilina (100 UI / ml) / estreptomicina (100 μg / ml)).
NOTA: Para aumentar la proporción de células tumorales, si es necesario, diseccione y extraiga el tejido que rodea el tumor en la placa de Petri, bajo un microscopio, utilizando instrumentos quirúrgicos estériles. - Corte finamente el tejido fresco con cuchillas de afeitar esterilizadas en cubos de 1-2 mm. Agregue 4 ml de RPMI completo y pipetee el contenido de la placa hacia arriba y hacia abajo 5-10 veces con una pipeta serológica de 10 ml.
- Transfiera la suspensión celular a un tubo cónico de polipropileno de 15 ml y haga girar las células hacia abajo (180 × g durante 5 minutos a 4 °C). Aspire el sobrenadante, resuspenda el pellet celular en 1 ml de medio fresco y transfiera la suspensión a un matraz de cultivo tisular de25 cm 2 .
- Para ayudar a que los fragmentos de tejido se adhieran a la parte inferior, coloque el matraz inclinado en un ángulo de 20 ° -30 ° en una incubadora de cultivo de tejidos a 37 ° C, 5% de CO2 durante 20 min.
- Coloque el matraz plano para permitir que el medio cubra el tejido y verifique el estado del cultivo diariamente. Divida las células cuando alcancen el 90-100% de confluencia. Mantenga las culturas a corto plazo en un número de pasaje "bajo".
NOTA: Los STC se establecerán aproximadamente 2 meses después del aislamiento y cultivo celular, aunque la línea de tiempo real varía entre las muestras y los tipos de tumores. Después de 10 a 14 pasajes, las líneas celulares alcanzan el 100% de pureza, conteniendo solo células de melanoma29. El umbral del número de paso se determina empíricamente mediante la observación de cambios en la morfología celular, el tiempo de duplicación y el comportamiento in vivo. Para preservar la heterogeneidad y otras características del tumor original, no divida las células más de 1:5. - Tras el establecimiento de un STC y con cualquier modelo de línea celular que se inyectará en animales como se describe en pasos posteriores, transduzca las células con un reportero.
NOTA: Una etiqueta fluorescente (por ejemplo, proteína fluorescente roja (RFP), proteína fluorescente verde (GFP)), por ejemplo, permite obtener imágenes de inmunofluorescencia ex-vivo y clasificar las células tumorales mediante clasificación celular activada por fluorescencia (FACS). La luciferasa permite la obtención de imágenes de bioluminiscencia in vivo , una herramienta útil para el seguimiento de la progresión experimental (sección 4).
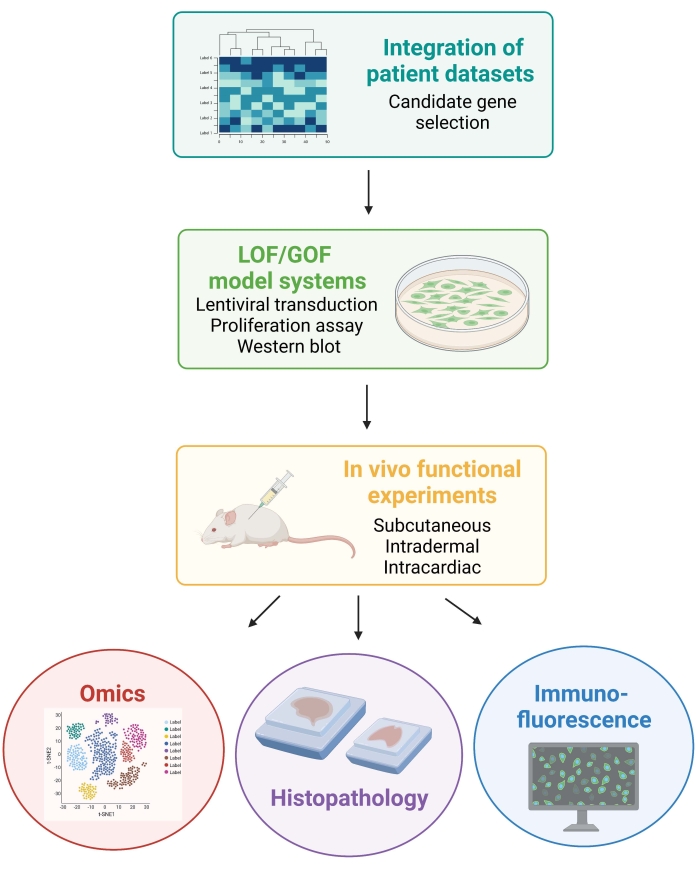
Figura 1: Esquema que ilustra el flujo de trabajo descrito, desde la integración de datos de pacientes hasta la generación y análisis de datos in vivo de ratones. Abreviaturas: LOF = pérdida de función; GOF = ganancia de función. Haga clic aquí para ver una versión más grande de esta figura.
2. Implantación de xenoinjerto
NOTA: Los procedimientos experimentales descritos aquí se llevan a cabo en ratones que tienen sistemas inmunes adaptativos e innatos deteriorados, NOD.Cg-PrkdcscidIl2rgtm1Wjl / SzJ (NSG) ratones; o en ratones que carecen solo de inmunidad adaptativa, como los ratones atímicos/desnudos (NU/J) deficientes en células T. Los animales son de sexo masculino, de 8 a 10 semanas de edad. Las mujeres a menudo exhiben una alta incidencia de metástasis gonadales tras la inyección intracardíaca de células tumorales, lo que reduce su supervivencia.
- Para inyecciones subcutáneas e intradérmicas, prepare una suspensión celular 1:1 mezclando una parte de las células suspendidas en 1x solución salina tamponada con fosfato (DPBS) de Dulbecco con una parte de sustrato de matriz extracelular (EMS) descongelado, y manténgala en hielo a 4 °C. Para inyecciones intravasculares (intracardíacas, intracarótidas, retroorbitales, venas de la cola o esplénicas), suspenda las células solo en DPBS.
NOTA: El volumen apropiado para las inyecciones intradérmicas debe mantenerse lo más bajo posible (30 μL). Para inyecciones subcutáneas, el volumen inyectado puede llegar hasta 150 μL, y para inyecciones intravasculares, hasta 250 μL (según el peso del animal). Agregue a la suspensión celular final un volumen adicional de inyección del 10-30%, según la cantidad inyectada y la jeringa utilizada para tener en cuenta el volumen muerto dentro de la punta deslizante y el de la aguja (por ejemplo, una jeringa de tuberculina de 1 ml con una aguja de 30 G y 25 mm tiene un volumen muerto de 100 μL). - Realizar un piloto para caracterizar el comportamiento de las líneas celulares en uso y la línea de tiempo de progresión tumoral in vivo. Para inyecciones intradérmicas, comience inyectando 1,000 hasta 50,000 células / 30 μL. Para inyecciones subcutáneas, comience inyectando 10,000 hasta 2 × 106 células / 150 μL. Para las inyecciones intravasculares (intracardíacas, intracarótidas, retroorbitales y esplénicas), comience inyectando 50.000 células/150 μL.
NOTA: Las inyecciones intravasculares predisponen a los animales a eventos embólicos, ya sea introduciendo aire en el sistema circulatorio o utilizando un número excesivo de células que ocluyen los pequeños vasos. Mezcle bien la suspensión celular para evitar aglomeraciones. Cebar la jeringa antes de cargar la suspensión celular. Retire las burbujas de aire dentro de la jeringa. Mantenga la suspensión/jeringas celulares en hielo hasta el momento de la carga y la inyección. - Administrar anestesia por inhalación. Ajuste el regulador de nivel de oxígeno entre 1-2 L/min. Coloque al animal en la cámara de inducción con el vaporizador de isoflurano al 2,5-5% para la inducción y al 1,5-3% para el mantenimiento.
NOTA: Controle la respiración y la frecuencia cardíaca del animal mientras se encuentra en la fase de inducción de la anestesia. No deje al animal desatendido. No controle más de un animal simultáneamente. Titula la cantidad de anestesia al peso del animal. - Mueva al animal de la cámara de inducción al cono de la nariz. Aplique ungüento oftálmico de vaselina estéril en los ojos del animal para prevenir la sequedad corneal durante el procedimiento.
- Afeitar el sitio del procedimiento con una hoja de afeitar recta inclinada en un ángulo de 30 °. Limpie la piel del área del procedimiento con hisopos de alcohol isopropílico al 70%. Antes de cualquier otro paso, evalúe un nivel suficiente de anestesia por reflejo de pedal.
- Para las inyecciones intradérmicas, realice todo el procedimiento dentro de un gabinete de bioseguridad para mantener las condiciones asépticas.
- Anestesiar y afeitar al animal como se describe en los pasos 2.3-2.5.
- Agarre y retraiga la piel hacia atrás contra la trayectoria de la puñalada con aguja. Usando una aguja de jeringa de insulina de 31 G, de 6 mm de largo, sostenida en un ángulo agudo, perfore suavemente la piel con el bisel hacia arriba.
- Siente la liberación de presión en la punta de la aguja. Avance suavemente para permanecer dentro del compartimento intradérmico y no pase a través de toda la profundidad de la piel hacia el subcutis. Crucial: Si uno se desliza en el espacio subcutáneo, retire la aguja, cambie el área de inyección y vuelva a insertar la aguja. Inyecte lentamente todo el volumen (30 μL) de suspensión celular hasta que se observe una roncha en forma de cúpula.
NOTA: Los bajos volúmenes de inyección inducirán menos disección de las capas de la piel y menos distorsión arquitectónica. - Mantenga la aguja y cuente hasta 5.
NOTA: EMS se vuelve viscoso a temperatura corporal, lo que ayuda a evitar el reflujo a través de la herida punzante de la aguja. - Retire la aguja y aloje al animal en una jaula en una almohadilla caliente para recuperarse. Devolver al animal a la jaula del vivero después de recuperar la conciencia, cuando sea esternal y ambulatorio.
NOTA: Monitorear al animal continuamente durante todos los procedimientos descritos en este protocolo. No deje al animal desatendido ni monitoree a más de un animal simultáneamente. - Monitoree la progresión del crecimiento del tumor, la pérdida de peso y el estado de salud general junto con el personal veterinario diariamente en la fase de crecimiento inicial y más intensamente, si es necesario, después de que los animales comiencen a perder peso. Durante estas sesiones de monitoreo: pese a los animales y trace una tabla para monitorear la pérdida de peso, y verifique si hay signos de ulceración tumoral, neurológicos, locomotores y / o signos de comportamiento (letargo, falta de aseo, baja ingesta de alimentos o agua).
NOTA: Sacrificar a los animales inmediatamente después de observar signos de enfermedad avanzada (más del 20% de pérdida de peso, una puntuación de condición corporal de <2, niveles de actividad extremadamente reducidos, parálisis o convulsiones). Utilice el método de eutanasia aprobado por el IACUC de la institución (por ejemplo, se utiliza una cámara automatizada de CO2 de mesa para exponer a los animales a CO2 durante 15 minutos, seguido de un método secundario de eutanasia, ya sea dislocación cervical, decapitación o neumotórax inducido bilateralmente mediante la incisión de la caja torácica). - Tome medidas con pinzas y use las dimensiones de longitud (L) y anchura (W) del tumor para calcular el volumen (V) con la fórmula:
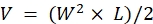
- Para inyecciones subcutáneas:
- Realizar todo el procedimiento dentro de un gabinete de bioseguridad para mantener condiciones asépticas26,27.
- Anestesiar y afeitar al animal como se describe en los pasos 2.3-2.5.
- Usando una aguja de jeringa de insulina de 28 G a 31 G, de 6 mm de longitud, sostenida en un ángulo agudo, perfore suavemente la piel con el bisel hacia arriba. Sienta la liberación de presión en la punta de la aguja dos veces mientras pasa por la epidermis, la dermis y la hipodermis.
NOTA: La segunda vez que se siente una liberación de presión en la punta de la aguja indica que se ha alcanzado el compartimento subcutáneo. - Inyecte lentamente todo el volumen (30-150 μL) de suspensión celular hasta que se observe una roncha alargada en forma de elipse. Mantenga la aguja y cuente hasta 5. Cuente hasta 10 para volúmenes más grandes (más de 50 μL).
NOTA: EMS se vuelve viscoso a temperatura corporal, lo que ayuda a evitar el reflujo a través de la herida punzante de la aguja. - Retire la aguja y aloje al animal en una jaula en una almohadilla caliente para recuperarse. Devolver al animal a su jaula de vivero después de recuperar la conciencia, cuando sea esternal y ambulatorio.
NOTA: Durante el monitoreo postprocedimiento, observe cualquier signo de complicaciones (frecuencia respiratoria baja, sangrado, recuperación lenta) y aborde adecuadamente. Si no se observa ninguna mejoría, proceda a los procedimientos de eutanasia humana descritos en la NOTA del paso 2.6.6. - Monitoree al animal para detectar el crecimiento del tumor, la pérdida de peso y el estado de salud general como se describe en los pasos 2.6.6-2.6.7.
- Para inyecciones intracardíacas:
- Realizar todo el procedimiento dentro de un gabinete de bioseguridad para mantener condiciones asépticas26,30.
- Anestesiar al animal como se describe en los pasos 2.3-2.4.
- Transfiera el animal a la plataforma calentada de la máquina de ultrasonido y asegúrelo con cinta hipoalergénica al cono de la nariz.
- Afeitarse el tórax con una hoja de afeitar recta inclinada en un ángulo de 30°. Limpie la piel del área de procedimiento con 3 aplicaciones de povidona-yodo al 10% alternando con 3 aplicaciones de alcohol isopropílico.
- Antes de cualquier otro paso, evalúe un nivel suficiente de anestesia por reflejo de pedal. Aplique gel de ultrasonido en el sitio del procedimiento.
- Capture la ventana cardíaca con la sonda de ultrasonido. Coloque la sonda de ultrasonido en el centro del tórax en el lado izquierdo del animal para capturar una ventana horizontal orientada a obtener una vista transversal (eje corto) del ventrículo izquierdo. Asegurándose de que el eje largo de la sonda mire hacia arriba, fije la sonda en un ángulo de 50 ° y la plataforma calentada en un ángulo de 20 °. Bloquee la sonda y el marco de soporte en su posición.
- Extraiga la suspensión celular mientras trabaja dentro del gabinete de bioseguridad en una jeringa de tuberculina de 1 ml con una aguja de 30 G y 25 mm. Retire las burbujas de aire en la jeringa.
NOTA: Es importante crear y mantener una suspensión de una sola célula mientras las células se procesan e inyectan. Eliminar las burbujas de aire es un paso importante para evitar la embolia aérea. Un sistema de jeringa-aguja bien cebado evitará muertes evitables en el grupo experimental. Siempre extraiga más volumen en la jeringa del que se inyectará. El volumen adicional ayudará a eliminar el aire inyectando parte de la suspensión celular de nuevo en un tubo de 1,5 ml. - Bloquee la jeringa en el inyector estereotáctico. Bajo guía de ultrasonido, avance la aguja a través de la pared torácica hacia el ventrículo izquierdo del corazón. Inyecte lentamente todo el volumen (100-250 μL) de suspensión celular.
- Retire la aguja y aloje al animal en una jaula en una almohadilla caliente para recuperarse. Devolver al animal a su jaula de vivero después de recuperar la conciencia, cuando sea esternal y ambulatorio. Monitoree al animal para detectar el crecimiento del tumor, la pérdida de peso y el estado de salud general como se describe en el paso 2.6.6.
- Para inyecciones intracarotídeas:
- Realice todo el procedimiento en una superficie debidamente desinfectada para ayudar a mantener las condiciones asépticas30.
- Anestesiar al animal con un cóctel de ketamina (100 mg/kg) y xilazina (10 mg/kg) mediante inyección intraperitoneal con una jeringa de insulina, aguja de 28 G. Aplique ungüento oftálmico de vaselina estéril en los ojos del animal para prevenir la sequedad corneal durante el procedimiento.
- Afeitar el área del procedimiento con una hoja de afeitar recta inclinada en un ángulo de 30°. Antes de cualquier otro paso, evalúe un nivel suficiente de anestesia por reflejo de pedal.
- Coloque al animal bajo un microscopio estereoscópico en una almohadilla de calentamiento. Limpie la piel del área de procedimiento con 3 aplicaciones de povidona-yodo al 10% alternando con 3 aplicaciones de alcohol isopropílico.
- Póngase equipos estériles de protección personal (EPP) y guantes estériles. Prepare el campo estéril colocando una cortina estéril sobre el cuerpo del animal.
NOTA: Si la cortina estéril no tiene un orificio apropiado para el tamaño y la ubicación de la incisión, doble la cortina por la mitad y use tijeras Metzenbaum para cortar el orificio del tamaño apropiado en el medio de la cortina estéril. - Use un bisturí o unas tijeras Iris para incisar la piel desde la mitad del cuello hasta el esternón. Con dos pinzas de microcirugía, disecciona sin rodeos las 2 glándulas salivales submandibulares en el plano de la línea media. Use un cauterio eléctrico para la hemostasia, si es necesario.
- Diseccionar la fascia que rodea la arteria carótida común (CCA) desde el manubrio hacia la bifurcación y continuar medialmente para liberar la pared posterior de la carótida externa. Recorte la arteria carótida externa (ECA) temporalmente antes de inyectarse.
NOTA: Al diseccionar alrededor de la circunferencia de la CCA, se debe tener cuidado de no dañar el nervio vago (se encuentra lateral a la arteria). - Cargue la suspensión celular en una jeringa de 1 ml con una aguja de 33 G y 15 mm.
- Pase dos ligaduras 7-0 bajo el CCA y realice un nudo de instrumento suelto para cada una de las dos ligaduras. Utilice un clip de recipiente a presión de 5 mm y 10 G y recorte temporalmente el ECA. Atar la ligadura proximal; luego, ate la ligadura distal libremente (junto a la bifurcación del CCA). Use el asa distal más tarde para controlar el sangrado después de la inyección.
- Usando la jeringa con una aguja de 33 G, 15 mm, perfore suavemente el CCA con el bisel de la aguja hacia arriba y en un ángulo agudo. Inyecte lentamente todo el volumen (50-150 μL) de suspensión celular.
- Agarre el asa distal con las pinzas y levántela mientras retira la aguja para ocluir la luz del CCA y detener el sangrado. Cambie la jeringa con una pinza #7 Jewelers y ate el lazo distal.
- Lance otro nudo de instrumento en la ligadura distal y retire el clip del vaso de la ECA. Controle el campo quirúrgico para detectar sangrado y cauterice cualquier vaso sangrante antes del cierre. Use un dispositivo de grapado de 9 mm para cerrar la piel del animal y coloque al animal en una almohadilla tibia para recuperarse.
NOTA: Retire las grapas 7-10 días después de la cirugía. - Administrar medicación analgésica subcutánea-buprenorfina (0,3 mg/ml) cada 12 h durante 72 h después de la cirugía a una concentración de 0,1 mg/kg.
NOTA: Alternativamente, considere el uso de un medicamento analgésico de liberación prolongada, que requiere 1 dosis cada 72 h. - Devolver al animal a su jaula de vivero después de recuperar la conciencia, cuando sea esternal y ambulatorio. Monitoree a los animales después de la operación diariamente para detectar signos de infección o dolor en el sitio quirúrgico, estado de salud general y complicaciones.
NOTA: Los animales que no se recuperan bien de la cirugía de supervivencia pueden recibir dosis adicionales de analgésicos y serán sacrificados humanamente si no se recuperan completamente a las 72 horas posteriores a la cirugía. - Monitoree al animal para detectar el crecimiento del tumor, la pérdida de peso y el estado de salud general como se describe en el paso 2.6.6.
- Para inyecciones retroorbitales:
NOTA: Utilice esta técnica como una alternativa a las inyecciones de venas de la cola cuando el operador esté capacitado y sea competente en esta técnica y cuando exista una fuerte justificación científica. Las suspensiones celulares administradas por esta vía pueden inducir el crecimiento tumoral en el espacio retroorbital; por lo tanto, se debe considerar cuidadosamente los riesgos y beneficios al elegir esta técnica. Por ejemplo, para aprovechar la conexión circulatoria directa del seno venoso retroorbital con las venas intracerebrales a través de anastomosis, seleccione este método cuando la formación de tumores cerebrales haya fallado utilizando otras vías de inyección.- Realice todo el procedimiento dentro de un gabinete de bioseguridad para mantener las condiciones asépticas. Póngase EPI y guantes estériles.
- Anestesiar al animal como se describe en los pasos 2.3-2.4.
NOTA: Para este procedimiento, no aplique ungüento oftálmico de vaselina estéril en los ojos del animal porque esto impedirá la inyección; aplicar sólo gotas anestésicas locales. - Cargue la suspensión celular en una jeringa de insulina con una aguja de 28-31 G, 6 mm.
- Con el animal en posición prona, retraiga los párpados hasta que el ojo sobresalga. Aplique 1 gota de anestésico local en el ojo en el lado que se somete al procedimiento.
- Inserte la aguja en un ángulo de 30-45 ° entre el ojo y el epicanto medial con el bisel hacia abajo. Inyecte la suspensión celular (10-150 μL) lentamente.
NOTA: Los movimientos más lentos evitan daños en el ojo y el reflujo de la inyección. - Realice los pasos descritos en 2.7.5-2.7.6.
- Para inyecciones esplénicas:
- Realizar todo el procedimiento dentro de un gabinete de bioseguridad para mantener condiciones asépticas31. Póngase EPI estéril y guantes estériles.
- Anestesiar y afeitar al animal como se describe en los pasos 2.3-2.5.
- Coloque al animal en una posición reclinada lateral derecha. Limpie la piel del área del procedimiento con 3 aplicaciones de povidona-yodo al 10% alternando con 3 aplicaciones de alcohol isopropílico y prepare el campo quirúrgico como se describe en el paso 2.9.5.
- Usando tijeras Metzenbaum o un bisturí, haga una incisión de 1 cm en el flanco izquierdo de la pared abdominal seguida de una incisión en el peritoneo.
NOTA: El bazo se verá a través de la pared abdominal translúcida después de hacer la incisión en la piel. Realice la incisión peritoneal exactamente en este sitio. - Exponga el bazo y el hilio esplénico a través de la incisión. Usando una aguja de jeringa de insulina de 28-31 G, de 6 mm de longitud, perfore suavemente el bazo con el bisel de la aguja hacia arriba y en un ángulo agudo.
NOTA: Si la herida punzante sangra, cauterice el sitio para limitar el sangrado y el reflujo. - Inyecte lentamente todo el volumen (50-100 μL) de suspensión celular. Retire la aguja. Coloque una pequeña gasa en el bazo y aplique presión con un fórceps. Sujete el bazo ligeramente entre la gasa con pinzas finas para mosquitos y espere 15 minutos.
- Realice una esplenectomía atando el hilio esplénico con una sutura de seda 3-0 o 4-0, cauterizando los vasos si es necesario. Cierre el peritoneo con una sutura absorbible de polidioxanona (PDS) o ácido poliglicólico 5-0.
- Realice los pasos descritos en los pasos 2.7.5 a 2.7.6.
NOTA: Los animales que presenten complicaciones hemorrágicas o que no se hayan recuperado completamente 72h después de la cirugía deben ser sacrificados humanamente. Recuerda que el bienestar de los ratones es la prioridad en todo momento.
3. Cirugía de supervivencia por etapas (SSS)
- Sobre la base de las conclusiones experimentales del paso 2.2, determinar el tiempo adecuado para la cirugía de supervivencia. Dependiendo de la línea celular y la hipótesis experimental, seleccione un punto de tiempo anterior para la resección tumoral (a un volumen tumoral = 150 mm3) o un punto de tiempo posterior (a un volumen tumoral = 500 mm3)26.
NOTA: El límite de volumen tumoral es de 1.500 mm3 cuando la carga tumoral es lo suficientemente alta como para ser perjudicial para el bienestar del animal y predispone a complicaciones. - Anestesiar y afeitar al animal como se describe en los pasos 2.3-2.5.
NOTA: Todo el procedimiento se realiza dentro de un gabinete de bioseguridad. - Limpie la piel del área del procedimiento con 3 aplicaciones de povidona-yodo al 10% alternando con 3 aplicaciones de alcohol isopropílico y prepare el campo quirúrgico como se describe en el paso 2.9.5.
- Usando tijeras Iris o un bisturí, incise la piel, manteniendo un margen de resección de 5-7 mm desde el borde del tumor.
NOTA: El margen para la resección depende de la capacidad del tumor para diseminarse localmente. Para tumores agresivos, aumente el margen de resección mientras se asegura de que quede suficiente piel para realizar el cierre de la herida. - En el caso de tumores intradérmicos, reseque el tumor junto con la piel circunferencial.
- Para los tumores subcutáneos, diseccionar y extirpar el tumor debajo de la piel.
NOTA: Si el tumor invade el peritoneo y/o la piel, resecarlo en bloque con el tumor y cerrar el peritoneo con 5-0/4-0 PDS o suturas absorbibles de ácido poliglicólico. - Cierre la herida con el dispositivo de grapado de 9 mm.
NOTA: Retire las grapas 7-10 días después de la cirugía. Administre medicamentos analgésicos y coloque al animal en una almohadilla tibia para recuperarse. Continuar administrando medicación analgésica durante 72 h después de la cirugía, una vez cada 12 h según el paso 2.9.13. Los animales con complicaciones hemorrágicas o que no han recuperado la plena conciencia después de la cirugía deben ser sacrificados humanamente. - Una sola casa del animal en una jaula, en una almohadilla caliente para recuperarse. Devolver al animal a la jaula del vivero después de recuperar la conciencia, cuando sea esternal y ambulatorio.
- Continúe monitoreando al animal después de la cirugía para detectar recurrencias locales, pérdida de peso, signos neurológicos, locomotores y / o de comportamiento (letargo, falta de aseo, baja ingesta de alimentos o agua) y estado de salud general.
4. Imágenes in vivo (Figura 2A)
- Administrar sustrato de D-luciferina (150 mg/kg) a animales mediante inyección intraperitoneal con una jeringa de insulina de 1 ml, aguja de 28 G.
NOTA: Las células tumorales deben ser transducidas de manera estable con la luciferasa cDNA. - Induzca la anestesia como se describe en los pasos 2.3-2.4, 6 min después de la inyección de sustrato de D-luciferina.
- Realizar imágenes utilizando un escáner de imágenes de bioluminiscencia (BLI) (sistema de imágenes in vivo )26.
- Mueva al animal dentro de la cámara de imágenes y dentro del cono de la nariz. Imagene hasta 5 animales simultáneamente, dependiendo de la capacidad del sistema de imágenes.
- Inicie el instrumento presionando inicializar. Establezca el ajuste de tiempo de exposición en automático (1-120 s).
- Capture una imagen en blanco para restar cualquier fondo si es necesario. Haga clic en adquirir y guarde la imagen una vez completada la secuencia de adquisición.
- Coloque al animal de nuevo en una jaula, que se sienta con el 50% del área de la superficie de la base sobre una almohadilla de calentamiento para recuperarse de la anestesia. Devolver al animal a la jaula del vivero después de recuperar la conciencia, cuando sea esternal y ambulatorio.
- Para el análisis de datos en el mismo software de imágenes in vivo con el que se capturaron las imágenes, navegue hasta la carpeta donde se guardan las imágenes y abra las imágenes de todos los ratones pertenecientes al experimento a la vez.
NOTA: El análisis de una imagen a la vez no permitirá la normalización entre grupos. - Establezca las unidades en radiancia (no en recuentos). Asegúrese de que la casilla de verificación que indica individuo no esté marcada, ya que esto impedirá la normalización de la señal entre grupos.
- Con la herramienta de dibujo Región de interés (ROI ), dibuje ROI circulares para la región del cerebro y ROI rectangulares para el cuerpo. Tenga cuidado de excluir los oídos y la nariz del ROI cerebral, ya que tienden a emitir luminiscencia inespecífica. Para minimizar el sesgo en este proceso, dibuje ROI solo en las fotografías de los ratones, sin la señal luminiscente superpuesta.
- Seleccione Medir ROI para cuantificar la señal y exportar los datos a una hoja de cálculo. Analice las diferencias entre los grupos trazando el flujo luminiscente total (p/seg/cm2/sr) en las regiones del cuerpo de interés.
NOTA: Para evaluar las diferencias entre los grupos en el tropismo cerebral específicamente, calcule la relación entre la señal cerebral y la señal corporal para cada ratón. Esto controla la variación entre el ratón en la carga tumoral general y las diferencias en los niveles de expresión de luciferasa entre los grupos experimentales.
5. Resonancia magnética ex vivo
- Realice una resonancia magnética ex vivo inmediatamente después de la eutanasia. Alternativamente, extraiga los órganos de interés, fíjelos en formalina durante un máximo de 72 h y realice la toma de imágenes en un punto de tiempo posterior.
- Adquiera las imágenes con un sistema de micro-MRI de 7 Tesla (7-T) (300 MHz) equipado con una consola de RMN y un imán de orificio horizontal de ebullición cero o equipo similar.
NOTA: La necesidad de un inserto de bobina de gradiente blindado activamente con la compensación correcta de rendimiento es crucial. Debe proporcionar una linealidad de gradiente de al menos 50 mm de volumen esférico dinámico (DSV) para cubrir el conjunto de muestras examinadas simultáneamente sin distorsión geométrica. La combinación de resistencia de gradiente (que oscila entre 440 y 750 mT / m) y el ciclo de trabajo que permite corrientes de CC simultáneas máximas que van desde 3 x 30 A a 3 x 87 A permitirá un rendimiento de imagen adecuado. El inserto de bobina de gradiente utilizado (consulte la Tabla de materiales) permite el siguiente rendimiento: 660 mT / m, tiempo de elevación de 130 μs, 3 x 87 A y un DSV = 80 mm. - Realice los escaneos con una bobina de radiofrecuencia comercial de cuerpo de ratón entero polarizada circularmente (OD = 59 mm, ID = 38 mm, L = 40 mm) sintonizada a 300.16 MHz, la frecuencia de larmor de protones 1H.
NOTA: Esta sonda de rf permite la adquisición de conjuntos de datos 3D con resolución isotrópica submilimétrica (<150 μm) durante escaneos nocturnos que abarcan 8-12 h. - Detectar la carga tumoral mediante múltiples secuencias30.
NOTA: La señal hiperintensa detectada por una secuencia de imágenes rápidas con ecos reenfocados (RARE) ponderada en T2 reconoce el edema que rodea a los tumores. - Realizar la secuencia RARE 3D con los siguientes parámetros de adquisición: resolución isotrópica [120 μm]3 ; tiempo de adquisición 5 h, 27 min; tiempo de repetición (TR) = 500 ms; espaciado de eco (ES) = 12,7 min; Factor turbo TFx = 12; tiempo de eco efectivo (TEeff) = 76,2 ms; ancho de banda (BW) = 75 KHz; Tamaño de la matriz = 2843; campo de visión (FOV) = [4,0 mm]3; número de promedios (Nav) = 6.
- Detectar metástasis utilizando los siguientes parámetros.
- Para metástasis pigmentadas con brillo de señal, utilice una secuencia de eco de gradiente 3D ponderada en T1 con los siguientes parámetros: resolución isotrópica [120 μm]3 ; tiempo de adquisición 2 h, 41 min; TR = 20 ms; tiempo de eco (TE) = 4,0 ms; ángulo de giro (FA) = 18°; BW = 75 KHz; Tamaño de la matriz = 2843; FOV = [34,0 mm]3; Nav = 6.
- Para metástasis no pigmentadas y/o hemorrágicas, utilice una señal de hipnoticia al adquirir bajo una secuencia de eco multigradiente (MGE) ponderada por T2* (3D MGE, [120 μm]3 resolución isotrópica; tiempo de adquisición 3 h, 35 min; TR = 40 ms; TE = 3,6 ms; ES = 3,2 ms; 4 ecos; FA = 20°; BW = 100 kHz; Tamaño de la matriz = 2843; FOV = (34,0 mm)3; Nav = 4.
- Utilice las 3 secuencias para cuantificar la carga tumoral.
- Referencia cruzada de las áreas tumorales identificadas durante el análisis con secciones histológicas para garantizar la precisión. Véanse las secciones 7 y 8.
6. Procesamiento de tejidos para la secuenciación de ARN unicelular o a granel
- Sacrificar al animal utilizando cualquier método aprobado por la IACUC de la institución. Consulte uno de los procedimientos descritos en la NOTA del paso 2.6.6.
- Diseccionar los órganos de interés y colocarlos en pocillos separados de una placa que contenga la Solución de Sal Equilibrada de Hank (HBSS) en hielo. Trabaje de manera expedita y mantenga el tejido en hielo en todo momento para maximizar la viabilidad celular.
NOTA: Los siguientes pasos son específicos para el procesamiento cerebral. Ajuste el tipo de colagenasa al tejido específico, según sus necesidades. - Prepare una placa de 6 pocillos con 3 ml de HBSS en cada pozo.
- Para visualizar y ayudar a guiar aún más la disección, use un microscopio de fluorescencia e identifique las áreas marcadas.
- Diseccionar las áreas fluorescentes y colocar los fragmentos de tejido en la placa de 6 pocillos (1 fragmento por pozo si se van a analizar focos metastásicos individuales o múltiples fragmentos de un órgano si se van a analizar múltiples metástasis en el mismo órgano). Use cuchillas de afeitar estériles para picar el tejido en fragmentos lo más pequeños posible (sin gastar más de 1-2 minutos en este paso para cada muestra).
NOTA: Limitar el tiempo de procesamiento de los tumores ayuda a preservar la viabilidad celular. - Aspirar y transferir el contenido de cada pozo a un tubo cónico de 15 ml.
NOTA: Cortar la punta de una punta de pipeta de 1.000 μL para facilitar la transferencia de fragmentos más grandes. - Agregue 1 ml de HBSS al pozo y asegúrese de que los fragmentos / células de tejido restantes se transfieran al tubo de 15 ml, que contendrá un volumen final de 4 ml. Añadir 50 μL de colagenasa tipo I (40 mg/ml) y 12,5 μL de DNasa I (2.000 unidades/ml) a cada tubo.
- Coloque los tubos cónicos en un baño de agua calentado a 37 °C durante 45 min. Vórtice brevemente los tubos cónicos cada 5 min.
- Prewet un colador de 70 μm con HBSS. Use el extremo tapado de un tubo de microcentrífuga esterilizado o la parte plástica de un émbolo de jeringa y muela el tejido homogeneizado a través de un colador de 70 μm en un nuevo tubo cónico de 50 ml.
NOTA: La humectación previa de los coladores con tampón HBSS o FACS facilita el esfuerzo. - Lave el colador con 1 ml de HBSS. Prewet un colador de 40 μm con HBSS. Filtre cada muestra nuevamente a través de un colador de 40 μm en un nuevo tubo cónico de 50 ml. Agregue 1 ml de FBS al colador de 40 μm para lavarlo. Mantenga los tubos cónicos en hielo todo el tiempo.
- Llene el tubo cónico a 50 ml con DPBS helado. Girar hacia abajo las células (180 × g durante 10 min a 4 °C). Deseche el sobrenadante, teniendo cuidado de no perder la bolita celular.
NOTA: Para muestras de cerebro, resuspender las células en 2,5 ml de solución de separación de densidad al 38% (diluir en HBSS y almacenar a temperatura ambiente (RT)). Transferencia a tubos FACS de 5 ml. Girar durante 20 min a 800 × g. Corta la punta de una punta de pipeta de 1.000 μL y retira la capa de grasa superior. No deje grasa en las paredes de los tubos. Si queda grasa, gire hacia abajo nuevamente y repita el proceso. Este es un paso crítico . Retire el resto de la fase líquida (el pellet será translúcido y difícil de visualizar). - Resuspend las células en 1 mL de tampón de lisis de glóbulos rojos (RBC) e incubar durante 60 s en RT. Apague la solución de lisis agregando 20 mL de DPBS.
- Gire hacia abajo las células a 180 × g durante 10 min a 4 °C. Retire el sobrenadante y resuspenda las células en 2 ml de tampón FACS (5% FBS en DPBS).
- Proceda con la clasificación de las células marcadas y / o la preparación de la biblioteca para la secuenciación de ARN a granel o de una sola célula.
NOTA: Las células se pueden hilar, congelar y almacenar a -80 ° C antes del aislamiento de ARN para ARN a granel.
7. Perfusión de tejidos animales y preparación para análisis inmunohistológicos
- Anestesiar al animal con una sobredosis de ketamina (300 mg/kg) y xilazina (30 mg/kg) mediante inyección intraperitoneal con una jeringa de insulina y una aguja de 28 G.
- Exponga el corazón mediante disección macroscópica y haga una incisión en la aurícula derecha. Sostenga el corazón suavemente en su lugar con pinzas largas y curvas mirando hacia arriba.
NOTA: La formalina y el paraformaldehído (PFA) son carcinógenos. Lea la Hoja de datos de seguridad (SDS), evite la exposición a los humos y use el EPP adecuado. - Usando una jeringa de 10 ml con una aguja de 22 G y 22 mm, inyecte 10 ml de DPBS seguido de 10 ml de PFA al 4% en el ventrículo izquierdo.
- Proceda a extraer los órganos y cargarlos en casetes histológicos preetiquetados. Coloque los casetes en un recipiente del tamaño adecuado que acomode suficiente fijador (formalina) para cubrir los tejidos.
NOTA: Idealmente, el volumen fijador debe ser de 5 a 10 veces el volumen de los tejidos. - Fijar los órganos dentro de los casetes histológicos en formalina al 10% durante 48-72 h. Deseche el 10% de formalina y lave los casetes dos veces con 1x DPBS.
- Comience el proceso de deshidratación sumergiendo los casetes en etanol al 70% durante 2 h. Continúe sumergiendo los casetes sucesivamente en concentraciones crecientes de etanol: 80%, 95%, 100% durante 1 h cada uno. Cambie la solución al 100% dos veces después de 1,5 h. Sumergir los casetes en xileno durante 1,5 h y realizar tres cambios de la solución.
- Inserte los casetes en cera de parafina a 58-60 °C. Secciona los bloques de parafina. Proceda a la tinción de hematoxilina y eosina (H&E) o inmunohistoquímica.
- Para identificar las células de melanoma, use cualquiera de estos marcadores o un panel: S100, Melan-A, HMB-45, Tirosinasa, MITF. Cuando sea posible, use la tinción de proteína del aparato mitótico nuclear (NuMA), ya que es un marcador celular humano altamente específico.
NOTA: La tinción NuMA ofrece una delineación nítida entre el huésped (ratón) y las células injertadas (humano) que ayuda en el procesamiento de imágenes y las etapas posteriores de cuantificación del tumor.

Figura 2: Ejemplos de imágenes de tinción BLI, campo brillante, fluorescencia ex vivo y H&E que ilustran el enfoque múltiple para el análisis de los efectos de los genes candidatos en la metástasis del melanoma. (A) BLI, (B) BF, (C) fluorescencia ex vivo y (D) imágenes de tinción H&E. Las imágenes utilizadas con fines ilustrativos corresponden a un experimento en el que se inyectaron células de melanoma 131/6-4L transducidas con un shRNA de control no dirigido (shNTC) o un shRNA dirigido a FUT8 en ratones inmunodeficientes (NSG). El silenciamiento de FUT8 perjudicó la diseminación metastásica de las células de melanoma. Barras de escala y barra de color = p/seg/cm2/sr × 106 (A), 100 mm (B, C), 100 μm (D). Abreviaturas: BLI = imágenes de bioluminiscencia; H&E = hematoxilina y eosina; shRNA = ARN de horquilla corta; shNTC = shRNA de control no dirigido; NSG = gamma de inmunodeficiencia combinada severa diabética no obesa; FUT8 = fucosiltransferasa 8; BF = campo brillante. Haga clic aquí para ver una versión más grande de esta figura.
8. Tinción de proteínas del aparato mitótico nuclear (NuMA) (Figura 3)
- Utilice un anticuerpo anti-NuMA como marcador de huso mitótico altamente específico para humanos para la identificación y cuantificación de la carga metastásica en las secciones de tejido. 8.1. Se logra una identificación altamente específica y sensible de las células de melanoma.
- Si la inmunohistoquímica cromogénica para NuMA se realiza en un instrumento de inmunotinción automática, siga estos pasos como se describe32:
- Desparafinar las secciones en xileno y rehidratarlas en concentraciones de etanol decrecientes secuencialmente. Mantenga los portaobjetos sumergidos durante 15 minutos en xileno y transfiéralos al 100% de etanol durante otros 15 minutos.
NOTA: El resto de los pasos de rehidratación de etanol (95%, 80%, 75%) duran de 3 a 5 minutos cada uno. - Enjuague los toboganes en agua desionizada.
- Realice la recuperación del epítopo sumergiendo las diapositivas en un recipiente (por ejemplo, frasco de tinción Coplin) en un tampón de citrato de sodio de 10 mM, pH 6.0, en un horno de microondas de 1200 vatios al 100% de potencia durante 10 minutos.
- Use anticuerpos NuMA antihumanos de conejo policlonales no conjugados para el etiquetado, diluidos 1:7,000 en albúmina sérica Tris-Bovina (BSA) (25 mM Tris, 15 mM NaCl, 1% BSA, pH 7.2). Ejecute los controles positivos y negativos apropiados en paralelo con las secciones del estudio.
- Incubar los portaobjetos con el anticuerpo primario durante 12 h. Detecte el anticuerpo primario con el multímero conjugado HRP anti-conejo de cabra y visualice el complejo con 3,3-diaminobencidina y un potenciador de sulfato de cobre.
- Lave los portaobjetos en agua destilada, contramante con hematoxilina, deshidrate y monte con medio permanente.
NOTA: Los pasos de deshidratación son los pasos de rehidratación descritos en el paso 8.3. Escanee las diapositivas con el escáner disponible a un aumento de 20x o 40x y cárguelas en una base de datos. - Usando software, dibuje ROI para incluir todas las células teñidas con NuMA dentro del tejido del órgano, excluyendo otros parénquimas de órganos y espacios vacíos.
- Ajuste la configuración para categorizar las células NuMA positivas y NuMA negativas mientras usa los controles positivos y negativos apropiados para cada órgano. Utilice un algoritmo de software establecido para cuantificar el número total/porcentaje de células NuMA positivas para cada muestra.
9. Inmunofluorescencia en rodajas tisulares
Para identificar la etapa metastásica en la que se requiere un candidato a gen en particular (por ejemplo, extravasación vs. supervivencia después de la siembra), se puede determinar la inmunofluorescencia de corte de tejido en diferentes puntos de tiempo para rastrear la progresión de las células tumorales desde la inyección hasta la invasión de órganos a distancia, la siembra y el crecimiento. Este enfoque permite la adición de marcadores para que las células vecinas capturen el evento de extravasación y los cambios en el microambiente tumoral circundante33.
- Anestesiar al animal como se describe en el paso 7.1.
- Inyectar 100 μg de fluoróforo conjugado Lycopersicon Esculentum (Tomate) Lectina en el ventrículo izquierdo de cada animal, 3 min antes de la perfusión, para delinear el endotelio vascular.
NOTA: Deje tiempo para que la lectina de tomate recircule en todo el sistema. - Perfundir el animal como se describe en los pasos 7.2-7.3. Extraiga los órganos de interés y transfiéralos a recipientes preetiquetados llenos de 4% de PFA. Fijar el tejido durante 24 a 48 h. Seccionar el tejido con un vibratomo en rodajas de 30-50 μm de espesor.
NOTA: El grosor debe optimizarse. Se recomiendan cortes entre 30 μm y 50 μm de espesor, especialmente cuando se realizan imágenes de pila z. - Incubar las rodajas en tampón de bloqueo (10% Normal Goat Serum, 2% BSA, 0.25% Triton X-100 en DPBS) durante 2 h en RT.
- Realice un experimento de optimización de tinción.
NOTA: Como el tiempo de recuperación de antígenos, los tampones utilizados para la recuperación de antígenos, la temperatura, los diferentes anticuerpos / diferentes lotes y el tipo de tejido influyen en la tinción, son necesarios experimentos de optimización. - Agregue anticuerpos primarios a una dilución optimizada e incube durante un tiempo optimizado a una temperatura optimizada (ver ejemplos en la Tabla 1).
NOTA: Utilice los controles apropiados para anticuerpos primarios/secundarios y muestras de tejido no teñido. - Lave las rodajas de tejido 3 veces durante 5 min con Triton X-100 al 0,25% en DPBS.
- Incubar las rodajas de tejido en anticuerpos secundarios diluidos en solución de bloqueo durante el tiempo deseado (Tabla 1).
- Lave las rodajas de tejido 3 veces durante 5 min con Triton X-100 al 0,25% en DPBS.
- Mante los núcleos con 4′,6-diamidino-2-fenilindol (DAPI) diluido 1:1.000 en DPBS o tampón de bloqueo durante 5 min.
- Agregue 2 gotas de medio de montaje de fluorescencia antifade a una cubierta y monte el tejido en portaobjetos de vidrio, asegurándose de que las rebanadas estén completamente cubiertas por el medio de montaje.
NOTA: Asegúrese de que no haya burbujas de aire directamente en las rodajas, ya que esto distorsiona la microscopía. - Capture imágenes confocales con el microscopio disponible utilizando un objetivo de inmersión en aceite de 60x.
NOTA: Al adquirir imágenes confocales, aplique los mismos parámetros de configuración (voltaje, unidades aireadas y ganancia) en todas las imágenes del experimento. - Capture imágenes no confocales con el microscopio a 10x, 20x o 40x.
- Cargue las imágenes en un software de análisis de imágenes y analícelas comparando los parámetros de elección (es decir, área, número, intensidad de los marcadores o contacto con células adyacentes).
Resultados
Las siguientes figuras ilustran cómo se ha aplicado el flujo de trabajo descrito para la identificación de nuevos impulsores de la metástasis del melanoma. La Figura 2 resume los resultados de un estudio publicado en el que se estudiaron los efectos del silenciamiento de la fucosiltransferasa FUT8 en metástasis de melanoma in vivo 26. Brevemente, el análisis de los datos glucómicos del paciente humano (obtenidos por matrices de lectinas) y el perfil tra...
Discusión
El objetivo de este informe técnico es ofrecer un flujo de trabajo estandarizado de arriba a abajo para la investigación de actores potenciales en la metástasis del melanoma. Como los experimentos in vivo pueden ser costosos y llevar mucho tiempo, las estrategias para maximizar la eficiencia y aumentar el valor de la información obtenida son primordiales.
Es imperativo utilizar enfoques complementarios para validar los hallazgos dentro del mismo experimento. Por ejemplo, tanto la ...
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Agradecemos a la División de Tecnologías de Investigación Avanzada (DART) de NYU Langone Health, y en particular, al Laboratorio de Investigación de Patología Experimental, el Centro de Tecnología del Genoma, el Laboratorio de Citometría y Clasificación Celular, el Núcleo de Imágenes Preclínicas, que cuentan con el apoyo parcial de la Subvención de Apoyo del Centro de Cáncer Perlmutter NIH / NCI 5P30CA016087. Agradecemos al NYU Interdisciplinary Melanoma Cooperative Group (PI: Dr. Iman Osman) por proporcionar acceso a cultivos a corto plazo de melanoma derivado de pacientes + (10-230BM y 12-273BM), que se obtuvieron a través de protocolos aprobados por IRB (estudio de consentimiento universal #s16-00122 y estudio del Grupo Cooperativo interdisciplinario de melanoma # 10362). Agradecemos al Dr. Robert Kerbel (Universidad de Toronto) por proporcionar líneas celulares de melanoma 113/6-4L y 131/4-5B1* y al Dr. Meenhard Herlyn (Instituto Wistar) por proporcionar cultivos a corto plazo de melanoma WM 4265-2, WM 4257s-1, WM 4257-2*. E.H. cuenta con el apoyo de NIH/NCI R01CA243446, P01CA206980, un Premio científico del equipo de la American Cancer Society-Melanoma Research Alliance y una ESPORA de melanoma de los NIH (NCI P50 CA225450; PI: I.O.). La figura 1 se creó con Biorender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| #15 Scapel Blade | WPI | 500242 | For surgical procedures |
| #3 Scapel Handle | WPI | 500236 | For surgical procedures |
| 1 mL Tuberculin syringe, slip tip | BD | 309626 | Injections |
| 10 mL syringe, slip tip | BD | 301029 | Perfusion |
| 10% Formalin Sodium Buffered | EK Industries | 4499-20L | For perfusion/tissue fixative |
| 15 mL Conical | Corning | 430052 | Cell culture |
| 15 mL Conical Polypropylene Centrifuge Tubes | Falcon | 352196 | Cell culture |
| 200 Proof Ethanol | Deacon Labs | 04-355-223 | Histology |
| 22G – 22mm needle | BD | 305156 | Perfusion |
| 4-0 Vicryl Suture | Ethicon | J464G | Suture |
| 4% Carson's phosphate buffered paraformaldehyde | EMS | 15733-10 | For perfusion/tissue fixative |
| 40µm | Corning | 431750 | Tissue processing |
| 5-0 Absorbable Suture | Ethicon | 6542000 | Closure |
| 50 mL Conical | Corning | 430828 | Cell culture |
| 50mL Conical Polypropylene Centrifuge Tubes | Falcon | 352070 | Cell culture |
| 7-0 Silk suture | FST | 18020-70 | Ligature |
| 70µm | Corning | 431751 | Tissue processing |
| Anti-fade mounting media | Vector Labs | H-1000-10 | Immunofluorescence |
| Approximator applying Forceps, 10cm | WPI | 14189 | For microsurgical procedures |
| Avance | Bruker | 3 HD | NMR Console |
| Biospec 7030 | Bruker | 7030 | Micro MRI |
| BSA | Bioreg | A941 | NuMA Staining |
| Castroviejo suturing forceps, straight tips 5.5mm tying platform, 11cm | WPI | WP5025501 | For microsurgical procedures |
| Coplin Staining Jar | Bel-Art | F44208-1000 | Histology |
| DAPI | Sigma-Aldrich | D9542-1MG | Immunofluorescence |
| dCas9-KRAB | Addgene | 110820 | Genetic manipulation |
| DNase I | NEB | M0303L | Tissue processing |
| DPBS | Corning | 21-030-CM | Tissue processing |
| Extra Sharp Uncoated Single Edge Blade | GEM | 62-0167 | Tissue processing |
| Extracellular Matrix Substrate | Corning | 354234 | Consider the Growth Factor Reduced ( as alternative |
| FBS | Cytiva | SH30910.03 | Cell culture |
| Fiji Image J | Fiji Image J | Software | Immunofluorescence |
| Goat anti-rabbit HRP conjugated multimer | Thermo Fisher | A16104 | NuMA Staining |
| Goat Serum | Gibco | PCN5000 | Immunofluorescence |
| HBSS | Corning | 21-020-CV | Tissue processing |
| Hematoxylin | Richard-Allan Scientific | 7231 | Histology |
| Illumina III | PerkinElmer | CLS136334 | BLI Instrument |
| Insulin syringe 28G - 8mm needle | BD | 329424 | Injections |
| Insulin syringe 31G - 6mm needle | BD | 326730 | Injections |
| Iris Forceps, 10.2cm, Full Curve, serrated | WPI | 504478 | For perfusion and surgical procedures |
| Isoflurane USP | Covetrus | 11695067772 | Anesthesia |
| Jewelers #7 Forceps Titanium 11 cm 0.07 x 0.01 mm Tip | WPI | WP6570 | For microsurgical procedures |
| Ketamine HCl 100mg/mL | Mylan Ind. | 1049007 | Anesthesia |
| lentiCRISPRv2 | Addgene | 98290 | Genetic manipulation |
| Lycopersicon Esculentum (Tomato) Lectin, DyLight 649 | Invitrogen | L32472 | Vascular endothelial cells marker |
| MEM non-essential amino acids X 100 | Corning | 25-025-CI | Cell culture |
| Metzenbaum Scissors | WPI | 503269 | For surgical procedures |
| Microinjection Unit | KOPF | 5000 | Intracardiac injections |
| NaCl | Fisher | S25877 | NuMA Staining |
| Needle 30G x 25mm | BD | 305128 | Intracardiac Injection |
| Needle 33G x 15mm | Hamilton | 7747-01 | Intracarotid Injection |
| Needle holder, Castroviejo, 14cm, with lock, 1.2mm Serrated Jaws | WPI | 14137-G | For microsurgical procedures |
| NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ mice | The Jackson Laboratory | 005557 | Murine model |
| NU/J mice | The Jackson Laboratory | 002019 | Murine model |
| Nuclear Mitotic Apparatus Protein polyclonal rabbit anti-human | Abcam | 97585 | NuMA Staining |
| Penicillin-Streptomycin 10000U/mL | Gibco | 15140122 | Cell culture |
| Percoll | GE | 0891-01 | density separation solution |
| PI Classic Surgical Gloves | Cardinal Health | 2D72PT75X | Surgery |
| pLKO Tet-On | Addgene | 21915 | Genetic manipulation |
| Povidone-Iodine 10% Solution | Medline | MDS093943 | Surgery |
| Proparacaine Drops 0.5% | Akorn Pharma | AX0501 | Opthalmic local anesthetic |
| Puralube Petrolatum Opthalmic Ointment | Dechra | 83592 | Anesthesia |
| Razor Blade Double Edge Blades | EMS | 72000 | Shaving and Vibrotome Brain Slicing |
| Reflex 9mm EZ Clip | Braintree | EZC- KIT | Wound closure |
| RPMI 1640 | Corning | 10-040-CM | Cell culture |
| Scissors, Spring 10.5cm Str, 8mm Blades | WPI | 501235 | For microsurgical procedures |
| Semi-Automatic Vibrating Blade Microtome | Leica | VT1200 | Brain Slice Immunofluorescence |
| Single Channel Anesthesia Vaporizer System | Kent Scientific | VetFlo-1210S | Anesthesia |
| Smartbox Tabletop Chamber System and Exhaust Blower | EZ Systems | TT4000 | CO2 Euthanasia |
| Sterile Fenestrated Disposable Drape | Medline | NON21002 | Surgery |
| Sterile Non-Reinforced Aurora Surgical Gowns with Set-In Sleeves | Medline | DYNJP2715 | Surgery |
| T25 Flask | Corning | 430639 | Cell culture |
| Tris | Corning | 46-031-CM | NuMA Staining |
| Triton X-100 | Sigma-Aldrich | X100-500ML | Immunofluorescence |
| Troutman tying forceps, 10cm, Curved G pattern, 0.52mm tip with tying platform | WPI | WP505210 | For microsurgical procedures |
| Vessel clips 10G Pressure 5x 0.8mm Jaws, 5/pkg | WPI | 15911 | For microsurgical procedures |
| Visiopharm | Visiopharm | Visiopharm | NuMA Staining Quantification Software |
| Xylasine 100mg/mL | Akorn Pharma | 59399-111-50 | Anesthesia |
| Xylene | Fisher | X3P-1GAL | Histology |
Referencias
- Sung, H., et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Adler, N. R., Haydon, A., McLean, C. A., Kelly, J. W., Mar, V. J. Metastatic pathways in patients with cutaneous melanoma. Pigment Cell Melanoma Research. 30 (1), 13-27 (2017).
- Platz, A., Egyhazi, S., Ringborg, U., Hansson, J. Human cutaneous melanoma; a review of NRAS and BRAF mutation frequencies in relation to histogenetic subclass and body site. Molecular Oncology. 1 (4), 395-405 (2008).
- Alonso, S. R., et al. A high-throughput study in melanoma identifies epithelial-mesenchymal transition as a major determinant of metastasis. Cancer Research. 67 (7), 3450-3460 (2007).
- Rowe, C. J., Khosrotehrani, K. Clinical and biological determinants of melanoma progression: Should all be considered for clinical management. Australasian Journal of Dermatology. 57 (3), 175-181 (2016).
- Plebanek, M. P., et al. Pre-metastatic cancer exosomes induce immune surveillance by patrolling monocytes at the metastatic niche. Nature Communications. 8 (1), 1319 (2017).
- Orgaz, J. L., et al. Loss of pigment epithelium-derived factor enables migration, invasion and metastatic spread of human melanoma. Oncogene. 28 (47), 4147-4161 (2009).
- Ladhani, O., Sanchez-Martinez, C., Orgaz, J. L., Jimenez, B., Volpert, O. V. Pigment epithelium-derived factor blocks tumor extravasation by suppressing amoeboid morphology and mesenchymal proteolysis. Neoplasia. 13 (7), 633-642 (2011).
- Ju, R. J., Stehbens, S. J., Haass, N. K. The role of melanoma cell-stroma interaction in cell motility, invasion, and metastasis. Frontiers in Medicine - Dermatology. 5, 307 (2018).
- Wiley, H. E., Gonzalez, E. B., Maki, W., Wu, M. T., Hwang, S. T. Expression of CC chemokine receptor-7 and regional lymph node metastasis of B16 murine melanoma. Journal of the National Cancer Institute. 93 (21), 1638-1643 (2001).
- Meier, F., et al. Metastatic pathways and time courses in the orderly progression of cutaneous melanoma. British Journal of Dermatology. 147 (1), 62-70 (2002).
- Turner, N., Ware, O., Bosenberg, M. Genetics of metastasis: melanoma and other cancers. Clinical & Experimental Metastasis. 35 (5-6), 379-391 (2018).
- Ubellacker, J. M., et al. Lymph protects metastasizing melanoma cells from ferroptosis. Nature. 585 (7823), 113-118 (2020).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Cunningham, C. C., et al. Actin-binding protein requirement for cortical stability and efficient locomotion. Science. 255 (5042), 325-327 (1992).
- Unger, C., et al. Modeling human carcinomas: physiologically relevant 3D models to improve anti-cancer drug development. Advanced Drug Delivery Reviews. 79-80, 50-67 (2014).
- Fong, E. L., Harrington, D. A., Farach-Carson, M. C., Yu, H. Heralding a new paradigm in 3D tumor modeling. Biomaterials. 108, 197-213 (2016).
- Nakamura, K., et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Science. 70 (7), 791-798 (2002).
- Meeth, K., Wang, J. X., Micevic, G., Damsky, W., Bosenberg, M. W. The YUMM lines: a series of congenic mouse melanoma cell lines with defined genetic alterations. Pigment Cell Melanoma Research. 29 (5), 590-597 (2016).
- Koya, R. C., et al. BRAF inhibitor vemurafenib improves the antitumor activity of adoptive cell immunotherapy. Cancer Research. 72 (16), 3928-3937 (2012).
- Jenkins, M. H. Multiple murine BRaf(V600E) melanoma cell lines with sensitivity to PLX4032. Pigment Cell Melanoma Research. 27 (3), 495-501 (2014).
- Tuncer, E., et al. SMAD signaling promotes melanoma metastasis independently of phenotype switching. The Journal of Clinical Investigation. 129 (7), 2702-2716 (2019).
- Schwartz, H., et al. Incipient Melanoma Brain Metastases Instigate Astrogliosis and Neuroinflammation. Cancer Research. 76 (15), 4359-4371 (2016).
- Perez-Guijarro, E., et al. Multimodel preclinical platform predicts clinical response of melanoma to immunotherapy. Nature Medicine. 26 (5), 781-791 (2020).
- Krepler, C., et al. A Comprehensive Patient-Derived Xenograft Collection Representing the Heterogeneity of Melanoma. Cell Reports. 21 (7), 1953-1967 (2017).
- Agrawal, P., et al. A systems biology approach identifies FUT8 as a driver of melanoma metastasis. Cell. 31 (6), 804-819 (2017).
- Hanniford, D., et al. Epigenetic silencing of CDR1as drives IGF2BP3-mediated melanoma invasion and metastasis. Cancer Cell. 37 (1), 55-70 (2020).
- Kim, H., et al. PRMT5 control of cGAS/STING and NLRC5 pathways defines melanoma response to antitumor immunity. Science Translational Medicine. 12 (551), (2020).
- de Miera, E. V., Friedman, E. B., Greenwald, H. S., Perle, M. A., Osman, I. Development of five new melanoma low passage cell lines representing the clinical and genetic profile of their tumors of origin. Pigment Cell Melanoma Research. 25 (3), 395-397 (2012).
- Morsi, A., et al. Development and characterization of a clinically relevant mouse model of melanoma brain metastasis. Pigment Cell Melanoma Research. 26 (5), 743-745 (2013).
- Huynh, C., et al. Efficient in vivo microRNA targeting of liver metastasis. Oncogene. 30 (12), 1481-1488 (2011).
- Zou, C., et al. Experimental variables that affect human hepatocyte AAV transduction in liver chimeric mice. Molecular Therapy Methods and Clinical Development. 18, 189-198 (2020).
- Kleffman, K., et al. Melanoma-secreted Amyloid Beta Suppresses Neuroinflammation and Promotes Brain Metastasis. bioRxiv. , 854885 (2019).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Molecular Imaging and Biology. 13 (6), 1114-1123 (2011).
- Sil, P., Wong, S. W., Martinez, J. More than skin deep: autophagy is vital for skin barrier function. Frontiers in Immunology. 9, 1376 (2018).
- Chen, S., et al. Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis. Cell. 160 (6), 1246-1260 (2015).
- Hart, T., et al. High-resolution CRISPR screens reveal fitness genes and genotype-specific cancer liabilities. Cell. 163 (6), 1515-1526 (2015).
- Wang, T., et al. Identification and characterization of essential genes in the human genome. Science. 350 (6264), 1096-1101 (2015).
- Edgar, R., Domrachev, M., Lash, A. E. Gene Expression Omnibus: NCBI gene expression and hybridization array data repository. Nucleic Acids Research. 30 (1), 207-210 (2002).
- Lappalainen, I., et al. The European Genome-phenome Archive of human data consented for biomedical research. Nature Genetics. 47 (7), 692-695 (2015).
- Cerami, E., et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data. Cancer Discovery. 2 (5), 401-404 (2012).
- Grossman, R. L., et al. Toward a shared vision for cancer genomic data. New England Journal of Medicine. 375 (12), 1109-1112 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados