A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إعادة تنشيط الخلايا الجذعية العصبية في ذبابة الفاكهة المستزرعة في الدماغ
In This Article
Summary
تم إنشاء طريقة لإعادة تنشيط الخلايا الجذعية العصبية الهادئة في خلايا دماغ ذبابة الفاكهة المستزرعة . باستخدام هذه الطريقة ، يمكن فصل دور الإشارات الجهازية عن الإشارات الجوهرية للأنسجة في تنظيم هدوء الخلايا الجذعية العصبية ودخولها وخروجها.
Abstract
الخلايا الجذعية العصبية (NSCs) لديها القدرة على التكاثر والتمايز والخضوع لموت الخلايا المبرمج وحتى الدخول والخروج من السكون. يتم التحكم في العديد من هذه العمليات من خلال التفاعل المعقد بين البرامج الجينية الجوهرية NSC مع العوامل الخارجية NSC ، المحلية والنظامية. في الكائن الحي الوراثي النموذجي ، ذبابة الفاكهة الميلانوغاستر ، NSCs ، والمعروفة باسم الأرومات العصبية (NBs) ، تتحول من السكون إلى الانتشار أثناء الانتقال الجنيني إلى اليرقات. خلال هذا الوقت ، تخرج اليرقات من قشر البيض وتبدأ في الزحف ، بحثا عن العناصر الغذائية الغذائية. استجابة لتغذية الحيوانات ، ينتج الجسم الدهني ، وهو عضو غدد صماء يتمتع بسعة تخزين الدهون ، إشارة يتم إطلاقها بشكل منهجي في الهيموليمف المتداول. استجابة للإشارة المشتقة من الجسم الدهني (FBDS) ، يتم إنتاج الببتيدات الشبيهة بالأنسولين (Dilps) وإطلاقها من الخلايا العصبية الإفرازية العصبية في الدماغ والدبقية ، مما يؤدي إلى تنشيط المصب لإشارات نمو PI3-kinase في NBs ومكانتها الدبقية والقصبة الهوائية. وعلى الرغم من أن هذا هو النموذج الحالي لكيفية تحول الاستراتيجيات وخطط العمل الوطنية من السكون إلى الانتشار، فإن طبيعة الإشارة الخارجية ل FBDS لا تزال بعيدة المنال. لفهم أفضل لكيفية تنظيم الإشارات الجهازية الخارجية NB للخروج من السكون ، تم تطوير طريقة لزراعة أدمغة اليرقات المبكرة في المختبر قبل إطعام الحيوانات. باستخدام هذه الطريقة ، يمكن توفير العوامل الخارجية لوسائل الإعلام الثقافية وخروج NB من فحص السكون. وجدنا أن الأنسولين الخارجي المنشأ يكفي لإعادة تنشيط NBs من السكون في الدماغ كله explants. نظرا لأن هذه الطريقة مناسبة تماما للشاشات واسعة النطاق ، فإننا نهدف إلى تحديد إشارات خارجية إضافية تنظم هدوء NB مقابل قرارات الانتشار. نظرا لأن الجينات والمسارات التي تنظم قرارات انتشار NSC محفوظة تطوريا ، فإن نتائج هذا الفحص يمكن أن توفر نظرة ثاقبة لتحسين العلاجات التجديدية في العيادة.
Introduction
الخلايا الجذعية ذات أهمية كبيرة بسبب إمكانية استخدامها في الطب التجديدي 1,2. تحتفظ العديد من الحيوانات ، وخاصة تلك التي تعيش طويلا ، بالخلايا الجذعية داخل أنسجتها البالغة. تعمل هذه الخلايا الجذعية المقيمة للحفاظ على توازن الأنسجة وتستخدم للإصلاح بعد الإصابة الجسدية أو المرض 3,4. معظم الخلايا الجذعية في الحيوانات البالغة هادئة ، وهي حالة نائمة نسبيا تتميز باحتجاز دورة الخلية وتعطيل إشارات النمو5. استجابة للإشارات الخارجية ، تخرج الخلايا الجذعية من السكون ، وتدخل دورة الخلية وتبدأ في توليد ذرية ابنة خاصة بنوع أنسجتها. على سبيل المثال ، من أجل تركيب استجابة مناعية فعالة ، تحفز الخلايا التي تقدم المستضدات الخلايا التائية الساذجة الهادئة على الدخول في دورة الخلية وتوسيع6 نسخيا. استجابة لتلف العضلات الهيكلية ، تدخل الخلايا الجذعية الساتلية للعضلات دورة الخلية وتولد الأرومات العضلية الابنة لتحل محل myofibrils التالفة 5,7. في حين أنه من الواضح أن الخلايا الجذعية الهادئة تستجيب للإشارات الخارجية ، في كثير من الحالات ، لا تزال طبيعة الإشارة الخارجية غير واضحة وكذلك آلية تنشيط الخلايا الجذعية التي يسببها الإشارة. إن اكتساب فهم أفضل لكيفية استجابة الخلايا الجذعية الهادئة للإشارات الخارجية ودخولها دورة الخلية سيساعد في تطوير علاجات أفضل بالخلايا الجذعية في العيادة وزيادة المعرفة العلمية.
لعقود حتى الآن ، تم استخدام الكائنات الحية النموذجية للكشف عن الجينات ومسارات إشارات الخلايا التي تنظم تكاثر الخلايا الجذعية أثناء التطور وفي مرحلة البلوغ. في ذبابة الفاكهة ، تنقسم الخلايا الجذعية العصبية (NSCs) ، والمعروفة باسم الخلايا العصبية (NBs) ، طوال فترة التطور لتوليد جميع الخلايا العصبية والدبقية التي تتكامل في النهاية ، وتشكل الدائرة العصبية اللازمة لوظائف الدماغ 8,9. مثل الخلايا الجذعية الأخرى ، تنقسم NBs بشكل غير متماثل إلى التجديد الذاتي ، وفي بعض الحالات ، بشكل متماثل لتوسيع مجموعة الخلايا الجذعية. يتم تحديد NBs أثناء التكوين الجنيني ومعظمها يدخل في حالة هدوء نحو النهاية ، بالتزامن مع انخفاض مخازن المغذيات لدى الأمهات (الشكل 1). بعد اكتمال التكوين الجنيني ، تفقس اليرقات وتبدأ في التغذية. استجابة لتغذية الحيوانات ، تعيد NBs تنشيط من السكون وتستأنف انقسامات الخلايا10،11،12،13،14،15،16. نظرا لأن ذبابة الفاكهة CNS بسيطة نسبيا ولأن NBs تدخل وتخرج من السكون في أوقات محددة ، فإن استخدام ذبابة الفاكهة للتحقيق في تنظيم السكون والدخول والخروج ، يثبت أنه مثالي.
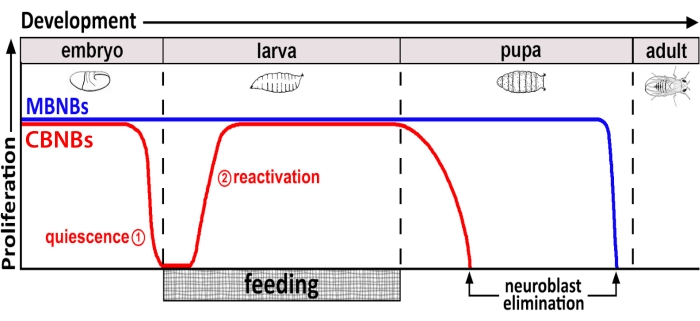
الشكل 1: الانتشار النسبي ل CB NBs (الأرومات العصبية الدماغية المركزية ، الحمراء) و MB NBs (الأرومات العصبية لجسم الفطر ، الأزرق) بمرور الوقت التنموي. في نهاية التكوين الجنيني ، تتوقف معظم NBs (الخط الأحمر) عن الانتشار وتدخل في حالة من السكون. يستمر الهدوء حتى تستهلك اليرقات الطازجة أول وجبة كاملة لها. يشار إلى نقاط التركيز الزمنية لهذه المنهجية في دوائر حمراء (1 ، هدوء و 2 ، إعادة التنشيط). MB NBs (أزرق) هي مجموعة فرعية من NBs الدماغ المركزية التي تنقسم باستمرار طوال فترة التطور (4 لكل نصف الكرة المخية). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
استجابة لتغذية الحيوانات ، تصبح مسارات إشارات نمو PI3-kinase و TOR نشطة في NBs وفي مكانتها الدبقية والقصبة الهوائية10,11,15,16. عندما يتم سحب العناصر الغذائية الغذائية أو عندما يتم تقليل مستويات PI3-kinase ، تفشل NBs في إعادة تنشيط ونمو الدبقية والقصبة الهوائية يتم أيضا تقليل 10،11،15،16. يفترض النموذج الحالي أن إعادة تنشيط NB مقترنة بنمو اليرقات بواسطة الجسم الدهني ، والذي يطلق إشارة نظامية استجابة لتغذية الحيوانات12،17،18. هذه الإشارة ، التي لا تزال بعيدة المنال ، من المحتمل أن تعزز التعبير عن الببتيد الشبيه بالأنسولين (Dilps) وإطلاقه في الدماغ ، مما يؤدي إلى تنشيط PI3-kinase في نهاية المطاف في NBs ومكانتها الدبقية والقصبة الهوائية. لفهم طبيعة الإشارة (الإشارات) النظامية بشكل أفضل ، طورنا طريقة لإعادة تنشيط NBs الهادئة في الدماغ المستزرع. باستخدام هذه الطريقة ، يمكن فحص إعادة تنشيط NBs في غياب إشارات نظامية حيوانية كاملة. يمكن إعادة تزويد العوامل الخارجية بوسائل الإعلام الثقافية وإعادة تنشيط NB بناء على دمج نظير الثيميدين ، EdU. باستخدام هذه الطريقة ، قررنا أن الأنسولين الخارجي المنشأ يكفي لإعادة تنشيط NBs الهادئة في الدماغ explants. وسيهدف العمل المستقبلي إلى تحديد العوامل الإضافية التي، عند إضافتها مرة أخرى، إما بشكل إيجابي أو سلبي تنظم سكون NB في عمليات زرع الدماغ.
Protocol
1. جمع يرقات ذبابة الفاكهة
ملاحظة: قم بإعداد طبق الخميرة ومعجون العنب وشقة Fly قبل البدء:
- معجون الخميرة: في وعاء صغير ، امزج 5 غرام من الخميرة الجافة النشطة مع 10 مل من الماء لتشكيل عجينة تحتوي على اتساق زبدة الفول السوداني. قم بتغطية معجون الخميرة بغلاف بلاستيكي واستخدم شريطا مطاطيا لإرفاقه بإحكام بالحاوية.
ملاحظة: سوف يتوسع معجون الخميرة الطازجة في حاويته وسوف ينبثق من الغطاء ما لم يتم تثبيته بإحكام. سوف يستمر معجون الخميرة لعدة أيام في درجة حرارة الغرفة (RT). - أطباق العنب: اتبع وصفة صنع أطباق العنب (الجدول 1). في حالة استخدام ألواح مخزنة عند 4 درجات مئوية، تأكد من تسخين الألواح مسبقا قبل الاستخدام عن طريق وضعها على RT لمدة 1 ساعة.
- امزج الماء (750 مل) والأجار (18.75 جم) في قارورة سعة 4 لتر ودوامة وأوتوكلاف لمدة 20 دقيقة (دورة سائلة).
- امزج عصير العنب (250 مل) والسكروز (25 جم) في قارورة سعة 1 لتر مع قضيب تحريك كبير على طبق ساخن (نار خفيفة). عندما يذوب السكروز ، أطفئ الحرارة ، وانتظر حتى يمكن لمس القارورة قبل إضافة Tegosept (10٪ ، 4 مل) وحمض Propionic (5 مل). حافظ على شريط التحريك قيد التشغيل.
- عند اكتمال التعقيم ، اتركه يبرد حتى يمكن لمس القارورة (~ 60 درجة مئوية) ، ثم اخلطها في مزيج عصير العنب.
- امزج جميع الحلول في قارورة واحدة واتركها تحرك على الطبق.
- ماصة الحل في أغطية من أطباق بتري صغيرة الحجم (35 ملم). ماصة حوالي 9 مل لكل غطاء أو حتى يتم الحصول على قبة محدبة.
- اختياري: قم بلهب الأغطية للتخلص من أي فقاعات.
- عندما تتصلب الألواح ، قم بتكديس ألواح العنب في صندوق بغطاء محكم الإغلاق ووضع الصندوق عند 4 درجات مئوية. يمكن تخزين لوحات لمدة تصل إلى 1 شهر.
- يطير شقة: لكمة ~ 20 ثقوب في زجاجة البولي بروبيلين ذبابة الفاكهة 6 أونصات مربعة القاع باستخدام إبرة 18 G.
- نقل الذباب البالغ (~ 100 OregonR أو أي نمط وراثي) إلى شقة ذبابة وتغطية الشقة بلوحة أجار العنب المغطاة بقطعة من معجون الخميرة. ضع الرذاذ باتجاه وسط اللوحة وقم بلصق اللوحة على الشقة بشريط مختبري.
- اقلب الحاوية بحيث تكون لوحة أجار العنب في القاع وضعها في حاضنة 25 درجة مئوية لمدة 24 ساعة (الشكل 2).
الشكل 2: التمثيل البصري لزجاجة ذبابة مقلوبة (شقة) مع البالغين ذبابة الفاكهة الذكور والإناث. تحتوي الزجاجة البلاستيكية على ثقوب صغيرة ، يتم إنشاؤها باستخدام إبرة 18 جم ، لتبادل الأكسجين. يتم إغلاق فم الزجاجة بغطاء عصير عنب أجار ويتم عكسه وتخزينه في حاضنة 25 درجة مئوية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- بعد 24 ساعة ، قم بتغيير طبق أجار العنب واستبدله بطبق جديد يعلوه معجون الخميرة. قم بتبديل اللوحتين بسرعة أثناء النقر باستمرار على الشقة بخفة على المقعد حتى لا يهرب الذباب البالغ.
- فحص الصفيحة بالعين وتقييم عدد الأجنة على اللوحة. أجنة ذبابة الفاكهة مستطيلة وبيضاء مع اثنين من الزوائد الشبيهة بالسلسلة.
- إذا كان هناك عدد قليل جدا من الأجنة على اللوحة (أقل من 100) ، تخلص من اللوحة (كشط الأجار في سلة المهملات الطائرة واحفظ الغطاء البلاستيكي لإعادة استخدامه). في كثير من الحالات ، لن تضع الإناث البالغات العديد من الأجنة في الليلة الأولى في شقة جديدة. إذا كان هذا هو الحال ، فقم بإعطاء الذباب البالغ 24 ساعة أخرى للتأقلم.
- إذا كان هناك عدد كبير من الأجنة على اللوحة (100 على الأقل) ، فاحتفظ بها ، وقم بإزالة معجون الخميرة بعناية باستخدام ملعقة مسطحة القاع.
- بمجرد إزالة معجون الخميرة ، استخدم معوتا معدنيا لإزالة جميع اليرقات يدويا من صفيحة العنب تحت مجهر تشريح. عند النظر إلى اللوحة تحت مجهر تشريح ، يجب ملاحظة اليرقات الزاحفة وكذلك الأجنة.
- قم بإزالة جميع اليرقات عن طريق تنظيف المعدن بالفرشاة نحو جانب يرقة واحدة. اليرقات لزجة وسوف تلتصق بالاختيار. بمجرد أن تكون يرقة واحدة على الانتقاء ، يمكن التقاط يرقات إضافية بسهولة باستخدام اليرقة الموجودة على الأداة لإرفاق المزيد.
ملاحظة: تحب اليرقات الالتصاق ببعضها البعض. في هذه المرحلة ، لا يهم ما إذا كانت اليرقات تتلف. سيتم التخلص من هذه اليرقات. - بعد اختيار وإزالة جميع اليرقات ، ضع اللوحة مرة أخرى في الحاضنة 25 درجة مئوية. تأكد من وضع اللوحة في حاوية أكبر يمكن إغلاقها. ضع مناشف ورقية مبللة في قاع الحاوية الأكبر للحفاظ على الرطوبة.
- بعد 30-60 دقيقة ، خذ اللوحة مرة أخرى إلى المجهر التشريحي والآن ، اختر بعناية ~ 20-25 يرقات من نفس صفيحة العنب أجار لضمان أن اليرقات المنتقاة تفقس طازجة في غضون فترة زمنية 30-60 دقيقة.
- اغمر طرف الأداة باليرقات الطازجة 20-25 في طبق بتري (60 مم) مملوء ب 1-2 مل من 1x محلول ملحي مخزن مؤقتا بالفوسفات (PBS) لمدة دقيقتين.
- بعد 2 دقيقة ، قم بقلب الطبق بزاوية لتجميع السائل في الأسفل. باستخدام فرشاة طلاء صغيرة ، قم بتنظيف اليرقات من السائل حتى أسفل طبق Petri.
- جمع جميع اليرقات على فرشاة الطلاء ونقل اليرقات إلى طبق بتري جديد (60 ملم) يحتوي على 1-2 مل من الإيثانول 70٪. كرر الخطوات 1.15 لجمع اليرقات باستخدام فرشاة الطلاء ونقلها إلى طبق بتري جديد مع 1-2 مل من 1x PBS.
2. الإعلام الثقافي وإعداد الأدوات
- رش المقعد ومنطقة العمل مع 70٪ من الإيثانول واتركه يجف.
- رش أدوات التشريح والملقط وطبقين زجاجيين للساعة ، مع 70٪ من الإيثانول واتركها تجف على مقاعد البدلاء.
- اصنع وسائط شنايدر المكملة (SSM، الجدول 2) وضعها على الجليد.
- ماصة 1 مل من SSM في كل طبق من أطباق الساعة الزجاجية.
- باستخدام ماصة صغيرة ذات طرف معقم ، انقل اليرقات الطازجة من لوحة PBS إلى SSM في أول طبق ساعة زجاجي. باستخدام ماصة صغيرة ذات طرف معقم ، انقل اليرقات الطازجة إلى SSM في طبق الساعة الزجاجي الثاني.
3. تشريح وثقافات الدماغ
- بمجرد أن تكون اليرقات في طبق الساعة الزجاجي الثاني مع SSM ، قم بتشريح الأدمغة خارج اليرقات باستخدام ملقط ومجهر تشريح. اضبط التكبير حسب الحاجة.
- استخدم ملقطا واحدا للاستيلاء على خطافات الفم ومع الآخر ، أمسك الجسم بلطف في منتصف الطريق إلى الأسفل واسحب في الاتجاه المعاكس (الشكل 3) لتقسيم اليرقة إلى قطعتين.
ملاحظة: سيكون الدماغ موجودا خلف خطافات الفم مباشرة. لاحظ أنه قد تكون هناك أنسجة أخرى تحيط بالدماغ. كن حذرا جدا عند إزالة هذه الأنسجة لأنها يمكن أن تؤدي إلى إتلاف الدماغ

الشكل 3: يرقات ذبابة الفاكهة في طبق ساعة زجاجي مع SSM. يتم وضع الملقط بشكل صحيح للتشريح. موقع دماغ اليرقات (الرمادي الداكن) هو الخلفي لخطافات الفم (أسود) ، وكلاهما يظهر داخل اليرقات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- بمجرد تشريح 15-20 دماغا ، أضف 1 مل من SSM إلى بئر واحد من صينية زراعة 12 بئرا معقمة. انقل الأدمغة التي تم تشريحها حديثا إلى SSM باستخدام ماصة دقيقة وطرف معقم (الشكل 4A).
- ضع الأدمغة في وسائط SSM في صينية الاستزراع المكونة من 12 بئرا في حاضنة عند 25 درجة مئوية لمدة 24 ساعة (الشكل 4A).

الشكل 4: زراعة الدماغ والتلطيخ المناعي . (أ) أدمغة كاملة في طبق استزراع مكون من 12 بئرا يحتوي على 1 مل من SSM. ثم يتم وضع طبق الاستزراع في حاضنة 25 درجة مئوية لمدة 24 ساعة (B) صينية صغيرة 72 بئر تحمل الدماغ أثناء تلطيخ المناعة. يتم غسل الأدمغة ونقل الحلول باستخدام ماصة دقيقة P20 مضبوطة على 10 ميكرولتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. فحص الانتشار ، وتثبيت الدماغ ، وتلطيخ الأجسام المضادة
- في اليوم التالي ، قم بعمل 1 مل من حل EdU SSM. ماصة 10 ميكرولتر من مخزون 10 mM من 5-Ethynyl-2′-deoxyuridine (EdU) مع 990 ميكرولتر من SSM (تركيز EdU النهائي يساوي 0.1 mM) في أنبوب طرد مركزي دقيق معقم ومزيج. بعد اكتمال الحضانة على مدار 24 ساعة ، قم بماصة 1 مل من EdU SSM في بئر واحد من صينية الاستزراع المعقمة المكونة من 12 بئرا.
- انقل الأدمغة باستخدام ماصة دقيقة ذات طرف معقم من البئر الذي يحتوي على SSM فقط إلى البئر الجديد الذي يحتوي على حل EdU SSM. حضانة لمدة 1 ساعة في 25 درجة مئوية.
- بعد ذلك ، انقل الأدمغة التي تحمل علامة EdU إلى بئر آخر في نفس صينية الثقافة التي تحتوي على 1 مل من المثبت (4٪ paraformaldehyde ، انظر الجدول 3 للحصول على الوصفة) لمدة 20 دقيقة.
تحذير: بارافورمالدهيد هو خطر بيولوجي ويجب التخلص منه بشكل صحيح. - بعد التثبيت ، انقل الأدمغة بسرعة إلى آبار صينية صغيرة من 72 بئرا باستخدام ماصة دقيقة. يمكن لكل بئر أن يحمل 10 أدمغة و 10-15 ميكرولتر من السائل (الشكل 4B). بمجرد نقل الأدمغة إلى الدرج الصغير (لا يزيد عن 10 أدمغة لكل بئر) ، قم بإزالة الإصلاح وشطف الأدمغة 3 مرات في 10 ميكرولتر من 1x PBT (مخزن الفوسفات المؤقت ، الرقم الهيدروجيني 7.4 يحتوي على 0.1٪ Triton-X 100).
ملاحظة: الشطف يعني سحب 10 ميكرولتر من 1x PBT على الأدمغة ، وإزالة ، وتكرار 3 مرات. - بعد ذلك ، اغسل الأدمغة 3 مرات لمدة 10 دقائق لكل منها ، مرة أخرى في 10 ميكرولتر 1x PBT. تأكد من أن الأدمغة مغطاة ببعض السوائل في جميع الأوقات.
- بعد اكتمال الغسيل ، ماصة 10 ميكرولتر من محلول الحجب (1x PBT مع مصل الماعز الطبيعي 10٪) على الأدمغة. قم بتغطية الدرج وختمه باستخدام شريط من البارافيلم حول الحافة.
- بمجرد إغلاقه ، ضع الدرج الصغير في صندوق مغلق بمناشف مبللة لتوفير بيئة رطبة لمنع التبخر. ضع الصندوق الذي يحتوي على الدرج عند 4 درجات مئوية طوال الليل.
- في اليوم التالي ، قم بعمل محلول أولي للأجسام المضادة.
ملاحظة: في هذا البروتوكول ، تم استخدام الأرانب المضادة للخربشة لتسمية أغشية الخلايا والفئران المضادة للموت الميت لتسمية الأرومات العصبية ، على الرغم من أنه يمكن استخدام أي عدد من الأجسام المضادة الأولية الأخرى.- لجعل محلول الأجسام المضادة الأولية ، أولا ، قم بإجراء تخفيفات للأجسام المضادة الأولية في محلول الحظر. على سبيل المثال ، يتم استخدام الأرانب المضادة للخربشة بتركيز نهائي قدره 1: 1000. لذلك ، أولا ، قم بتخفيف الجسم المضاد المضاد للخربشة في الأرنب في الساعة 1:100 (1 ميكرولتر من الجسم المضاد بالإضافة إلى 99 ميكرولتر من محلول الحظر). يستخدم Rat-deadpan بتركيز نهائي قدره 1:100. لذلك ، أولا ، قم بتخفيف الجسم المضاد للفئران الميتة عند 1:10 (1 ميكرولتر من الأجسام المضادة بالإضافة إلى 9 ميكرولتر من محلول الحظر).
ملاحظة: يمكن تخزين هذه المخففات على المدى الطويل عند 4 درجات مئوية إذا تمت إضافة أزيد الصوديوم (0.05٪) أيضا لمنع نمو البكتيريا. - بعد ذلك ، احسب عدد الآبار التي تحتوي على أدمغة. يحدد عدد الآبار حجم محلول الأجسام المضادة الأولي الذي يجب صنعه. على سبيل المثال ، إذا كان هناك بئران من الأدمغة ، فقم بإعداد 20 ميكرولتر من محلول الأجسام المضادة الأولي (ل 10 آبار ، 100 ميكرولتر ، إلخ). لصنع محلول الأجسام المضادة الأولية 20 ميكرولتر ، أضف 2 ميكرولتر من كل تخفيف أولي للأجسام المضادة و 16 ميكرولتر من محلول الحظر.
ملاحظة: التركيز النهائي لكل من الأجسام المضادة الأولية هو 1:1000 و 1:100 على التوالي. باختصار ، قم بإجراء التخفيف الأول للأجسام المضادة الأولية بتركيز بحيث يكون التخفيف الثاني دائما 1:10 للوصول إلى التركيزات النهائية المعنية. في هذه الحالة ، 1:1000 للأرانب المضادة للخربشة و 1:100 للفئران المضادة للميتة.
- لجعل محلول الأجسام المضادة الأولية ، أولا ، قم بإجراء تخفيفات للأجسام المضادة الأولية في محلول الحظر. على سبيل المثال ، يتم استخدام الأرانب المضادة للخربشة بتركيز نهائي قدره 1: 1000. لذلك ، أولا ، قم بتخفيف الجسم المضاد المضاد للخربشة في الأرنب في الساعة 1:100 (1 ميكرولتر من الجسم المضاد بالإضافة إلى 99 ميكرولتر من محلول الحظر). يستخدم Rat-deadpan بتركيز نهائي قدره 1:100. لذلك ، أولا ، قم بتخفيف الجسم المضاد للفئران الميتة عند 1:10 (1 ميكرولتر من الأجسام المضادة بالإضافة إلى 9 ميكرولتر من محلول الحظر).
- قم بإزالة محلول الحجب مع ضبط الماصة الدقيقة على 10 ميكرولتر وماصة 10 ميكرولتر من محلول الأجسام المضادة الأساسي في كل بئر.
- قم بتغطية الدرج وختمه باستخدام البارافيلم وضعه مرة أخرى في الصندوق المختوم بمناشف مبللة. احتضان بين عشية وضحاها في 4 درجات مئوية.
ملاحظة: الاهتزاز غير مطلوب ويتم تثبيطه بشدة. سوف تخترق الأجسام المضادة الأدمغة دون اهتزاز أو اختلاط. - في اليوم التالي ، قم بإزالة محلول الأجسام المضادة الأساسي باستخدام ماصة دقيقة وشطف الأدمغة 3 مرات باستخدام 10 ميكرولتر من 1x PBT. بعد ذلك ، اغسل الأدمغة 4 مرات باستخدام 10 ميكرولتر من 1x PBT لمدة 10 دقائق لكل منهما. خلال 10 دقائق يغسل ، قم بإعداد محلول الأجسام المضادة الثانوي.
- لصنع محلول الأجسام المضادة الثانوي ، اختر الأجسام المضادة الثانوية التي تتعرف على الأجسام المضادة الأولية. في هذا البروتوكول ، تم استخدام الماعز المضاد للأرانب Alexa Fluor 488 والماعز المضاد للفئران Alexa 555.
- ماصة 1 ميكرولتر من كل من الأجسام المضادة الثانوية في أنبوب الطرد المركزي الدقيق مع 298 ميكرولتر من محلول الحجب لجعل التركيز النهائي 1:300 لكل جسم مضاد ثانوي.
- بعد آخر 10 دقائق من الغسيل ، قم بإزالة 1x PBT وماصة 10 ميكرولتر من محلول الأجسام المضادة الثانوي في كل بئر. أغلق الدرج باستخدام البارافيلم وضعه مرة أخرى في الصندوق بمناشف رطبة. احتضان بين عشية وضحاها في 4 درجات مئوية.
ملاحظة: لا تقلق بشأن إزالة كل ميكرولتر أخير في الآبار بين الشطف أو الغسيل أو عند إضافة محاليل الأجسام المضادة الأولية والثانوية. ستبقى الأدمغة دائما مغمورة في بضعة ميكرولتر من السائل ، وهو أمر جيد. - في اليوم التالي ، قم بإزالة محلول الأجسام المضادة الثانوي باستخدام ماصة دقيقة وشطف الأدمغة 3 مرات ب 10 ميكرولتر لكل من 1x PBT. بعد ذلك ، اغسل الأدمغة 4 مرات ب 10 ميكرولتر لكل من 1x PBT لمدة 10 دقائق لكل منهما.
- أثناء الغسيل لمدة 10 دقائق، قم بإعداد مزيج تفاعل EdU للكشف عن دمج EdU. قم بإعداد مزيج تفاعل EdU وفقا لإرشادات الشركات المصنعة.
- بعد الغسيل النهائي ، قم بإزالة 1x PBT وماصة 10 ميكرولتر من مزيج تفاعل EdU في كل بئر مع الأدمغة. ختم لوحة microwell مع parafilm وتغطي مع رقائق الألومنيوم. اترك الطبق على المقعد لمدة 30 دقيقة.
- بعد 30 دقيقة ، شطف الأدمغة 3 مرات مع 10 ميكرولتر لكل من 1x PBT وغسل الأدمغة 3 مرات مع 10 ميكرولتر لكل من 1x PBT لمدة 5 دقائق لكل منهما.
- بعد الغسيل الأخير ، قم بإزالة 1x PBT وماصة 10 ميكرولتر من محلول وسائط التركيب القائم على الجلسرين. أغلق الطبق وضعه على حرارة 4 درجات مئوية طوال الليل.
5. تركيب وتصوير الأدمغة
- في اليوم التالي ، قم بإعداد شرائح المجهر (25 مم × 75 مم × 1 مم): الغراء (على سبيل المثال ، الغراء الفائق) زجاج غطاء مربع 22 مم × 22 مم × 1 مم لكل طرف من شرائح المجهر لإنشاء "جسر" يتم وضع الغطاء الأكبر حجما عليه 22 مم × 50 مم × 1 مم لعمل مسافة بين الشريحة والغطاء الأكبر (الشكل 5A). ستسمح هذه المساحة للدماغ بحركة كافية فقط لتكون موجهة بشكل صحيح مع منعه من السحق.

الشكل 5: مخطط يوضح شريحة المجهر واتجاهه وأنواع الخلايا في دماغ اليرقات . (أ) التمثيل البصري لشريحة المجهر التي يتم تركيب دماغ اليرقات عليها ويكون جاهزا للتصوير. (ب) يظهر أيضا أن هناك مبدأ توجيهيا يستخدم لتوجيه الأنسجة. (ج) شريحة مجهرية جاهزة للتصوير على مجهر بؤري. (د) رسم كاريكاتوري يوضح بعض أنواع الخلايا في دماغ اليرقات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- بعد لصق نظارات الغطاء 22 مم × 22 مم × 1 مم على شريحة المجهر ، ماصة 9.3 ميكرولتر من محلول وسائط التركيب القائم على الجلسرين الذي يحتوي على دماغ واحد من بئر من صفيحة microwell ووضعها على وسط الشريحة (الشكل 5A).
ملاحظة: قد تلتصق أدمغة اليرقات بطرف الماصة، لذا كن حذرا. لتجنب الالتصاق ، ابدأ بشفط مضاد التلاشي ثم استنشاق الدماغ الواحد نحو نهاية حجم 9.3 ميكرولتر. - بمجرد أن يكون الدماغ على الشريحة ، ضع الغطاء 22 مم × 50 مم × 1 مم برفق في الأعلى. ضع الدماغ كما هو موضح في الشكل 5B. حرك الغطاء بلطف لتوجيه الدماغ. ثم تكون العينة جاهزة للتصوير.
- استخدم مجهرا متحد البؤرة مزودا بتكبير عال وهدف فتحة رقمية عالية (الشكل 5C) للحصول على أفضل الصور. على سبيل المثال: 60x أو 63x ، عدسة غمر الزيت 1.4 NA.
- صورة للأدمغة مع السطح الظهري الأقرب إلى الغطاء (والهدف). احصل على مكدسات Z عبر نصف الكرة المخية بأكمله بدءا من السطح البطني (الأبعد عن الهدف) على فترات 1 ميكرومتر أو حجم خطوة Z.
ملاحظة: يعتمد الليزر المستخدم على الأجسام المضادة الثانوية. في هذا البروتوكول ، كانت خطوط الليزر المستخدمة 488 نانومتر للكشف عن تلطيخ الخربشة ، و 555 نانومتر للكشف عن Deadpan ، و 633 نانومتر للكشف عن EdU.
- صورة للأدمغة مع السطح الظهري الأقرب إلى الغطاء (والهدف). احصل على مكدسات Z عبر نصف الكرة المخية بأكمله بدءا من السطح البطني (الأبعد عن الهدف) على فترات 1 ميكرومتر أو حجم خطوة Z.
6. تحليل البيانات
- استخدم برنامج فيجي مفتوح المصدر لتحليل نصفي الكرة المخية واستخدم المكون الإضافي عداد خلايا فيجي لحساب الخلايا.
النتائج
تم تشريح أدمغة أوريغون آر الطازجة من النوع البري وزراعتها لمدة 24 ساعة في وسائط شنايدر المكملة (SSM) بالأنسولين. تم إصلاح الأنسجة وتلطيخها وفقا للبروتوكول. تم استخدام الأجسام المضادة الأولية التي تم إنشاؤها ضد Deadpan (Dpn) للكشف عن NBs و Scribble لتسمية أغشية الخلايا. تمت إضافة التناظرية ثيميدين 5-إيثي?...
Discussion
يمكن تنفيذ الطريقة الموصوفة هنا لزراعة الدماغ في معظم بيئات المختبرات. الأدوات المطلوبة ، وكذلك الإجراءات وجمع البيانات ، بسيطة ومباشرة. باستخدام هذه الطريقة ، يمكن للمرء اختبار مجموعة متنوعة من الفرضيات ، بما في ذلك تلك المتعلقة بشلالات إشارات الخلايا والعوامل الخارجية التي تنظم إعادة ...
Disclosures
ليس لدى المؤلفين مصالح متنافسة.
Acknowledgements
نحن نعترف ببرنامج LSAMP Bridges to Doctorate للتمويل (CNK) وكذلك NIH / NIGMS (R01-GM120421 و R35-GM141886). ونحن ممتنون للدكتور كونور سيب على الشكل 1. كما نشكر جميع أعضاء مختبر Siegrist على دعمهم المستمر وإرشادهم. ونشكر بشكل خاص تشافي سود وغاري تيترز على قراءتهما المتأنية للمخطوطة وعلى تقديمهما تعليقاتهما.
Materials
| Name | Company | Catalog Number | Comments |
| 10 µL Pipette tips | Denville Sci | P2102 | |
| 1000 µL Pipette tips | Denville Sci | P2103-N | |
| 1000 µL Pipettor | Gilson | P1000 | |
| 16% paraformaldehyde (10 x 10 mL) | Electron Microscopy Sciences | 2912.60.0000 | Used for Fixation of Larval Brains |
| 20 µL Pipette | Gilson | P20 | |
| 200 µL Pipette tips | Denville Sci | 1158U56 | |
| 24-well multiwell culture plates | Fisher Scientific | 50-197-4477 | |
| 35 mm Petri dishes | Fisher Scientific | 08-757-100A | Grape Plate Ingredients |
| 4 °C refrigerator | Fisher Scientific | Provides an ideal temperature for >24 h incubations in antibody solution | |
| 63x Objective | Lecia | ||
| Active dry yeast | Most supermarkets | ||
| Agarose | Fisher Scientific | 214010 | Grape Plate Ingredients |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Fisher Scientific | C10340 | to label proliferating cells |
| Confocal Microscope | Leica | SP8 | |
| Coverslips 22 mm x 22 mm x 1 mm , 10 pack of 4 oz | Fisher Scientific | 12-544-10 | Two Coverslips are super glued to the ends of the microscope slide. This creates a space that allows for the brains to float in antifade while being imaged. |
| Coverslips, 22 mm x 50 mm x 1 mm | Fisher Scientific | 12-545E | The coverslip is placed on two square coverslips on the microscope slide ensuring that the brain in the antifade does not move while imaging. |
| Dissecting microscope | Zeiss | Stemi 2000 | |
| Ethanol 200 proof (100%), Decon Labs, 1 gallon bottle | Fisher Scientific | 2701 | Used to wash off the larvae before the 24 hr hold in culture medium |
| Fetal Bovine Serum (10%) | Sigma | F4135-100ML | Supplement for cell culture media. |
| Fine forceps for dissection | Fine Science Tools | 11295-20 | Forcepts used in disections. They work best when sharpened. |
| Fly Bottles for Crossing | Genessee Scientific | 32-130 | This bottle is used as a container that lets the flies lay eggs on the grape plate. |
| Glass Dissection Dish (3 well) | These are no longer available | ||
| Glutathione | Sigma | G6013 | Provides oxidative protection during cell culture. |
| Goat Serum | Sigma | G9023- 10ML | Blocking Agent |
| Grape Plates | Made in house | Made in house | Grape juice/agarose plates for collecting freshly hatched eggs |
| Image J | Imagej.net/fiji/downloads | Free Download: https://fiji.sc | Imaging platform that is used to count cells and Edu reactivation |
| Incubator | Thermo Fisher Scientific | Ensures that the temperature, humidity, and light exposure is exactly the same throughout experiment. | |
| Insulin | Sigma | I0516 | Independant variable of the experiment |
| Laminar flow hood | For aliquoting culture media | ||
| L-Glutamine | Sigma | G7513 | Provides support during cell culture |
| Nunc 72-well Microwell Mini Trays | Fisher Scientific | 12-565-154 | Immunostaining steps are performed in this tray |
| Parafilm | Fisher Scientific | S37440 | Film used to seal plates in order to prevent evaporation |
| Pen-Strep | Sigma | P4458-100ml | Antibiodics used to prevent bacterial contamination of cells during culture. |
| Phosphate Buffer, pH7.4 | Made in house | Made in house | Solvent used to wash the brains after fixing and staining steps |
| Pick | Fine Science Tools | 10140-01 | Used to pick larvae off of the grape plate |
| Propionic acid | Fisher Scientific | A-258 | Grape Plate Ingredients |
| Rabbit 405 | Abcam | ab175653 | Antibodies used for immunostaining |
| Rat 555 | Abcam | ab150166 | Antibodies used for immunostaining |
| Rb Scribble | A Gift from Chris Doe | Antibodies used for immunostaining | |
| Rt Deadpan | Abcam | ab195173 | Antibodies used for immunostaining |
| Schneiders Culture Medium | Life Tech | 21720024 | Contains nutrients that help the cells grow and proliferate |
| SlowFade Diamond Antifade (5 x 2 mL) | Life Tech | S36963 | Reagent that provides protection against fading fluorophores |
| Sterile Water | Autoclave Milli-Q water made in house | Needed for Solutions | |
| Sucrose | Fisher | S2-12 | Grape Plate Ingredients |
| Superfrost Microscope Slides | Fisher Scientific | 12-544-7 | |
| Superglue | Most supermarkets | ||
| Tegosept | Genesee Scientific | 20-259 | Grape Plate Ingredients |
| Triton-X 100 | Sigma | T9284-100ML | PBT |
| Welch's 100% grape grape juice | Most supermarkets | Grape Plate Ingredients |
References
- Suman, S., Domingues, A., Ratajczak, J., Ratajczak, M. Z. Potential clinical applications of stem cells in regenerative medicine. Advances in Experimental Medicine and Biology. 1201, 1-22 (2019).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Reviews Genetics. 15, 82-92 (2014).
- Daley, G. Q. Stem cells and the evolving notion of cellular identity. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 370, 20140376 (2015).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: A cellular perspective. Physiological Reviews. 99, 665-706 (2019).
- van Velthoven, C. T. J., Rando, T. A. Stem cell quiescence: Dynamism, restraint, and cellular idling. Cell Stem Cell. 24, 213-225 (2019).
- Chapman, N. M., Boothby, M. R., Chi, H. Metabolic coordination of T cell quiescence and activation. Nature Reviews Immunology. 20, 55-70 (2020).
- Wosczyna, M. N., Rando, T. A. A muscle stem cell support group: Coordinated cellular responses in muscle regeneration. Developmental Cell. 46, 135-143 (2018).
- Homem, C. C., Knoblich, J. A. Drosophila neuroblasts: a model for stem cell biology. Development. 139, 4297-4310 (2012).
- Kang, K. H., Reichert, H. Control of neural stem cell self-renewal and differentiation in Drosophila. Cell and Tissue Research. 359, 33-45 (2015).
- Chell, J. M., Brand, A. H. Nutrition-responsive glia control exit of neural stem cells from quiescence. Cell. 143, 1161-1173 (2010).
- Sousa-Nunes, R., Yee, L. L., Gould, A. P. Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila. Nature. 471, 508-512 (2011).
- Britton, J. S., Edgar, B. A. Environmental control of the cell cycle in Drosophila: nutrition activates mitotic and endoreplicative cells by distinct mechanisms. Development. 125, 2149-2158 (1998).
- Lin, S., et al. Extremes of lineage plasticity in the Drosophila brain. Current biology : CB. 23, 1908-1913 (2013).
- Sipe, C. W., Siegrist, S. E. Eyeless uncouples mushroom body neuroblast proliferation from dietary amino acids in Drosophila. Elife. 6, 26343 (2017).
- Speder, P., Brand, A. H. Systemic and local cues drive neural stem cell niche remodelling during neurogenesis in Drosophila. Elife. 7, 30413 (2018).
- Yuan, X., Sipe, C. W., Suzawa, M., Bland, M. L., Siegrist, S. E. Dilp-2-mediated PI3-kinase activation coordinates reactivation of quiescent neuroblasts with growth of their glial stem cell niche. PLoS Biology. 18, 3000721 (2020).
- Colombani, J., et al. A nutrient sensor mechanism controls Drosophila growth. Cell. 114, 739-749 (2003).
- Geminard, C., Rulifson, E. J., Leopold, P. Remote control of insulin secretion by fat cells in Drosophila. Cell Metabolism. 10, 199-207 (2009).
- Siller, K. H., Serr, M., Steward, R., Hays, T. S., Doe, C. Q. Live imaging of Drosophila brain neuroblasts reveals a role for Lis1/dynactin in spindle assembly and mitotic checkpoint control. Molecular Biology of the Cell. 16, 5127-5140 (2005).
- Prithviraj, R., Trunova, S., Giniger, E. Ex vivo culturing of whole, developing Drosophila brains. Journal of Visualized Experiments: JoVE. (65), e4270 (2012).
- Bostock, M. P., et al. An immobilization technique for long-term time-lapse imaging of explanted drosophila tissues. Frontiers in Cell and Developmental Biology. 8, 590094 (2020).
- Datta, S. Activation of neuroblast proliferation in explant culture of the Drosophila larval CNS. Brain Research. 818, 77-83 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved