A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הפעלה מחדש של תאי גזע עצביים במוח דרוזופילה מתורבת
In This Article
Summary
שיטה להפעיל מחדש תאי גזע עצביים שקטים בגרשי מוח דרוזופילה מתורבתים הוקמה. בשיטה זו, ניתן לנתק את תפקיד האותות המערכתיים מאותות מהותיים רקמה בוויסות של השבתת תאי גזע עצביים, כניסה ויציאה.
Abstract
לתאי גזע עצביים (NSCs) יש את היכולת להתרבות, להבדיל, לעבור אפופטוזיס, ואפילו להיכנס ולצאת מההירגעות. רבים מתהליכים אלה נשלטים על ידי יחסי הגומלין המורכבים בין תוכניות גנטיות מהותיות של המל"ל עם גורמים חיצוניים של המל"ל, מקומיים ומערכתיים. באורגניזם המודל הגנטי, Drosophila melanogaster, NSCs, המכונה נוירובלסטים (NBs), לעבור מ quiescence להתפשטות במהלך המעבר העוברי לזחל. במהלך תקופה זו, זחלים מגיחים מקליפות הביצים שלהם ומתחילים לזחול, בחיפוש אחר חומרים מזינים תזונתיים. בתגובה להאכלת בעלי חיים, גוף השומן, איבר אנדוקריני עם יכולת אחסון שומנים בדם, מייצר אות, אשר משתחרר באופן שיטתי לתוך המולימפה במחזור. בתגובה לאות שמקורו בגוף השומן (FBDS), פפטידים דמויי אינסולין Drosophila (Dilps) מיוצרים ומשוחררים מתאי עצב neurosecretory במוח וגליה, מה שמוביל להפעלה במורד הזרם של פי3-קינאז צמיחה איתות NBs ואת נישה גליה וקשת קנה הנשימה שלהם. למרות שזהו המודל הנוכחי לאופן שבו NBs עוברים מדיכאון להתפשטות, אופיו של האות החיצוני FBDS נשאר חמקמק. כדי להבין טוב יותר כיצד רמזים מערכתיים חיצוניים של NB מווסתים את היציאה מדיכאון, פותחה שיטה לתרבות המוחות הזחליים המוקדמים במבחנה לפני האכלת בעלי חיים. בשיטה זו, ניתן לספק גורמים אקסוגניים למדיה התרבותית וליציאה של NB מהקיפאון. מצאנו כי אינסולין אקסוגני מספיק כדי להפעיל מחדש NBs מ quiescence ב explants כל המוח. מכיוון ששיטה זו מתאימה היטב למסכים בקנה מידה גדול, אנו שואפים לזהות רמזים חיצוניים נוספים המסדירים את השבתת NB לעומת החלטות התפשטות. מכיוון שהגנים והמסלולים המסדירים את החלטות התפשטות המל"ל נשמרים אבולוציונית, התוצאות של בדיקה זו יכולות לספק תובנה לשיפור הטיפולים הרגנרטיביים במרפאה.
Introduction
תאי גזע הם עניין רב בגלל הפוטנציאל שלהם לשימוש ברפואה רגנרטיבית 1,2. בעלי חיים רבים, במיוחד אלה שחיו זמן רב, שומרים על תאי גזע בתוך הרקמות הבוגרות שלהם. תאי גזע מקומיים אלה פועלים כדי לשמור על הומאוסטזיס רקמות ומנוצלים לתיקון בעקבות פגיעה גופנית או מחלה 3,4. רוב תאי הגזע בבעלי חיים בוגרים הם רגיעה, מצב רדום יחסית המאופיין על ידי מעצר מחזור התאים ואיון של צמיחה איתות5. בתגובה לרמזים חיצוניים, תאי גזע יוצאים מדיכאון, נכנסים למחזור התא ומתחילים לייצר צאצאי בת ספציפיים לסוג הרקמה שלהם. לדוגמה, על מנת להרכיב תגובה חיסונית יעילה, תאים המציגים אנטיגן גורמים לתאי T נאיביים רגיעה להיכנס למחזור התאים ולהתרחב באופן קלוני6. בתגובה לנזק לשרירי השלד, תאי גזע לווין שריר להיכנס מחזור התא וליצור myoblasts הבת להחליף myofibrils פגום 5,7. אמנם ברור כי תאי גזע שקטים מגיבים לאותות חיצוניים, במקרים רבים, אופיו של הסימן החיצוני נותר לא ברור, כמו גם את המנגנון של הפעלת תאי גזע הנגרמים על ידי אותות. השגת הבנה טובה יותר של האופן שבו תאי גזע שקטים מגיבים לרמזים חיצוניים ונכנסים למחזור התאים תסייע בפיתוח טיפולים טובים יותר בתאי גזע במרפאה ותגביר את הידע המדעי.
במשך עשרות שנים, אורגניזמים מודל שימשו כדי לחשוף את הגנים ואת מסלולי איתות התאים המסדירים את התפשטות תאי הגזע במהלך ההתפתחות ובבגרות. ב Drosophila, תאי גזע עצביים (NSCs), המכונה neuroblasts (NBs), לחלק לאורך כל הפיתוח כדי ליצור את כל הנוירונים גליה כי בסופו של דבר לשלב, ויוצרים את המעגל העצבי הנדרש לתפקוד המוח 8,9. כמו תאי גזע אחרים, NBs מתחלקים באופן אסימטרי לחידוש עצמי, ובמקרים מסוימים, באופן סימטרי כדי להרחיב את מאגר תאי הגזע. NBs מצוינים במהלך העובר ורובם נכנסים לרגיעה לקראת הסוף, במקביל לירידה בחנויות התזונתיים האימהיות (איור 1). לאחר השלמת העובר, הזחלים בוקעים ומתחילים לאכול. בתגובה להאכלת בעלי חיים, NBs להפעיל מחדש מן השבתה ולחדש חלוקת תאים 10,11,12,13,14,15,16. מכיוון שמערכת העצבים המרכזית של Drosophila היא פשוטה יחסית ומכיוון ש- NBs נכנסים ויוצאים מהשבתה בזמנים מוגדרים, השימוש בדרוסופילה כדי לחקור את הרגולציה של רגיעה, כניסה ויציאה, מוכיח אידיאלי.
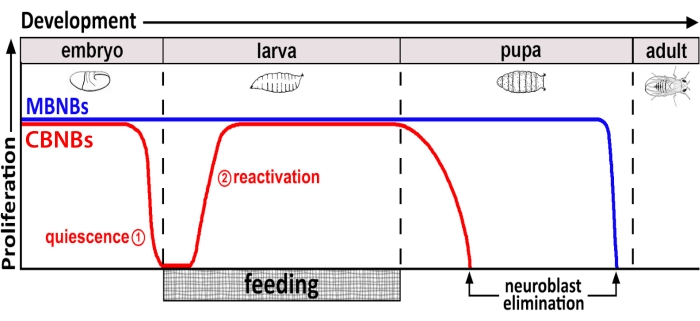
איור 1: התפשטות יחסית של CB NBs (נוירובלסטים במוח מרכזי, אדום) ו- MB NBs (נוירובלסטים של גוף פטריות, כחול) לאורך זמן התפתחותי. בסוף העובר, רוב NBs (קו אדום) להפסיק התפשטות ולהיכנס רגיעה. השקט נמשך עד שזחלים טריים בקעו צורכים את הארוחה המלאה הראשונה שלהם. נקודות הזמן של המיקוד עבור מתודולוגיה זו מסומנות בעיגולים אדומים (1, quiescence ו 2, הפעלה מחדש). MB NBs (כחול) הם תת-קבוצה של NBs במוח המרכזי המתחלקים ללא הרף לאורך כל ההתפתחות (4 לכל חצי הכדור במוח). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בתגובה להאכלת בעלי חיים, מסלולי איתות צמיחה PI3-kinase ו- TOR הופכים פעילים ב- NBs ובנישה גליה וקנה הנשימה שלהם 10,11,15,16. כאשר חומרים מזינים תזונתיים נסוגים או כאשר רמות של PI3-קינאז מופחתים, NBs אינם מצליחים להפעיל מחדש וצמיחה של גליה וקשת הנשימה מופחתים גם 10,11,15,16. המודל הנוכחי מניח כי הפעלה מחדש של NB מצמידה לצמיחת הזחל על ידי גוף השומן, אשר משחרר אות מערכתי בתגובה להאכלת בעלי חיים 12,17,18. אות זה, שנותר חמקמק, מקדם ככל הנראה את הביטוי והשחרור של פפטיד דמוי אינסולין Drosophila (Dilps) במוח, מה שמוביל להפעלה במורד הזרם של PI3-קינאז ב- NBs ואת נישה גליה וקנה הנשימה שלהם. כדי להבין טוב יותר את טבעם של הסימנים המערכתיים, פיתחנו שיטה להפעלה מחדש של NBs רגיעה בביטויי מוח מתורבתים. בשיטה זו, ניתן לבצע הפעלה מחדש של NBs בהיעדר רמזים מערכתיים של בעלי חיים שלמים. גורמים אקסוגניים יכולים להיות resupplied לתקשורת התרבות ואת NB הפעלה מחדש נבדק בהתבסס על שילוב של אנלוגי thymidine, EdU. בשיטה זו, קבענו כי אינסולין אקסוגני מספיק כדי להפעיל מחדש NBs רגיעה ב explants המוח. עבודה עתידית תהיה מכוונת לזהות גורמים נוספים, אשר, כאשר מתווספים בחזרה, או חיובי או שלילי לווסת את ההשבתה NB ב explants המוח.
Protocol
1. אוסף זחלי דרוזופילה
הערה: הכן את צלחת השמרים, ממרח הענבים ואת הדירה לטוס לפני תחילת:
- ממרח שמרים: במיכל קטן, מערבבים 5 גרם של שמרים יבשים פעילים עם 10 מ"ל של מים כדי ליצור משחה שיש לה את העקביות של חמאת בוטנים. מכסים את משחת השמרים בניילון נצמד ומשתמשים בגומייה כדי לחבר אותה בחוזקה למיכל.
הערה: ממרח שמרים טריים יתרחב במיכל שלו ויפתח את המכסה אלא אם כן הוא מחובר היטב. ממרח שמרים יימשך מספר ימים בטמפרטורת החדר (RT). - צלחות ענבים: עקבו אחר המתכון להכנת צלחות ענבים (טבלה 1). אם אתם משתמשים בצלחות המאוחסנות בטמפרטורה של 4 מעלות צלזיוס, הקפידו לחמם מראש צלחות לפני השימוש על ידי הצבתן ב-RT למשך שעה אחת.
- מערבבים מים (750 מ"ל) ואגר (18.75 גרם) בבקבוקון 4 ליטר, מערבולת ואוטוקלאב למשך 20 דקות (מחזור נוזלי).
- מערבבים את מיץ הענבים (250 מ"ל) וסוכרוז (25 גרם) בבקבוקון 1 L עם מוט ערבוב גדול על צלחת מחוממת (חום נמוך). כאשר הסוכרוז מתמוסס, לכבות את החום, לחכות עד הבקבוקון ניתן לגעת לפני הוספת Tegosept (10%, 4 מ"ל) וחומצה Propionic (5 מ"ל). תשאיר את המהומה דולקת.
- כאשר autoclaving הושלם, תן לו להתקרר עד הבקבוק ניתן לגעת (~ 60 °C (~ 60 °C ((60 °F), ולאחר מכן לערבב את תערובת מיץ ענבים.
- מערבבים את כל הפתרונות בבקבוקון אחד ומניחים לערבב על הצלחת.
- פיפטה הפתרון לתוך מכסים של מנות פטרי בגודל קטן (35 מ"מ). פיפטה בערך 9 מ"ל לכל מכסה או עד שמתקבלת כיפה קמורה.
- אופציונלי: להבה את המכסים כדי להיפטר מכל בועות.
- כאשר הצלחות מתמצקות, עורמים את צלחות הענבים לתוך קופסה עם מכסה אטום ומניחים את הקופסה בטמפרטורה של 4 מעלות צלזיוס. ניתן לאחסן צלחות עד חודש אחד.
- דירה מעופפת: יש לגרוף כ-20 חורים בבקבוק פוליפרופילן דרוזופילה מרובע בגודל 6 אונקיות באמצעות מחט של 18 גרם.
- העבר זבובים למבוגרים (~ 100 OregonR או כל גנוטיפ) לדירה זבובים וכסה את הדירה עם צלחת אגר ענבים עם טיפה של ממרח שמרים. מניחים את הטפטוף לכיוון מרכז הצלחת ומצמידים את הצלחת לדירה עם סרט מעבדה.
- הפכו את המיכל כך שצלחת אגר הענבים תהיה בתחתית והניחו אותה בחממה של 25 מעלות צלזיוס למשך 24 שעות (איור 2).
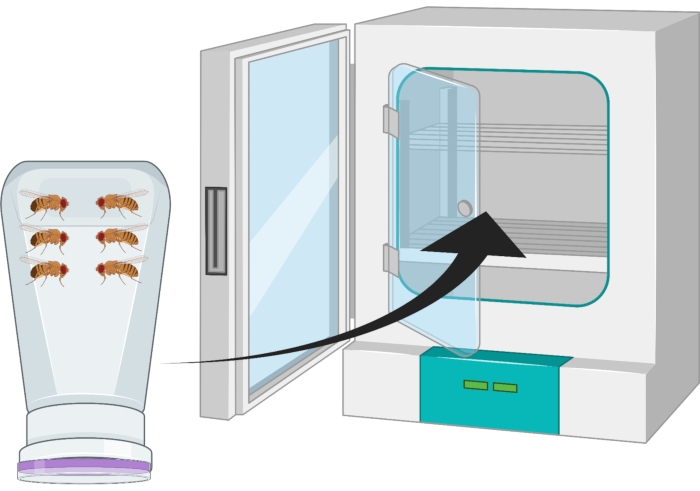
איור 2: ייצוג חזותי של בקבוק זבוב הפוך (דירה) עם מבוגרים דרוזופילה גברים ונשים. בקבוק הפלסטיק כולל נקבים קטנים, שנוצרו עם מחט 18 גרם, להחלפת חמצן. פי הבקבוק אטום בכובע מיץ ענבי אגר והוא הפוך ומאוחסן בחממה של 25 מעלות צלזיוס. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- לאחר 24 שעות, לשנות את צלחת אגר ענבים ולהחליף אותו עם צלחת חדשה עם ממרח שמרים. החלף במהירות את שתי הצלחות תוך הקשה מתמדת על הדירה קלות על הספסל, כך שהזבובים הבוגרים לא יברחו.
- לבחון את הצלחת בעין ולהעריך את מספר העוברים על הצלחת. עוברים Drosophila הם מלבניים ולבנים עם שני נספחים דמויי מחרוזת.
- אם יש מעט מאוד עוברים על הצלחת (פחות מ -100), להשליך את הצלחת (לגרד את אגר לתוך האשפה הזבוב ולשמור את מכסה הפלסטיק לשימוש חוזר). במקרים רבים, נקבות בוגרות לא יניחו עוברים רבים בלילה הראשון בדירה חדשה. אם זה המקרה, לתת למבוגר טס עוד 24 שעות כדי להתאקלם.
- אם יש מספר גדול של עוברים על הצלחת (לפחות 100), לשמור אותו, ולהסיר בזהירות את הדבק שמרים באמצעות מרית תחתונה שטוחה.
- לאחר הסרת ממרח השמרים, השתמש בקטיף מתכת כדי להסיר באופן ידני את כל הזחלים מצלחת הענבים תחת מיקרוסקופ מנתח. כאשר מסתכלים על הצלחת תחת מיקרוסקופ מנתח, זחלים זוחלים יש לראות, כמו גם עוברים.
- הסר את כל הזחלים על ידי צחצוח דוקרן המתכת לכיוון הצד של זחל אחד. הזחלים דביקים וייצמדו לבחירה. ברגע זחל אחד הוא על הבחירה, זחלים נוספים ניתן להרים בקלות באמצעות הזחל על הכלי כדי לצרף יותר.
הערה: זחלים אוהבים לדבוק זה בזה. בשלב זה, זה לא משנה אם זחלים ניזוקו. הזחלים האלה יושלכו. - לאחר קטיף והסרה של כל הזחלים, מניחים את הצלחת בחזרה לתוך אינקובטור 25 °C (60 °F). ודא למקם את הצלחת במיכל גדול יותר שניתן לאטום. מניחים מגבות נייר רטובות בתחתית המיכל הגדול יותר כדי לשמור על לחות.
- לאחר 30-60 דקות, לקחת את הצלחת בחזרה למיקרוסקופ לנתח ועכשיו, בזהירות לבחור ~ 20-25 זחלים מאותה צלחת אגר ענבים כדי להבטיח כי הזחלים שנקטפו הם בקעו טרי בתוך חלון זמן 30-60 דקות.
- שקועים בקצה הכלי עם 20-25 זחלים טריים בקעו לתוך צלחת פטרי (60 מ"מ) מלא 1-2 מ"ל של 1x פוספט תמיסת מלח חוצץ (PBS) במשך 2 דקות.
- לאחר 2 דקות, להטות את המנה בזווית כדי לאסוף את הנוזל בתחתית. בעזרת מברשת צבע קטנה, מברישים את הזחלים מהנוזל בתחתית צלחת הפטרי.
- לאסוף את כל הזחלים על מברשת הצבע ולהעביר את הזחלים לצלחת פטרי חדשה (60 מ"מ) המכילה 1-2 מ"ל של 70% אתנול. חזור על שלבים 1.15 כדי לאסוף זחלים עם מברשת צבע ולהעביר אותם לצלחת פטרי חדשה עם 1-2 מ"ל של 1x PBS.
2. מדיה תרבותית והכנת כלים
- לרסס את הספסל ואת פינת העבודה עם 70% אתנול ולתת יבש.
- מרססים את כלי הניתוח, המלקחיים ושתי מנות שעון הזכוכית, עם 70% אתנול ומניחים להם להתייבש על הספסל.
- הפוך את המדיה הנוספת של שניידר (SSM, טבלה 2) ולהניח אותו על קרח.
- פיפטה 1 מ"ל של SSM לתוך כל אחת מכלי השעון זכוכית.
- בעזרת מיקרופיפט עם קצה סטרילי, העבירו את הזחלים הטריים שבקעו מצלחת ה-PBS ל-SSM בצלחת שעון הזכוכית הראשונה. בעזרת מיקרופיפט עם קצה סטרילי, העבירו את הזחלים הטריים שבקעו ל-SSM בצלחת שעון הזכוכית השנייה.
3. ניתוחים ותרביות מוח
- ברגע שהזחלים נמצאים בצלחת השעון השנייה מזכוכית עם SSM, מנתחים את המוחות מתוך הזחלים באמצעות מלקחיים ומיקרוסקופ מנתח. התאם את ההגדלה לפי הצורך.
- השתמשו במלקחיים אחד כדי לתפוס את קרסי הפה ובשני, תפסו בעדינות את הגוף באמצע הדרך למטה ומשכו בכיוון ההפוך (איור 3) כדי לפצל את הזחל לשני חלקים.
הערה: המוח יהיה ממוקם ממש מאחורי ווים הפה. שים לב כי ייתכן שיש רקמות אחרות המקיפות את המוח. היזהר מאוד בעת הסרת רקמות אלה כפי שהוא יכול לגרום נזק למוח

איור 3: זחלי דרוסופילה בצלחת שעון זכוכית עם SSM. מלקחיים ממוקמים כראוי לנתיחה. מיקומו של מוח הזחל (אפור כהה) הוא אחורי לקרסים בפה (שחור), ושניהם מוצגים בתוך הזחל. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- לאחר ש-15-20 מוחות נותחו, הוסיפו מ"ל אחד של SSM לבאר אחת של מגש תרבות סטרילי בן 12 בארות. העבירו את המוחות המנותחים הטריים ל-SSM באמצעות מיקרו-פיקאט וטיפ סטרילי (איור 4A).
- הניחו את המוחות במדיה של SSM במגש התרבות בן 12 הבארות באינקובטור בטמפרטורה של 25 °C (25 °F) למשך 24 שעות (איור 4A).

איור 4: תרבות המוח וחיסון. (A) מוח שלם בצלחת תרבות של 12 בארות המכילה 1 מ"ל של SSM. צלחת התרבות ממוקמת לאחר מכן בחממה של 25 מעלות צלזיוס למשך 24 שעות. (B) מגש מיני של 72 בארות שמחזיק את המוח explants במהלך החיסון. המוח נשטף ופתרונות מועברים באמצעות micropipette P20 להגדיר 10 μL. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. בדיקת התפשטות, קיבוע מוחי וכתמי נוגדנים
- למחרת, לעשות 1 מ"ל של פתרון SSM EdU. Pipette 10 μL של מלאי 10 מ"מ של 5-אתיניל-2′-deoxyuridine (EdU) עם 990 μL של SSM (ריכוז EdU הסופי שווה 0.1 mM) לתוך צינור microcentrifuge סטרילי ומערבבים. לאחר השלמת הדגירה של 24 שעות, פיפטה 1 מ"ל של EdU SSM לתוך באר אחת של מגש התרבות סטרילי 12-well.
- העבר את המוח באמצעות micropipette עם קצה סטרילי מן הבאר המכילה SSM רק לבאר החדשה המכילה את פתרון EdU SSM. דגירה במשך שעה אחת ב 25 °C (50 °F).
- לאחר מכן, להעביר את המוחות המסומנים EdU לבאר אחרת באותו מגש תרבות המכיל 1 מ"ל של קבוע (4% paraformaldehyde, ראה טבלה 3 למתכון) במשך 20 דקות.
אזהרה: Paraformaldehyde הוא סכנה ביולוגית ויש להיפטר ממנו כראוי. - לאחר הקיבעון, העבירו במהירות את המוחות לבארות של מגש מיני בן 72 בארות באמצעות מיקרופיפט. כל באר יכולה להכיל 10 מוחות ו-10-15 μL של נוזל (איור 4B). לאחר שהמוח מועבר למגש המיני (לא יותר מ-10 מוחות לבאר), הסירו את התיקון ושטפו את המוח 3 פעמים ב-10 μL של 1x PBT (מאגר פוספט, pH 7.4 המכיל 0.1% טריטון-X 100).
הערה: שטיפה פירושה צנרת 10 μL של 1x PBT על המוח, הסרה, וחזרה על עצמה 3 פעמים. - לאחר מכן, לשטוף את המוח 3 פעמים במשך 10 דקות כל אחד, שוב ב 10 μL 1x PBT. ודא שהמוחות מכוסים בנוזל כלשהו בכל עת.
- לאחר השלמת השטיפות, פיפטה 10 μL של פתרון חסימה (1x PBT עם 10% סרום עזים רגיל) על המוח. מכסים את המגש וחותמים אותו באמצעות רצועה של parafilm סביב הקצה.
- לאחר האטימה, מניחים את המגש הקטן לתוך קופסה אטומה עם מגבות רטובות כדי לספק סביבה לחה למניעת אידוי. מניחים את הקופסה המכילה את המגש בטמפרטורה של 4 מעלות צלזיוס למשך הלילה.
- למחרת, לעשות פתרון נוגדנים ראשוני.
הערה: בפרוטוקול זה, ארנב אנטי שרבוט שימש לתיוג קרום התא ואנטי deadpan חולדה לתייג נוירובלסטים, אם כי כל מספר של נוגדנים ראשוניים אחרים יכול לשמש.- כדי להפוך את פתרון הנוגדנים העיקרי, ראשית, לעשות דילול של נוגדנים ראשוניים בפתרון החסימה. לדוגמה, ארנב אנטי שרבוט משמש בריכוז הסופי של 1:1000. לכן, ראשית, לדלל את הארנב נגד שרבוטים נוגדן ב 1:100 (1 μL של נוגדן בתוספת 99 μL של פתרון חסימה). עכברוש-deadpan משמש בריכוז הסופי של 1:100. לכן, ראשית, לדלל את נוגדן החולדה deadpan ב 1:10 (1 μL של נוגדן בתוספת 9 μL של פתרון חסימה).
הערה: דילולים אלה ניתן לאחסן לטווח ארוך ב 4 °C (4 °F) אם נתרן אזיד (0.05%) הוא הוסיף גם כדי לעכב את הצמיחה חיידקית. - לאחר מכן, ספור את מספר הבארות המכילות מוחות. מספר הבארות קובע את הנפח של פתרון הנוגדנים העיקרי לעשות. לדוגמה, אם יש 2 בארות של מוח, להכין 20 μL של פתרון נוגדנים ראשוני (עבור 10 בארות, 100 μL, וכו '). כדי להפוך את פתרון נוגדן ראשוני 20 μL, להוסיף 2 μL של כל דילול נוגדנים ראשוני ו 16 μL של פתרון החסימה.
הערה: הריכוז הסופי של כל אחד מהנוגדנים העיקריים הוא 1:1000 ו-1:100, בהתאמה. בקיצור, לעשות את הדילול הראשון של נוגדנים ראשוניים בריכוז, כך הדילול השני הוא תמיד 1:10 כדי להגיע לריכוזים הסופיים המתאימים. במקרה זה, 1: 1000 עבור ארנב נגד שרבוטים ו 1: 100 עבור חולדה נגד deadpan.
- כדי להפוך את פתרון הנוגדנים העיקרי, ראשית, לעשות דילול של נוגדנים ראשוניים בפתרון החסימה. לדוגמה, ארנב אנטי שרבוט משמש בריכוז הסופי של 1:1000. לכן, ראשית, לדלל את הארנב נגד שרבוטים נוגדן ב 1:100 (1 μL של נוגדן בתוספת 99 μL של פתרון חסימה). עכברוש-deadpan משמש בריכוז הסופי של 1:100. לכן, ראשית, לדלל את נוגדן החולדה deadpan ב 1:10 (1 μL של נוגדן בתוספת 9 μL של פתרון חסימה).
- הסר את פתרון החסימה עם micropipette להגדיר 10 μL ו pipette 10 μL של פתרון נוגדנים ראשוני לתוך כל באר.
- מכסים ואטמים את המגש באמצעות parafilm ומחזירים אותו לקופסה האטומה עם מגבות רטובות. דגירה לילה ב-4 מעלות צלזיוס.
הערה: רעד אינו נדרש והוא מיואש מאוד. נוגדנים יחדרו למוח מבלי לרעוד או לערבב. - למחרת, להסיר את תמיסת הנוגדנים העיקרית באמצעות micropipette ולשטוף את המוח 3 פעמים עם 10 μL של 1x PBT. לאחר מכן, לשטוף את המוח 4 פעמים עם 10 μL של 1x PBT במשך 10 דקות כל אחד. במהלך 10 דקות שטיפות, להכין את פתרון הנוגדנים המשני.
- כדי ליצור את תמיסת הנוגדנים המשנית, בחרו בנוגדנים משניים המזהים את הנוגדנים העיקריים. בפרוטוקול זה, עז נגד ארנב אלכסה פלואור 488 ועז נגד חולדה Alexa 555 שימשו.
- Pipette 1 μL של כל אחד מהנוגדנים המשניים לתוך צינור microcentrifuge עם 298 μL של פתרון החסימה כדי להפוך את הריכוז הסופי 1:300 עבור כל נוגדן משני.
- לאחר 10 הדקות האחרונות לשטוף, להסיר את 1x PBT ו pipette 10 μL של פתרון הנוגדנים המשני לתוך כל באר. לאטום את המגש באמצעות parafilm ולהחזיר אותו לתוך הקופסה עם מגבות לחות. דגירה לילה ב-4 מעלות צלזיוס.
הערה: אל תדאגו לגבי הסרת כל μL האחרון בבארות בין שטיפות, שטיפות, או בעת הוספת פתרונות נוגדנים ראשוניים ומשניים. המוחות תמיד יישארו שקועים בכמה מיקרו-אל של נוזלים, שזה בסדר גמור. - למחרת, להסיר את פתרון הנוגדנים המשני באמצעות micropipette ולשטוף את המוח 3 פעמים עם 10 μL כל אחד של 1x PBT. לאחר מכן, לשטוף את המוח 4 פעמים עם 10 μL כל אחד של 1x PBT במשך 10 דקות כל אחד.
- במהלך 10 דקות שטיפות, להכין את תערובת התגובה EdU כדי לזהות התאגדות EdU. הכן את תמהיל התגובה של EdU בהתאם להנחיות היצרנים.
- לאחר הכביסה הסופית, להסיר את 1x PBT ו pipette 10 μL של תגובת EdU לערבב לתוך כל באר עם המוח. לאטום את צלחת microwell עם parafilm לכסות עם רדיד אלומיניום. להשאיר את הצלחת על הספסל במשך 30 דקות.
- לאחר 30 דקות, לשטוף את המוח 3 פעמים עם 10 μL כל אחד של 1x PBT ולשטוף את המוח 3 פעמים עם 10 μL כל אחד של 1x PBT במשך 5 דקות כל אחד.
- לאחר הכביסה האחרונה, להסיר את 1x PBT ו פיפטה 10 μL של פתרון מדיה הרכבה מבוסס גליצרול. לאטום את הצלחת ומניחים ב 4 °C (65 °F) לילה.
5. הרכבה והדמיה של המוחות
- למחרת, הכינו שקופיות מיקרוסקופ (25 מ"מ x 75 מ"מ x 1 מ"מ): דבק (למשל, דבק) אחד 22 מ"מ x 22 מ"מ x 22 מ"מ x 1 מ"מ זכוכית כיסוי מרובעת לכל קצה של שקופית המיקרוסקופ כדי ליצור 'גשר' שעליו יוצב כיסוי גדול יותר של 22 מ"מ x 50 מ"מ x 1 מ"מ x 1 מ"מ לכסות כדי ליצור רווח בין השקופית לבין כיסוי כיסוי גדול יותר (איור 5A). מרחב זה יאפשר למוח מספיק תנועה כדי להיות מכוון כראוי תוך מניעת ריסוקו.

איור 5: סכמטי המציג שקופיות מיקרוסקופ, אוריינטציה וסוגי תאים במוח הזחל. (A) ייצוג חזותי של שקופית מיקרוסקופ שעליה מותקן מוח זחל ומוכן לצילום. (B) קו מנחה מוצג גם לשימוש עבור אוריינטציה רקמות. (ג) שקופית מיקרוסקופ מוכנה להדמיה במיקרוסקופ קונפוקלי. (D) קריקטורה המציגה כמה מסוגי התאים במוח הזחל. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- לאחר הדבקת 22 מ"מ x 22 מ"מ x 22 מ"מ x 1 מ"מ מכסה משקפיים למגלשת המיקרוסקופ, פיפטה 9.3 μL של תמיסת מדיה הרכבה מבוססת גליצרול המכילה מוח אחד מבאר של צלחת המיקרווול ומניחים אותו על מרכז השקופית (איור 5A).
הערה: מוחות זחלים עשויים לדבוק בקצה הפיפטה, אז היזהרו. כדי למנוע הידבקות, התחל על ידי שאיפה antifade ולאחר מכן שאיפה המוח הבודד לקראת סוף נפח 9.3 μL. - ברגע שהמוח נמצא במגלשה, מניחים בעדינות את כיסוי 22 מ"מ x 50 מ"מ x 1 מ"מ על גבי. מקם את המוח כפי שניתן לראות באיור 5B. הזיזו בעדינות את כיסוי הכיסוי כדי לכוון את המוח. לאחר מכן הדגימה מוכנה להדמיה.
- השתמשו במיקרוסקופ קונפוקלי המצויד בהגדלה גבוהה ובמטרת צמצם מספרי גבוהה (איור 5C) כדי להשיג את התמונות הטובות ביותר. לדוגמה: 60x או 63x, 1.4 NA שמן-טבילה עדשה.
- דמיינו את המוחות עם המשטח הגבי הקרוב ביותר לכיסוי (ואובייקטיבי). לרכוש את ערימות Z דרך חצי הכדור במוח כולו החל על פני השטח הגחון (הרחוק ביותר מן המטרה) במרווחי 1 מיקרומטרה או גודל צעד Z.
הערה: הלייזרים המשמשים תלויים בנוגדנים המשניים. בפרוטוקול זה, קווי הלייזר המשמשים היו 488 ננומטר כדי לזהות כתמי שרבוט, 555 ננומטר כדי לזהות Deadpan, ו 633 ננומטר כדי לזהות EdU.
- דמיינו את המוחות עם המשטח הגבי הקרוב ביותר לכיסוי (ואובייקטיבי). לרכוש את ערימות Z דרך חצי הכדור במוח כולו החל על פני השטח הגחון (הרחוק ביותר מן המטרה) במרווחי 1 מיקרומטרה או גודל צעד Z.
6. ניתוח נתונים
- השתמש בתוכנת קוד פתוח של פיג'י כדי לנתח את ההמיספרות במוח ולהשתמש בתוסף מונה התאים של פיג'י כדי לספור את התאים.
תוצאות
מוחות פראיים טריים של אורגוןR נותחו ותרבות במשך 24 שעות בתוספת מדיה של שניידר (SSM) עם אינסולין. הרקמות תוקנו והוכתמו על פי הפרוטוקול. נעשה שימוש בנוגדנים ראשוניים שנוצרו נגד Deadpan (Dpn) כדי לזהות NBs ושרבוט לסימון קרום התא. תימידין אנלוגי 5-אתיניל-2′-deoxyuridine (Edu) נוספה כדי לזהות כניסה שלב S והפעלה מחד?...
Discussion
השיטה המתוארת כאן כדי לתרבות המוח explants יכול להתבצע ברוב סביבות המעבדה. הכלים הנדרשים, כמו גם ההליך ואיסוף הנתונים, הם פשוטים ופשוטים. בשיטה זו, ניתן לבדוק מגוון של השערות, כולל אלה הקשורות מפלי איתות התא וגורמים חיצוניים המסדירים הפעלה מחדש של NB והתפשטות. כאן, באמצעות חיות אורגוןR מסוג בר, מ?...
Disclosures
למחברים אין אינטרסים מתחרים.
Acknowledgements
אנו מכירים בתוכנית LSAMP Bridges to Phate למימון (CNK) כמו גם NIH/ NIGMS (R01-GM120421 ו- R35-GM141886). אנו מודים לד"ר קונור סייפ על איור 1. אנו מודים גם לכל חברי המעבדה של סיגריסט על תמיכתם המתמשכת והחונכות שלהם. אנו מודים במיוחד לצ'אבי סוד וגארי טיטרס על הקריאה הקפדנית של כתב היד ועל מתן הערות.
Materials
| Name | Company | Catalog Number | Comments |
| 10 µL Pipette tips | Denville Sci | P2102 | |
| 1000 µL Pipette tips | Denville Sci | P2103-N | |
| 1000 µL Pipettor | Gilson | P1000 | |
| 16% paraformaldehyde (10 x 10 mL) | Electron Microscopy Sciences | 2912.60.0000 | Used for Fixation of Larval Brains |
| 20 µL Pipette | Gilson | P20 | |
| 200 µL Pipette tips | Denville Sci | 1158U56 | |
| 24-well multiwell culture plates | Fisher Scientific | 50-197-4477 | |
| 35 mm Petri dishes | Fisher Scientific | 08-757-100A | Grape Plate Ingredients |
| 4 °C refrigerator | Fisher Scientific | Provides an ideal temperature for >24 h incubations in antibody solution | |
| 63x Objective | Lecia | ||
| Active dry yeast | Most supermarkets | ||
| Agarose | Fisher Scientific | 214010 | Grape Plate Ingredients |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Fisher Scientific | C10340 | to label proliferating cells |
| Confocal Microscope | Leica | SP8 | |
| Coverslips 22 mm x 22 mm x 1 mm , 10 pack of 4 oz | Fisher Scientific | 12-544-10 | Two Coverslips are super glued to the ends of the microscope slide. This creates a space that allows for the brains to float in antifade while being imaged. |
| Coverslips, 22 mm x 50 mm x 1 mm | Fisher Scientific | 12-545E | The coverslip is placed on two square coverslips on the microscope slide ensuring that the brain in the antifade does not move while imaging. |
| Dissecting microscope | Zeiss | Stemi 2000 | |
| Ethanol 200 proof (100%), Decon Labs, 1 gallon bottle | Fisher Scientific | 2701 | Used to wash off the larvae before the 24 hr hold in culture medium |
| Fetal Bovine Serum (10%) | Sigma | F4135-100ML | Supplement for cell culture media. |
| Fine forceps for dissection | Fine Science Tools | 11295-20 | Forcepts used in disections. They work best when sharpened. |
| Fly Bottles for Crossing | Genessee Scientific | 32-130 | This bottle is used as a container that lets the flies lay eggs on the grape plate. |
| Glass Dissection Dish (3 well) | These are no longer available | ||
| Glutathione | Sigma | G6013 | Provides oxidative protection during cell culture. |
| Goat Serum | Sigma | G9023- 10ML | Blocking Agent |
| Grape Plates | Made in house | Made in house | Grape juice/agarose plates for collecting freshly hatched eggs |
| Image J | Imagej.net/fiji/downloads | Free Download: https://fiji.sc | Imaging platform that is used to count cells and Edu reactivation |
| Incubator | Thermo Fisher Scientific | Ensures that the temperature, humidity, and light exposure is exactly the same throughout experiment. | |
| Insulin | Sigma | I0516 | Independant variable of the experiment |
| Laminar flow hood | For aliquoting culture media | ||
| L-Glutamine | Sigma | G7513 | Provides support during cell culture |
| Nunc 72-well Microwell Mini Trays | Fisher Scientific | 12-565-154 | Immunostaining steps are performed in this tray |
| Parafilm | Fisher Scientific | S37440 | Film used to seal plates in order to prevent evaporation |
| Pen-Strep | Sigma | P4458-100ml | Antibiodics used to prevent bacterial contamination of cells during culture. |
| Phosphate Buffer, pH7.4 | Made in house | Made in house | Solvent used to wash the brains after fixing and staining steps |
| Pick | Fine Science Tools | 10140-01 | Used to pick larvae off of the grape plate |
| Propionic acid | Fisher Scientific | A-258 | Grape Plate Ingredients |
| Rabbit 405 | Abcam | ab175653 | Antibodies used for immunostaining |
| Rat 555 | Abcam | ab150166 | Antibodies used for immunostaining |
| Rb Scribble | A Gift from Chris Doe | Antibodies used for immunostaining | |
| Rt Deadpan | Abcam | ab195173 | Antibodies used for immunostaining |
| Schneiders Culture Medium | Life Tech | 21720024 | Contains nutrients that help the cells grow and proliferate |
| SlowFade Diamond Antifade (5 x 2 mL) | Life Tech | S36963 | Reagent that provides protection against fading fluorophores |
| Sterile Water | Autoclave Milli-Q water made in house | Needed for Solutions | |
| Sucrose | Fisher | S2-12 | Grape Plate Ingredients |
| Superfrost Microscope Slides | Fisher Scientific | 12-544-7 | |
| Superglue | Most supermarkets | ||
| Tegosept | Genesee Scientific | 20-259 | Grape Plate Ingredients |
| Triton-X 100 | Sigma | T9284-100ML | PBT |
| Welch's 100% grape grape juice | Most supermarkets | Grape Plate Ingredients |
References
- Suman, S., Domingues, A., Ratajczak, J., Ratajczak, M. Z. Potential clinical applications of stem cells in regenerative medicine. Advances in Experimental Medicine and Biology. 1201, 1-22 (2019).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Reviews Genetics. 15, 82-92 (2014).
- Daley, G. Q. Stem cells and the evolving notion of cellular identity. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 370, 20140376 (2015).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: A cellular perspective. Physiological Reviews. 99, 665-706 (2019).
- van Velthoven, C. T. J., Rando, T. A. Stem cell quiescence: Dynamism, restraint, and cellular idling. Cell Stem Cell. 24, 213-225 (2019).
- Chapman, N. M., Boothby, M. R., Chi, H. Metabolic coordination of T cell quiescence and activation. Nature Reviews Immunology. 20, 55-70 (2020).
- Wosczyna, M. N., Rando, T. A. A muscle stem cell support group: Coordinated cellular responses in muscle regeneration. Developmental Cell. 46, 135-143 (2018).
- Homem, C. C., Knoblich, J. A. Drosophila neuroblasts: a model for stem cell biology. Development. 139, 4297-4310 (2012).
- Kang, K. H., Reichert, H. Control of neural stem cell self-renewal and differentiation in Drosophila. Cell and Tissue Research. 359, 33-45 (2015).
- Chell, J. M., Brand, A. H. Nutrition-responsive glia control exit of neural stem cells from quiescence. Cell. 143, 1161-1173 (2010).
- Sousa-Nunes, R., Yee, L. L., Gould, A. P. Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila. Nature. 471, 508-512 (2011).
- Britton, J. S., Edgar, B. A. Environmental control of the cell cycle in Drosophila: nutrition activates mitotic and endoreplicative cells by distinct mechanisms. Development. 125, 2149-2158 (1998).
- Lin, S., et al. Extremes of lineage plasticity in the Drosophila brain. Current biology : CB. 23, 1908-1913 (2013).
- Sipe, C. W., Siegrist, S. E. Eyeless uncouples mushroom body neuroblast proliferation from dietary amino acids in Drosophila. Elife. 6, 26343 (2017).
- Speder, P., Brand, A. H. Systemic and local cues drive neural stem cell niche remodelling during neurogenesis in Drosophila. Elife. 7, 30413 (2018).
- Yuan, X., Sipe, C. W., Suzawa, M., Bland, M. L., Siegrist, S. E. Dilp-2-mediated PI3-kinase activation coordinates reactivation of quiescent neuroblasts with growth of their glial stem cell niche. PLoS Biology. 18, 3000721 (2020).
- Colombani, J., et al. A nutrient sensor mechanism controls Drosophila growth. Cell. 114, 739-749 (2003).
- Geminard, C., Rulifson, E. J., Leopold, P. Remote control of insulin secretion by fat cells in Drosophila. Cell Metabolism. 10, 199-207 (2009).
- Siller, K. H., Serr, M., Steward, R., Hays, T. S., Doe, C. Q. Live imaging of Drosophila brain neuroblasts reveals a role for Lis1/dynactin in spindle assembly and mitotic checkpoint control. Molecular Biology of the Cell. 16, 5127-5140 (2005).
- Prithviraj, R., Trunova, S., Giniger, E. Ex vivo culturing of whole, developing Drosophila brains. Journal of Visualized Experiments: JoVE. (65), e4270 (2012).
- Bostock, M. P., et al. An immobilization technique for long-term time-lapse imaging of explanted drosophila tissues. Frontiers in Cell and Developmental Biology. 8, 590094 (2020).
- Datta, S. Activation of neuroblast proliferation in explant culture of the Drosophila larval CNS. Brain Research. 818, 77-83 (1999).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved