Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kültürlü Drosophila Beyin Eksplantlarında Nöral Kök Hücre Reaktivasyonu
Bu Makalede
Özet
Kültürlü Drosophila beyin eksplantlarında sessiz nöral kök hücreleri yeniden aktive etmek için bir yöntem oluşturulmuştur. Bu yöntem kullanılarak, nöral kök hücre sessizliğinin, giriş ve çıkışın düzenlenmesinde sistemik sinyallerin rolü doku-intrinsik sinyallerden ayrılabilir.
Özet
Nöral kök hücreler (NSC'ler) çoğalma, farklılaşma, apoptoza maruz kalma ve hatta sessizliğe girip çıkma yeteneğine sahiptir. Bu süreçlerin çoğu, NSC içsel genetik programları ile NSC dışsal faktörleri, lokal ve sistemik arasındaki karmaşık etkileşim ile kontrol edilir. Genetik model organizmada, Drosophila melanogaster, nöroblastlar (NB'ler) olarak bilinen NSC'ler, embriyonik larva geçişi sırasında sessizlikten proliferasyona geçer. Bu süre zarfında larvalar yumurta kabuklarından çıkar ve diyet besinleri arayarak emeklemeye başlar. Hayvan beslenmesine yanıt olarak, lipit depolama kapasitesine sahip bir endokrin organ olan yağ gövdesi, dolaşımdaki hemolenfin içine sistemik olarak salınan bir sinyal üretir. Yağ gövdesinden türetilmiş sinyale (FBDS) yanıt olarak, Drosophila insülin benzeri peptitler (Dilps) beyin nörosekretuar nöronlarından ve glia'dan üretilir ve salınır, bu da NB'lerde PI3-kinaz büyüme sinyalinin aşağı akış aktivasyonuna ve glial ve trakeal nişlerine yol açar. Bu, NB'lerin sessizlikten çoğalmaya nasıl geçtiğine dair mevcut model olmasına rağmen, FBDS dışsal ipucunun doğası belirsizliğini korumaktadır. NB dışsal sistemik ipuçlarının sessizlikten çıkışı nasıl düzenlediğini daha iyi anlamak için, hayvan beslemeden önce in vitro erken larva beyinlerini kültürlemek için bir yöntem geliştirilmiştir. Bu yöntemle kültür ortamına eksojen faktörler sağlanabilir ve NB'den sessizlik tahlilinden çıkış yapılabilir. Eksojen insülinin, NB'leri tüm beyin eksplantlarında sessizlikten yeniden aktive etmek için yeterli olduğunu bulduk. Bu yöntem büyük ölçekli ekranlar için çok uygun olduğundan, NB sessizliğini ve çoğalma kararlarını düzenleyen ek dışsal ipuçlarını tanımlamayı amaçlıyoruz. NSC proliferasyon kararlarını düzenleyen genler ve yollar evrimsel olarak korunduğundan, bu tahlilden elde edilen sonuçlar klinikte rejeneratif tedavilerin iyileştirilmesi konusunda fikir verebilir.
Giriş
Kök hücreler, rejeneratif tıpta kullanım potansiyelleri nedeniyle büyük ilgi görmektedir 1,2. Birçok hayvan, özellikle uzun ömürlü olanlar, yetişkin dokularında kök hücreleri korur. Bu yerleşik kök hücreler doku homeostazını korumak için işlev görür ve fiziksel yaralanma veya hastalık 3,4 sonrası onarım için kullanılır. Yetişkin hayvanlardaki kök hücrelerin çoğu, hücre döngüsü durması ve büyüme sinyalinin inaktivasyonu ile karakterize nispeten uykuda olan bir durum olan sessizdir5. Dışsal ipuçlarına yanıt olarak, kök hücreler sessizlikten çıkar, hücre döngüsüne girer ve doku tiplerine özgü yavru soy üretmeye başlar. Örneğin, etkili bir bağışıklık tepkisi oluşturmak için, antijen sunan hücreler, sessiz naif T hücrelerini hücre döngüsüne girmeye ve klonalolarak 6'yı genişletmeye teşvik eder. İskelet kası hasarına yanıt olarak, kas uydusu kök hücreleri hücre döngüsüne girer ve hasarlı miyofibrillerin yerini almak için kızı miyoblastlar üretir 5,7. Sessiz kök hücrelerin dışsal sinyallere cevap verdiği açık olsa da, çoğu durumda, dışsal ipucunun doğası ve ipucu kaynaklı kök hücre aktivasyonunun mekanizması belirsizliğini korumaktadır. Sessiz kök hücrelerin dışsal ipuçlarına nasıl tepki verdiğini ve hücre döngüsüne nasıl girdiğini daha iyi anlamak, klinikte daha iyi kök hücre tedavilerinin geliştirilmesine yardımcı olacak ve bilimsel bilgiyi artıracaktır.
Onlarca yıldır, model organizmalar, gelişim sırasında ve yetişkinlikte kök hücre proliferasyonunu düzenleyen genleri ve hücre sinyal yollarını ortaya çıkarmak için kullanılmıştır. Drosophila'da, nöroblastlar (NB'ler) olarak bilinen nöral kök hücreler (NSC'ler), sonuçta bütünleşen tüm nöronları ve gliaları üretmek için gelişim boyunca bölünür ve beyin fonksiyonu için gerekli nöral devreyi oluşturur 8,9. Diğer kök hücreler gibi, NB'ler de asimetrik olarak bölünerek kendini yeniler ve bazı durumlarda kök hücre havuzunu genişletmek için simetrik olarak bölünür. NB'ler embriyogenez sırasında belirtilir ve çoğu anne besin depolarının azalmasıyla çakışan sonlara doğru sessizliğe girer (Şekil 1). Embriyogenez tamamlandıktan sonra larvalar yumurtadan çıkar ve beslenmeye başlar. Hayvan beslemeye yanıt olarak, NB'ler sessizlikten yeniden aktive olur ve hücre bölünmelerinisürdürür 10,11,12,13,14,15,16. Drosophila CNS nispeten basit olduğundan ve NB'ler belirli zamanlarda sessizliğe girip çıktıklarından, sessizlik, giriş ve çıkış düzenlemelerini araştırmak için Drosophila'yı kullanmak ideal olduğunu kanıtlar.
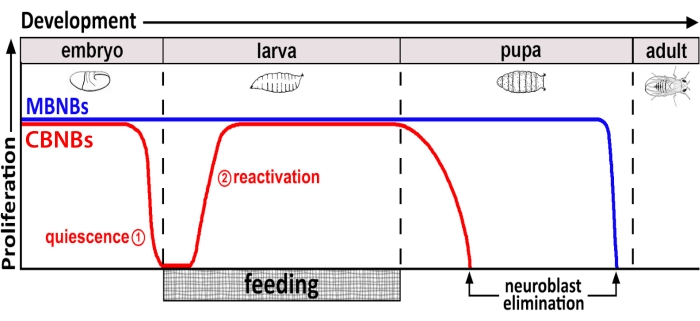
Şekil 1: CB NB'lerin (merkezi beyin nöroblastları, kırmızı) ve MB NB'lerin (mantar vücut nöroblastları, mavi) gelişimsel zaman içinde göreceli proliferasyonu. Embriyogenezin sonunda, çoğu NB (kırmızı çizgi) proliferasyonu durdurur ve sessizliğe girer. Sessizlik, yumurtadan çıkmış larvalar ilk tam öğünlerini tüketene kadar devam eder. Bu metodoloji için odak noktası zaman noktaları kırmızı dairelerle gösterilir (1, sessizlik ve 2, yeniden etkinleştirme). MB NB'ler (mavi), gelişim boyunca sürekli olarak bölünen merkezi beyin NB'lerinin bir alt kümesidir (beyin yarımküresi başına 4). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Hayvan beslenmesine yanıt olarak, PI3-kinaz ve TOR büyüme sinyal yolları NB'lerde ve glial ve trakeal nişlerinde aktif hale gelir10,11,15,16. Diyet besinleri geri çekildiğinde veya PI3-kinaz seviyeleri azaldığında, NB'ler yeniden aktive edilemez ve glia ve trakea büyümesi de azalır10,11,15,16. Mevcut model, NB reaktivasyonunun, hayvan beslenmesine yanıt olarak sistemik bir sinyal serbest bırakan yağ gövdesi tarafından larva büyümesine bağlandığını öne sürmektedir12,17,18. Belirsiz kalan bu sinyal, muhtemelen beyinde Drosophila insülin benzeri peptidin (Dilps) ekspresyonunu ve salınımını teşvik eder, bu da NB'lerde PI3-kinazın aşağı akış aktivasyonuna ve glial ve trakeal nişlerine yol açar. Sistemik ipucu (lar) ın doğasını daha iyi anlamak için, kültürlü beyin eksplantlarında sessiz NB'leri yeniden etkinleştirmek için bir yöntem geliştirdik. Bu yöntemle, NB'lerin reaktivasyonu, tüm hayvan sistemik ipuçlarının yokluğunda test edilebilir. Ekzojen faktörler kültür medyasına yeniden sağlanabilir ve NB reaktivasyonu, timidin analoğu EdU'nun dahil edilmesine dayanarak test edilebilir. Bu yöntemi kullanarak, eksojen insülinin beyin eksplantlarında sessiz NB'leri yeniden aktive etmek için yeterli olduğunu belirledik. Gelecekteki çalışmalar, geri eklendiğinde, beyin eksplantlarında NB sessizliğini olumlu veya olumsuz olarak düzenleyen ek faktörleri tanımlamayı amaçlayacaktır.
Protokol
1. Drosophila larva koleksiyonu
NOT: Başlamadan önce maya tabağını, üzüm ezmesini ve Fly kınamasını hazırlayın:
- Maya ezmesi: Küçük bir kapta, fıstık ezmesi kıvamında bir macun oluşturmak için 5 g aktif kuru mayayı 10 mL su ile karıştırın. Maya macununu plastik ambalajla örtün ve kaba sıkıca tutturmak için lastik bir bant kullanın.
NOT: Taze maya macunu kabında genişleyecek ve sıkıca tutturulmadıkça kapağı çıkaracaktır. Maya macunu oda sıcaklığında (RT) birkaç gün sürecektir. - Üzüm tabakları: Üzüm tabakları yapmak için tarifi izleyin (Tablo 1). 4°C'de saklanan plakaları kullanıyorsanız, kullanmadan önce plakaları RT'ye 1 saat boyunca yerleştirerek önceden ısıttığınızdan emin olun.
- Suyu (750 mL) ve agar'ı (18,75 g) 4 L'lik bir şişede, girdapta ve otoklavda 20 dakika (sıvı döngüsü) boyunca karıştırın.
- Üzüm suyunu (250 mL) ve sakarozu (25 g) 1 L'lik bir şişede ısıtılmış bir plakada (düşük ısı) büyük bir karıştırma çubuğuyla karıştırın. Sakkaroz çözündüğünde, ısıyı kapatın, Tegosept (% 10, 4 mL) ve Propiyonik asit (5 mL) eklemeden önce şişeye dokunulmasını bekleyin. Karıştırma çubuğunu açık tutun.
- Otoklavlama tamamlandığında, şişeye dokunulana kadar soğumaya bırakın (~ 60 ° C), ardından üzüm suyu karışımında karıştırın.
- Tüm çözeltileri tek bir şişede birleştirin ve plakayı karıştırın.
- Çözeltiyi küçük boyutlu Petri tabaklarının kapaklarına (35 mm) pipetleyin. Pipet, kapak başına kabaca 9 mL veya dışbükey bir kubbe elde edilene kadar.
- İSTEĞE BAĞLI: Herhangi bir kabarcıktan kurtulmak için kapakları alevlendirin.
- Plakalar katılaştığında, üzüm plakalarını hava geçirmez kapaklı bir kutuya istifleyin ve kutuyu 4 ° C'ye yerleştirin. Plakalar 1 aya kadar saklanabilir.
- Sinek apartman dairesi: 18 G'lik bir iğne kullanarak 6 onsluk kare tabanlı bir polipropilen Drosophila şişesine ~ 20 delik açın.
- Yetişkin sinekleri (~ 100 OregonR veya herhangi bir genotip) bir sinek kınamasına aktarın ve kınamayı bir miktar maya ezmesi ile tepesinde bir üzüm agar tabağı ile kapatın. Dab'ı plakanın ortasına doğru yerleştirin ve plakayı laboratuvar bandı ile kınamaya yapıştırın.
- Kabı, üzüm agar plakası altta olacak şekilde ters çevirin ve 24 saat boyunca 25 ° C'lik bir inkübatöre yerleştirin (Şekil 2).
Resim 2: Ters çevrilmiş sinek şişesinin (apartman dairesi) erkek ve dişi Drosophila yetişkinleriyle görsel temsili. Plastik şişe, oksijen değişimi için 18 G'lik bir iğne ile üretilen küçük deliklere sahiptir. Şişenin ağzı bir agar üzüm suyu kapağı ile kapatılır ve ters çevrilir ve 25 ° C'lik bir inkübatörde saklanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- 24 saat sonra, üzüm agar tabağını değiştirin ve maya ezmesi ile doldurulmuş yeni bir plaka ile değiştirin. Yetişkin sineklerin kaçmaması için apartman dairesine bankta hafifçe hafifçe dokunurken iki plakayı hızla değiştirin.
- Plakayı gözle inceleyin ve plakadaki embriyo sayısını değerlendirin. Drosophila embriyoları dikdörtgen ve beyazdır ve iki ip benzeri uzantıya sahiptir.
- Plakada çok az embriyo varsa (100'den az), plakayı atın (agar'ı sinek çöpüne kazıyın ve plastik kapağı tekrar kullanılmak üzere saklayın). Çoğu durumda, yetişkin dişiler yeni bir apartman dairesinde ilk gece çok fazla embriyo bırakmaz. Bu durumda, yetişkin sineklere alışmaları için 24 saat daha verin.
- Plakada çok sayıda embriyo varsa (en az 100), saklayın ve maya macununu düz bir dip spatula kullanarak dikkatlice çıkarın.
- Maya macunu çıkarıldıktan sonra, tüm larvaları diseksiyon mikroskobu altında üzüm plakasından manuel olarak çıkarmak için metal bir toplama kullanın. Plakaya diseksiyon mikroskobu altında bakıldığında, embriyoların yanı sıra sürünen larvalar da gözlenmelidir.
- Metal toplayıcıyı bir larva tarafına doğru fırçalayarak tüm larvaları çıkarın. Larvalar yapışkandır ve seçime yapışır. Bir larva toplandıktan sonra, daha fazlasını eklemek için alet üzerindeki larva kullanılarak ek larvalar kolayca toplanabilir.
NOT: Larvalar birbirlerine yapışmayı severler. Bu noktada, larvaların zarar görmesi önemli değildir. Bu larvalar atılacak. - Tüm larvaları toplayıp çıkardıktan sonra, plakayı tekrar 25 ° C inkübatöre yerleştirin. Plakayı kapatılabilen daha büyük bir kaba koyduğunuzdan emin olun. Islak kağıt havluları nemde tutmak için daha büyük kabın altına yerleştirin.
- 30-60 dakika sonra, plakayı diseksiyon mikroskobuna geri götürün ve şimdi, toplanan larvaların 30-60 dakikalık bir zaman dilimi içinde taze yumurtadan çıkmasını sağlamak için aynı üzüm agar plakasından ~ 20-25 larvayı dikkatlice seçin.
- Aletin ucunu 20-25 taze yumurtadan çıkmış larva ile 2 dakika boyunca 1-2 mL 1x Fosfat Tamponlu Salin (PBS) ile doldurulmuş bir Petri kabına (60 mm) batırın.
- 2 dakika sonra, sıvıyı altta toplamak için çanağı bir açıyla devirin. Küçük bir boya fırçası kullanarak, larvaları Petri kabının dibindeki sıvıdan fırçalayın.
- Boya fırçasındaki tüm larvaları toplayın ve larvaları% 70 etanolün 1-2 mL'sini içeren yeni bir Petri kabına (60 mm) aktarın. Larvaları bir boya fırçasıyla toplamak ve 1-2 mL 1x PBS içeren yeni bir Petri kabına aktarmak için 1.15 adımlarını tekrarlayın.
2. Kültür ortamı ve alet hazırlama
- Tezgahı ve çalışma alanını% 70 etanol ile püskürtün ve kurumaya bırakın.
- Diseksiyon aletlerini, forsepsleri ve iki cam saat kabını% 70 etanol ile püskürtün ve tezgahta kurumasını bekleyin.
- Schneider'in ek ortamını (SSM, Tablo 2) yapın ve buzun üzerine yerleştirin.
- Pipet, cam saat tabaklarının her birine 1 mL SSM sığar.
- Steril uçlu bir mikropipet kullanarak, taze yumurtadan çıkmış larvaları PBS plakasından ilk cam saat kabındaki SSM'ye aktarın. Steril uçlu bir mikropipet kullanarak, taze yumurtadan çıkmış larvaları ikinci cam saat kabındaki SSM'ye aktarın.
3. Diseksiyonlar ve beyin kültürleri
- Larvalar SSM ile ikinci cam saat kabına girdikten sonra, forseps ve diseksiyon mikroskobu kullanarak beyinleri larvalardan diseke edin. Büyütmeyi gerektiği gibi ayarlayın.
- Ağız kancalarını tutmak için bir forseps kullanın ve diğeriyle birlikte, larvaları iki parçaya bölmek için vücudu yavaşça yarıya kadar tutun ve ters yönde çekin (Şekil 3).
NOT: Beyin ağız kancalarının hemen arkasında yer alacaktır. Beyni çevreleyen başka dokular olabileceğini unutmayın. Bu dokuları çıkarırken çok dikkatli olun, çünkü beyne zarar verebilir.

Resim 3: SSM ile bir cam saat kabında Drosophila larvaları. Forsepsler diseksiyon için uygun şekilde konumlandırılmıştır. Larva beyninin yeri (koyu gri) ağız kancalarının arkasındadır (siyah) ve her ikisi de larvaların içinde gösterilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- 15-20 beyin diseke edildikten sonra, steril 12 delikli bir kültür tepsisinin bir kuyucuğuna 1 mL SSM ekleyin. Yeni disseke edilmiş beyinleri bir mikropipet ve steril bir uç kullanarak SSM'ye aktarın (Şekil 4A).
- Beyinleri SSM ortamındaki 12 kuyucuklu kültür tepsisine 24 saat boyunca 25 ° C'de bir inkübatöre yerleştirin (Şekil 4A).

Şekil 4: Beyin kültürü ve immün boyama . (A) 1 mL SSM içeren 12 kuyucuklu bir kültür kabındaki tüm beyinler. Kültür kabı daha sonra 24 saat boyunca 25 ° C'lik bir inkübatöre yerleştirilir. (B) immün boyama sırasında beyin eksplantlarını tutan 72 delikli mini tepsi. Beyinler yıkanır ve çözeltiler 10 μL'ye ayarlanmış bir P20 mikropipet kullanılarak aktarılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Proliferasyon testi, beyin fiksasyonu ve antikor boyama
- Ertesi gün, 1 mL EdU SSM çözümü yapın. 990 μL SSM (son EdU konsantrasyonu 0,1 mM'ye eşittir) ile 10 mM 5-Etinil-2′-deoksiüridin (EdU) stoğunun 10 μL'sini steril bir mikrosantrifüj tüpüne 10 μL pipet ve karışım. 24 saatlik inkübasyon tamamlandıktan sonra, 1 mL'lik EdU SSM'yi steril 12 delikli kültür tepsisinin bir kuyucuğuna pipetleyin.
- Steril uçlu bir mikropipet kullanarak beyinleri SSM içeren kuyudan sadece EdU SSM çözeltisini içeren yeni kuyuya aktarın. 25 °C'de 1 saat inkübe edin.
- Daha sonra, EdU etiketli beyinleri 20 dakika boyunca 1 mL fiksatif (% 4 paraformaldehit, tarif için Tablo 3'e bakınız) içeren aynı kültür tepsisindeki başka bir kuyuya aktarın.
DİKKAT: Paraformaldehit biyolojik bir tehlikedir ve uygun şekilde bertaraf edilmelidir. - Fiksasyondan sonra, bir mikropipet kullanarak beyinleri hızlı bir şekilde 72 delikli bir mini tepsinin kuyularına aktarın. Her kuyucuk 10 beyin ve 10-15 μL sıvı tutabilir (Şekil 4B). Beyinler mini tepsiye aktarıldıktan sonra (kuyucuk başına en fazla 10 beyin), sabitlemeyi çıkarın ve beyinleri 10 μL 1x PBT'de (fosfat tamponu,% 0.1 Triton-X 100 içeren pH 7.4) 3 kez durulayın.
NOT: Durulama, beyinlere 10 μL 1x PBT pipetleme, çıkarma ve 3 kez tekrarlama anlamına gelir. - Daha sonra, beyinleri her biri 10 dakika boyunca 3 kez, yine 10 μL 1x PBT'de yıkayın. Beyinlerin her zaman bir miktar sıvı ile kaplandığından emin olun.
- Yıkamalar tamamlandıktan sonra, beyinlere 10 μL blokaj çözeltisi (% 10 normal keçi serumu ile 1x PBT) pipet yerleştirin. Tepsiyi örtün ve kenarından bir parafilm şeridi kullanarak kapatın.
- Kapatıldıktan sonra, buharlaşmayı önlemek için nemli bir ortam sağlamak için mini tepsiyi ıslak havlularla kapalı bir kutuya yerleştirin. Tepsiyi içeren kutuyu gece boyunca 4 °C'ye yerleştirin.
- Ertesi gün, birincil bir antikor çözeltisi yapın.
NOT: Bu protokolde, hücre zarlarını etiketlemek için tavşan anti-karalama ve nöroblastları etiketlemek için sıçan anti-deadpan kullanılmıştır, ancak herhangi bir sayıda başka birincil antikor kullanılabilir.- Birincil antikor çözeltisini yapmak için, ilk önce, bloke edici çözeltideki birincil antikorların seyreltilmesini sağlayın. Örneğin, tavşan anti-karalama 1:1000 nihai konsantrasyonda kullanılır. Bu nedenle, ilk önce, tavşan anti-karalama antikorunu 1:100'de seyreltin (1 μL antikor artı 99 μL bloke edici çözelti). Sıçan-deadpan, 1:100'lük son konsantrasyonda kullanılır. Bu nedenle, ilk önce, sıçan-deadpan antikorunu 1:10'da seyreltin (1 μL antikor artı 9 μL bloke edici çözelti).
NOT: Bu seyreltmeler, bakteri üremesini inhibe etmek için sodyum azid (% 0.05) de eklenirse, 4 ° C'de uzun süreli olarak saklanabilir. - Ardından, beyin içeren kuyuların sayısını sayın. Kuyu sayısı, yapılacak birincil antikor çözeltisinin hacmini belirler. Örneğin, 2 beyin kuyucuğu varsa, 20 μL birincil antikor çözeltisi hazırlayın (10 kuyucuk, 100 μL, vb. İçin). 20 μL'lik bir primer antikor çözeltisi yapmak için, her bir birincil antikor seyreltmesinden 2 μL ve bloke edici çözeltiden 16 μL ekleyin.
NOT: Birincil antikorların her birinin nihai konsantrasyonu sırasıyla 1:1000 ve 1:100'dür. Kısacası, birincil antikorların ilk seyreltmesini bir konsantrasyonda yapın, böylece ikinci seyreltme ilgili nihai konsantrasyonlara ulaşmak için her zaman 1:10 olur. Bu durumda, tavşan anti-karalama için 1:1000 ve sıçan anti-deadpan için 1:100.
- Birincil antikor çözeltisini yapmak için, ilk önce, bloke edici çözeltideki birincil antikorların seyreltilmesini sağlayın. Örneğin, tavşan anti-karalama 1:1000 nihai konsantrasyonda kullanılır. Bu nedenle, ilk önce, tavşan anti-karalama antikorunu 1:100'de seyreltin (1 μL antikor artı 99 μL bloke edici çözelti). Sıçan-deadpan, 1:100'lük son konsantrasyonda kullanılır. Bu nedenle, ilk önce, sıçan-deadpan antikorunu 1:10'da seyreltin (1 μL antikor artı 9 μL bloke edici çözelti).
- Blokaj çözeltisini, mikropipet 10 μL'ye ayarlanmış ve pipet 10 μL birincil antikor çözeltisi ile her bir oyuğa çıkarın.
- Tepsiyi parafilm kullanarak örtün ve kapatın ve ıslak havlularla kapalı kutuya geri yerleştirin. Gece boyunca 4 ° C'de inkübe edin.
NOT: Sallama gerekli değildir ve kesinlikle önerilmez. Antikorlar titremeden veya karışmadan beyinlere nüfuz edecektir. - Ertesi gün, bir mikropipet kullanarak birincil antikor çözeltisini çıkarın ve beyinleri 10 μL 1x PBT ile 3 kez durulayın. Daha sonra, beyinleri her biri 10 dakika boyunca 10 μL 1x PBT ile 4 kez yıkayın. 10 dakikalık yıkamalar sırasında, ikincil antikor çözeltisini hazırlayın.
- İkincil antikor çözeltisini yapmak için, birincil antikorları tanıyan ikincil antikorları seçin. Bu protokolde keçi karşıtı tavşan Alexa Fluor 488 ve keçi karşıtı sıçan Alexa 555 kullanılmıştır.
- İkincil antikorların her birinin 1 μL'lik pipeti, her bir ikincil antikor için son konsantrasyonu 1:300 yapmak üzere bloke edici çözeltinin 298 μL'si ile bir mikrosantrifüj tüpüne dönüştürür.
- Son 10 dakikalık yıkamadan sonra, sekonder antikor çözeltisinin 1x PBT'sini ve pipeti 10 μL'yi her bir oyuğa çıkarın. Tepsiyi parafilm kullanarak kapatın ve nemli havlularla tekrar kutuya yerleştirin. Gece boyunca 4 ° C'de inkübe edin.
NOT: Durulamalar, yıkamalar arasındaki kuyucuklardaki veya birincil ve ikincil antikor çözeltileri eklerken her son μL'nin çıkarılması konusunda endişelenmeyin. Beyinler her zaman birkaç μL sıvıya batırılmış kalacaktır, ki bu gayet iyi. - Ertesi gün, bir mikropipet kullanarak ikincil antikor çözeltisini çıkarın ve beyinleri her biri 1x PBT'nin 10 μL ile 3 kez durulayın. Daha sonra, beyinleri her biri 10 dakika boyunca 1x PBT'nin her biri 10 μL ile 4 kez yıkayın.
- 10 dakikalık yıkamalar sırasında, EdU birleşmesini tespit etmek için EdU reaksiyon karışımını hazırlayın. EdU reaksiyon karışımını üreticilerin yönergelerine göre hazırlayın.
- Son yıkamadan sonra, EdU reaksiyon karışımının 1x PBT'sini ve pipeti 10 μL'yi beyinlerle birlikte her bir oyuğa çıkarın. Mikrowell plakasını parafilm ile kapatın ve alüminyum folyo ile örtün. Tabağı tezgahta 30 dakika bekletin.
- 30 dakika sonra, beyinleri 1x PBT'nin her biri 10 μL ile 3 kez durulayın ve beyinleri her biri 5 dakika boyunca 1x PBT'nin her biri 10 μL ile 3 kez yıkayın.
- Son yıkamadan sonra, gliserol bazlı bir montaj ortamı çözeltisinin 1x PBT'sini ve pipeti 10 μL'yi çıkarın. Plakayı kapatın ve gece boyunca 4 ° C'ye yerleştirin.
5. Beyinlerin montajı ve görüntülenmesi
- Ertesi gün, mikroskop slaytları hazırlayın (25 mm x 75 mm x 1 mm): Mikroskop slaytının her iki ucuna bir adet 22 mm x 22 mm x 1 mm kare kapak camı yapıştırın (örneğin, süper yapıştırıcı), slayt ile daha büyük kapak kayması arasında bir boşluk bırakmak için üzerine daha büyük 22 mm x 50 mm x 1 mm kapak kaymasının yerleştirileceği bir 'köprü' oluşturun (Şekil 5A). Bu alan, beynin ezilmesini önlerken doğru yönlendirilmesi için yeterli harekete izin verecektir.

Şekil 5: Larva beynindeki mikroskop slaytını, yönünü ve hücre tiplerini gösteren şematik . (A) Larva beyninin monte edildiği ve görüntülenmeye hazır olduğu mikroskop slaytının görsel gösterimi. (B) Doku oryantasyonu için bir kılavuz da gösterilmiştir. (C) Konfokal mikroskopta görüntülemeye hazır mikroskop kaydırağı. (D) Larva beynindeki bazı hücre tiplerini gösteren karikatür. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- 22 mm x 22 mm x 1 mm kapak camlarını mikroskop slaytına yapıştırdıktan sonra, mikrovel plakasının bir kuyucuğundan bir beyin içeren gliserol bazlı montaj ortamı çözeltisinin 9,3 μL'lik pipeti, slaytın ortasına yerleştirir (Şekil 5A).
NOT: Larva beyinleri pipet ucuna yapışabilir, bu yüzden dikkatli olun. Yapışmayı önlemek için, antifadeyi aspire ederek başlayın ve daha sonra 9.3 μL hacminin sonuna doğru tek beyni aspire edin. - Beyin slayta girdikten sonra, 22 mm x 50 mm x 1 mm kapak kapağını yavaşça üstüne yerleştirin. Beyni Şekil 5B'de görüldüğü gibi konumlandırın. Beyni yönlendirmek için kapak kaymasını yavaşça hareket ettirin. Örnek daha sonra görüntüleme için hazırdır.
- En iyi görüntüleri elde etmek için yüksek büyütme ve yüksek sayısal diyafram hedefi (Şekil 5C) ile donatılmış bir konfokal mikroskop kullanın. Örneğin: 60x veya 63x, 1,4 NA yağa daldırma lensi.
- Beyinleri, kapak kaymasına (ve nesnel) en yakın sırt yüzeyi ile görüntüleyin. Z yığınlarını, ventral yüzeyden (hedeften en uzakta) başlayarak tüm beyin yarımküresi boyunca 1 μm aralıklarla veya Z adım boyutunda elde edin.
NOT: Kullanılan lazerler ikincil antikorlara bağlıdır. Bu protokolde, kullanılan lazer çizgileri Karalama lekelemesini tespit etmek için 488 nm, Deadpan'ı tespit etmek için 555 nm ve EdU'yu tespit etmek için 633 nm idi.
- Beyinleri, kapak kaymasına (ve nesnel) en yakın sırt yüzeyi ile görüntüleyin. Z yığınlarını, ventral yüzeyden (hedeften en uzakta) başlayarak tüm beyin yarımküresi boyunca 1 μm aralıklarla veya Z adım boyutunda elde edin.
6. Veri analizi
- Beyin yarımkürelerini analiz etmek için Fiji açık kaynaklı yazılımı kullanın ve hücreleri saymak için Fiji hücre sayacı eklentisini kullanın.
Sonuçlar
Yeni yumurtadan çıkmış OregonR vahşi tip beyinler, insülin ile takviye edilmiş Schneider'in medyasında (SSM) 24 saat boyunca disseke edildi ve kültürlendi. Dokular protokole göre sabitlenmiş ve boyanmıştır. NB'leri tespit etmek için Deadpan'a (Dpn) karşı üretilen birincil antikorlar ve hücre zarlarını etiketlemek için Karalama kullanıldı. S-faz girişini ve NB reaktivasyonunu tespit etmek için timidin analog 5-Etinil-2′-deoksiüridin (Edu) eklendi. Kültürde 24 saat sonra büyük boyutlu Edu ...
Tartışmalar
Burada açıklanan kültür beyin eksplantları yöntemi çoğu laboratuvar ortamında gerçekleştirilebilir. Gerekli araçların yanı sıra prosedür ve veri toplama basit ve anlaşılırdır. Bu yöntemle, hücre sinyal kaskadları ve NB reaktivasyonunu ve proliferasyonunu düzenleyen dışsal faktörlerle ilgili olanlar da dahil olmak üzere çeşitli hipotezler test edilebilir. Burada, vahşi tip OregonR hayvanlarını kullanarak, eksojen insülinin, NB'leri diğer hayvana özgü sistemik ipuçlarından bağımsız...
Açıklamalar
Yazarların birbiriyle çelişen çıkarları yoktur.
Teşekkürler
LSAMP Bridges to Doctorate programını finansman (CNK) ve NIH / NIGMS'yi (R01-GM120421 ve R35-GM141886) kabul ediyoruz. Şekil 1 için Dr. Conor Sipe'ye minnettarız. Ayrıca tüm Siegrist laboratuvar üyelerine sürekli destekleri ve mentorlukları için teşekkür ederiz. Özellikle Chhavi Sood ve Gary Teeters'e makaleyi dikkatli bir şekilde okudukları ve yorum yaptıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 µL Pipette tips | Denville Sci | P2102 | |
| 1000 µL Pipette tips | Denville Sci | P2103-N | |
| 1000 µL Pipettor | Gilson | P1000 | |
| 16% paraformaldehyde (10 x 10 mL) | Electron Microscopy Sciences | 2912.60.0000 | Used for Fixation of Larval Brains |
| 20 µL Pipette | Gilson | P20 | |
| 200 µL Pipette tips | Denville Sci | 1158U56 | |
| 24-well multiwell culture plates | Fisher Scientific | 50-197-4477 | |
| 35 mm Petri dishes | Fisher Scientific | 08-757-100A | Grape Plate Ingredients |
| 4 °C refrigerator | Fisher Scientific | Provides an ideal temperature for >24 h incubations in antibody solution | |
| 63x Objective | Lecia | ||
| Active dry yeast | Most supermarkets | ||
| Agarose | Fisher Scientific | 214010 | Grape Plate Ingredients |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Fisher Scientific | C10340 | to label proliferating cells |
| Confocal Microscope | Leica | SP8 | |
| Coverslips 22 mm x 22 mm x 1 mm , 10 pack of 4 oz | Fisher Scientific | 12-544-10 | Two Coverslips are super glued to the ends of the microscope slide. This creates a space that allows for the brains to float in antifade while being imaged. |
| Coverslips, 22 mm x 50 mm x 1 mm | Fisher Scientific | 12-545E | The coverslip is placed on two square coverslips on the microscope slide ensuring that the brain in the antifade does not move while imaging. |
| Dissecting microscope | Zeiss | Stemi 2000 | |
| Ethanol 200 proof (100%), Decon Labs, 1 gallon bottle | Fisher Scientific | 2701 | Used to wash off the larvae before the 24 hr hold in culture medium |
| Fetal Bovine Serum (10%) | Sigma | F4135-100ML | Supplement for cell culture media. |
| Fine forceps for dissection | Fine Science Tools | 11295-20 | Forcepts used in disections. They work best when sharpened. |
| Fly Bottles for Crossing | Genessee Scientific | 32-130 | This bottle is used as a container that lets the flies lay eggs on the grape plate. |
| Glass Dissection Dish (3 well) | These are no longer available | ||
| Glutathione | Sigma | G6013 | Provides oxidative protection during cell culture. |
| Goat Serum | Sigma | G9023- 10ML | Blocking Agent |
| Grape Plates | Made in house | Made in house | Grape juice/agarose plates for collecting freshly hatched eggs |
| Image J | Imagej.net/fiji/downloads | Free Download: https://fiji.sc | Imaging platform that is used to count cells and Edu reactivation |
| Incubator | Thermo Fisher Scientific | Ensures that the temperature, humidity, and light exposure is exactly the same throughout experiment. | |
| Insulin | Sigma | I0516 | Independant variable of the experiment |
| Laminar flow hood | For aliquoting culture media | ||
| L-Glutamine | Sigma | G7513 | Provides support during cell culture |
| Nunc 72-well Microwell Mini Trays | Fisher Scientific | 12-565-154 | Immunostaining steps are performed in this tray |
| Parafilm | Fisher Scientific | S37440 | Film used to seal plates in order to prevent evaporation |
| Pen-Strep | Sigma | P4458-100ml | Antibiodics used to prevent bacterial contamination of cells during culture. |
| Phosphate Buffer, pH7.4 | Made in house | Made in house | Solvent used to wash the brains after fixing and staining steps |
| Pick | Fine Science Tools | 10140-01 | Used to pick larvae off of the grape plate |
| Propionic acid | Fisher Scientific | A-258 | Grape Plate Ingredients |
| Rabbit 405 | Abcam | ab175653 | Antibodies used for immunostaining |
| Rat 555 | Abcam | ab150166 | Antibodies used for immunostaining |
| Rb Scribble | A Gift from Chris Doe | Antibodies used for immunostaining | |
| Rt Deadpan | Abcam | ab195173 | Antibodies used for immunostaining |
| Schneiders Culture Medium | Life Tech | 21720024 | Contains nutrients that help the cells grow and proliferate |
| SlowFade Diamond Antifade (5 x 2 mL) | Life Tech | S36963 | Reagent that provides protection against fading fluorophores |
| Sterile Water | Autoclave Milli-Q water made in house | Needed for Solutions | |
| Sucrose | Fisher | S2-12 | Grape Plate Ingredients |
| Superfrost Microscope Slides | Fisher Scientific | 12-544-7 | |
| Superglue | Most supermarkets | ||
| Tegosept | Genesee Scientific | 20-259 | Grape Plate Ingredients |
| Triton-X 100 | Sigma | T9284-100ML | PBT |
| Welch's 100% grape grape juice | Most supermarkets | Grape Plate Ingredients |
Referanslar
- Suman, S., Domingues, A., Ratajczak, J., Ratajczak, M. Z. Potential clinical applications of stem cells in regenerative medicine. Advances in Experimental Medicine and Biology. 1201, 1-22 (2019).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Reviews Genetics. 15, 82-92 (2014).
- Daley, G. Q. Stem cells and the evolving notion of cellular identity. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 370, 20140376 (2015).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: A cellular perspective. Physiological Reviews. 99, 665-706 (2019).
- van Velthoven, C. T. J., Rando, T. A. Stem cell quiescence: Dynamism, restraint, and cellular idling. Cell Stem Cell. 24, 213-225 (2019).
- Chapman, N. M., Boothby, M. R., Chi, H. Metabolic coordination of T cell quiescence and activation. Nature Reviews Immunology. 20, 55-70 (2020).
- Wosczyna, M. N., Rando, T. A. A muscle stem cell support group: Coordinated cellular responses in muscle regeneration. Developmental Cell. 46, 135-143 (2018).
- Homem, C. C., Knoblich, J. A. Drosophila neuroblasts: a model for stem cell biology. Development. 139, 4297-4310 (2012).
- Kang, K. H., Reichert, H. Control of neural stem cell self-renewal and differentiation in Drosophila. Cell and Tissue Research. 359, 33-45 (2015).
- Chell, J. M., Brand, A. H. Nutrition-responsive glia control exit of neural stem cells from quiescence. Cell. 143, 1161-1173 (2010).
- Sousa-Nunes, R., Yee, L. L., Gould, A. P. Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila. Nature. 471, 508-512 (2011).
- Britton, J. S., Edgar, B. A. Environmental control of the cell cycle in Drosophila: nutrition activates mitotic and endoreplicative cells by distinct mechanisms. Development. 125, 2149-2158 (1998).
- Lin, S., et al. Extremes of lineage plasticity in the Drosophila brain. Current biology : CB. 23, 1908-1913 (2013).
- Sipe, C. W., Siegrist, S. E. Eyeless uncouples mushroom body neuroblast proliferation from dietary amino acids in Drosophila. Elife. 6, 26343 (2017).
- Speder, P., Brand, A. H. Systemic and local cues drive neural stem cell niche remodelling during neurogenesis in Drosophila. Elife. 7, 30413 (2018).
- Yuan, X., Sipe, C. W., Suzawa, M., Bland, M. L., Siegrist, S. E. Dilp-2-mediated PI3-kinase activation coordinates reactivation of quiescent neuroblasts with growth of their glial stem cell niche. PLoS Biology. 18, 3000721 (2020).
- Colombani, J., et al. A nutrient sensor mechanism controls Drosophila growth. Cell. 114, 739-749 (2003).
- Geminard, C., Rulifson, E. J., Leopold, P. Remote control of insulin secretion by fat cells in Drosophila. Cell Metabolism. 10, 199-207 (2009).
- Siller, K. H., Serr, M., Steward, R., Hays, T. S., Doe, C. Q. Live imaging of Drosophila brain neuroblasts reveals a role for Lis1/dynactin in spindle assembly and mitotic checkpoint control. Molecular Biology of the Cell. 16, 5127-5140 (2005).
- Prithviraj, R., Trunova, S., Giniger, E. Ex vivo culturing of whole, developing Drosophila brains. Journal of Visualized Experiments: JoVE. (65), e4270 (2012).
- Bostock, M. P., et al. An immobilization technique for long-term time-lapse imaging of explanted drosophila tissues. Frontiers in Cell and Developmental Biology. 8, 590094 (2020).
- Datta, S. Activation of neuroblast proliferation in explant culture of the Drosophila larval CNS. Brain Research. 818, 77-83 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır