需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
培养的 果蝇 脑外植体中的神经干细胞再激活
摘要
已经建立了一种在培养的 果蝇 脑外植体中重新激活静止神经干细胞的方法。使用这种方法,全身信号的作用可以从组织内在信号中分离出来,调节神经干细胞的静止,进入和退出。
摘要
神经干细胞(NSC)具有增殖,分化,进行细胞凋亡甚至进入和退出静止的能力。其中许多过程是由NSC内在遗传程序与NSC外在因素(局部和系统性)之间的复杂相互作用控制的。在遗传模式生物体中, 黑腹果蝇NSCs,称为神经母细胞(NBs),在胚胎到幼虫的转变过程中从静止到增殖。在此期间,幼虫从蛋壳中出来并开始爬行,寻找饮食营养。作为对动物喂养的反应,脂肪体,具有脂质储存能力的内分泌器官,产生信号,该信号被系统地释放到循环血淋巴中。作为对脂肪体源信号(FBDS)的反应, 果蝇 胰岛素样肽(Dilps)产生并从脑神经分泌神经元和神经胶质细胞释放,导致NBs及其神经胶质和气管生态位中PI3激酶生长信号传导的下游激活。虽然这是NBs如何从静止转向增殖的当前模型,但FBDS外在线索的性质仍然难以捉摸。为了更好地了解NB外在系统性线索如何调节静止状态,开发了一种在动物喂养前体外培养早期幼虫大脑的方法。使用这种方法,可以将外源因子提供给培养基并测定NB从静止中退出。我们发现,外源性胰岛素足以使NBs从全脑外植体的静止中重新激活。由于这种方法非常适合大规模筛选,因此我们的目标是识别调节NB静止与增殖决策的其他外在线索。由于调节NSC增殖决定的基因和途径在进化上是保守的,因此该测定的结果可以为改善临床再生疗法提供见解。
引言
干细胞因其在再生医学中的潜力而引起人们的极大兴趣1,2。许多动物,特别是那些长寿的动物,在成年组织中维持干细胞。这些常驻干细胞具有维持组织稳态的功能,并用于物理损伤或疾病后的修复3,4。成体动物中的大多数干细胞是静止的,一种相对休眠的状态,其特征在于细胞周期停滞和生长信号传导失活5。作为对外在线索的反应,干细胞从静止中退出,进入细胞周期并开始产生特定于其组织类型的子后代。例如,为了建立有效的免疫应答,抗原呈递细胞诱导静止的幼稚T细胞进入细胞周期并克隆扩增6.作为对骨骼肌损伤的反应,肌肉卫星干细胞进入细胞周期并产生子成肌细胞以取代受损的肌原纤维5,7。虽然很明显,静止的干细胞对外在信号有反应,但在许多情况下,外在线索的性质以及线索诱导的干细胞活化的机制仍然不清楚。更好地了解静止干细胞如何响应外在线索并进入细胞周期将有助于在临床上开发更好的干细胞疗法并增加科学知识。
几十年来,模式生物一直被用来揭示在发育和成年期调节干细胞增殖的基因和细胞信号通路。在 果蝇中,神经干细胞(NSC),称为神经母细胞(NBs),在整个发育过程中分裂,产生所有神经元和神经胶质细胞,最终整合,形成大脑功能所需的神经回路8,9。像其他干细胞一样,NBs不对称地分裂以进行自我更新,并且在某些情况下,对称地扩展干细胞库。在胚胎发生期间指定NBs,并且大多数在接近结束时进入静止状态,这与母体营养储存的减少相吻合(图1)。胚胎发生完成后,幼虫孵化并开始进食。作为对动物喂养的反应,NBs从静止中重新激活并恢复细胞分裂10,11,12,13,14,15,16。由于 果蝇 CNS相对简单,并且由于NBs在规定时间进入和退出静止,因此使用 果蝇 来研究静止,进入和退出的调节被证明是理想的。
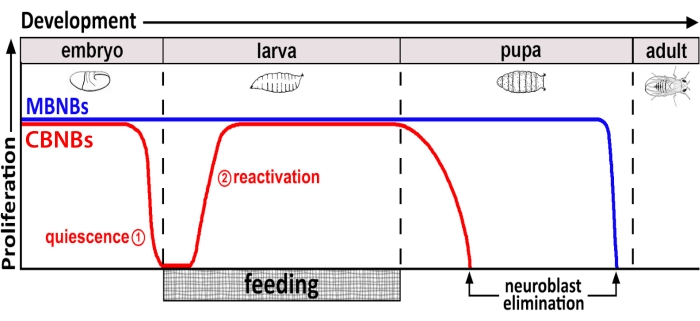
图1:CB NBs(中枢脑神经母细胞,红色)和MB NBs(蘑菇体神经母细胞,蓝色)在发育过程中的相对增殖。 在胚胎发生结束时,大多数NBs(红线)停止增殖并进入静止状态。静止一直持续到刚孵化的幼虫吃完第一顿完整的食物。该方法的时间焦点以红色圆圈表示(1,静止和2,重新激活)。MB NBs(蓝色)是在整个发育过程中连续分裂的中枢脑NBs的一个子集(每个大脑半球4个)。 请点击此处查看此图的大图。
作为对动物喂养的反应,PI3激酶和TOR生长信号通路在NBs及其神经胶质和气管生态位10,11,15,16中变得活跃。当膳食营养素被撤回或当PI3激酶水平降低时,NBs无法重新激活,神经胶质细胞和气管的生长也减少了10,11,15,16。目前的模型假设NB再激活与脂肪体的幼虫生长耦合,其释放系统信号以响应动物喂养12,17,18。这种信号仍然难以捉摸,可能促进果蝇胰岛素样肽(Dilps)在大脑中的表达和释放,从而导致NBs及其神经胶质和气管生态位中PI3激酶的下游激活。为了更好地了解系统线索的性质,我们开发了一种在培养的大脑外植体中重新激活静止NBs的方法。使用这种方法,可以在没有整个动物全身线索的情况下测定NBs的再激活。外源因子可以重新供应到培养基中,并且基于掺入胸苷类似物EdU的NB再活化测定。使用这种方法,我们确定外源性胰岛素足以重新激活大脑外植体中的静止NBs。未来的工作将旨在确定其他因素,当添加回去时,这些因素会积极或消极地调节大脑外植体中的NB静止。
研究方案
1. 果蝇 幼虫收集
注意:在开始之前,请准备酵母盘,葡萄糊和Fly公寓:
- 酵母糊:在小容器中,将5克活性干酵母与10毫升水混合,形成具有花生酱稠度的糊状物。用保鲜膜盖住酵母糊,并用橡皮筋将其牢固地固定在容器上。
注意:新鲜的酵母糊会在其容器中膨胀,除非牢固地附着,否则会从盖子上弹出。酵母糊将在室温(RT)下持续数天。 - 葡萄盘:按照制作葡萄盘的配方(表1)。如果使用储存在4°C的板,请确保在使用前将板置于室温下1小时预热。
- 在4 L烧瓶,漩涡和高压釜中混合水(750 mL)和琼脂(18.75g)20分钟(液体循环)。
- 将葡萄汁(250毫升)和蔗糖(25克)在1升烧瓶中混合,并在加热的盘子(小火)上用大搅拌棒搅拌。当蔗糖溶解时,关火,等到可以触摸烧瓶后再加入Tegoosept(10%,4mL)和丙酸(5mL)。保持搅拌棒打开。
- 高压灭菌完成后,让它冷却,直到可以触摸烧瓶(〜60°C),然后混合葡萄汁混合物。
- 将所有溶液混合在一个烧瓶中,让其在板上搅拌。
- 将溶液移液到小型培养皿(35毫米)的盖子中。每个盖子移液约9 mL或直到获得凸圆顶。
- 可选:烙火盖子以去除任何气泡。
- 当盘子凝固时,将葡萄板堆叠到带有密封盖的盒子中,并将盒子放在4°C。 板材可存放长达 1 个月。
- 飞行公寓:使用18 G针头在6盎司方形底部聚丙烯 果蝇 瓶中打孔约20个孔。
- 将成年苍蝇(约100只俄勒冈R或任何基因型)转移到苍蝇公寓,并用葡萄琼脂盘子盖住公寓,上面放一点酵母糊。将轻拍朝板的中心放置,并用实验室胶带将板固定在公寓上。
- 倒置容器,使葡萄琼脂板位于底部,并将其置于25°C培养箱中24小时(图2)。
图2:倒置苍蝇瓶(公寓)与男性和女性 果蝇 成虫的视觉表示。 塑料瓶有小穿刺,用18 G针产生,用于氧气交换。瓶子的嘴用琼脂葡萄汁帽密封,倒置并储存在25°C的培养箱中。 请点击此处查看此图的大图。
- 24小时后,更换葡萄琼脂平板,并用一个上面放有酵母糊的新盘子代替它。快速切换两个板,同时连续轻轻敲击板凳上的公寓,以便成年苍蝇不会逃脱。
- 用眼睛检查板并评估板上胚胎的数量。 果蝇 胚胎呈椭圆形,白色,有两个弦状的附属物。
- 如果板上的胚胎很少(少于100个),丢弃板(将琼脂刮出到苍蝇垃圾桶中,并保存塑料盖以供重复使用)。在许多情况下,成年女性不会在新公寓的第一个晚上产下很多胚胎。如果是这种情况,给成年苍蝇另外24小时以适应。
- 如果平板上有大量胚胎(至少100个),请保留它,并使用平底刮刀小心地去除酵母糊。
- 一旦酵母糊被去除,使用金属镐在解剖显微镜下手动从葡萄板上取出所有幼虫。当在解剖显微镜下观察板时,应观察爬行幼虫以及胚胎。
- 通过将金属镐刷向一个幼虫的侧面来清除所有幼虫。幼虫是粘性的,会粘在镐上。一旦一只幼虫在镐上,通过使用工具上的幼虫附着更多幼虫,可以很容易地捡起更多的幼虫。
注意:幼虫喜欢互相粘附。在这一点上,幼虫是否受损并不重要。这些幼虫将被丢弃。 - 挑选并除去所有幼虫后,将板放回25°C培养箱中。确保将板放在可以密封的较大容器中。将湿纸巾放在较大容器的底部以保持水分。
- 30-60分钟后,将板带回解剖显微镜,现在,从同一葡萄琼脂平板中仔细挑选〜20-25只幼虫,以确保采摘的幼虫在30-60分钟的时间内新鲜孵化。
- 将工具的尖端与20-25个新鲜孵化的幼虫浸入装有1-2mL磷酸盐缓冲盐水(PBS)的培养皿(60mm)中2分钟。
- 2分钟后,将盘子倾斜一定角度以池底部的液体。使用小画笔,将幼虫从培养皿底部的液体中刷出。
- 收集画笔上的所有幼虫,并将幼虫转移到含有1-2mL 70%乙醇的新培养皿(60 mm)中。重复步骤1.15,用画笔收集幼虫,并将它们转移到带有1-2 mL 1x PBS的新培养皿中。
2. 培养基和工具制备
- 用70%乙醇喷洒工作台和工作区域,然后晾干。
- 用70%乙醇喷洒解剖工具,镊子和两个玻璃手表盘,让它们在工作台上干燥。
- 制作补充的施耐德培养基(SSM, 表2)并将其放在冰上。
- 将1毫升SSM移液到每个玻璃手表盘子中。
- 使用带有无菌尖端的微量移液管,将新鲜孵化的幼虫从PBS板转移到第一个玻璃手表盘中的SSM。使用带有无菌尖端的微量移液器,将刚孵化的幼虫转移到第二个玻璃手表盘中的SSM中。
3. 解剖和脑培养
- 一旦幼虫进入带有SSM的第二个玻璃手表盘中,使用镊子和解剖显微镜将大脑从幼虫中解剖出来。根据需要调整放大倍率。
- 使用一个镊子抓住嘴钩,另一个用镊子轻轻抓住身体的一半,向相反的方向拉动(图3)将幼虫分成两部分。
注意:大脑将位于嘴钩的正后方。请注意,大脑周围可能还有其他组织。去除这些组织时要非常小心,因为它可能导致大脑受损

图3: 果蝇 幼虫在带有SSM的玻璃手表盘中。 镊子位置正确,用于解剖。幼虫脑的位置(深灰色)位于嘴钩的后方(黑色),两者都显示在幼虫内部。 请点击此处查看此图的大图。
- 解剖15-20个大脑后,将1mL SSM加入无菌12孔培养盘的一孔中。使用微量移液管和无菌尖端将新鲜解剖的大脑转移到SSM中(图4A)。
- 将大脑置于12孔培养盘中的SSM培养基中,在25°C的培养箱中培养24小时(图4A)。

图4:脑培养和免疫染色。 (A)在含有1 mL SSM的12孔培养皿中的全脑。然后将培养皿置于25°C培养箱中24小时。(B)72孔迷你托盘,该托盘在免疫染色期间容纳脑外植体。使用设置为10μL的P20微量移液管清洗大脑并转移溶液。 请点击此处查看此图的大图。
4. 增殖试验、脑固定和抗体染色
- 第二天,制作1毫升EdU SSM溶液。将10μL的10mM储备的5-乙炔基-2′-脱氧尿苷(EdU)与990μLSM(最终EdU浓度等于0.1mM)移液到无菌微量离心管中并混合。孵育24小时完成后,将1mLEdU SSM移液到无菌12孔培养盘的一孔中。
- 使用具有无菌尖端的微量移液管将大脑从仅含有SSM的孔转移到含有EdU SSM溶液的新孔中。在25°C下孵育1小时。
- 接下来,将EdU标记的大脑转移到含有1mL固定剂(4%多聚甲醛,见 配方表3 )的同一培养托盘中的另一个孔中20分钟。
注意:多聚甲醛是一种生物危害,必须妥善处理。 - 固定后,使用微量移液管将大脑快速转移到72孔迷你托盘的孔中。每个孔可以容纳10个大脑和10-15μL液体(图4B)。一旦将大脑转移到迷你托盘(每孔不超过10个大脑),取出固定物并在10μL1x PBT(磷酸盐缓冲液,pH 7.4,含有0.1%Triton-X 100)中冲洗大脑3次。
注意:冲洗意味着在大脑上移液10μL的1x PBT,去除并重复3次。 - 接下来,清洗大脑3次,每次10分钟,再次在10μL 1x PBT中洗涤。确保大脑始终被一些液体覆盖。
- 洗涤完成后,将10μL封闭溶液(1x PBT和10%正常山羊血清)移液到大脑上。盖上托盘,并在边缘周围用一条石蜡膜密封。
- 密封后,将迷你托盘放入带有湿毛巾的密封盒中,以提供潮湿的环境以防止蒸发。将装有托盘的盒子在4°C下放置过夜。
- 第二天,制作一抗溶液。
注意:在该协议中,兔抗涂鸦用于标记细胞膜,大鼠抗死板用于标记神经母细胞,尽管可以使用任意数量的其他一抗。- 要制作一抗溶液,首先,在封闭溶液中稀释一抗。例如,兔防涂鸦在最终浓度为1:1000时使用。因此,首先,将兔抗涂鸦抗体在1:100(1μL抗体加99μL封闭溶液)下稀释。大鼠死板以1:100的最终浓度使用。因此,首先,以1:10稀释大鼠死盘抗体(1μL抗体加9μL封闭溶液)。
注意:如果还加入叠氮化钠(0.05%)以抑制细菌生长,这些稀释液可以在4°C下长期储存。 - 接下来,计算包含大脑的孔的数量。孔的数量决定了要制造的一抗溶液的体积。例如,如果有2个脑孔,则制备20μL一抗溶液(用于10孔,100μL等)。要制造20μL一抗溶液,加入2μL每个一抗稀释液和16μL封闭溶液。
注意:每种一抗的最终浓度分别为1:1000和1:100。简而言之,以一定浓度进行第一次一次稀释,使第二次稀释始终为1:10以达到相应的最终浓度。在这种情况下,兔子反涂鸦为1:1000,大鼠防死药为1:100。
- 要制作一抗溶液,首先,在封闭溶液中稀释一抗。例如,兔防涂鸦在最终浓度为1:1000时使用。因此,首先,将兔抗涂鸦抗体在1:100(1μL抗体加99μL封闭溶液)下稀释。大鼠死板以1:100的最终浓度使用。因此,首先,以1:10稀释大鼠死盘抗体(1μL抗体加9μL封闭溶液)。
- 用设置为10μL的微量移液管除去封闭溶液,并将10μL一抗溶液移液到每个孔中。
- 使用石蜡膜盖住托盘并密封托盘,然后用湿毛巾将其放回密封盒中。在4°C下孵育过夜。
注意:摇晃不是必需的,强烈建议不要摇晃。抗体将穿透大脑而不会摇晃或混合。 - 第二天,使用微量移液管除去一抗溶液,并用10μL1x PBT冲洗大脑3次。接下来,用10μL1x PBT清洗大脑4次,每次10分钟。在10分钟的洗涤过程中,制备二抗溶液。
- 要制造二抗溶液,请选择识别一抗的二抗。在该协议中,使用了山羊抗兔Alexa Fluor 488和山羊抗鼠Alexa 555。
- 将每种二抗的1μL移液到带有298μL封闭溶液的微量离心管中,以使每个二抗的最终浓度为1:300。
- 在最后10分钟洗涤后,除去1x PBT并将10μL二抗溶液移液到每个孔中。使用石蜡膜密封托盘,然后用湿毛巾将其放回盒子中。在4°C下孵育过夜。
注意:不要担心在冲洗,洗涤之间或添加一抗和二抗溶液时去除孔中的每一个最后μL。大脑将始终浸没在几μL液体中,这很好。 - 第二天,使用微量移液管除去二抗溶液,并用10μL每个1x PBT冲洗大脑3次。接下来,用10μL每次1x PBT洗涤大脑4次,每次10分钟。
- 在10分钟的洗涤过程中,制备EdU反应混合物以检测EdU掺入。根据制造商的指南准备EdU反应混合物。
- 最后洗涤后,除去1x PBT和移液器10μLEdU反应混合物,与大脑一起进入每个孔中。用石蜡膜密封微孔板,并用铝箔盖住。将板放在工作台上30分钟。
- 30分钟后,用10μL每个1x PBT冲洗大脑3次,并用1x PBT的10μL洗涤大脑3次,每次5分钟。
- 最后一次洗涤后,取出1x PBT和移液器10μL基于甘油的贴样介质溶液。密封板并在4°C下放置过夜。
5. 安装和成像大脑
- 第二天,准备显微镜载玻片(25 mm x 75 mm x 1 mm):将一个22 mm x 22 mm x 1 mm方形盖玻片的胶水(例如,超级胶水)一个22 mm x 22 mm x 1 mm方形盖玻片放在显微镜载玻片的两端,以创建一个"桥",在其上放置较大的22 mm x 50 mm x 1 mm盖玻片,以在载玻片和较大的盖玻片之间留出空间(图5A)。这个空间将允许大脑有足够的运动来正确定向,同时防止它被压碎。

图5:显示幼虫脑中的显微镜载玻片,方向和细胞类型的示意图。 (A)显微镜载玻片的视觉表示,在其上安装幼虫脑并准备成像。(B)还显示指南用于组织取向。(C)显微镜载玻片准备在共聚焦显微镜上进行成像。(D)卡通显示幼虫大脑中的一些细胞类型。 请点击此处查看此图的大图。
- 将22 mm x 22 mm x 1 mm盖玻片粘合到显微镜载玻片上后,移液9.3μL基于甘油的安装介质溶液,其中包含来自微孔板孔的一个大脑,并将其放置在载玻片的中心(图5A)。
注意:幼虫的大脑可能会粘附在移液器尖端上,所以要小心。为避免粘连,首先吸出抗褪色剂,然后抽吸单个大脑,以接近9.3μL体积的末端。 - 一旦大脑在载玻片上,轻轻地将22 mm x 50 mm x 1 mm盖玻片放在顶部。如图 5B所示定位大脑。轻轻移动盖玻片以定向大脑。然后,样品准备好进行成像。
- 使用配备高放大倍率和高数值孔径物镜的共聚焦显微镜(图5C)来获得最佳图像。例如:60x 或 63x,1.4 NA 油浸透镜。
- 对背表面最靠近盖玻片(和物镜)的大脑进行成像。从腹侧表面(距物镜最远)以1μm间隔或Z步长通过整个大脑半球获取Z堆栈。
注意:使用的激光取决于二抗。在该协议中,使用的激光线为488 nm以检测Scribble染色,555 nm用于检测Deadpan,633 nm用于检测EdU。
- 对背表面最靠近盖玻片(和物镜)的大脑进行成像。从腹侧表面(距物镜最远)以1μm间隔或Z步长通过整个大脑半球获取Z堆栈。
6. 数据分析
- 使用斐济开源软件分析大脑半球,并使用斐济细胞计数器插件对细胞进行计数。
结果
新鲜孵化的OregonR野生型大脑在补充胰岛素的施耐德培养基(SSM)中解剖并培养24小时。根据方案固定和组织染色。使用针对Deadpan(Dpn)产生的一抗来检测NBs和Scribble来标记细胞膜。加入胸苷类似物5-乙炔基-2′-脱氧尿苷(Edu)以检测S相进入和NB再活化。我们在培养24小时后发现大尺寸的Edu阳性和Dpn阳性NBs(图6A-C)。接下来,将新鲜孵化的OregonR野生型...
讨论
这里描述的培养大脑外植体的方法可以在大多数实验室环境中进行。所需的工具以及程序和数据收集都简单明了。通过这种方法,人们可以测试各种假设,包括与细胞信号传导级联和调节NB再激活和增殖的外在因素相关的假设。在这里,使用野生型OregonR动物,我们发现外源性胰岛素足以独立于其他动物特异性全身线索的静止中重新激活NBs。使用GAL4 / UAS系统,还可以以细胞类型特异性方式敲低或过...
披露声明
作者没有相互竞争的利益。
致谢
我们感谢LSAMP Bridges to Doctorate计划(CNK)以及NIH / NIGMS(R01-GM120421和R35-GM141886)。我们感谢 Conor Sipe 博士提供图 1。我们也感谢所有Siegrist实验室成员的持续支持和指导。我们特别感谢Chhavi Sood和Gary Teeters仔细阅读手稿并提供评论。
材料
| Name | Company | Catalog Number | Comments |
| 10 µL Pipette tips | Denville Sci | P2102 | |
| 1000 µL Pipette tips | Denville Sci | P2103-N | |
| 1000 µL Pipettor | Gilson | P1000 | |
| 16% paraformaldehyde (10 x 10 mL) | Electron Microscopy Sciences | 2912.60.0000 | Used for Fixation of Larval Brains |
| 20 µL Pipette | Gilson | P20 | |
| 200 µL Pipette tips | Denville Sci | 1158U56 | |
| 24-well multiwell culture plates | Fisher Scientific | 50-197-4477 | |
| 35 mm Petri dishes | Fisher Scientific | 08-757-100A | Grape Plate Ingredients |
| 4 °C refrigerator | Fisher Scientific | Provides an ideal temperature for >24 h incubations in antibody solution | |
| 63x Objective | Lecia | ||
| Active dry yeast | Most supermarkets | ||
| Agarose | Fisher Scientific | 214010 | Grape Plate Ingredients |
| Click-iT EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Fisher Scientific | C10340 | to label proliferating cells |
| Confocal Microscope | Leica | SP8 | |
| Coverslips 22 mm x 22 mm x 1 mm , 10 pack of 4 oz | Fisher Scientific | 12-544-10 | Two Coverslips are super glued to the ends of the microscope slide. This creates a space that allows for the brains to float in antifade while being imaged. |
| Coverslips, 22 mm x 50 mm x 1 mm | Fisher Scientific | 12-545E | The coverslip is placed on two square coverslips on the microscope slide ensuring that the brain in the antifade does not move while imaging. |
| Dissecting microscope | Zeiss | Stemi 2000 | |
| Ethanol 200 proof (100%), Decon Labs, 1 gallon bottle | Fisher Scientific | 2701 | Used to wash off the larvae before the 24 hr hold in culture medium |
| Fetal Bovine Serum (10%) | Sigma | F4135-100ML | Supplement for cell culture media. |
| Fine forceps for dissection | Fine Science Tools | 11295-20 | Forcepts used in disections. They work best when sharpened. |
| Fly Bottles for Crossing | Genessee Scientific | 32-130 | This bottle is used as a container that lets the flies lay eggs on the grape plate. |
| Glass Dissection Dish (3 well) | These are no longer available | ||
| Glutathione | Sigma | G6013 | Provides oxidative protection during cell culture. |
| Goat Serum | Sigma | G9023- 10ML | Blocking Agent |
| Grape Plates | Made in house | Made in house | Grape juice/agarose plates for collecting freshly hatched eggs |
| Image J | Imagej.net/fiji/downloads | Free Download: https://fiji.sc | Imaging platform that is used to count cells and Edu reactivation |
| Incubator | Thermo Fisher Scientific | Ensures that the temperature, humidity, and light exposure is exactly the same throughout experiment. | |
| Insulin | Sigma | I0516 | Independant variable of the experiment |
| Laminar flow hood | For aliquoting culture media | ||
| L-Glutamine | Sigma | G7513 | Provides support during cell culture |
| Nunc 72-well Microwell Mini Trays | Fisher Scientific | 12-565-154 | Immunostaining steps are performed in this tray |
| Parafilm | Fisher Scientific | S37440 | Film used to seal plates in order to prevent evaporation |
| Pen-Strep | Sigma | P4458-100ml | Antibiodics used to prevent bacterial contamination of cells during culture. |
| Phosphate Buffer, pH7.4 | Made in house | Made in house | Solvent used to wash the brains after fixing and staining steps |
| Pick | Fine Science Tools | 10140-01 | Used to pick larvae off of the grape plate |
| Propionic acid | Fisher Scientific | A-258 | Grape Plate Ingredients |
| Rabbit 405 | Abcam | ab175653 | Antibodies used for immunostaining |
| Rat 555 | Abcam | ab150166 | Antibodies used for immunostaining |
| Rb Scribble | A Gift from Chris Doe | Antibodies used for immunostaining | |
| Rt Deadpan | Abcam | ab195173 | Antibodies used for immunostaining |
| Schneiders Culture Medium | Life Tech | 21720024 | Contains nutrients that help the cells grow and proliferate |
| SlowFade Diamond Antifade (5 x 2 mL) | Life Tech | S36963 | Reagent that provides protection against fading fluorophores |
| Sterile Water | Autoclave Milli-Q water made in house | Needed for Solutions | |
| Sucrose | Fisher | S2-12 | Grape Plate Ingredients |
| Superfrost Microscope Slides | Fisher Scientific | 12-544-7 | |
| Superglue | Most supermarkets | ||
| Tegosept | Genesee Scientific | 20-259 | Grape Plate Ingredients |
| Triton-X 100 | Sigma | T9284-100ML | PBT |
| Welch's 100% grape grape juice | Most supermarkets | Grape Plate Ingredients |
参考文献
- Suman, S., Domingues, A., Ratajczak, J., Ratajczak, M. Z. Potential clinical applications of stem cells in regenerative medicine. Advances in Experimental Medicine and Biology. 1201, 1-22 (2019).
- Tabar, V., Studer, L. Pluripotent stem cells in regenerative medicine: challenges and recent progress. Nature Reviews Genetics. 15, 82-92 (2014).
- Daley, G. Q. Stem cells and the evolving notion of cellular identity. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 370, 20140376 (2015).
- Rodrigues, M., Kosaric, N., Bonham, C. A., Gurtner, G. C. Wound healing: A cellular perspective. Physiological Reviews. 99, 665-706 (2019).
- van Velthoven, C. T. J., Rando, T. A. Stem cell quiescence: Dynamism, restraint, and cellular idling. Cell Stem Cell. 24, 213-225 (2019).
- Chapman, N. M., Boothby, M. R., Chi, H. Metabolic coordination of T cell quiescence and activation. Nature Reviews Immunology. 20, 55-70 (2020).
- Wosczyna, M. N., Rando, T. A. A muscle stem cell support group: Coordinated cellular responses in muscle regeneration. Developmental Cell. 46, 135-143 (2018).
- Homem, C. C., Knoblich, J. A. Drosophila neuroblasts: a model for stem cell biology. Development. 139, 4297-4310 (2012).
- Kang, K. H., Reichert, H. Control of neural stem cell self-renewal and differentiation in Drosophila. Cell and Tissue Research. 359, 33-45 (2015).
- Chell, J. M., Brand, A. H. Nutrition-responsive glia control exit of neural stem cells from quiescence. Cell. 143, 1161-1173 (2010).
- Sousa-Nunes, R., Yee, L. L., Gould, A. P. Fat cells reactivate quiescent neuroblasts via TOR and glial insulin relays in Drosophila. Nature. 471, 508-512 (2011).
- Britton, J. S., Edgar, B. A. Environmental control of the cell cycle in Drosophila: nutrition activates mitotic and endoreplicative cells by distinct mechanisms. Development. 125, 2149-2158 (1998).
- Lin, S., et al. Extremes of lineage plasticity in the Drosophila brain. Current biology : CB. 23, 1908-1913 (2013).
- Sipe, C. W., Siegrist, S. E. Eyeless uncouples mushroom body neuroblast proliferation from dietary amino acids in Drosophila. Elife. 6, 26343 (2017).
- Speder, P., Brand, A. H. Systemic and local cues drive neural stem cell niche remodelling during neurogenesis in Drosophila. Elife. 7, 30413 (2018).
- Yuan, X., Sipe, C. W., Suzawa, M., Bland, M. L., Siegrist, S. E. Dilp-2-mediated PI3-kinase activation coordinates reactivation of quiescent neuroblasts with growth of their glial stem cell niche. PLoS Biology. 18, 3000721 (2020).
- Colombani, J., et al. A nutrient sensor mechanism controls Drosophila growth. Cell. 114, 739-749 (2003).
- Geminard, C., Rulifson, E. J., Leopold, P. Remote control of insulin secretion by fat cells in Drosophila. Cell Metabolism. 10, 199-207 (2009).
- Siller, K. H., Serr, M., Steward, R., Hays, T. S., Doe, C. Q. Live imaging of Drosophila brain neuroblasts reveals a role for Lis1/dynactin in spindle assembly and mitotic checkpoint control. Molecular Biology of the Cell. 16, 5127-5140 (2005).
- Prithviraj, R., Trunova, S., Giniger, E. Ex vivo culturing of whole, developing Drosophila brains. Journal of Visualized Experiments: JoVE. (65), e4270 (2012).
- Bostock, M. P., et al. An immobilization technique for long-term time-lapse imaging of explanted drosophila tissues. Frontiers in Cell and Developmental Biology. 8, 590094 (2020).
- Datta, S. Activation of neuroblast proliferation in explant culture of the Drosophila larval CNS. Brain Research. 818, 77-83 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。