A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
فحص كيميائي محسن للتعرف السريع على الجاذبات الكيميائية الريزوبكتيرية في إفرازات الجذر
In This Article
Summary
هنا ، نقدم بروتوكول فحص كيميائي محسن. الهدف من هذا البروتوكول هو تقليل خطوات وتكاليف طرق التاكسي الكيميائي البكتيرية التقليدية والعمل كمورد قيم لفهم التفاعلات بين النبات والميكروبات.
Abstract
تحديد التاكسي الكيميائي مهم جدا للبحث وتطبيق البكتيريا المعززة لنمو الريزوسفير. أنشأنا طريقة مباشرة لتحديد الجاذبات الكيميائية بسرعة والتي يمكن أن تحفز الحركة الكيميائية للبكتيريا المعززة لنمو الريزوسفير على شرائح زجاجية معقمة عبر خطوات بسيطة. تمت إضافة محلول البكتيريا (OD600 = 0.5) والمحلول المائي الجاذب الكيميائي المعقم قطرة على الشريحة الزجاجية بفاصل زمني قدره 1 سم. تم استخدام حلقة تلقيح لتوصيل المحلول المائي الجاذب الكيميائي بالمحلول البكتيري. تم الاحتفاظ بالشريحة في درجة حرارة الغرفة لمدة 20 دقيقة على المقعد النظيف. وأخيرا ، تم جمع المحلول المائي الجاذب الكيميائي للعد البكتيري والمراقبة المجهرية. في هذه الدراسة ، من خلال مقارنات متعددة للنتائج التجريبية ، تغلبت الطريقة على أوجه قصور متعددة في طرق التاكسي الكيميائي البكتيرية التقليدية. قللت الطريقة من خطأ عد اللوحات وقصرت الدورة التجريبية. لتحديد المواد الجاذبة للكيماويات ، يمكن لهذه الطريقة الجديدة توفير 2-3 أيام مقارنة بالطريقة التقليدية. بالإضافة إلى ذلك ، تسمح هذه الطريقة لأي باحث بإكمال تجربة التاكسي الكيميائي البكتيري بشكل منهجي في غضون 1-2 أيام. يمكن اعتبار البروتوكول موردا قيما لفهم التفاعلات بين النبات والميكروبات.
Introduction
يعتبر التاكسي الكيميائي مهما لاستعمار البكتيريا الجذرية المعززة لنمو النبات (PGPR) على الجذور ولفهم التفاعلات بين النبات والميكروبات1. تحفز فئة من المركبات منخفضة الوزن الجزيئي (الجاذبات الكيميائية) في إفرازات جذور النباتات الحركة الكيميائية ل PGPR إلى الريزوسفير2. حمض الماليك وحمض الستريك والمكونات الأخرى في إفرازات الجذر تحفز التاكسي الكيميائي لسلالات العصوية3. على سبيل المثال، الجلوكوز وحامض الستريك وحمض الفوماريك في إفرازات جذور الذرة تجند البكتيريا إلى سطح الجذر4. D-galactose ، المشتق من إفرازات الجذر ، يحفز التاكسي الكيميائي ل Bacillus velezensis SQR95. تؤثر الأحماض العضوية ، بما في ذلك الفومارات وحمض الماليك والسكسينات ، على التاكسي الكيميائي واستعمار مختلف PGPR في كاجانوس كاجان - Zea mays نظام المحاصيل البينية 6. حمض الأوليانوليك في إفرازات جذر الأرز ، يعمل كعامل جذب كيميائي للسلالة FP357. يمكن أن تلعب الإفرازات النباتية الأخرى (بما في ذلك الهيستيدين والأرجينين والأسبارتات) دورا حاسما في الاستجابة الكيميائية للبكتيريا8. تعمل إفرازات النبات كإشارة لتوجيه حركة البكتيريا ، وهي الخطوة الأولى أثناء استعمار الريزوسفير. استعمار النبات بواسطة PGPR هو عملية ذات أهمية هائلة ، حيث أن PGPR مفيد لمضيف النبات.
تم استخدام العديد من الطرق لتحليل التاكسي الكيميائي البكتيري. طريقة لوحة السباحة هي واحدة من الطرق الموضحة سابقا9. في هذه الطريقة ، تم تصنيع الألواح بوسط شبه صلب. تمت إضافة مخزن مؤقت كيميائي يحتوي على أجار (1.0٪ ، ث / v) إلى اللوحة. يتم تسخين المخزن المؤقت ، ثم يتم خلطه مع الجاذب الكيميائي. ثم ، تمت إضافة 8 ميكرولتر من تعليق البكتيريا إلى منتصف اللوحة وتم وضع اللوحة في حاضنة عند 28 درجة مئوية. تمت ملاحظة اللوحة وتصويرها بانتظام. ومع ذلك ، كانت الدورة التجريبية لطريقة لوحة السباحة طويلة جدا. في الطريقة الشبيهة بالشعيرات الدموية10 ، يعمل طرف الماصة كغرفة لحمل 100 ميكرولتر من التعليق البكتيري. تم استخدام إبرة حقنة 1 مل كشعيرات دموية. تم إدخال إبرة حقنة تحتوي على جاذبات كيميائية ذات تدرجات تركيز مختلفة في طرف ماصة 100 ميكرولتر. بعد الحضانة في درجة حرارة الغرفة لمدة 3 ساعات ، تمت إزالة إبرة المحقنة ، وتم تخفيف المحتوى وطلائه على الوسط. تم تمثيل التراكم البكتيري في المحقنة بوحدات تشكيل مستعمرة (CFUs) في اللوحات. ومع ذلك ، كان الخطأ التجريبي داخل النسخ المتماثلة للطريقة الشبيهة بالشعيرات الدموية كبيرا. استخدمت طريقة أخرى جهاز SlipChip ميكروفلويديك 11. باختصار ، تم حقن محلول ألبومين مصل البقر (BSA) في جميع القنوات وإزالته باستخدام فراغ. تمت إضافة المحاليل التي تحتوي على جاذبات كيميائية مختلفة (تركيز 1 mM للكشف النوعي فقط) ، والخلايا البكتيرية المعلقة في محلول ملحي مخزن بالفوسفات ومخزن ملحي مخزن بالفوسفات (التحكم السلبي) إلى الآبار الدقيقة العلوية والوسطى والسفلية ، على التوالي. ثم تم إجراء الحضانة في بيئة مظلمة في درجة حرارة الغرفة لمدة 30 دقيقة. ثم تم الكشف عن الخلايا البكتيرية في الآبار الصغيرة. ومع ذلك ، كان جهاز SlipChip الموائع الدقيقة باهظ الثمن. لذلك ، كان لكل طريقة من الطرق الموضحة أعلاه مزايا وعيوب.
أنشأنا مقايسة كيميائية محسنة للتعرف السريع على الجاذبات الكيميائية الريزوبكتيرية في إفرازات الجذر باستخدام شرائح زجاجية معقمة دون خطوات معقدة. في هذه الدراسة ، من خلال مقارنات متعددة للنتائج التجريبية ، تغلبت الطريقة على أوجه قصور متعددة في طرق التاكسي الكيميائي البكتيرية التقليدية. قللت الطريقة من خطأ عد اللوحات وقصرت الدورة التجريبية. لذلك ، إذا تم استخدامها لتحديد مادة جاذبة كيميائيا ، فإن هذه الطريقة الجديدة يمكن أن توفر 2-3 أيام وتقلل من تكلفة المواد التجريبية.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. المواد والمعدات
ملاحظة: تم عزل Bacillus altitudinis LZP02 (CP075052) من ريزوسفير الأرز في شمال شرق الصين12,13 لهذه الدراسة.
- الثقافة ب. ألتيتودينيس LZP02 في لوريا بيرتاني (LB) المتوسطة (الببتون ، 10 غرام L-1 ؛ كلوريد الصوديوم ، 8 غرام L-1 ومستخلص الخميرة ، 5 غرام L-1) لمدة 10 ساعات. جمع الخلايا عن طريق الطرد المركزي في 9,569 × g لمدة 2 دقيقة عند 4 °C. وتخزينها مع 15٪ الجلسرين في -80 درجة مئوية.
ملاحظة: بالنسبة لهذه التجربة ، تم توفير بذور الأرز (Oryza sativa Longgeng 46) من قبل معهد أبحاث الأرز التابع لأكاديمية هيلونغجيانغ للعلوم الزراعية.
2. جمع إفرازات الجذر
- توزيع بذور الأرز عشوائيا في غرفة النمو.
ملاحظة: تم تعقيم بذور الأرز بنسبة 30٪ H2O2 لمدة 30 دقيقة ونقعت في الماء طوال الليل. كانت الظروف على النحو التالي: الضوء المتحكم فيه (16/8 ساعة دورة الضوء / الظلام) ، ودرجة الحرارة (22 ± 2 درجة مئوية) والرطوبة النسبية (70٪). - استزرع بذور الأرز لمدة أسبوع وأضف الماء المعقم مرتين.
- اختر شتلات الأرز ذات الحجم المماثل والنبات في 50 مل من موراشيج وسكوغ (MS) وسط سائل. حضانة لمدة 48 ساعة عند 22 درجة مئوية في ظل ظروف معقمة.
ملاحظة: سيتم إطلاق إفرازات جذور الأرز في وسط MS14،15،16.
3. تحليل الكروماتوغرافيا السائلة لقياس الطيف الكتلي لإفرازات الجذر
- اجمع 100 ميكرولتر من العينة (وسط MS يحتوي على إفرازات الجذر) في أنبوب طرد مركزي سعة 1.5 مل. أضف 20 ميكرولتر من مذيب الاستخراج (الأسيتونيتريل - الميثانول - الماء ، 2: 2: 1 ، بما في ذلك المعيار الداخلي). تجانس العينة عند 45 هرتز لمدة 4 دقائق، تليها الموجات فوق الصوتية على الجليد لمدة 5 دقائق في حمام مائي.
- كرر التجانس ودورة الموجات فوق الصوتية ثلاث مرات. احتضن العينة عند -20 درجة مئوية لمدة 1 ساعة ، تليها الطرد المركزي عند 133,778 × g و 4 °C لمدة 15 دقيقة.
- انقل المادة الفائقة الناتجة إلى قوارير LC-MS وخزنها عند -80 درجة مئوية حتى تحليل UHPLC-QE. تحضير عينات مراقبة الجودة (QC) عن طريق خلط أجزاء متساوية من supernatant من جميع العينات.
ملاحظة: كان حجم كل عينة 600 ميكرولتر (ستة تكرارات لكل تجربة) في التجربة المقدمة. - قم بإجراء تحليل LC-MS/MS باستخدام نظام UHPLC وعمود UPLC HSS T3 (2.1 مم × 100 مم و1.8 ميكرومتر) وQ Exactive12.
- استخدم محلول مائي لحمض الفورميك بنسبة 0.1٪ ومحلول مائي من خلات الأمونيوم بنسبة 5 مليمول / لتر كمرحلة متنقلة A وأسيتونيتريل كمرحلة متنقلة B. استخدم حمض الفورميك وخلات الأمونيوم كأوضاع أيون موجبة وسالبة ، على التوالي.
- اضبط تدرج الاستخلاص على النحو التالي: 0 دقيقة ، 1٪ B ؛ 1 دقيقة ، 1 ٪ ب ؛ 8 دقائق، 99٪ ب. 10 دقائق، 99٪ ب. 10.1 دقيقة، 1٪ ب؛ 12 دقيقة ، 1٪ B. اضبط معدل التدفق وحجم الحقن على 0.5 مل / دقيقة و 2 ميكرولتر ، على التوالي.
ملاحظة: لا يمكن اكتشاف الجزيء الكبير (>1000 دالتون).
4. فحص التاكسي الكيميائي
- تحضير محلول مائي جاذب كيميائي. تأكد من أنها معقمة. قم بتصفية محلول الجاذب الكيميائي باستخدام مرشح بكتيريا 0.22 ميكرومتر.
ملاحظة: كان المحلول المائي الجاذب الكيميائي هو المادة الوحيدة التي تم الحصول عليها من دراسات LC-MS المذابة في الماء. يمكن تعديل التركيز والحجم بشكل مناسب وفقا للدراسات المختلفة. تم استخدام محلول حمض الستريك كمثال. يجب تنفيذ جميع الإجراءات بجانب المصباح. - ضع علامة على الموضع الأوسط للشريحة الزجاجية بفاصل زمني قدره 1 سم. تأكد من تعقيم الشريحة الزجاجية عدة مرات على اللهب.
- أضف 30 ميكرولتر من محلول الجاذب الكيميائي على يسار الشريحة الزجاجية. تأكد من أن البكتيريا قد تم زراعتها إلى المرحلة اللوغاريتمية (2 × 108 CFU / mL) في وسط LB. أضف 30 ميكرولتر من المحلول البكتيري على يمين الشريحة الزجاجية.
ملاحظة: قم بإعداد مجموعة تحكم سالبة بحجم متساو من الماء المعقم. تم استخدام المحلول الملحي (0.9٪ NaCI) كعنصر تحكم إيجابي من أجل القضاء على التغيرات التي تسببها القوة بين الجزيئات في التجربة. - تعقيم حلقة التلقيح عدة مرات على اللهب. استخدم حلقة التلقيح لتوصيل المحلول المائي الجاذب الكيميائي بالمحلول البكتيري واحتفظ به في درجة حرارة الغرفة لمدة 20 دقيقة على مقعد نظيف.
ملاحظة: يجب إجراء التجربة في بيئة خالية من الرياح. اضبط الوقت قبل فصل خط الاتصال عن سلالات القدرات الرياضية المختلفة بشكل مناسب. - بعد 20 دقيقة، افصل خط التوصيل بورق التصفية.
- تأكد من أن أنبوب الطرد المركزي سعة 1.5 مل معقم. جمع المحلول المائي الجاذب الكيميائي على يسار الشريحة الزجاجية. انقل المحلول إلى أنبوب الطرد المركزي المعقم سعة 1.5 مل.
- أضف الحجم المناسب من السافرانين إلى أنبوب جهاز الطرد المركزي. بعد 2 دقيقة ، اجمع السوائل القابلة للامتزاج لحساب البكتيريا والمراقبة المجهرية باستخدام غرفة عد الدم.
5. تحليل النتائج
- أوجد عدد الكائنات الحية الدقيقة القابلة للحياة التي تم جذبها باستخدام المعادلة التالية:
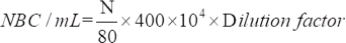
حيث NBC: العدد الإجمالي لخلايا البكتيريا. N: عدد البكتيريا في 80 شبكة.
ملاحظة: تم استخدام برنامج التحليل الإحصائي لتحليل البيانات. استند الخطأ إلى ثلاث قيم تجريبية مختلفة مكررة وتم حسابه باستخدام ANOVA أحادي الاتجاه متبوعا بتحليل تركيا بعد المخصصات. واعتبر P ≤ 0.05 مهما.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم الكشف عن ما مجموعه 584 و 937 مستقلبا معروفا في مؤشرات الأيونات الإيجابية والسالبة ، على التوالي. وقد أظهرت الدراسات السابقة أن الجاذبات الكيميائية هي عادة الأحماض العضوية والأحماض الأمينية والكربوهيدرات17،18.
في هذه الدراسة ، تم اختيار 16 نوعا...
Access restricted. Please log in or start a trial to view this content.
Discussion
تشير الأبحاث المتزايدة إلى أن التفاعلات بين النبات والبكتيريا تحدث بشكل رئيسي في الريزوسفير وتتأثر بإفرازات الجذر20،21،22،23،24. تشمل إفرازات جذور النباتات مجموعة متنوعة من الأيضات الأولية ، بما في ذلك...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 31870493) ، ومشاريع البحث والتطوير الرئيسية في هيلونغجيانغ ، الصين (GA21B007) ، ورسوم البحوث الأساسية للجامعات في مقاطعة هيلونغجيانغ ، الصين (رقم 135409103).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Beijing InnoChem Science & Technology C.,Ltd. | 490-79-9 | |
| Acetonitrile | CNW Technologies | 75-05-8 | |
| Ammonium acetate | CNW Technologies | 631-61-8 | |
| Caffeic acid | Beijing InnoChem Science & Technology C.,Ltd. | 331-39-5 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Fresco17 | |
| Citric acid | Beijing InnoChem Science & Technology C.,Ltd. | 77-92-9 | |
| Clean bench | Shanghai Boxun Industrial Co., Ltd. | BJ-CD | |
| Ferulic acid | Beijing InnoChem Science & Technology C.,Ltd. | 1135-24-6 | |
| Formic acid | CNW Technologies | 64-18-6 | |
| Fructose | Beijing InnoChem Science & Technology C.,Ltd. | 57-48-7 | |
| Galactose | Beijing InnoChem Science & Technology C.,Ltd. | 59-23-4 | |
| Glycine | Beijing InnoChem Science & Technology C.,Ltd. | 56-40-6 | |
| Grinding Mill | Shanghai Jingxin Industrial Development Co., Ltd. | JXFSTPRP-24 | |
| Histidine | Beijing InnoChem Science & Technology C.,Ltd. | 71-00-1 | |
| Internal standard: 2-Chloro-L-phenylalanine | Shanghai Hengbai Biotech C.,Ltd. | 103616-89-3 | |
| Leucine | Beijing InnoChem Science & Technology C.,Ltd. | 61-90-5 | |
| Malic acid | Beijing InnoChem Science & Technology C.,Ltd. | 6915-15-7 | |
| Mannose | Beijing InnoChem Science & Technology C.,Ltd. | 3458-28-4 | |
| Mass Spectrometer | Thermo Fisher Scientific | Q Exactive Focus | |
| Methanol | CNW Technologies | 67-56-1 | |
| Optical Microscope | Olympus | BX43 | |
| Phenylalanine | Beijing InnoChem Science & Technology C.,Ltd. | 63-91-2 | |
| Proline | Beijing InnoChem Science & Technology C.,Ltd. | 147-85-3 | |
| Scales | Sartorius | BSA124S-CW | |
| Serine | Beijing InnoChem Science & Technology C.,Ltd. | 56-45-1 | |
| Threonine | Beijing InnoChem Science & Technology C.,Ltd. | 72-19-5 | |
| UHPLC | Agilent | 1290 UHPLC | |
| Ultrasound Instrument | Shenzhen Leidebang Electronics Co., Ltd. | PS-60AL | |
| Valine | Beijing InnoChem Science & Technology C.,Ltd. | 7004-03-7 |
References
- Belas, R. Biofilms, flagella, and mechanosensing of surfaces by bacteria. Trends in Microbiology. 22 (9), 517-527 (2014).
- Haichar, Z., Santaella, C., Heulin, T., Achouak, W. Root exudates mediated interactions belowground. Soil Biology and Biochemistry. 77 (7), 69-80 (2014).
- Zhang, N., et al. Effects of different plant root exudates and their organic acid components on chemotaxis, biofilm formation and colonization by beneficial rhizosphere-associated bacterial strains. Plant and Soil. 374 (1-2), 689-700 (2014).
- Zhang, N., et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates. BMC Genomics. 16 (1), 685(2015).
- Lui, Y., et al. Induced root-secreted D-galactose functions as a chemoattractant and enhances the biofilm formation of Bacillus velezensis SQR9 in an mcpa-dependent manner. Applied Microbiology and Biotechnology. 104 (17), 785-797 (2020).
- Vora, S. M., Joshi, P., Belwalkar, M., Archana, G. Root exudates influence chemotaxis and colonization of diverse plant growth-promoting rhizobacteria in the Cajanus cajan - Zea mays intercropping system. Rhizosphere. 18 (12), 100331(2021).
- Sampedro, I., et al. Effects of halophyte root exudates and their components on chemotaxis, biofilm formation and colonization of the halophilic bacterium halomonas anticariensis FP35T. Microorganisms. 8 (4), 575(2020).
- Liu, X. L., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. A dual role amino acid from sesbania rostrata seed exudates in the chemotaxis response of Azorhizobium caulinodans ORS571. Molecular Plant-Microbe Interactions. 32 (9), 1134-1147 (2019).
- Ling, N., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. European Journal of Soil Biology. 47 (6), 374-379 (2011).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiology. 148 (3), 1547-1556 (2008).
- Shen, C., et al. Bacterial chemotaxis on Slipchip. Lab on a Chip. 14 (16), 3074-3080 (2014).
- Liu, H., et al. Bacillus pumilus LZP02 promotes rice root growth by improving carbohydrate metabolism and phenylpropanoid biosynthesis. Molecular Plant-Microbe Interactions. 33 (10), 1222-1231 (2020).
- Goswami, M., Deka, S. Isolation of a novel rhizobacteria having multiple plant growth promoting traits and antifungal activity against certain phytopathogens. Microbiological Research. 240, 126516(2020).
- Kaiira, M., Chemining'Wa, G., Ayuke, F., Baguma, Y., Nganga, F. Profiles of compounds in root exudates of rice, cymbopogon, desmodium, mucuna and maize. Journal of Agricultural Sciences Belgrade. 64 (4), 399-412 (2019).
- Shi, Y., et al. Effect of rice root exudates and strain combination on biofilm formation of Paenibacillus polymyxa and Paenibacillus macerans. African Journal of Microbiology Research. 6 (13), 3343-3347 (2012).
- Lee, H. W., Ghimire, S. R., Shin, D. H., Lee, I. J., Kim, K. U. Allelopathic effect of the root exudates of K21, a potent allelopathic rice. Weed Biology and Management. 8 (2), 85-90 (2008).
- Belimov, A. A., et al. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum). Annals of Applied Biology. 167 (1), 11-25 (2015).
- Ankati, S., Podile, A. R. Metabolites in the root exudates of groundnut change during interaction with plant growth promoting rhizobacteria in a strain-specific manner. Journal of Plant Physiology. 243, 153057(2019).
- Gordillo, F., Chavez, F., Jerez, C. A. Motility and chemotaxis of Pseudomonas sp. B4 towards polychlorobiphenyls and chlorobenzoates. FEMS Microbiology Ecology. 60 (2), 322-328 (2007).
- Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., Vivanco, J. M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology. 57, 233-266 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Badri, D. V., Weir, T. L., Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: plant-microbe interactions. Curr Opin Biotech. Current Opinion in Biotechnology. 20 (6), 642-650 (2009).
- Kamilova, F., Kravchenko, L. V., Shaposhnikov, A. I., Makarova, N., Lugtenberg, B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions. 19 (10), 1121-1126 (2006).
- Kamilova, F., et al. Organic acids, sugars, and L-tryptophane in exudates of vegetables growing on stonewool and their effects on activities of rhizosphere bacteria. Molecular Plant-Microbe Interactions. 19 (3), 250-256 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Hao, W. Y., Ren, L. X., Ran, W., Shen, Q. R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. Niveum. Plant and Soil. 336 (1-2), 485-497 (2010).
- Hao, Z. P., Wang, Q., Christie, P., Li, X. L. Allelopathic potential of watermelon tissues and root exudates. Scientia Horticulturae. 112 (3), 315-320 (2007).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved