È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un test di chemiotassi migliorato per la rapida identificazione dei chemioattrattivi rizobatterici negli essudati radicali
In questo articolo
Riepilogo
Qui, presentiamo un protocollo di test di chemiotassi migliorato. L'obiettivo di questo protocollo è quello di ridurre i passaggi e i costi dei metodi tradizionali di chemiotassi batterica e di servire come risorsa preziosa per la comprensione delle interazioni pianta-microbo.
Abstract
L'identificazione della chemiotassi è molto importante per la ricerca e l'applicazione dei batteri che promuovono la crescita della rizosfera. Abbiamo stabilito un metodo semplice per identificare rapidamente i chemioattrattivi che potrebbero indurre il movimento chemiotattico dei batteri che promuovono la crescita della rizosfera su vetrini sterili attraverso semplici passaggi. La soluzione batterica (OD600 = 0,5) e la soluzione acquosa chemioattrattante sterile sono state aggiunte gocciamente sul vetrino ad un intervallo di 1 cm. Un anello inoculante è stato utilizzato per collegare la soluzione acquosa chemioattrattante alla soluzione batterica. Lo scivolo è stato mantenuto a temperatura ambiente per 20 minuti sulla panca pulita. Infine, la soluzione acquosa chemioattrattante è stata raccolta per il conteggio batterico e l'osservazione microscopica. In questo studio, attraverso molteplici confronti di risultati sperimentali, il metodo ha superato molteplici carenze dei tradizionali metodi di chemiotassi batterica. Il metodo ha ridotto l'errore di conteggio delle piastre e abbreviato il ciclo sperimentale. Per l'identificazione delle sostanze chemioattrattatenti, questo nuovo metodo può far risparmiare 2-3 giorni rispetto al metodo tradizionale. Inoltre, questo metodo consente a qualsiasi ricercatore di completare sistematicamente un esperimento di chemiotassi batterica entro 1-2 giorni. Il protocollo può essere considerato una risorsa preziosa per comprendere le interazioni pianta-microbo.
Introduzione
La chemiotassi è importante per la colonizzazione del rizobatterico che promuove la crescita delle piante (PGPR) sulle radici e per comprendere le interazioni pianta-microbo1. Una classe di composti a basso peso molecolare (chemioattrattivi) negli essudati delle radici delle piante induce il movimento chemiotattico della PGPR alla rizosfera2. L'acido malico, l'acido citrico e altri componenti negli essudati radicali stimolano la chemiotassi dei ceppi di Bacillus3. Ad esempio, il glucosio, l'acido citrico e l'acido fumarico negli essudati della radice di mais reclutano batteri sulla superficie della radice4. Il D-galattosio, che deriva dagli essudati radicali, induce la chemiotassi del Bacillus velezensis SQR95. Gli acidi organici, tra cui fumarato, acido malico e succinato, influenzano la chemiotassi e la colonizzazione di vari PGPR nel sistema di intercropping Cajanus cajan - Zea mays6. L'acido oleanolico negli essudati di radice di riso, agisce come chemioattrattante per il ceppo FP357. Altri essudati vegetali (tra cui istidina, arginina e aspartato) possono svolgere un ruolo cruciale nella risposta chemiotattica dei batteri8. Gli essudati vegetali funzionano come un segnale per dirigere il movimento dei batteri, che è il primo passo durante la colonizzazione della rizosfera. La colonizzazione delle piante da parte del PGPR è un processo di enorme rilevanza, in quanto i PGPR sono utili per l'ospite della pianta.
Molti metodi sono stati utilizzati per analizzare la chemiotassi batterica. Il metodo della piastra di nuoto è uno dei metodi descritti in precedenza9. In questo metodo, le piastre sono state realizzate con un mezzo semisolido. Un tampone chemiotattico contenente agar (1,0%, p/v) è stato aggiunto alla piastra. Il tampone viene riscaldato e quindi miscelato con il chemioattrattante. Quindi, 8 μL di sospensione batterica sono stati aggiunti a goccia al centro della piastra e la piastra è stata posta in un incubatore a 28 °C. La lastra è stata regolarmente osservata e fotografata. Tuttavia, il ciclo sperimentale del metodo della piastra di nuoto è stato molto lungo. Nel metodo simile a un capillare10, una punta di pipetta funge da camera per contenere 100 μL di sospensione batterica. 1 mL di ago per siringa è stato usato come capillare. Un ago per siringa contenente chemioattrattivi con diversi gradienti di concentrazione è stato inserito nella punta della pipetta da 100 μL. Dopo l'incubazione a temperatura ambiente per 3 ore, l'ago della siringa è stato rimosso, il contenuto è stato diluito e placcato sul mezzo. L'accumulo batterico nella siringa era rappresentato da unità formanti colonie (CFU) nelle piastre. Tuttavia, l'errore sperimentale all'interno delle repliche per il metodo simile a quello capillare era grande. Un altro metodo utilizzava un dispositivo SlipChip microfluidico11. In breve, la soluzione di albumina sierica bovina (BSA) è stata iniettata in tutti i canali e rimossa usando il vuoto. Le soluzioni contenenti diversi chemioattrattivi (concentrazione di 1 mM solo per il rilevamento qualitativo), cellule batteriche sospese in soluzione salina tamponata con fosfato e tampone fosfato tamponato tamponato (controllo negativo) sono state aggiunte rispettivamente ai micro pozzetti superiore, centrale e inferiore. L'incubazione è stata quindi eseguita in un ambiente buio a temperatura ambiente per 30 minuti. Le cellule batteriche sono state quindi rilevate nei micro pozzetti. Il dispositivo microfluidico SlipChip, tuttavia, era costoso. Pertanto, ciascuno dei metodi sopra descritti presentava vantaggi e svantaggi.
Abbiamo stabilito un test di chemiotassi migliorato per la rapida identificazione di chemioattrattivi rizobatterici negli essudati radicali utilizzando vetrini sterili senza passaggi complicati. In questo studio, attraverso molteplici confronti di risultati sperimentali, il metodo ha superato molteplici carenze dei tradizionali metodi di chemiotassi batterica. Il metodo ha ridotto l'errore di conteggio delle piastre e abbreviato il ciclo sperimentale. Pertanto, se utilizzato per identificare una sostanza chemioattrattante, questo nuovo metodo può risparmiare 2-3 giorni e ridurre il costo dei materiali sperimentali.
Protocollo
1. Materiali e attrezzature
NOTA: Bacillus altitudinis LZP02 (CP075052) è stato isolato dalla rizosfera del riso nel nord-est della Cina12,13 per questo studio.
- Cultura B. altitudinis LZP02 in Luria-Bertani (LB) medio (peptone, 10 g L-1; NaCl, 8 g L-1 ed estratto di lievito, 5 g L-1) per 10 h. Raccogliere le cellule per centrifugazione a 9.569 x g per 2 minuti a 4 °C. e conservare con il 15% di glicerolo a -80 °C.
NOTA: Per questo esperimento, i semi di riso (Oryza sativa Longgeng 46) sono stati forniti dal Rice Research Institute dell'Accademia delle scienze agrarie di Heilongjiang.
2. Raccolta di essudati radicali
- Distribuire casualmente i semi di riso in una camera di crescita.
NOTA: i semi di riso sono stati sterilizzati con il 30% di H2O2 per 30 minuti e immersi in acqua durante la notte. Le condizioni erano le seguenti: la luce controllata (ciclo luce/buio 16/8 h), la temperatura (22 ± 2 °C) e l'umidità relativa (͂70%). - Coltiva i semi di riso per una settimana e aggiungi acqua sterile due volte.
- Selezionare piantine di riso di dimensioni simili e piantare in 50 ml di terreno liquido Murashige e Skoog (MS). Incubare per 48 ore a 22 °C in condizioni asettiche.
NOTA: gli essudati di radice di riso verranno rilasciati nel mezzo MS14,15,16.
3. Cromatografia liquida-spettrometria di massa analisi degli essudati radicali
- Raccogliere 100 μL del campione (mezzo MS contenente essudati radicali) in un tubo centrifugo da 1,5 mL. Aggiungere 20 μL del solvente di estrazione (acetonitrile-metanolo-acqua, 2:2:1, incluso lo standard interno). Omogeneizzare il campione a 45 Hz per 4 minuti, seguito da ultrasuoni su ghiaccio per 5 minuti a bagnomaria.
- Ripetere l'omogeneizzazione e il ciclo ad ultrasuoni tre volte. Incubare il campione a -20 °C per 1 ora, seguito da centrifugazione a 133.778 x g e 4 °C per 15 min.
- Trasferire il surnatante risultante in flaconcini LC-MS e conservare a -80 °C fino all'analisi UHPLC-QE. Preparare i campioni di controllo qualità (QC) mescolando porzioni uguali del surnatante di tutti i campioni.
NOTA: Ogni volume di campione era di 600 μL (sei repliche per esperimento) nell'esperimento presentato. - Eseguire analisi LC-MS/MS utilizzando il sistema UHPLC, la colonna UPLC HSS T3 (2,1 mm x 100 mm, 1,8 μm) e Q Exactive12.
- Utilizzare una soluzione acquosa di acido formico allo 0,1% e una soluzione acquosa di acetato di ammonio 5 mmol/L come fase mobile A e acetonitrile come fase mobile B. Utilizzare rispettivamente acido formico e acetato di ammonio come modalità ioniche positive e negative.
- Impostare il gradiente di eluizione come segue: 0 min, 1% B; 1 min, 1% B; 8 min, 99% B. 10 min, 99% B. 10,1 min, 1% B; 12 min, 1% B. Impostare la portata e il volume di iniezione rispettivamente a 0,5 mL/min e 2 μL.
NOTA: La macromolecola (>1.000 Dalton) non può essere rilevata.
4. Test di chemiotassi
- Preparare la soluzione acquosa chemioattrattante. Assicurarsi che sia sterile. Filtrare la soluzione chemioattrattante con un filtro batterico da 0,22 μm.
NOTA: La soluzione acquosa chemioattrattante era la singola sostanza ottenuta dagli studi LC-MS disciolta in acqua. La concentrazione e il volume possono essere regolati in modo appropriato in base a diversi studi. La soluzione di acido citrico è stata usata come esempio. Tutte le azioni devono essere eseguite dal lato di una lampada. - Contrassegnare la posizione centrale della diapositiva di vetro ad un intervallo di 1 cm. Assicurarsi che il vetrino sia sterilizzato più volte sulla fiamma.
- Aggiungere i 30 μL di soluzione chemioattrattante a sinistra del vetrino. Assicurarsi che i batteri siano stati coltivati allo stadio logaritmico (2 x 108 CFU/mL) in terreno LB. Aggiungere 30 μL della soluzione batterica a destra del vetrino.
NOTA: Preparare un gruppo di controllo negativo con un volume uguale di acqua sterile. La soluzione salina (0,9% NaCI) è stata utilizzata come controllo positivo al fine di eliminare i cambiamenti causati dalla forza intermolecolare sull'esperimento. - Sterilizzare un ciclo di inoculazione più volte sulla fiamma. Utilizzare il ciclo di inoculazione per collegare la soluzione acquosa chemioattrattante alla soluzione batterica e mantenerla a temperatura ambiente per 20 minuti su un banco pulito.
NOTA: L'esperimento deve essere effettuato in un ambiente senza vento. Regolare il tempo prima di scollegare la linea di connessione per ceppi di diverse capacità atletiche in modo appropriato. - Dopo 20 minuti, scollegare la linea di collegamento con carta da filtro.
- Assicurarsi che il tubo della centrifuga da 1,5 ml sia sterile. Raccogliere la soluzione acquosa chemioattrattante a sinistra del vetrino. Trasferire la soluzione nel tubo centrifugo sterile da 1,5 ml.
- Aggiungere il volume appropriato di safranina al tubo della centrifuga. Dopo 2 minuti, raccogliere i liquidi miscibili per il conteggio dei batteri e l'osservazione microscopica con una camera di conteggio del sangue.
5. Analisi dei risultati
- Determinare il numero di microrganismi vitali attratti utilizzando la seguente equazione:
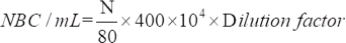
dove NBC: numero totale di cellule batteriche; N: Numero di batteri in 80 griglie.
NOTA: per l'analisi dei dati è stato utilizzato un software di analisi statistica. L'errore si basava su tre diversi valori sperimentali replicati ed è stato calcolato utilizzando ANOVA unidirezionale seguito dall'analisi post-hoc della Turchia. P ≤ 0,05 è stato considerato significativo.
Risultati
Un totale di 584 e 937 metaboliti noti sono stati rilevati rispettivamente negli indici ionici positivi e negativi. Studi precedenti hanno dimostrato che i chemioattrattivi sono tipicamente acidi organici, amminoacidi e carboidrati17,18.
In questo studio, 16 tipi di chemioattrattivi dagli studi LC-MS negli essudati della rizosfera del riso sono stati selezionati per esperimenti successivi (Tabella 1). Utilizzando il me...
Discussione
La crescente ricerca indica che le interazioni pianta-batteri si verificano principalmente nella rizosfera e sono influenzate dagli essudati radicali20,21,22,23,24. Gli essudati delle radici delle piante comprendono una vasta gamma di metaboliti primari, tra cui acidi fenolici, acidi organici e amminoacidi, nonché composti secondari più complessi25,26,27.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (n. 31870493), dai progetti chiave di ricerca e sviluppo a Heilongjiang, in Cina (GA21B007) e dalle tasse di ricerca di base delle università nella provincia di Heilongjiang, in Cina (n. 135409103).
Materiali
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Beijing InnoChem Science & Technology C.,Ltd. | 490-79-9 | |
| Acetonitrile | CNW Technologies | 75-05-8 | |
| Ammonium acetate | CNW Technologies | 631-61-8 | |
| Caffeic acid | Beijing InnoChem Science & Technology C.,Ltd. | 331-39-5 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Fresco17 | |
| Citric acid | Beijing InnoChem Science & Technology C.,Ltd. | 77-92-9 | |
| Clean bench | Shanghai Boxun Industrial Co., Ltd. | BJ-CD | |
| Ferulic acid | Beijing InnoChem Science & Technology C.,Ltd. | 1135-24-6 | |
| Formic acid | CNW Technologies | 64-18-6 | |
| Fructose | Beijing InnoChem Science & Technology C.,Ltd. | 57-48-7 | |
| Galactose | Beijing InnoChem Science & Technology C.,Ltd. | 59-23-4 | |
| Glycine | Beijing InnoChem Science & Technology C.,Ltd. | 56-40-6 | |
| Grinding Mill | Shanghai Jingxin Industrial Development Co., Ltd. | JXFSTPRP-24 | |
| Histidine | Beijing InnoChem Science & Technology C.,Ltd. | 71-00-1 | |
| Internal standard: 2-Chloro-L-phenylalanine | Shanghai Hengbai Biotech C.,Ltd. | 103616-89-3 | |
| Leucine | Beijing InnoChem Science & Technology C.,Ltd. | 61-90-5 | |
| Malic acid | Beijing InnoChem Science & Technology C.,Ltd. | 6915-15-7 | |
| Mannose | Beijing InnoChem Science & Technology C.,Ltd. | 3458-28-4 | |
| Mass Spectrometer | Thermo Fisher Scientific | Q Exactive Focus | |
| Methanol | CNW Technologies | 67-56-1 | |
| Optical Microscope | Olympus | BX43 | |
| Phenylalanine | Beijing InnoChem Science & Technology C.,Ltd. | 63-91-2 | |
| Proline | Beijing InnoChem Science & Technology C.,Ltd. | 147-85-3 | |
| Scales | Sartorius | BSA124S-CW | |
| Serine | Beijing InnoChem Science & Technology C.,Ltd. | 56-45-1 | |
| Threonine | Beijing InnoChem Science & Technology C.,Ltd. | 72-19-5 | |
| UHPLC | Agilent | 1290 UHPLC | |
| Ultrasound Instrument | Shenzhen Leidebang Electronics Co., Ltd. | PS-60AL | |
| Valine | Beijing InnoChem Science & Technology C.,Ltd. | 7004-03-7 |
Riferimenti
- Belas, R. Biofilms, flagella, and mechanosensing of surfaces by bacteria. Trends in Microbiology. 22 (9), 517-527 (2014).
- Haichar, Z., Santaella, C., Heulin, T., Achouak, W. Root exudates mediated interactions belowground. Soil Biology and Biochemistry. 77 (7), 69-80 (2014).
- Zhang, N., et al. Effects of different plant root exudates and their organic acid components on chemotaxis, biofilm formation and colonization by beneficial rhizosphere-associated bacterial strains. Plant and Soil. 374 (1-2), 689-700 (2014).
- Zhang, N., et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates. BMC Genomics. 16 (1), 685 (2015).
- Lui, Y., et al. Induced root-secreted D-galactose functions as a chemoattractant and enhances the biofilm formation of Bacillus velezensis SQR9 in an mcpa-dependent manner. Applied Microbiology and Biotechnology. 104 (17), 785-797 (2020).
- Vora, S. M., Joshi, P., Belwalkar, M., Archana, G. Root exudates influence chemotaxis and colonization of diverse plant growth-promoting rhizobacteria in the Cajanus cajan - Zea mays intercropping system. Rhizosphere. 18 (12), 100331 (2021).
- Sampedro, I., et al. Effects of halophyte root exudates and their components on chemotaxis, biofilm formation and colonization of the halophilic bacterium halomonas anticariensis FP35T. Microorganisms. 8 (4), 575 (2020).
- Liu, X. L., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. A dual role amino acid from sesbania rostrata seed exudates in the chemotaxis response of Azorhizobium caulinodans ORS571. Molecular Plant-Microbe Interactions. 32 (9), 1134-1147 (2019).
- Ling, N., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. European Journal of Soil Biology. 47 (6), 374-379 (2011).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiology. 148 (3), 1547-1556 (2008).
- Shen, C., et al. Bacterial chemotaxis on Slipchip. Lab on a Chip. 14 (16), 3074-3080 (2014).
- Liu, H., et al. Bacillus pumilus LZP02 promotes rice root growth by improving carbohydrate metabolism and phenylpropanoid biosynthesis. Molecular Plant-Microbe Interactions. 33 (10), 1222-1231 (2020).
- Goswami, M., Deka, S. Isolation of a novel rhizobacteria having multiple plant growth promoting traits and antifungal activity against certain phytopathogens. Microbiological Research. 240, 126516 (2020).
- Kaiira, M., Chemining'Wa, G., Ayuke, F., Baguma, Y., Nganga, F. Profiles of compounds in root exudates of rice, cymbopogon, desmodium, mucuna and maize. Journal of Agricultural Sciences Belgrade. 64 (4), 399-412 (2019).
- Shi, Y., et al. Effect of rice root exudates and strain combination on biofilm formation of Paenibacillus polymyxa and Paenibacillus macerans. African Journal of Microbiology Research. 6 (13), 3343-3347 (2012).
- Lee, H. W., Ghimire, S. R., Shin, D. H., Lee, I. J., Kim, K. U. Allelopathic effect of the root exudates of K21, a potent allelopathic rice. Weed Biology and Management. 8 (2), 85-90 (2008).
- Belimov, A. A., et al. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum). Annals of Applied Biology. 167 (1), 11-25 (2015).
- Ankati, S., Podile, A. R. Metabolites in the root exudates of groundnut change during interaction with plant growth promoting rhizobacteria in a strain-specific manner. Journal of Plant Physiology. 243, 153057 (2019).
- Gordillo, F., Chavez, F., Jerez, C. A. Motility and chemotaxis of Pseudomonas sp. B4 towards polychlorobiphenyls and chlorobenzoates. FEMS Microbiology Ecology. 60 (2), 322-328 (2007).
- Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., Vivanco, J. M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology. 57, 233-266 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Badri, D. V., Weir, T. L., Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: plant-microbe interactions. Curr Opin Biotech. Current Opinion in Biotechnology. 20 (6), 642-650 (2009).
- Kamilova, F., Kravchenko, L. V., Shaposhnikov, A. I., Makarova, N., Lugtenberg, B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions. 19 (10), 1121-1126 (2006).
- Kamilova, F., et al. Organic acids, sugars, and L-tryptophane in exudates of vegetables growing on stonewool and their effects on activities of rhizosphere bacteria. Molecular Plant-Microbe Interactions. 19 (3), 250-256 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Hao, W. Y., Ren, L. X., Ran, W., Shen, Q. R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. Niveum. Plant and Soil. 336 (1-2), 485-497 (2010).
- Hao, Z. P., Wang, Q., Christie, P., Li, X. L. Allelopathic potential of watermelon tissues and root exudates. Scientia Horticulturae. 112 (3), 315-320 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon