Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein verbesserter Chemotaxis-Assay zur schnellen Identifizierung von rhizobakteriellen Chemoattraktantien in Wurzelexsudaten
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein verbessertes Chemotaxis-Assay-Protokoll. Ziel dieses Protokolls ist es, die Schritte und Kosten herkömmlicher bakterieller Chemotaxis-Methoden zu reduzieren und als wertvolle Ressource für das Verständnis von Pflanzen-Mikroben-Interaktionen zu dienen.
Zusammenfassung
Die Chemotaxis-Identifizierung ist sehr wichtig für die Erforschung und Anwendung von rhizosphärenwachstumsfördernden Bakterien. Wir haben eine einfache Methode etabliert, um schnell die Chemoattraktiva zu identifizieren, die die chemotaktische Bewegung von rhizosphärenwachstumsfördernden Bakterien auf sterilen Glasobjektträgern in einfachen Schritten induzieren könnten. Bakterienlösung (OD600 = 0,5) und sterile chemoattraktive wässrige Lösung wurden im Abstand von 1 cm tropfenweise auf den Glasobjektträger gegeben. Eine Impfschleife wurde verwendet, um die chemoattraktive wässrige Lösung mit der bakteriellen Lösung zu verbinden. Die Rutsche wurde bei Raumtemperatur für 20 min auf der sauberen Bank gehalten. Schließlich wurde die chemoattraktive wässrige Lösung für die Bakterienzählung und mikroskopische Beobachtung gesammelt. In dieser Studie überwand die Methode durch mehrfache Vergleiche experimenteller Ergebnisse mehrere Mängel herkömmlicher bakterieller Chemotaxis-Methoden. Die Methode reduzierte den Fehler der Plattenzählung und verkürzte den Versuchszyklus. Für die Identifizierung von chemoattraktiven Substanzen kann diese neue Methode im Vergleich zur herkömmlichen Methode 2-3 Tage einsparen. Darüber hinaus ermöglicht diese Methode jedem Forscher, ein bakterielles Chemotaxis-Experiment innerhalb von 1-2 Tagen systematisch abzuschließen. Das Protokoll kann als wertvolle Ressource für das Verständnis von Pflanzen-Mikroben-Interaktionen angesehen werden.
Einleitung
Chemotaxis ist wichtig für die Besiedlung von pflanzenwachstumsfördernden Rhizobakterien (PGPR) auf Wurzeln und für das Verständnis von Pflanzen-Mikroben-Interaktionen1. Eine Klasse niedermolekularer Verbindungen (Chemoattraktiva) in Pflanzenwurzelexsudaten induziert die chemotaktische Bewegung von PGPR in die Rhizosphäre2. Apfelsäure, Zitronensäure und andere Komponenten in den Wurzelexsudaten stimulieren die Chemotaxis von Bacillus-Stämmen3. Zum Beispiel rekrutieren Glukose, Zitronensäure und Fumarsäure in Maiswurzelexsudaten Bakterien an die Wurzeloberfläche4. D-Galactose, die aus Wurzelexsudaten gewonnen wird, induziert die Chemotaxis von Bacillus velezensis SQR95. Organische Säuren, einschließlich Fumarat, Apfelsäure und Bernsteinat, beeinflussen die Chemotaxis und die Besiedlung verschiedener PGPR im Cajanus cajan - Zea mays Zwischenfruchtsystem6. Oleanolsäure in Reiswurzelexsudaten wirkt als Chemoattraktivum für den Stamm FP357. Andere pflanzliche Exsudate (einschließlich Histidin, Arginin und Aspartat) können eine entscheidende Rolle bei der chemotaktischen Reaktion von Bakterien spielen8. Pflanzenexsudate fungieren als Signal, um die Bewegung von Bakterien zu steuern, was der erste Schritt während der Rhizosphärenbesiedlung ist. Die Pflanzenbesiedlung durch PGPR ist ein Prozess von enormer Relevanz, da PGPR für den Pflanzenwirt von Vorteil sind.
Viele Methoden wurden zur Analyse der bakteriellen Chemotaxis verwendet. Die Schwimmplattenmethode ist eine der zuvor beschriebenen Methoden9. Bei diesem Verfahren wurden Platten mit einem halbfesten Medium hergestellt. Ein chemotaktischer Puffer, der Agar (1,0%, w/v) enthielt, wurde der Platte zugesetzt. Der Puffer wird erhitzt und dann mit dem Chemoattraktivum gemischt. Dann wurden 8 μL Bakteriensuspension tropfenweise in die Mitte der Platte gegeben und die Platte bei 28 °C in einen Inkubator gegeben. Die Platte wurde regelmäßig beobachtet und fotografiert. Der experimentelle Zyklus der Schwimmplattenmethode war jedoch sehr lang. Bei der kapillarartigen Methode10 dient eine Pipettenspitze als Kammer zur Aufnahme von 100 μL Bakteriensuspension. 1 ml Spritzennadel wurde als Kapillare verwendet. In die 100 μL Pipettenspitze wurde eine Spritzennadel mit Chemotraktoren mit unterschiedlichen Konzentrationsgradienten eingeführt. Nach der Inkubation bei Raumtemperatur für 3 h wurde die Spritzennadel entfernt, der Inhalt verdünnt und auf dem Medium plattiert. Die bakterielle Akkumulation in der Spritze wurde durch koloniebildende Einheiten (CFUs) in den Platten dargestellt. Der experimentelle Fehler innerhalb von Replikaten für die kapillarartige Methode war jedoch groß. Eine andere Methode verwendete ein mikrofluidisches SlipChip-Gerät11. Kurz gesagt, Rinderserumalbumin (BSA) -Lösung wurde in alle Kanäle injiziert und mit einem Vakuum entfernt. Die Lösungen, die verschiedene Chemoattraktiva (1 mM-Konzentration nur für den qualitativen Nachweis), Bakterienzellen, die in phosphatgepufferter Kochsalzlösung suspendiert sind, und phosphatgepufferter Kochsalzpuffer (Negativkontrolle) enthielten, wurden den oberen, mittleren bzw. unteren Mikrobohrlöchern zugesetzt. Die Inkubation wurde dann in einer dunklen Umgebung bei Raumtemperatur für 30 min durchgeführt. Die Bakterienzellen wurden dann in den Mikrotrüchtigen nachgewiesen. Das mikrofluidische SlipChip-Gerät war jedoch teuer. Daher hatte jede der oben beschriebenen Methoden Vor- und Nachteile.
Wir haben einen verbesserten Chemotaxis-Assay zur schnellen Identifizierung von rhizobakteriellen Chemoattraktiva in Wurzelexsudaten unter Verwendung steriler Glasobjektträger ohne komplizierte Schritte etabliert. In dieser Studie überwand die Methode durch mehrfache Vergleiche experimenteller Ergebnisse mehrere Mängel herkömmlicher bakterieller Chemotaxis-Methoden. Die Methode reduzierte den Fehler der Plattenzählung und verkürzte den Versuchszyklus. Wenn diese neue Methode zur Identifizierung einer chemoattraktiven Substanz verwendet wird, kann sie 2-3 Tage einsparen und die Kosten für experimentelle Materialien senken.
Protokoll
1. Materialien und Ausrüstung
ANMERKUNG: Bacillus altitudinis LZP02 (CP075052) wurde für diese Studie aus der Rhizosphäre von Reis im Nordosten Chinas isoliert12,13.
- Kultur B. altitudinis LZP02 in Luria-Bertani (LB) medium (Pepton, 10 g L-1; NaCl, 8 g L-1 und Hefeextrakt, 5 g L-1) für 10 h. Zellen durch Zentrifugation bei 9.569 x g für 2 min bei 4 °C sammeln und mit 15% Glycerin bei -80 °C lagern.
HINWEIS: Für dieses Experiment wurden Reissamen (Oryza sativa Longgeng 46) vom Reisforschungsinstitut der Heilongjiang Academy of Agricultural Sciences zur Verfügung gestellt.
2. Sammlung von Wurzelexsudaten
- Verteilen Sie zufällig Reissamen in einer Wachstumskammer.
HINWEIS: Reissamen wurden mit 30% H2O2 für 30 min sterilisiert und über Nacht in Wasser eingeweicht. Die Bedingungen waren wie folgt: das kontrollierte Licht (16/8 h Hell/Dunkel-Zyklus), die Temperatur (22 ± 2 °C) und die relative Luftfeuchtigkeit ( ͂70%). - Kultivieren Sie Reissamen für eine Woche und fügen Sie zweimal steriles Wasser hinzu.
- Wählen Sie Reissämlinge ähnlicher Größe und Pflanze in 50 ml Murashige und Skoog (MS) flüssigem Medium. 48 h bei 22 °C unter aseptischen Bedingungen inkubieren.
HINWEIS: Reiswurzelexsudate werden in das MS-Medium freigesetzt14,15,16.
3. Flüssigkeitschromatographie-Massenspektrometrie Analyse von Wurzelexsudaten
- 100 μL der Probe (MS-Medium mit Wurzelexsudaten) in einem 1,5 mL Zentrifugenröhrchen auffangen. 20 μL des Extraktionslösungsmittels (Acetonitril-Methanol-Wasser, 2:2:1, einschließlich interner Norm) zugeben. Homogenisieren Sie die Probe bei 45 Hz für 4 min, gefolgt von Ultraschall auf Eis für 5 min in einem Wasserbad.
- Wiederholen Sie den Homogenisierungs- und Ultraschallzyklus dreimal. Inkubieren der Probe bei -20 °C für 1 h, gefolgt von einer Zentrifugation bei 133,778 x g und 4 °C für 15 min.
- Den resultierenden Überstand auf LC-MS-Fläschchen übertragen und bei -80 °C bis zur UHPLC-QE-Analyse lagern. Bereiten Sie die Proben der Qualitätskontrolle (QC) vor, indem Sie gleiche Teile des Überstands aller Proben mischen.
HINWEIS: Jedes Probenvolumen betrug im vorgestellten Experiment 600 μL (sechs Replikate pro Experiment). - Durchführung von LC-MS/MS-Analysen mit UHPLC-System, UPLC HSS T3-Säule (2,1 mm x 100 mm, 1,8 μm) und Q Exactive12.
- Verwenden Sie 0,1% ige wässrige Ameisensäurelösung und 5 mmol/L wässrige Ammoniumacetatlösung als mobile Phase A und Acetonitril als mobile Phase B. Verwenden Sie Ameisensäure und Ammoniumacetat als positive bzw. negative Ionenmoden.
- Stellen Sie den Elutionsgradienten wie folgt ein: 0 min, 1% B; 1 Min., 1% B; 8 min, 99% B. 10 min, 99% B. 10,1 min, 1% B; 12 min, 1% B. Stellen Sie die Durchflussrate und das Injektionsvolumen auf 0,5 ml/min bzw. 2 μL ein.
HINWEIS: Das Makromolekül (>1.000 Dalton) kann nicht erkannt werden.
4. Chemotaxis-Assay
- Bereiten Sie die chemoattraktive wässrige Lösung vor. Stellen Sie sicher, dass es steril ist. Die chemoattraktive Lösung wird mit einem 0,22 μm Bakterienfilter filtriert.
ANMERKUNG: Die chemoattraktive wässrige Lösung war die aus den LC-MS-Studien erhaltene Einzelsubstanz, gelöst in Wasser. Die Konzentration und das Volumen können entsprechend den verschiedenen Studien angepasst werden. Als Beispiel wurde Zitronensäurelösung verwendet. Alle Aktionen müssen an der Seite einer Lampe ausgeführt werden. - Markieren Sie die mittlere Position des Glasobjektträgers in einem Abstand von 1 cm. Stellen Sie sicher, dass der Glasobjektträger mehrmals auf der Flamme sterilisiert wird.
- Fügen Sie die 30 μL chemoattraktive Lösung auf der linken Seite des Glasobjektträgers hinzu. Stellen Sie sicher, dass Bakterien bis zum logarithmischen Stadium (2 x 108 KBE/ml) in LB-Medium kultiviert wurden. Fügen Sie 30 μL der Bakterienlösung auf der rechten Seite des Glasobjektträgers hinzu.
HINWEIS: Bereiten Sie eine Negativkontrollgruppe mit einem gleichen Volumen sterilen Wassers vor. Die Kochsalzlösung (0,9% NaCI) wurde als Positivkontrolle verwendet, um die durch die intermolekulare Kraft auf das Experiment verursachten Veränderungen zu eliminieren. - Sterilisieren Sie eine Impfschlaufe mehrmals auf der Flamme. Verwenden Sie die Impfschleife, um die chemoattraktive wässrige Lösung mit der Bakterienlösung zu verbinden und sie 20 Minuten lang auf einer sauberen Bank bei Raumtemperatur zu halten.
HINWEIS: Das Experiment muss in einer windstillen Umgebung durchgeführt werden. Passen Sie die Zeit vor dem Trennen der Verbindungsleitung für Belastungen unterschiedlicher sportlicher Fähigkeiten entsprechend an. - Nach 20 min trennen Sie die Verbindungsleitung mit Filterpapier.
- Stellen Sie sicher, dass das 1,5 ml Zentrifugenröhrchen steril ist. Sammeln Sie die chemoattraktive wässrige Lösung auf der linken Seite des Glasobjektträgers. Die Lösung wird in das 1,5 ml sterile Zentrifugenröhrchen gegeben.
- Das entsprechende Volumen Safranin in das Zentrifugenröhrchen geben. Sammeln Sie nach 2 Min die mischbaren Flüssigkeiten zum Zählen von Bakterien und zur mikroskopischen Beobachtung mit einer Blutzählkammer.
5. Ergebnisanalyse
- Bestimmen Sie die Anzahl der lebensfähigen Mikroorganismen, die mit der folgenden Gleichung angezogen werden:
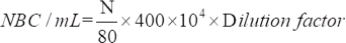
wobei NBC: Gesamtzahl der Bakterienzellen; N: Anzahl der Bakterien in 80 Gittern.
HINWEIS: Für die Datenanalyse wurde eine Statistische Analysesoftware verwendet. Der Fehler basierte auf drei verschiedenen replizierten experimentellen Werten und wurde unter Verwendung der Einweg-ANOVA berechnet, gefolgt von der Post-hoc-Analyse der Türkei. P ≤ 0,05 wurde als signifikant angesehen.
Ergebnisse
Insgesamt wurden 584 bzw. 937 bekannte Metaboliten im positiven bzw. negativen Ionenindex nachgewiesen. Frühere Studien haben gezeigt, dass Chemoattraktiva typischerweise organische Säuren, Aminosäuren und Kohlenhydrate sind17,18.
In dieser Studie wurden 16 Arten von Chemoattraktiva aus den LC-MS-Studien in den Reis-Rhizosphären-Exsudaten für nachfolgende Experimente ausgewählt (Tabelle 1). Mit der Schwimmplatten...
Diskussion
Zunehmende Forschungen deuten darauf hin, dass Pflanzen-Bakterien-Interaktionen hauptsächlich in der Rhizosphäre auftreten und durch Wurzelexsudate beeinflusst werden20,21,22,23,24. Pflanzenwurzelexsudate umfassen eine Vielzahl von Primärmetaboliten, darunter Phenolsäuren, organische Säuren und Aminosäuren sowie komplexere Sekundärverbindungen25,26,27.<...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (Nr. 31870493), den Key Research and Development Projects in Heilongjiang, China (GA21B007), und den Basic Research Fees of Universities in Heilongjiang Province, China (No. 135409103) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Beijing InnoChem Science & Technology C.,Ltd. | 490-79-9 | |
| Acetonitrile | CNW Technologies | 75-05-8 | |
| Ammonium acetate | CNW Technologies | 631-61-8 | |
| Caffeic acid | Beijing InnoChem Science & Technology C.,Ltd. | 331-39-5 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Fresco17 | |
| Citric acid | Beijing InnoChem Science & Technology C.,Ltd. | 77-92-9 | |
| Clean bench | Shanghai Boxun Industrial Co., Ltd. | BJ-CD | |
| Ferulic acid | Beijing InnoChem Science & Technology C.,Ltd. | 1135-24-6 | |
| Formic acid | CNW Technologies | 64-18-6 | |
| Fructose | Beijing InnoChem Science & Technology C.,Ltd. | 57-48-7 | |
| Galactose | Beijing InnoChem Science & Technology C.,Ltd. | 59-23-4 | |
| Glycine | Beijing InnoChem Science & Technology C.,Ltd. | 56-40-6 | |
| Grinding Mill | Shanghai Jingxin Industrial Development Co., Ltd. | JXFSTPRP-24 | |
| Histidine | Beijing InnoChem Science & Technology C.,Ltd. | 71-00-1 | |
| Internal standard: 2-Chloro-L-phenylalanine | Shanghai Hengbai Biotech C.,Ltd. | 103616-89-3 | |
| Leucine | Beijing InnoChem Science & Technology C.,Ltd. | 61-90-5 | |
| Malic acid | Beijing InnoChem Science & Technology C.,Ltd. | 6915-15-7 | |
| Mannose | Beijing InnoChem Science & Technology C.,Ltd. | 3458-28-4 | |
| Mass Spectrometer | Thermo Fisher Scientific | Q Exactive Focus | |
| Methanol | CNW Technologies | 67-56-1 | |
| Optical Microscope | Olympus | BX43 | |
| Phenylalanine | Beijing InnoChem Science & Technology C.,Ltd. | 63-91-2 | |
| Proline | Beijing InnoChem Science & Technology C.,Ltd. | 147-85-3 | |
| Scales | Sartorius | BSA124S-CW | |
| Serine | Beijing InnoChem Science & Technology C.,Ltd. | 56-45-1 | |
| Threonine | Beijing InnoChem Science & Technology C.,Ltd. | 72-19-5 | |
| UHPLC | Agilent | 1290 UHPLC | |
| Ultrasound Instrument | Shenzhen Leidebang Electronics Co., Ltd. | PS-60AL | |
| Valine | Beijing InnoChem Science & Technology C.,Ltd. | 7004-03-7 |
Referenzen
- Belas, R. Biofilms, flagella, and mechanosensing of surfaces by bacteria. Trends in Microbiology. 22 (9), 517-527 (2014).
- Haichar, Z., Santaella, C., Heulin, T., Achouak, W. Root exudates mediated interactions belowground. Soil Biology and Biochemistry. 77 (7), 69-80 (2014).
- Zhang, N., et al. Effects of different plant root exudates and their organic acid components on chemotaxis, biofilm formation and colonization by beneficial rhizosphere-associated bacterial strains. Plant and Soil. 374 (1-2), 689-700 (2014).
- Zhang, N., et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates. BMC Genomics. 16 (1), 685 (2015).
- Lui, Y., et al. Induced root-secreted D-galactose functions as a chemoattractant and enhances the biofilm formation of Bacillus velezensis SQR9 in an mcpa-dependent manner. Applied Microbiology and Biotechnology. 104 (17), 785-797 (2020).
- Vora, S. M., Joshi, P., Belwalkar, M., Archana, G. Root exudates influence chemotaxis and colonization of diverse plant growth-promoting rhizobacteria in the Cajanus cajan - Zea mays intercropping system. Rhizosphere. 18 (12), 100331 (2021).
- Sampedro, I., et al. Effects of halophyte root exudates and their components on chemotaxis, biofilm formation and colonization of the halophilic bacterium halomonas anticariensis FP35T. Microorganisms. 8 (4), 575 (2020).
- Liu, X. L., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. A dual role amino acid from sesbania rostrata seed exudates in the chemotaxis response of Azorhizobium caulinodans ORS571. Molecular Plant-Microbe Interactions. 32 (9), 1134-1147 (2019).
- Ling, N., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. European Journal of Soil Biology. 47 (6), 374-379 (2011).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiology. 148 (3), 1547-1556 (2008).
- Shen, C., et al. Bacterial chemotaxis on Slipchip. Lab on a Chip. 14 (16), 3074-3080 (2014).
- Liu, H., et al. Bacillus pumilus LZP02 promotes rice root growth by improving carbohydrate metabolism and phenylpropanoid biosynthesis. Molecular Plant-Microbe Interactions. 33 (10), 1222-1231 (2020).
- Goswami, M., Deka, S. Isolation of a novel rhizobacteria having multiple plant growth promoting traits and antifungal activity against certain phytopathogens. Microbiological Research. 240, 126516 (2020).
- Kaiira, M., Chemining'Wa, G., Ayuke, F., Baguma, Y., Nganga, F. Profiles of compounds in root exudates of rice, cymbopogon, desmodium, mucuna and maize. Journal of Agricultural Sciences Belgrade. 64 (4), 399-412 (2019).
- Shi, Y., et al. Effect of rice root exudates and strain combination on biofilm formation of Paenibacillus polymyxa and Paenibacillus macerans. African Journal of Microbiology Research. 6 (13), 3343-3347 (2012).
- Lee, H. W., Ghimire, S. R., Shin, D. H., Lee, I. J., Kim, K. U. Allelopathic effect of the root exudates of K21, a potent allelopathic rice. Weed Biology and Management. 8 (2), 85-90 (2008).
- Belimov, A. A., et al. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum). Annals of Applied Biology. 167 (1), 11-25 (2015).
- Ankati, S., Podile, A. R. Metabolites in the root exudates of groundnut change during interaction with plant growth promoting rhizobacteria in a strain-specific manner. Journal of Plant Physiology. 243, 153057 (2019).
- Gordillo, F., Chavez, F., Jerez, C. A. Motility and chemotaxis of Pseudomonas sp. B4 towards polychlorobiphenyls and chlorobenzoates. FEMS Microbiology Ecology. 60 (2), 322-328 (2007).
- Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., Vivanco, J. M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology. 57, 233-266 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Badri, D. V., Weir, T. L., Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: plant-microbe interactions. Curr Opin Biotech. Current Opinion in Biotechnology. 20 (6), 642-650 (2009).
- Kamilova, F., Kravchenko, L. V., Shaposhnikov, A. I., Makarova, N., Lugtenberg, B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions. 19 (10), 1121-1126 (2006).
- Kamilova, F., et al. Organic acids, sugars, and L-tryptophane in exudates of vegetables growing on stonewool and their effects on activities of rhizosphere bacteria. Molecular Plant-Microbe Interactions. 19 (3), 250-256 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Hao, W. Y., Ren, L. X., Ran, W., Shen, Q. R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. Niveum. Plant and Soil. 336 (1-2), 485-497 (2010).
- Hao, Z. P., Wang, Q., Christie, P., Li, X. L. Allelopathic potential of watermelon tissues and root exudates. Scientia Horticulturae. 112 (3), 315-320 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten