このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
根の滲出液中の根茎細菌の化学誘引物質の迅速な同定のための改良された気化症アッセイ
要約
ここでは、改善された走化性アッセイプロトコルを提示する。このプロトコルの目標は、従来の細菌走化性法のステップとコストを削減し、植物と微生物の相互作用を理解するための貴重なリソースとして機能することです。
要約
気道軸の同定は、根圏増殖促進細菌の研究と応用にとって非常に重要です。我々は、滅菌スライドガラス上の根圏増殖促進細菌の走化性運動を誘導する可能性のある化学誘引物質を簡単な手順で迅速に同定 するための 簡単な方法を確立した。細菌溶液(OD600=0.5 )および滅菌化学誘引剤水溶液を、1cmの間隔でスライドガラス上に滴下した。接種ループを用いて、化学誘引剤水溶液を細菌溶液に接続した。スライドをクリーンベンチ上で20分間室温に保った。最後に、化学誘引性水溶液を回収し、細菌計数および顕微鏡観察を行った。本研究では、実験結果の多重比較により、従来の細菌走化性法の複数の欠点を克服した。この方法は、プレートカウントの誤差を低減し、実験サイクルを短縮した。化学誘引物質の同定のために、この新しい方法は、従来の方法と比較して2〜3日を節約することができる。さらに、この方法は、任意の研究者が1〜2日以内に細菌走化性実験を体系的に完了させることを可能にする。このプロトコルは、植物と微生物の相互作用を理解するための貴重なリソースと考えることができます。
概要
ケモタキシーは、植物成長促進根細胞(PGPR)の根への定着や、植物と微生物の相互作用の理解に重要です1。植物根滲出液中の低分子量化合物(化学誘引剤)のクラスは、根圏へのPGPRの遊走性移動を誘導する2。リンゴ酸、クエン酸、および根の滲出液中の他の成分は、バチルス株の走化性を刺激する3。例えば、トウモロコシ根滲出液中のグルコース、クエン酸、フマル酸は、根表面に細菌をリクルートします4。根の滲出液に由来するD-ガラクトースは、バチルス・ベレゼンシスSQR95の走化性を誘導する。フマル酸、リンゴ酸、コハク酸などの有機酸は、カヤヌス・カジャン-ゼア・メイズ間作システムにおける様々なPGPRの走化性およびコロニー形成に影響を与えます6。オレアノール酸は、イネ根滲出液中で、FP357株の化学誘引剤として作用する。他の植物滲出液(ヒスチジン、アルギニン、アスパラギン酸を含む)は、細菌の走化性応答において重要な役割を果たし得る8。植物の滲出液は、根圏コロニー形成中の第一歩である細菌の動きを指示するシグナルとして機能する。PGPRによる植物コロニー形成は、PGPRが植物宿主にとって有益であるため、非常に関連性のあるプロセスである。
細菌走化性を分析するために多くの方法が用いられてきた。スイミングプレート法は、前述の方法の1つである9。この方法では、プレートを半固体培地で作製した。寒天を含む遊走性緩衝液(1.0%、w/v)をプレートに添加した。緩衝液を加熱し、次いで化学誘引剤と混合する。次いで、8 μLの細菌懸濁液をプレートの中央に滴下し、プレートを28°Cのインキュベーターに入れた。 プレートを定期的に観察し、写真を撮った。しかしながら、スイミングプレート法の実験サイクルは非常に長かった。キャピラリー様法10では、ピペットチップは100μLの細菌懸濁液を保持するチャンバとして機能する。1mLシリンジ針を毛細血管として用いた。異なる濃度勾配を有する化学誘引剤を含むシリンジ針を100μLピペットチップに挿入した。室温で3時間インキュベートした後、シリンジ針を除去し、内容物を希釈し、培地上に播種した。シリンジ内の細菌蓄積は、プレート内のコロニー形成単位(CFU)によって表された。しかしながら、毛細管状法については反復内の実験誤差が大きかった。別の方法は、マイクロ流体スリップチップデバイス11を用いた。簡単に述べると、ウシ血清アルブミン(BSA)溶液を全てのチャネルに注入し、真空を用いて除去した。異なる化学誘引物質を含む溶液(定性的検出のみのために1mM濃度)を、リン酸緩衝生理食塩水およびリン酸緩衝生理食塩水緩衝液(陰性対照)に懸濁した細菌細胞を、それぞれ上部、中型、および下部マイクロウェルに添加した。次いで、インキュベーションを室温で暗所環境で30分間行った。その後、細菌細胞をマイクロウェルで検出した。しかし、マイクロ流体SlipChipデバイスは高価でした。したがって、上述の各方法は、長所と短所を有していた。
我々は、複雑な工程を経ることなく滅菌スライドガラスを用いて根滲出液中の根茎細菌化学誘引物質を迅速に同定するための改良された走化性アッセイを確立した。本研究では、実験結果の多重比較により、従来の細菌走化性法の複数の欠点を克服した。この方法は、プレートカウントの誤差を低減し、実験サイクルを短縮した。したがって、化学誘引物質の同定に使用すれば、この新しい方法は2〜3日を節約し、実験材料のコストを削減することができる。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 材料・設備
注:この研究のために、バチルス・アルティトゥジニスLZP02(CP075052)を中国北東部のイネの根圏から単離した12,13。
- 文化B.アルティトゥジニスルリア・ベルターニ(LB)培地中のLZP02(ペプトン、10g L-1;NaCl、8g L-1および酵母エキス、5g L-1)を10時間投与する。9,569 x gで4°Cで2分間遠心分離して細胞を収集し、-80°Cで15%グリセロールとともに保存する。
注:この実験のために、米の種子(Oryza sativa Longgeng 46)は黒竜江省農業科学アカデミーの稲研究所から提供された。
2. 根滲出液の採取
- 成長室に米の種子をランダムに分配する。
注:イネの種子を30%H2O2で30分間滅菌し、一晩水に浸した。条件は、制御された光(16/8時間の明暗サイクル)、温度(22±2°C)、相対湿度(͂70%)であった。 - イネの種を1週間培養し、滅菌水を2回加える。
- 同様のサイズのイネの苗木を選択し、50mLのムラシゲおよびスクーグ(MS)液体培地で植物化する。無菌条件下で22°Cで48時間インキュベートする。
注:イネ根の滲出液はMS培地に放出されます14,15,16。
3. 根滲出液の液体クロマトグラフィー-質量分析
- 100 μL のサンプル (根の滲出液を含む MS 培地) を 1.5 mL 遠沈管に集めます。20 μLの抽出溶媒(アセトニトリル - メタノール - 水、2:2:1、内部標準を含む)を加える。サンプルを45Hzで4分間均質化し、続いて水浴中で氷上で5分間超音波処理を行う。
- 均質化と超音波サイクルを3回繰り返します。サンプルを-20°Cで1時間インキュベートし、続いて133,778 x g および4°Cで15分間遠心分離を行った。
- 得られた上清をLC-MSバイアルに移し、UHPLC-QE分析まで-80°Cで保存した。すべてのサンプルの上清の等しい部分を混合することによって品質管理(QC)サンプルを準備する。
注:各サンプル量は、提示された実験において600μL(実験ごとに6回の反復)であった。 - UHPLCシステム、UPLC HSS T3カラム(2.1 mm x 100 mm、1.8 μm)、およびQ Exactive12を使用して、LC-MS/MS 分析を実行します。
- 0.1%ギ酸水溶液と5mmol/L酢酸アンモニウム水溶液を移動相Aとして、アセトニトリルを移動相Bとして使用し、それぞれ正イオンモードと負イオンモードとしてギ酸アンモニウムを使用します。
- 溶出勾配を以下のように設定する:0分、1%B;1分、1%B;8分、99%B.10分、99%B.10.1分、1%B;12 分、1% B. 流量と注入量をそれぞれ 0.5 mL/分と 2 μL に設定します。
注:巨大分子(>1,000ダルトン)は検出できません。
4. ケモタキシーアッセイ
- 化学誘引剤水溶液を調製する。無菌であることを確認してください。化学誘引剤溶液を0.22μmの細菌フィルターでろ過する。
注:化学誘引剤水溶液は、LC−MS試験から得られた単一物質を水に溶解した。濃度及び体積は、異なる研究に応じて適宜調整することができる。クエン酸溶液を例に挙げた。すべてのアクションはランプの側面で実行する必要があります。 - スライドガラスの中央の位置に1cm間隔で印を付けます。スライドガラスが炎の上で数回滅菌されていることを確認します。
- スライドガラスの左側に30μLの化学誘引性溶液を加える。細菌がLB培地で対数段階(2 x 108 CFU/mL)まで培養されたことを確認します。スライドガラスの右側に30μLの細菌溶液を加える。
注:等量の滅菌水で陰性対照群を調製する。生理食塩水(0.9% NaCI)を、実験上の分子間力によって引き起こされる変化を排除するためにポジティブコントロールとして使用した。 - 接種ループを炎の上で数回滅菌する。接種ループを使用して化学誘引剤水溶液を細菌溶液に接続し、クリーンベンチ上で室温で20分間保持する。
注:実験は風のない環境で実施する必要があります。運動能力の異なる系統の接続線を切断するまでの時間を適切に調整してください。 - 20分後、ろ紙で接続ラインを外します。
- 1.5 mL 遠沈管が滅菌されていることを確認します。スライドガラスの左側に化学誘引剤水溶液を集める。この溶液を1.5 mL滅菌遠沈管に移す。
- 適切な量のサフラニンを遠沈管に加える。2分後、細菌を計数するための混和性液体を収集し、計血チャンバーで顕微鏡観察する。
5. 結果分析
- 引き付けられた生存微生物の数を、次の式を使用して決定します。
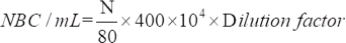
ここでNBC:細菌細胞の総数;N:80グリッド内の菌数。
注:データ分析には統計分析ソフトウェアを使用しました。誤差は3つの異なる反復実験値に基づいており、一元配置分散分析に続いてトルコの事後分析を使用して計算されました。 P≤0.05が有意であると考えられた。
Access restricted. Please log in or start a trial to view this content.
結果
合計584および937の既知の代謝産物が、それぞれ正および負のイオン指数で検出された。これまでの研究では、化学誘引物質は典型的には有機酸、アミノ酸、炭水化物であることが示されている17,18。
本研究では、イネ根圏滲出液中のLC-MS試験から16種類の化学誘引物質を、その後の実験のために選択した(表1)。スイ?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
研究の増加は、植物 - 細菌相互作用が主に根圏で起こり、根の滲出液20,21,22,23,24の影響を受けていることを示しています。植物の根の滲出液には、フェノール酸、有機酸、アミノ酸、より複雑な二次化合物25、26、27
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、中国国家自然科学財団(31870493号)、中国黒竜江省の主要研究開発プロジェクト(GA21B007)、中国黒竜江省大学の基礎研究費(135409103号)の支援を受けました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid | Beijing InnoChem Science & Technology C.,Ltd. | 490-79-9 | |
| Acetonitrile | CNW Technologies | 75-05-8 | |
| Ammonium acetate | CNW Technologies | 631-61-8 | |
| Caffeic acid | Beijing InnoChem Science & Technology C.,Ltd. | 331-39-5 | |
| Centrifuge | Thermo Fisher Scientific | Heraeus Fresco17 | |
| Citric acid | Beijing InnoChem Science & Technology C.,Ltd. | 77-92-9 | |
| Clean bench | Shanghai Boxun Industrial Co., Ltd. | BJ-CD | |
| Ferulic acid | Beijing InnoChem Science & Technology C.,Ltd. | 1135-24-6 | |
| Formic acid | CNW Technologies | 64-18-6 | |
| Fructose | Beijing InnoChem Science & Technology C.,Ltd. | 57-48-7 | |
| Galactose | Beijing InnoChem Science & Technology C.,Ltd. | 59-23-4 | |
| Glycine | Beijing InnoChem Science & Technology C.,Ltd. | 56-40-6 | |
| Grinding Mill | Shanghai Jingxin Industrial Development Co., Ltd. | JXFSTPRP-24 | |
| Histidine | Beijing InnoChem Science & Technology C.,Ltd. | 71-00-1 | |
| Internal standard: 2-Chloro-L-phenylalanine | Shanghai Hengbai Biotech C.,Ltd. | 103616-89-3 | |
| Leucine | Beijing InnoChem Science & Technology C.,Ltd. | 61-90-5 | |
| Malic acid | Beijing InnoChem Science & Technology C.,Ltd. | 6915-15-7 | |
| Mannose | Beijing InnoChem Science & Technology C.,Ltd. | 3458-28-4 | |
| Mass Spectrometer | Thermo Fisher Scientific | Q Exactive Focus | |
| Methanol | CNW Technologies | 67-56-1 | |
| Optical Microscope | Olympus | BX43 | |
| Phenylalanine | Beijing InnoChem Science & Technology C.,Ltd. | 63-91-2 | |
| Proline | Beijing InnoChem Science & Technology C.,Ltd. | 147-85-3 | |
| Scales | Sartorius | BSA124S-CW | |
| Serine | Beijing InnoChem Science & Technology C.,Ltd. | 56-45-1 | |
| Threonine | Beijing InnoChem Science & Technology C.,Ltd. | 72-19-5 | |
| UHPLC | Agilent | 1290 UHPLC | |
| Ultrasound Instrument | Shenzhen Leidebang Electronics Co., Ltd. | PS-60AL | |
| Valine | Beijing InnoChem Science & Technology C.,Ltd. | 7004-03-7 |
参考文献
- Belas, R. Biofilms, flagella, and mechanosensing of surfaces by bacteria. Trends in Microbiology. 22 (9), 517-527 (2014).
- Haichar, Z., Santaella, C., Heulin, T., Achouak, W. Root exudates mediated interactions belowground. Soil Biology and Biochemistry. 77 (7), 69-80 (2014).
- Zhang, N., et al. Effects of different plant root exudates and their organic acid components on chemotaxis, biofilm formation and colonization by beneficial rhizosphere-associated bacterial strains. Plant and Soil. 374 (1-2), 689-700 (2014).
- Zhang, N., et al. Whole transcriptomic analysis of the plant-beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 during enhanced biofilm formation regulated by maize root exudates. BMC Genomics. 16 (1), 685(2015).
- Lui, Y., et al. Induced root-secreted D-galactose functions as a chemoattractant and enhances the biofilm formation of Bacillus velezensis SQR9 in an mcpa-dependent manner. Applied Microbiology and Biotechnology. 104 (17), 785-797 (2020).
- Vora, S. M., Joshi, P., Belwalkar, M., Archana, G. Root exudates influence chemotaxis and colonization of diverse plant growth-promoting rhizobacteria in the Cajanus cajan - Zea mays intercropping system. Rhizosphere. 18 (12), 100331(2021).
- Sampedro, I., et al. Effects of halophyte root exudates and their components on chemotaxis, biofilm formation and colonization of the halophilic bacterium halomonas anticariensis FP35T. Microorganisms. 8 (4), 575(2020).
- Liu, X. L., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. A dual role amino acid from sesbania rostrata seed exudates in the chemotaxis response of Azorhizobium caulinodans ORS571. Molecular Plant-Microbe Interactions. 32 (9), 1134-1147 (2019).
- Ling, N., Raza, W., Ma, J. H., Huang, Q. W., Shen, Q. R. Identification and role of organic acids in watermelon root exudates for recruiting Paenibacillus polymyxa SQR-21 in the rhizosphere. European Journal of Soil Biology. 47 (6), 374-379 (2011).
- Rudrappa, T., Czymmek, K. J., Pare, P. W., Bais, H. P. Root-secreted malic acid recruits beneficial soil bacteria. Plant Physiology. 148 (3), 1547-1556 (2008).
- Shen, C., et al. Bacterial chemotaxis on Slipchip. Lab on a Chip. 14 (16), 3074-3080 (2014).
- Liu, H., et al. Bacillus pumilus LZP02 promotes rice root growth by improving carbohydrate metabolism and phenylpropanoid biosynthesis. Molecular Plant-Microbe Interactions. 33 (10), 1222-1231 (2020).
- Goswami, M., Deka, S. Isolation of a novel rhizobacteria having multiple plant growth promoting traits and antifungal activity against certain phytopathogens. Microbiological Research. 240, 126516(2020).
- Kaiira, M., Chemining'Wa, G., Ayuke, F., Baguma, Y., Nganga, F. Profiles of compounds in root exudates of rice, cymbopogon, desmodium, mucuna and maize. Journal of Agricultural Sciences Belgrade. 64 (4), 399-412 (2019).
- Shi, Y., et al. Effect of rice root exudates and strain combination on biofilm formation of Paenibacillus polymyxa and Paenibacillus macerans. African Journal of Microbiology Research. 6 (13), 3343-3347 (2012).
- Lee, H. W., Ghimire, S. R., Shin, D. H., Lee, I. J., Kim, K. U. Allelopathic effect of the root exudates of K21, a potent allelopathic rice. Weed Biology and Management. 8 (2), 85-90 (2008).
- Belimov, A. A., et al. Rhizobacteria that produce auxins and contain 1-amino-cyclopropane-1-carboxylic acid deaminase decrease amino acid concentrations in the rhizosphere and improve growth and yield of well-watered and water-limited potato (Solanum tuberosum). Annals of Applied Biology. 167 (1), 11-25 (2015).
- Ankati, S., Podile, A. R. Metabolites in the root exudates of groundnut change during interaction with plant growth promoting rhizobacteria in a strain-specific manner. Journal of Plant Physiology. 243, 153057(2019).
- Gordillo, F., Chavez, F., Jerez, C. A. Motility and chemotaxis of Pseudomonas sp. B4 towards polychlorobiphenyls and chlorobenzoates. FEMS Microbiology Ecology. 60 (2), 322-328 (2007).
- Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., Vivanco, J. M. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology. 57, 233-266 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Badri, D. V., Weir, T. L., Lelie, D., Vivanco, J. M. Rhizosphere chemical dialogues: plant-microbe interactions. Curr Opin Biotech. Current Opinion in Biotechnology. 20 (6), 642-650 (2009).
- Kamilova, F., Kravchenko, L. V., Shaposhnikov, A. I., Makarova, N., Lugtenberg, B. Effects of the tomato pathogen Fusarium oxysporum f. sp. radicis-lycopersici and of the biocontrol bacterium Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions. 19 (10), 1121-1126 (2006).
- Kamilova, F., et al. Organic acids, sugars, and L-tryptophane in exudates of vegetables growing on stonewool and their effects on activities of rhizosphere bacteria. Molecular Plant-Microbe Interactions. 19 (3), 250-256 (2006).
- Badri, D. V., Vivanco, J. M. Regulation and function of root exudates. Plant Cell Environment. 32 (6), 666-681 (2009).
- Hao, W. Y., Ren, L. X., Ran, W., Shen, Q. R. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f.sp. Niveum. Plant and Soil. 336 (1-2), 485-497 (2010).
- Hao, Z. P., Wang, Q., Christie, P., Li, X. L. Allelopathic potential of watermelon tissues and root exudates. Scientia Horticulturae. 112 (3), 315-320 (2007).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved